Может ли при беременности быть рак молочной железы

Обзор
Возможно, что хоть раз в своей практике каждый практикующий гинеколог наблюдал беременных пациенток, у которых во время беременности было диагностировано онкологическое заболеваний. Первым желанием любого врача будет рекомендация избавиться от беременности и заняться самым безолагательным лечением злокачественного заболевания. Но все меняется, в том числе и подходы к наблюдению и ведению таких пациенток.
РМЖ и беременность
Вопрос — влияет ли беременность на рост опухоли молочной железы и способствует ли ее распространению — волнует каждого гинеколога. Еще в 1880 г. С. Гросс высказал мнение, что РМЖ, развивающийся на фоне беременности и лактации, отличается быстрым ростом и более выраженным злокачественным течением. С годов прошлого века в литературе начинают появляться более оптимистичные прогнозы относительно течения и отдаленных исходов заболевания у больных данной группы.
По данным зарубежным материалов, на 3000 беременностей приходится 1 случай РМЖ. По данным Т. White, основанным на наблюдении 45 881 женщин, РМЖ развивается на фоне беременности или вскоре после родов у 2,8% обследованных. По другим данным до 7,3% женщин моложе 45 лет, страдающих РМЖ, являются беременными или кормящими.
25% случаев заболевания встречается в возрасте до 45 лет, в активный репродуктивный период, а около 70% случаев РМЖ, связанных с беременностью и лактацией, отмечается в молодом возрасте (данные American Cancer Society).
На сегодняшний день научных и клинических доказательств возникновения опухоли во время беременности de novo нет. Поэтому с большей долей вероятности можно предположить, что онкологический процесс, диагностированный во время беременности, — следствие уже имеющегося скрытого опухолевого процесса в молочной железе, просто ранее не обнаруженного.
Но угроза прогрессирования заболевания во время наступления беременности всегда будет существовать. Многие гинекологи знают, что пациентки, заметившие в начале беременности лишь небольшую по размерам опухоль, через 9 месяцев при отсутствии лечения обращаются к онкологу на поздней стадии. Возможно, подъем уровня половых гормонов во время беременности стимулирует рост уже имеющейся опухоли, которая связана с естественным повышением уровня эстрогенов и прогестерона. Помимо этого, обильное кровоснабжение молочной железы стимулирует развитие опухоли.
25–35% женщин, обнаруживших узел в молочной железе, к врачу не обращаются, списывая это образование на специфические изменения молочных желез при беременности. Следствие этого — поздняя диагностика опухоли.
По частоте встречаемости во время беременности встречаются:
- Рак молочной железы — 50% всех опухолей и опухолевидных образований, выявляемых во время беременности
- Галактоцеле
- Хронический лактационный мастит
Особенностями РМЖ при беременности является быстрая инвазия в окружающие ткани, что ведет к возникновению острых и форм рака, быстрая диссеминация опухолевого процесса, метастатическое поражение лимфатических коллекторов разного уровня, вплоть до надключичных.
Гистологические варианты РМЖ, наблюдаемые у молодых женщин, не зависят от того, беременны они или нет. Наиболее часто у этих женщин наблюдается инвазивный протоковый тип (75–90% наблюдений) [5]. формы встречаются чрезвычайно редко: 1,5–4% наблюдений. Более высокая частота лимфогенных метастазов характерна для РМЖ у молодых женщин, а не для рака в сочетании с беременностью
К моменту установления диагноза средние размеры опухоли колеблются от 5–6 до 15 см, частота распространенных форм — от 72 до 85%, при этом в 20% случаев выявляются метастазы во внутренние органы.
В РОНЦ им. проблемой РМЖ у беременных занимаются с 1972 года. По данным этого учреждения из числа наблюдавшихся беременных и лактирующих женщин 21% к моменту диагностики рака признаны . В 88% процесс оказался местнораспространенным и лишь в 12% — локальным. Наиболее частыми у обследованных в этот период наблюдения оказались маститоподобная, и формы рака. К настоящему времени Центр располагает данными более чем о 200 случаях сочетания РМЖ, ассоциированного с беременностью.

Диагностика РМЖ во время беременности
Лечение и ведение пациенток. Необходимость прерывания беременности
Повышение количества эстрогенов в начале беременности, как и увеличение уровня гормонов желтого тела и плаценты во ее половине, стимулируют рост опухоли в молочной железе. Но, несмотря на чувствительность опухолевой ткани к гормональной стимуляции в период беременности и лактации, при сравнении сопоставимых по возрасту и стадии процесса групп больных выживаемость среди беременных и небеременных женщин оказалась одинаковой.
Прерывание беременности с последующим проведением стандартной химиотерапии не улучшает прогноз заболевания. Даже при распространенных формах болезни выборочное прерывание беременности с последующим выключением функции яичников не позволяет существенно улучшить выживаемость. Таким образом, прерывание беременности у женщины, страдающей РМЖ, не является эффективной и адекватной мерой борьбы с заболеванием.
Если же пациентка принимает решение о прерывании беременности, то планирование лечения РМЖ в дальнейшем не отличается от такового у небеременных женщин. Наличие бывшей беременности может учитываться в таком случае как один из факторов неблагоприятного прогноза.
Алгоритм ведения пациентки:
- Совместное решение врачей, пациентки и ее семьи — сохранение или прерывание беременности.
- При решении прервать беременность — лечение начинается немедленно в полном объеме после прерывания беременности.
- При решении сохранения беременности — лечение откладывается до родов. Прогноз неблагоприятный.
В настоящее время есть методики, позволяющие проводить лечение беременных женщин с минимальным влиянием на плод.
1 этап — радикальная мастэктомия. Операция и анестезиологическое пособие во всех триместрах беременности безопасны для матери и для ребенка, не приводят к преждевременным родам, самопроизвольному аборту.
2 этап — химиотерапия и лучевая терапия
Лечение РМЖ в зависимости от триместра беременности
1 триместр — высокий риск развития врожденных уродств плода (10–20%) и самопроизвольных абортов.
2 и 3 триместры — увеличивается частота преждевременных родов, миелосупрессии у матери и плода, кровотечений и инфекций, задержки роста плода, рождения мертвого плода.
Andercen Cancer Center (США) опубликовал свои данные по наблюдению за 54 пациентками с беременностью и РМЖ. Средний срок беременности составлял 22,8 недель (от 10 до 34 недель).
23 (43%) из них получали неоадъювантную ХТ и 85% пациенток амбулаторно получали ХТ по схеме PAC во 2 и 3 триместрах беременности с последующим оперативным лечением.
Оперативное лечение выполнено 56% пациенток на любом сроке беременности.
Лучевая терапия проводилась после родов.
Роды происходили в среднем на 37 неделе.
Состояние детей: Масса тела рожденных детей составляла 2964 г. в среднем.
У 1 ребенка — субарахноидальное кровоизлияние, 1 ребенок — синдром Дауна.
На момент публикации исследования (2005 год) были живы 76% пациенток.
Выводы проведенного исследования:
Оперативное лечение безопасно на любом сроке беременности, проведение химиотерапии целесообразно на 2 и 3 сроках беременности. Лучевая терапия проводится после родов.
- Доксорубицин — менее токсичен по сравнению с другими препаратами в 1 триместре беременности, и относительно безопасен в других сроках беременности. Описано много наблюдений применения доксорубицина во 2 и 3 триместрах без отрицательного влияния на плод.
- Циклофосфан — стоит вторым в ряду после доксорубицина по токсичности, наряду с которым является препаратом выбора для лечения беременных с РМЖ.
- Метотрексат и — наиболее токсичные препараты, но последний все же применяется в схеме PAC.
- Таксаны — мало доступной информации по их применению у беременных.
У беременных ЛТ не применяется ее тератогенных свойств. Пороговой повреждающей дозой для плода в I и II триместрах считается 0,1 Гр; доза от 0,1 до 0,15 Гр приводит к дефектам развития, нарушениям ЦНС, доза 0,5- 1 Гр — к задержке развития, а доза 1–2,5 Гр — к уродствам. В III триместре плод менее чувствителен к лучевым воздействиям, но, тем не менее, от лучевой терапии воздерживаются на протяжении всей беременности.
Поля облучения можно сконцентрировать на МЖ, грудной клетке, подмышечных лимфатических узлах. На протяжении первых 2х недель беременности лучевая терапия может привести к спонтанному аборту. Между 2 и 8 неделями беременности повышается риск пороков развития плода. Лучевая терапия после 8 недель беременности приводит к задержке психосоматического развития новорожденных; на протяжении жизни у них повышается риск развития онкологических заболеваний
Результаты двух рандомизированных исследований показывают, что химиотерапия и лучевая терапия будут эффективными, если проводятся в течение 7 месяцев после хирургического лечения. Если интервал более длительный, адьювантная терапия неэффективна.
Споры о целесообразности проведения профилактической кастрации у пациенток, перенесших РМЖ на фоне беременности, все еще продолжаются. Пока нет достаточных оснований утверждать, что кастрация удлиняет срок безрецидивного течения и предупреждает метастазирование. Есть также мнение, что отдаленные результаты лечения у больных РМЖ, забеременевших впоследствии, лучше, чем у больных, перенесших овариэктомию. Объяснить это можно тем, что только при длительном безрецидивном течении болезни после операции женщина может решиться на новую беременность.
Выбора метода лечения в зависимости от стадии заболевания
- При начальных стадиях (Т1abN0М0) рекомендуется модифицированная радикальная мастэктомия с сохранением обеих грудных мышц с отсроченной реконструкцией. Органосохраняющие операции, требующие послеоперационной лучевой терапии, противопоказаны в I триместре беременности. Лучевая терапия может быть отложена до послеродового периода. Адъювантная химиотерапия при раннем раке (Т1abN0М0) и благоприятных прогностических факторах не рекомендуется, поскольку выживаемость в таких случаях достигает 100%, а рецидивы опухоли не возникают.
- При неблагоприятных факторах прогноза (недифференцированные, анапластические опухоли, отрицательные гормональные рецепторы опухоли) в начальных стадиях рекомендуется (после родов) адъювантная химиотерапия. При положительных рецепторах после химиотерапии назначают антиэстрогены.
- При IIа (Т1N1М0, Т1N1М0, Т2N0М0) — IIb (Т2N1М0, Т3N0М0) стадиях — модифицированная радикальная мастэктомия с отсроченной пластикой является операцией выбора в течение всего срока беременности. При решении пациентки прервать беременность химиотерапию назначают сразу после операции. Секторальная резекция с подмышечной лимфаденэктомией и последующей лучевой терапией предусматривает необходимость прерывания беременности в I триместре. Если беременность сохраняется и на ее фоне выполняется органосохраняющая операция, лучевую терапию следует отложить до послеродового периода.
- Если пациентка информирована о возможном риске для плода и отказывается от лекарственного лечения, после операции дополнительная терапия может быть отсрочена до момента раннего родоразрешения. Тамоксифен при эстрогенположительных рецепторах назначают после завершения беременности и проведения адъювантной химиотерапии.
- При РМЖ в стадии IIIa (М0; ), IIIb (), IIIc (любая TN3M0) и при формах РМЖ, рекомендовано прерывание беременности в качестве этапа лечения. Если же пациентка обратилась к врачу в III триместре беременности и считает (как и ее семья) приоритетом здоровье плода (будущего ребенка), в этом случае лечение начинается после раннего родоразрешения.
В случае полной информированности больной обо всех возможных осложнениях и при решении немедленно начать лечение, сохранив плод, во II и III триместрах предлагается неоадъювантная терапия по схеме АС (адриамицин, циклофосфан). После окончания химиотерапии и выполнения модифицированной радикальной мастэктомии при эстрогенположительных рецепторах назначают гормонотерапию (после родов).
Если у беременной диагностируется распространенный РМЖ с (множественными) отдаленными метастазами, после беседы с родственниками пациентки приоритетной целью становится здоровье плода/ребенка. Выбор метода лечения следует определять индивидуально и предпочтительно консилиумом (хирург, химиотерапевт, специалист по лучевой терапии, психолог) с учетом распространенности опухоли и сроков беременности.
Отсутствуют отдаленные данные о судьбах и здоровье детей, родившихся от матерей с РМЖ во время беременности.
Беременность после лечения РМЖ
Вопрос о повторной беременности после перенесенного РМЖ широко обсуждается в онкологических кругах. Некоторые ученые считают, что требуется категорически запретить последующие беременности, другие считают, что минимальный интервал между лечением и последующей беременностью составляет от 6 месяцев до 5 лет.
Прогноз заболевания
Многочисленные современные исследования свидетельствуют, что в случае одинакового возраста пациенток и одинаковой стадии развития заболевания прогноз не зависит от наличия или отсутствия беременности. По данным французских авторов, разница в продолжительности жизни у пациенток с одинаковой стадией на момент установления диагноза достоверно не отличается от наличия и отсутствия беременности, а также при стадии опухоли N+ и N-. В то же время существует много работ о том, что у беременных женщин рак выявляется впервые в более запущенной стадии, чем вне беременности. Именно запоздалая диагностика объясняет, почему продолжительность жизни без метастазов и показатели пятилетней выживаемости больных хуже при сочетании РМЖ и беременности.
В литературе не описано отрицательного влияния РМЖ на состояние плода. Неизвестны также случаи передачи заболевания плоду. Описано 60 случаев метастазов РМЖ в плаценту без поражения плода. Если на протяжении первого триместра беременности пациенткам не назначалась химиотерапия, частота пороков развития плода идентична таковой в общей популяции и составляет 2–3%.
Заключение
Проблема РМЖ и беременности является комплексной. Она требует коллективного участия врачей различных специальностей (рентгенологов, генетиков, , онкологов), а также разработки единой программы поэтапного обследования беременных для выявления болезни на максимально ранних сроках.
Целесообразно для решения этой проблемы включить молочных желез в план наблюдения беременной женщины (либо на этапе планирования беременности, либо в I триместре беременности).

Рак — это опухоль злокачественного характера из клеток эпителия, который в молочной железе присутствует в протоках, сосудах, структуре железистой ткани долек. Особенные опасения пациенток вызывает сочетание таких состояний, как рак груди и беременность, за счет определенных трудностей в первичной диагностике, последующем лечении и возможности сохранения беременности.
Следует помнить, что современными методами онкологии это заболевание успешно и полностью вылечивается. Доктора при назначении лечения чаще уделяют внимание сохранению качества жизни пациентки. Для подтверждения диагноза обследование нужно пройти в полном объеме, ведь злокачественные новообразования встречаются значительно реже доброкачественных.
Трудности первичной диагностики
Весьма часто опухоль удается обнаружить посредством самостоятельного обследования молочных желез или на осмотре гинеколога. Характерные для беременности изменения тканей молочных желез (увеличение, изменение консистенции) затрудняют выявление начальных стадий новообразований.
Повышенное содержание в крови эстрогена может спровоцировать начало опухолевого процесса при наличии к нему предрасположенности. Обнаружение рака груди во время беременности усложняется проявлениями действия эстрогена во время 1 триместра: набуханием молочных желез, увеличением долек, болезненностью. Изменения также могут маскироваться под мастит или воспалительные процессы кожи груди.
Изменения при раке молочной железы и беременности могут быть похожими. Выявленное образование встречается и доброкачественным, например, фиброаденома, киста или мастопатия. Сомнения развеет только осмотр специалиста и обследование.
Какие обследования можно пройти
Начальный этап обследования предусматривает осмотр у гинеколога или маммолога, сбор анамнеза и жалоб, УЗИ. Если при этом выявлены какие-либо значимые изменения, доктор направляет на маммографию. УЗИ молочных желез и маммография совершенно безвредны для плода, но полученные данные могут потребовать уточнения.
МРТ обследование позволяет рассмотреть железы в разных плоскостях, уточнить наличие и размеры опухоли, ее расположение в толще молочной железы. Сложность при этом методе в нежелательности использования контраста при беременности, хоть и подтверждено отсутствие его вредного влияния на плод.
Такое обследование показывает, какие клетки содержатся в опухоли. Биопсию проводят специальной аспирационной иглой, с помощью УЗИ аппарата контролируют проникновение непосредственно в образование.
Лечение
Пациенток, как правило, волнует вопрос сохранения беременности. Исследования показывают, что прерывание беременности никак не влияет на последующий опухолевый рост. Даже если повышение эстрогенов и спровоцировало начало заболевания, прерывание беременности не влияет на его дальнейшее развитие и на выживаемость пациенток. Тактика выбирается исходя из срока беременности, стадии заболевания и необходимости срочной лучевой терапии.
Если выявлена I — II стадия рака, то проводится оперативное лечение без прерывания беременности, а химиотерапия откладывается на 2 — 3 триместр, когда действие препаратов будет меньше влиять на развитие плода. Лучевое воздействие переносят на послеродовый период.
III — IV стадия требует не только безотлагательной операции, но и скорейшего проведения химиотерапии и лучевой терапии. На небольшом сроке беременности целесообразным будет ее прерывание для полноценного лечения исходя из опасений за жизнь пациентки.
При большом сроке (свыше 32 недель) и положительном решении врача делают отсрочку до родоразрешения. Операцию в нужном объеме (удаление опухоли или железы) проводят во время беременности, а после родов сразу начинают лучевую терапию. Но на III — IV стадии процесса необходим также поиск и удаление возможных метастазов.
Современные способы лечения рака груди при беременности во многих случаях позволяют сохранить плод и исцелить пациентку.
Беременность после лечения
После пройденной операции и курса лечения беременность уже безопасна. Сомнения, что возникнет ухудшение или рецидив, по последним данным не оправдывают себя. Беременность после рака молочной железы рекомендована как минимум спустя полгода после окончания химиотерапии и через 3 месяца после прохождения гормонотерапии. Кормление грудью после родов приветствуется.
Самые надежные рекомендации может дать только врач и применительно к конкретному случаю. Обязательно учитываются возможные риски заболевания, генетическая предрасположенность, гормональный фон и многие другие факторы.
Какие факторы риска рака груди стоит учесть при планировании беременности?
Изменение уровня гормонов при беременности — далеко не единственная причина, запускающая механизм образования опухоли. Прежде чем определить возможные риски возникновения процесса или его рецидива, доктор собирает подробный анамнез и выявляет все, что может предрасполагать к этому заболеванию:
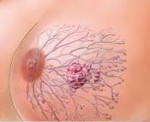
Рак молочной железы у беременных — это злокачественная неоплазия груди, выявленная на фоне гестации, лактации или в течение 12 месяцев после родов. Проявляется узловым или диффузным уплотнением грудных желез, их тяжестью и болезненностью, дискомфортом, болью в области ареолы, выделениями из соска, локальными изменениями кожи, увеличением аксиллярных лимфоузлов. Диагностируется при помощи УЗИ, трепанобиопсии, МРТ молочных желез. В период гестации используются хирургические методы лечения (обычно модифицированные варианты радикальной мастэктомии), химиотерапия по схеме AC. После родов терапию дополняют гормональными препаратами и лучевыми методиками.
МКБ-10
- Причины
- Патогенез
- Классификация
- Симптомы РМЖ у беременных
- Осложнения
- Диагностика
- Лечение РМЖ у беременных
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Злокачественные опухоли молочных желез — второй по распространенности вид неоплазий, диагностируемых у беременных. Их встречаемость составляет 1:3 000 — 1:10 000 гестаций. Средний возраст женщин, у которых диагностирован рак грудной железы, ассоциированный с беременностью, — составляет 33 года. До 82% пациенток выявляют новообразование самостоятельно в I триместре, при этом практически в 3/4 случаев диагностируются поздние стадии неоплазии с размерами опухоли от 6 до 15 см, а у каждой пятой беременной обнаруживаются метастазы во внутренних органах. Из-за несвоевременной диагностики заболевания задержка начала лечения в среднем составляет 2-3,5 месяца.

Причины
Этиология злокачественных неоплазий при гестации является такой же, как у небеременных женщин. В 5-10% случаев развитие рака обусловлено наследуемой мутацией генов BRCA1/BRCA2. У остальных пациенток новообразование возникает на фоне дисгормональных состояний, воздействий неблагоприятных факторов окружающей среды (мутагенных химических веществ, радиации и пр.), недостаточности иммунитета. Как правило, опухоли, выявляемые в грудных железах беременных, возникают до зачатия, однако их рост может ускориться на фоне физиологических гестационных изменений. По мнению специалистов в сфере онкологии и акушерства, специфическими провоцирующими факторами быстрого онкогенеза при беременности являются:
- Гормональная перестройка. Более чем в 70% случаев рак груди у беременных является эстроген-зависимым (ER+). При гестации уровень эстрогенов в крови возрастает почти в 30 раз. Под влиянием гормонов происходит подготовка молочных желез к лактации: грудь набухает, в ней увеличивается количество альвеол, молочных протоков. Гиперэстрогенная стимуляция может способствовать более быстрому развитию раковых клеток.
- Снижение иммунитета. Поскольку генетически плод чужероден материнскому организму, физиологические изменения в иммунной системе беременных направлены на снижение общей реактивности. За счет увеличение числа Т-супрессоров, уменьшения уровня Т-хелперов, появления блокирующих антител подавляется эффекторное звено иммунитета. В результате иммунная система хуже выявляет и уничтожает собственные перерождающиеся клетки.
Патогенез
Вероятный механизм развития рака молочной железы у беременных основан на стимуляции роста трансформированных клеток эстрогенами и прогестероном. Усиленное эстрогенное воздействие индуцирует синтез факторов роста, под влиянием которого пролиферируют эпителиальные клетки грудных желез, в том числе злокачественной опухоли. Одновременно тормозится клеточный апоптоз, за счет индуцированной транскрипции фактора роста сосудистого эндотелия начинается патологическая неоваскуляризация.
Поскольку эстрогены способны нивелировать действие ингибирующих факторов роста, включается отрицательная обратная связь, стимулирующая клеточную гиперплазию. Одним из эстрогенных эффектов является быстрое увеличение числа микрометастазов, вызванное стимуляцией так называемых спящих метастатических образований. Роль прогестерона в онкогенезе неоплазий молочных желез еще уточняется. Его эффекты могут быть связаны с поддержанием циклической пролиферации железистых клеток при гестации и стимуляции роста с потенциальным видоизменением ответа нормального и перерожденного железистого эпителия.
Классификация
Систематизация форм рака груди во время беременности основана на тех же критериях, что и вне гестационного периода, — анатомическом расположении неоплазии, ее размерах, особенностях метастазирования в лимфатические узлы и отдаленные органы, гистологическом строении, уровне клеточной дифференцировки, типе экспрессируемых рецепторов малигнизированных клеток. Наиболее значимую роль в разработке оптимальной тактики сопровождения беременности играет классификация опухоли по стадиям развития. Онкомаммологи различают:
- Неинвазивный рак (карциномаinsitu). Неоплазия локализована в молочном протоке или дольке. Лимфоузлы интактны. Клиника отсутствует. Рак становится случайной находкой при плановом обследовании. Наиболее благоприятная форма. Возможно продолжение гестации после оперативного лечения.
- РакIстадии. Максимальный поперечник новообразования не превышает 2 см. Неоплазия прорастает в окружающие ткани груди, но не метастазирует. Может определяться клинически в виде узлового уплотнения. Проведение хирургического вмешательства позволяет сохранить беременность.
- РакIIстадии. При IIA стадии опухоль имеет размеры до 2 см с метастазированием в аксиллярные лимфоузлы на стороне поражения или до 5 см без метастазов. При раке IIB стадии размеры неоплазии составляют 2-5 см при наличии метастазов в лимфоузлы или от 5 см и более — при их отсутствии. Для сохранения гестации показана радикальная мастэктомия.
- РакIIIстадии. Опухоль разрастается до 5 и более сантиметров либо отмечаются конгломераты спаянных подмышечных лимфатических узлов, прорастание рака в кожу молочной железы, ткани грудной клетки, поражение подключичных и надключичных лимфоузлов. Возможны отдаленные метастазы.
- РакIVстадии. Отмечается массивное поражение молочной железы с прорастанием окружающих тканей, диссеминацией в кожу, изъязвлениями. Возможно вовлечение в процесс второй груди, подмышечных лимфоузлов на противоположной стороне. Характерны множественные отдаленные метастазы.
При III-IV стадиях онкопроцесса по желанию пациентки и ее родственников допустимо сохранение гестации с досрочным родоразрешением в сроки достаточной жизнеспособности ребенка. В таких случаях выполнение радикального оперативного вмешательства позволяет приостановить распространение опухоли и начать активную терапию в послеродовом периоде. Назначение некоторых химиопрепаратов возможно с 15-й недели гестации.
Симптомы РМЖ у беременных
Хотя гестационные физиологические изменения тканей усложняют выявление злокачественного объемного образования, существуют маркерные признаки, повышающие онконастороженность. О развитии рака может свидетельствовать появление в одной из молочных желез узла или неоформленного уплотнения, болезненности и тяжести. У некоторых пациенток на фоне общего нагрубания асимметрично изменяется форма пораженной грудной железы, на коже возникают неровности, участки втяжений или локальной отечности.
Часто отмечается покалывание, боли в сосково-ареолярной области, может втягиваться сосок, появляются сукровичные выделения. При наличии регионарных метастазов в подмышке на пораженной стороне определяются увеличенные лимфатические узлы, в более тяжелых случаях лимфоузлы прощупываются над и под ключицей, в противоположной аксиллярной впадине. Признаки общей интоксикации в виде потери аппетита, снижения веса, нарастающей слабости и быстрой утомляемости характерны только для терминальных стадий болезни.
Осложнения
Рак грудных желез, возникающий у беременных, может быстро прогрессировать и осложняться метастазированием. Распространенные формы заболевания выявляются у 72-85% пациенток, у 20% женщин внутренние органы поражены метастазами. В некоторых случаях развивается воспаление тканей, окружающих опухоль. По мнению большинства акушеров-гинекологов, рак груди не оказывает негативного воздействия на ребенка, однако на поздних стадиях заболевания при наличии опухолевой интоксикации возможна гипоксия плода. Применение во II-III триместрах химиотерапевтических препаратов способно спровоцировать преждевременные роды, миелосупрессию у женщины и ребенка, задержку развития плода, мертворождение, массивные послеродовые кровотечения, инфекционные осложнения (эндометрит, хориоамнионит и др.).
Диагностика
Поскольку беременные женщины часто расценивают начальные признаки опухоли как специфические изменения молочных желез перед лактацией, рак груди при гестации обычно диагностируется на более поздних стадиях. Диагностически значимые радиологические методы исследования при беременности применяются ограниченно из-за возможного негативного влияния на плод, однако другие современные методики позволяют выявить опухоль и правильно оценить стадию онкопроцесса. Наиболее информативными при обнаружении злокачественной неоплазии груди являются:
- Маммосонография. УЗИ молочных желез - оптимальный метод скрининговой диагностики злокачественных опухолей у беременных и лактирующих женщин. Информативность ультрасонографии, дополненной цветовой и энергетической допплерографией, достигает 97%. Обычно на УЗИ рак выглядит как гиперваскуляризированное гипоэхогенное образование неправильной формы и неоднородной структуры. С помощью ультразвука удобно исследовать регионарные лимфоузлы.
- Трепанобиопсия молочной железы. Материал, полученный с помощью биопсийного пистолета, используют для определения морфологической структуры новообразования и его иммуногистохимического профиля (рецепторного статуса, амплификации гена Her2-neu, пролиферативного индекса Ki-67 и др.). Трепанобиопсия обладает большей информативностью, чем пункционная биопсия, позволяет верифицировать диагноз в 99,0-99,8% случаев.
- Томография. МРТ молочных желез проводят при получении неоднозначных результатов сонографии. Послойная визуализация дает возможность максимально точно оценить размеры и распространенность неоплазии. МРТ всего тела рекомендована для выявления метастазов. В I триместре сканирование осуществляют с осторожностью из-за возможной кавитации и перегревания эмбриона. Контрастирование допускается в исключительных случаях.
Маммографию беременным с подозрением на рак груди назначают редко, что связано с возможным повреждающим воздействием на плод и получением в 25% случаев ложноотрицательных результатов. В качестве дополнительных методов обследования рекомендовано определение онкомаркера CA 15-3, цитология мазка, полученного из соска пораженной молочной железы, оценка риска развития BRCA-ассоциированного рака, дуктоскопия, радиотермометрия груди, электроимпедансная маммография. Заболевание дифференцируют с маститом, доброкачественными неоплазиями (кистами, аденомами, фиброаденомами, липомами, листовидными опухолями), галактоцеле, гамартомами, лимфомами, саркомами, туберкулезом. Кроме онкомаммолога пациентку по показаниям консультирует онколог, химиотерапевт, хирург, фтизиатр, инфекционист.
Лечение РМЖ у беременных
Если ранее выявление злокачественного новообразования груди служило достаточным основанием для прерывания беременности, в последние десятилетия применяют стратегии, предполагающие раннее начало терапии и сохранение гестации. Выбор врачебной тактики в каждом конкретном случае рака выполняется индивидуально с учетом стадии процесса, гестационного срока и решения беременной. В 1-м триместре при выявлении инвазивных форм опухоли беременность рекомендуется прервать медицинским абортом, во 2-3-м — при желании пациентки продлить до минимально возможного срока рождения жизнеспособного плода. После искусственного прерывания гестации лечение производится по стандартным протоколам онкологической помощи. При решении сохранить ребенка могут использоваться следующие варианты:
- Хирургическое лечение. Наиболее оправданным вмешательством при ранних стадиях рака является радикальная мастэктомия, при необходимости дополненная аксиллярной диссекцией без последующей лучевой терапии. Лампэктомия, квадрантэктомия, секторальная резекция груди выполняются реже. Онкопластические операции не рекомендованы. Объем и срок проведения вмешательства при поздних стадиях болезни определяются индивидуально.
- Назначение химиопрепаратов. Антинеопластические средства могут применяться после 14 недели гестационного срока. Чем позже начато медикаментозное лечение, тем меньше вероятность возникновения уродств у плода. Препаратами выбора являются алкилирующие цитостатики и антрациклиновые антибиотики. При распространенных формах рака используется неоадъювантная полихимиотерапия как подготовительный этап перед радикальной операцией.
Гормонотерапия, наиболее эффективная при рецепторо-позитивных формах рака, беременным не проводится из-за тератогенного влияния антагонистов эстрогенов. Назначение лучевой терапии возможно только после завершения гестации. Рекомендованным способом родоразрешения являются естественные роды. Кесарево сечение осуществляется только при наличии акушерских показаний или тяжелой экстрагенитальной патологии, несовместимой с родовыми нагрузками.
Прогноз и профилактика
Показатели выживаемости пациенток, у которых в период беременности было диагностировано злокачественное новообразование молочной железы, не отличаются от данных по группам небеременных женщин. Прерывание гестации не влияет на исход заболевания. Однако в целом прогноз является более серьезным, поскольку у беременных зачастую выявляются распространенные формы рака. Минимальный безопасный интервал от момента завершения лечения до следующей беременности, по данным разных авторов, составляет от 6 месяцев до 5 лет. Основная задача профилактики рака грудных желез — обнаружение опухоли на ранних стадиях при помощи скрининговых методов (УЗИ, маммографии).
Читайте также:

