Полиморфизм генов при раке

МРТ молочных желез. Стрелочка указывает на опухоль
Nevit Dilmen, Wikimedia Commons
Генетики обнаружили 65 новых полиморфизмов в ДНК, ассоциированных с риском развития рака груди и еще десять, связанных с определенным его типом (эстроген-нечувствительным раком). Кроме того, большинство этих полиморфизмов удалось связать с изменением в регуляции активности конкретных генов, что расширило знания ученых о механизмах развития заболевания. Работы, опубликованные в Nature и Nature Genetics стали результатами нескольких масштабных международных проектов по исследованию генетики и механизмов развития рака груди.
Предрасположенность ко многим распространенным типам рака наследуется. Для рака груди количество семейных случаев насчитывает от пяти до десяти процентов от всех случаев развития болезни, однако близнецовые исследования показывают, что генетическая предрасположенность к развитию рака может объяснять до 40 процентов всех случаев. Самый высокий риск обусловлен мутациями в генах BRCA1 и BRCA2, которые кодируют компоненты системы репарации ДНК. К примеру, в 70-80 процентах случаев ER-негативный (эстроген-нечувствительный) рак молочной железы развивается у носительниц мутаций в гене BRCA1.
Для того чтобы вычислить риск развития заболевания, генетики занимаются поиском вариантов в ДНК (однонуклеотидных полиморфизмов), которые с большей вероятностью встречаются у женщин с диагностированным раком груди, чем у здоровых. В подавляющем большинстве случаев вклад единичного полиморфизма незначителен, однако на основе большого числа вариантов генетики определяют степень риска (risk score), которая количественно отражает предрасположенность к развитию заболевания.
До сих пор было известно около 120 полиморфизмов, ассоциированных с риском развития рака груди. Теперь, по итогам нескольких больших международных проектов ученые обнаружили еще 65 новых. Суммарно в опубликованном в Nature исследовании было задействовано более 120 тысяч женщин европейского происхождения и 14 тысяч азиатского с раком груди, а также 120 тысяч здоровых женщин.
Половина участниц была генотипирована при помощи теста OncoArray. В рамках этого проекта международная команда исследователей разработала тест для определения 570 тысяч однонуклеотидных полиморфизмов, включая редкие варианты и известные варианты, ассоциированные с различными видами рака. Образцы были собраны в результате 68 отдельных исследований, проведенных международным консорциумом по исследованию генетики и механизмов развития рака груди (BCAC). Данные для другой половины участниц были собраны в результате мета-анализа 12 крупных полногеномных исследований. Всего ученые проанализировали связь с заболеванием для 11,8 миллионов известных полиморфизмов.
По итогам исследования количество известных генетических вариантов, ассоциированных с риском развитием рака молочной железы, выросло до 180. Суммарно эти варианты вносят вклад в 18 процентов семейных случаев болезни, однако исследователи утверждают, что потенциал теста OncoArray не раскрыт до конца, и с его помощью можно обнаружить варианты для 40 процентов случаев. Большинство этих вариантов попадает в некодирующие области генома, то есть связано с регуляцией активности генов.
В опубликованном отдельно исследовании консорциум обнаружил десять новых полиморфизмов, ассоциированных с риском развития ER-негативного рака молочной железы у женщин европейского происхождения. Кроме того, ученые подтвердили десять ранее опубликованных полиморфизмов, связанных с этим типом рака. Данные были собраны также при помощи анализа OncoArray в ходе исследований BCAC и CIMBA (Consortium of Investigators of Modifiers of BRCA1/2) —консорциума по изучению вклада в развитие рака мутаций в генах BRCA. Большая часть мутаций, связанных с ER-негативным раком, при этом не была ассоциирована с ER-позитивным, что говорит о независимых механизмах возникновения двух типов заболевания. По словам исследователей, 20 найденных вариантов, вкупе с сотней обнаруженных ранее, объясняют 16 процентов наследственных случаев ER-негативного рака молочной железы.

Таблица с перечислением десяти полиморфизмов (SNP), ассоциированных с ER-негативным раком груди, с привязкой к конкретным генам
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению — сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента — не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют тестирование — определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида
2. Хромосомные аберрации.
Делеция — утрата участка хромосомы. Происходят обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё — этот ген в хромосоме больше не экспрессируется.
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы — в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
Каждый этап клеточного цикла контролируется
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) — две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF — немелкоклеточный рак легкого;
- BRAF — меланома;
- HER2 — рак молочной железы (РМЖ);
- KRAS — колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
опухоли (антионкогены) — напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация в результате мутации — резко увеличивает вероятность появления злокачественной опухоли.
- мутации BRCA1, BRCA2 — рак молочных желез, яичников;
- мутации p53 — до 50% различных видов раковых опухолей, саркомы;
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
Иматиниб связывается с активным участком молекулы белка , и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, , иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения
Кому это нужно?
В этом случае исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Эти гены действуют в качестве генов-супрессоров опухолевой трансформации клетки вследствие их роли в поддержании целостности генома. В норме эти гены обеспечивают синтез белков, которые подавляют образование опухоли путем ограничения роста клеток. Они также выступают в качестве регуляторов транскрипции и репарации ДНК. Мутации этих генов приводят к инактивации их функций и развитию опухолевого процесса.
Развитие рака молочной железы может быть спорадическим (около 85%), т.е. повреждения генов происходит после рождения под воздействием разных факторов, врожденные формы заболевания (около 15%) вызваны мутациями в генах, передающихся по наследству. В исследованиях выявлена четкая ассоциация наличия мутаций генов BRCA1,2 и развития рака молочных желез. Также обнаружена положительная корреляция с развитием рака яичников и мутаций в генах. Мутация в гене BRCA1 встречается в 75% случаев наследственных форм рака яичников, а в 25% в гене BRCA2.
По разным оценкам одна женщина из 800 является носительницей мутации в гене BRCA1Вероятность развития рака молочной железы или яичника у женщин, имеющих наследуемые мутации гена BRCA1, достигает более 80% в течение их жизни. При этом у них в возрасте до 50 лет заболеваемость данной онкопатологией оказывается в 8-10 раз выше, чем в общей популяции. Среди больных раком молочной железы с отягощенным семейным анамнезом (наличие рака молочной железы у близких родственников) генные мутации встречаютя очень часто. Наличие мутаций в генах BRCA1,2 в отягощенных РМЖ семьях обуславливает риск данной болезни на 80-90%.
Клиническое течение рака молочной железы у женщин с мутациями BRCA 1и 2 отличается от такового в популяции в целом. У таких больных чаще развивается высокодифференцированный рак с отсутствием рецепторов к эстрогенам. В целом же все эти факторы ассоциируются с большей склонностью к рецидиву и худшим прогнозом заболевания.
Кроме того, наблюдается высокая вероятность возникновения рака желудка, толстой кишки, эндометрия, поджелудочной железы, меланомы, мочевого пузыря, опухолей головы и шеи при патологическом BRCA1/2 генотипе.
Показания к анализу: новообразования в молочной железе, генетическая предрасположенность к раку молочных желез и яичников(наличие семейных форм рака молочных желез в анамнезе), планирование гормональной контрацепции.
- Мутация 1,киназы конторльной точки клеточного циклаCHEK2 полиморфизм 1100delC.
- Мутация 2киназы конторльной точки клеточного циклаCHEK2 полиморфизмIVS2+1G>A
Ген CHEK2 кодирует протеинкиназу, активирующуюся в ответ на повреждение молекулы ДНК. Данный опухолевый супрессор контролирует вход клетки в митоз (приводя к аресту клеточного цикла на стадии G1 или апопотозу.), репарацию ДНК. Впервые выявленные мутации CHEK2 были связаны с синдромом Li-Fraumeni (характеризующимся чрезвычайно инвазивным фенотипом семейного рака, обычно связанным с наследственными мутациями в гене р53). Кроме того, мутации в этом гене определяет предрасположенность к саркомам, раку молочной железы, и опухолям головного мозга.
Наследственная мутация 1100delC приводит к синтезу неполноценного укороченного белка CHEK2. Аллель 1100delC CHEK2 ассоциирован с 1.4–4.7 кратным увеличением риска возникновения рака груди у женщин, несущих эту мутацию. Частота аллеля 1100delC составляет 1.1–1.4% среди групп здорового контроля в европейской популяции. Данный аллель 1100delC вместе с BRCA1 5382insC вносит значительный вклад в развитие рака молочной железы в России. При наличии мутации 1100delC в отсутствие мутаций BRCA1,2 риск развития рака увеличивается в 2 раза. Частота данной мутации у лиц с семейными формами РМЖ, не имеющих мутаций в BRCA1,2 была выше, чем в популяции и в семьях с мутациями BRCA1,2.
Аллель IVS2+1G-A CHEK2 связывается с возникновением онкологии различной локализации; чаще всего встречается у больных с раком простаты и молочной железы. Частота встречаемости IVS2+1G-A меньше аллеля 1100delC и чаще встречается в Белоруссии.
Показания к анализу. Определение индивидуального риска развития рака молочной железы, сарком, опухолям головного мозга.
Мутации BRCA1 5382insC, BRCA1 6174 delA, CHEK2 1100delC и, вероятно, BRCA1 185delAG) и должны быть рекомендованы для обследования всех больных РМЖ. Детекция мутации CHEK2 IVS2+1G>A анализ может быть ограничен группами высокого риска.
- Полиморфизмы N-ацетилтрансферазы 2 (NAT2) 4 полиморфизма:NAT2*6А- Arg197Gln, NAT2*5B-Lys268Arg, Gly286Glu(857 g-a) Leu161Leu(481 c-t)
Показания к анализу: рак простаты, мочевого пузыря, рак легких, эндометриоз, прием лекарств, метаболизирующихся с участием NAT2.
- Мутация поли(АДФ-рибозил)полимеразыPARP1(ADPRT)Val762Ala T>C
Поли(АДФ-рибозил)полимеразы - группа ферментов, участвующих в репарации ДНК, катализируя поли(АДФ-рибозилирование) белков, связанных с ДНК. Эти ферменты активируются при повреждении ДНК.
Активность PARP возрастает в 500 раз и более при связывании с участками разрыва ДНК. Фермент PARP-1 вовлечен в процессы репликации, транскрипции и репарации. Известно несколько видов PARP, кодируемых разными генами. Наибольшее значение имеет PARP-1, так как она ответственна за синтез до 90% поли(ADP-рибозы) в клетке.
Показано, что окислительный стресс и апоптоз вносят немалый вклад в патогенез таких затолеваний как хронический гломерулонефрит, диабетическая полинейропатия, инсульт. И в ряде работ получены данные об ассоциации полиморфного маркера Val762Ala гена ADPRT1 с диабетической полинейропатией (ДПН) при сахарном диабете типа 1 (СД типа 1), хонического гламерулонефрита, инсульта при которых одним из патогенетических факторов развития является окислительный стресс и избыточное образование свободных радикалов оказывающих повреждающее действие на ДНК и мембранные структуры нейронов, и как следствие приводящих к гибели клеток и апоптозу.
Кроме того, были выявлены корреляции анализируемого полиморфизма гена PARP1 с объемом очага ишемического повреждения и с тяжестью состояния больных на разных сроках обследования. Упациентов с генотипом Т/Т на всех сроках обследования достоверно чаще встречались очаги инфаркта большого объема по сравнению с носителями С/С и Т/С генотипов. И среди носителей Т/Т генотипа преобладали пациенты с тяжелым течением инсульта, а у больных с генотипами С/С и Т/С наблюдалось заболевание средней степени тяжести.
Таким образом, полиморфизм гена PARP1 ассоциирован с развитием и прогрессированием инсульта у больных – С/С и Т/С генотипы являются вариантом более легкого течения заболевания, а Т/Т генотип связан с развитием тяжелого инсульта.
Показания к анализу: Риск ишемической болезни мозга ишемический инсульт, хронический гламерулонефрит, диабетическая полинейропатия.

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.

Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
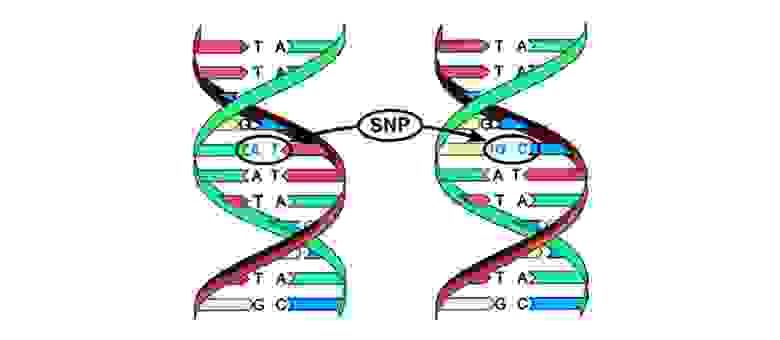
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
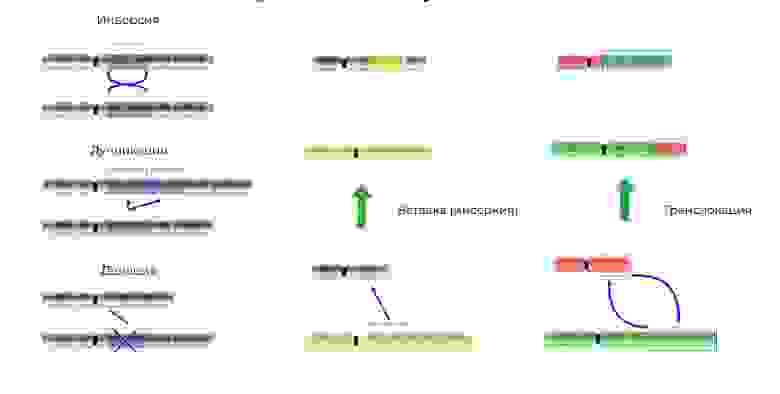
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
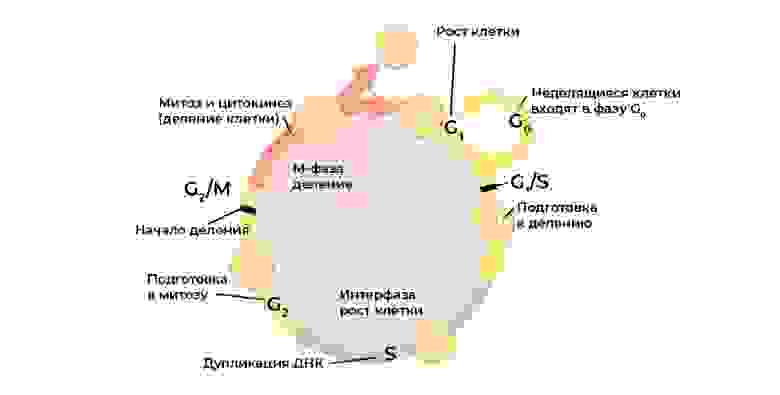
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
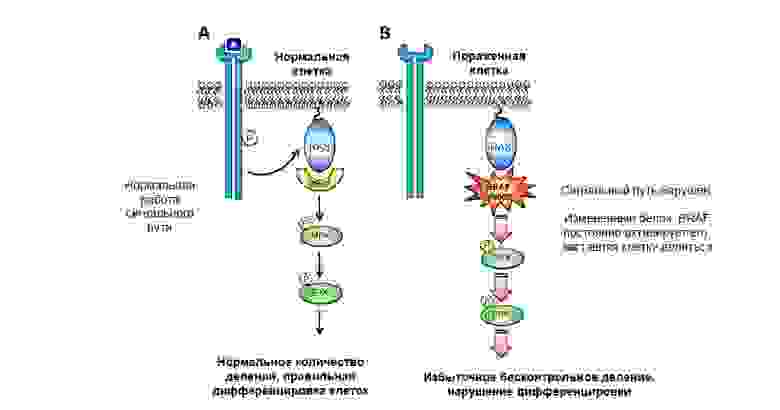
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
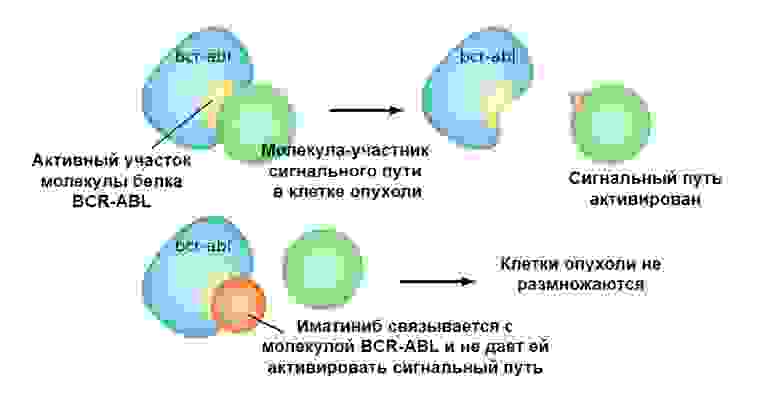
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:





