Плотность воды с хлором
Плотность хлора и другие его физические свойства
Хлор обладает резким запахом. Вдыхание его вызывает воспаление дыхательных путей. В качестве средства первой помощи при острых отравлениях хлором применяется вдыхание паров смеси спирта с эфиром.
Критическая температура хлора равна 144 o С, критическое давление 76 атм. При температуре кипения жидкий хлор имеет плотность 1,6 г/см 3 , а теплота его испарения составляет 4,9 ккал/моль. Твердый хлор имеет плотность 2,0 г/см 3 и теплоту плавления 165 ккал/моль. Кристаллы его образованы отдельными молекулами Cl2 (кратчайшее расстояние между которыми равно 3,34 А).
Связь Cl-Cl характеризуется ядерным расстоянием 1,98 А и силовой константой 3,2. Термическая диссоциация молекулярного хлора по уравнению
Cl2 + 58 ккал = 2Cl
Становится заметной примерно с 1000 o С.
Распространенность хлора в природе
По распространенности в природе хлор близок фтору – на его долю приходится 0,02% от общего числа атомов земной коры. Человеческий организм содержит 0,25 (мас.) % хлора.
Первичная форма нахождения хлора на земной поверхности отвечает его чрезвычайному распылению. В результате работы воды, на протяжении многих миллионов лет разрушавшей горные породы и вымывавшей из них все растворимые составные части, соединения хлора скапливались в морях. Усыхание последних привело к образованию во многих местах земного шара мощных залежей NaCl, который и служит исходным сырьем для получения всех соединений хлора.
Краткая характеристика химических свойств и плотность хлора
Сущность химической активности хлора проявляется в способностях его атома присоединять электроны и превращаться в отрицательно заряженный ион.
Химическая активность хлора очень велика – он соединяется почти со всеми металлами (иногда лишь в присутствии следов воды или при нагревании) и со всеми металлоидными элементами, кроме C, N и O. Важно отметить, что при полном отсутствии влаги хлор не действует на железо. Это и позволяет хранить его в стальных баллонах.
Взаимодействие хлора с водородом по реакции
Протекает крайне медленно, но нагревании смеси газов или её сильное освещение (прямым солнечным светом, горящим магнием и т.д.) сопровождается взрывом.
Среди сложных веществ, с которыми реагирует хлор: воды, щелочи и галогениды металлов.
Примеры решения задач
2Na + Cl2 = 2NaCl + 819 кДж
рассчитайте, какая масса натрия сгорела, если выделилось 1,43 кДж теплоты.
2Na + Cl2 = 2NaCl + 819 кДж.
Согласно уравнению реакции, горению подвергли 2 моль натрия. Молярная масса натрия равна 23 г/моль. Тогда, теоретическая масса натрия будет равна:
m(Na)th = 2 × 23 = 46 г.
x г Na – 1,43 кДж теплоты;
46 г Na – 819 кДж теплоты.
х = (46 × 1,43) / 819 = 0,08.
Следовательно, сгорело 0,08 г натрия.
| Задание | Найдите плотность по азоту воздуха, имеющего следующий объемный состав: 20,0% кислорода; 79,0% азота и 1,0% аргона. |
| Решение | Поскольку объемы газов пропорциональны их количествам (закон Авогадро), то среднюю мольную массу смеси можно выразить не только через моли, но и через объемы: |
M(O2) = 2 × Ar(O) = 2×16 = 32 г/моль;
M(N2) = 2 × Ar(O) = 2×14 = 28 г/моль;
M(Ar) = Ar(Ar) = 40 г/моль.
Возьмем 100 дм 3 смеси, тогда V(O2) = 20 дм 3 , V(N2) = 79 дм 3 , V(Ar) = 1 дм 3 . Подставляя эти значения в вышеуказанную формулу получим:
M = (32×20 + 28×79 + 40×1) / (20 + 79 + 1);
Плотность по азоту получается делением средней мольной массы смеси на мольную массу азота:

Рассмотрены физические свойства хлора: плотность хлора, его теплопроводность, удельная теплоемкость и динамическая вязкость при различных температурах. Физические свойства Cl2 представлены в виде таблиц для жидкого, твердого и газообразного состояния этого галогена.
Основные физические свойства хлора
Хлор входит в VII группу третьего периода периодической системы элементов под номером 17. Он относится к подгруппе галогенов, имеет относительные атомную и молекулярные массы 35,453 и 70,906, соответственно. При температурах выше -30°С хлор представляет собой зеленовато-желтый газ с характерным резким раздражающим запахом. Он легко сжижается под обычным давлением (1,013·10 5 Па), будучи охлажден до -34°С, и образует прозрачную жидкость янтарного цвета, затвердевающую при температуре -101°С.
Из-за своей высокой химической активности свободный хлор не встречается в природе, а существует только в форме соединений. Он содержится главным образом в минерале галите (хлорид натрия NaCl), также входит в состав таких минералов, как: сильвин (KCl), карналлит (KCl·MgCl2·6H2O) и сильвинит (KCl·NaCl). Содержание хлора в земной коре приближается к 0,02% от общего числа атомов земной коры, где он находится в виде двух изотопов 35 Cl и 37 Cl в процентном соотношении 75,77% 35 Cl и 24,23% 37 Cl.
| Свойство | Значение |
|---|---|
| Температура плавления, °С | -100,5 |
| Температура кипения, °С | -30,04 |
| Критическая температура, °С | 144 |
| Критическое давление, Па | 77,1·10 5 |
| Критическая плотность, кг/м 3 | 573 |
| Плотность газа (при 0°С и 1,013·10 5 Па), кг/м 3 | 3,214 |
| Плотность насыщенного пара (при 0°С и 3,664·10 5 Па), кг/м 3 | 12,08 |
| Плотность жидкого хлора (при 0°С и 3,664·10 5 Па), кг/м 3 | 1468 |
| Плотность жидкого хлора (при 15,6°С и 6,08·10 5 Па), кг/м 3 | 1422 |
| Плотность твердого хлора (при -102°С), кг/м 3 | 1900 |
| Относительная плотность по воздуху газа (при 0°С и 1,013·10 5 Па) | 2,482 |
| Относительная плотность по воздуху насыщенного пара (при 0°С и 3,664·10 5 Па) | 9,337 |
| Относительная плотность жидкого хлора при 0°С (по воде при 4°С) | 1,468 |
| Удельный объем газа (при 0°С и 1,013·10 5 Па), м 3 /кг | 0,3116 |
| Удельный объем насыщенного пара (при 0°С и 3,664·10 5 Па), м 3 /кг | 0,0828 |
| Удельный объем жидкого хлора (при 0°С и 3,664·10 5 Па), м 3 /кг | 0,00068 |
| Давление паров хлора при 0°С, Па | 3,664·10 5 |
| Динамическая вязкость газа при 20°С, 10 -3 Па·с | 0,013 |
| Динамическая вязкость жидкого хлора при 20°С, 10 -3 Па·с | 0,345 |
| Теплота плавления твердого хлора (при температуре плавления), кДж/кг | 90,3 |
| Теплота парообразования (при температуре кипения), кДж/кг | 288 |
| Теплота сублимации (при температуре плавления), кДж/моль | 29,16 |
| Молярная теплоемкость Cp газа (при -73…5727°С), Дж/(моль·К) | 31,7…40,6 |
| Молярная теплоемкость Cp жидкого хлора (при -101…-34°С), Дж/(моль·К) | 67,1…65,7 |
| Коэффициент теплопроводности газа при 0°С, Вт/(м·К) | 0,008 |
| Коэффициент теплопроводности жидкого хлора при 30°С, Вт/(м·К) | 0,62 |
| Энтальпия газа, кДж/кг | 1,377 |
| Энтальпия насыщенного пара, кДж/кг | 1,306 |
| Энтальпия жидкого хлора, кДж/кг | 0,879 |
| Показатель преломления при 14°С | 1,367 |
| Удельная электропроводность при -70°С, См/м | 10 -18 |
| Сродство к электрону, кДж/моль | 357 |
| Энергия ионизации, кДж/моль | 1260 |
Плотность хлора
При нормальных условиях хлор представляет собой тяжелый газ, плотность которого приблизительно в 2,5 раза выше плотности воздуха. Плотность газообразного и жидкого хлора при нормальных условиях (при 0°С) равна, соответственно 3,214 и 1468 кг/м 3 . При нагревании жидкого или газообразного хлора его плотность снижается из-за увеличения объема вследствие теплового расширения.
В таблице представлены значения плотности хлора в газообразном состоянии при различных температурах (в интервале от -30 до 140°С) и нормальном атмосферном давлении (1,013·10 5 Па). Плотность хлора меняется с изменением температуры — при нагревании она уменьшается. Например, при 20°С плотность хлора равна 2,985 кг/м 3 , а при повышении температуры этого газа до 100°С, величина плотности снижается до значения 2,328 кг/м 3 .
| t, °С | ρ, кг/м 3 | t, °С | ρ, кг/м 3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
При росте давления плотность хлора увеличивается. Ниже в таблицах приведена плотность газообразного хлора в интервале температуры от -40 до 140°С и давлении от 26,6·10 5 до 213·10 5 Па. С повышением давления плотность хлора в газообразном состоянии увеличивается пропорционально. Например, увеличение давления хлора с 53,2·10 5 до 106,4·10 5 Па при температуре 10°С приводит к двукратному увеличению плотности этого газа.
| ↓ t, °С | P, кПа → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, кПа → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Жидкий хлор может существовать в относительно узком температурном диапазоне, границы которого лежат от минус 100,5 до плюс 144°С (то есть от температуры плавления до критической температуры). Выше температуры 144°С хлор не перейдет в жидкое состояние ни при каком давлении. Плотность жидкого хлора в этом температурном интервале изменяется от 1717 до 573 кг/м 3 .
| t, °С | ρ, кг/м 3 | t, °С | ρ, кг/м 3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Удельная теплоемкость хлора
Удельная теплоемкость газообразного хлора Cp в размерности кДж/(кг·К) в интервале температуры от 0 до 1200°С и нормальном атмосферном давлении может быть рассчитана по формуле:
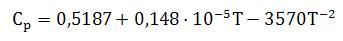
где T — абсолютная температура хлора в градусах Кельвина.
Следует отметить, что при нормальных условиях удельная теплоемкость хлора имеет значение 471 Дж/(кг·К) и при нагревании увеличивается. Рост теплоемкости при температурах выше 500°С становится незначительным, и при высоких температурах удельная теплоемкость хлора практически не изменяется.
В таблице приведены результаты расчета удельной теплоемкости хлора по указанной выше формуле (погрешность расчета составляет около 1%).
| t, °С | Cp, Дж/(кг·К) | t, °С | Cp, Дж/(кг·К) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
При температуре близкой к абсолютному нулю хлор находится в твердом состоянии и имеет низкую величину удельной теплоемкости (19 Дж/(кг·К)). По мере увеличения температуры твердого Cl2 его теплоемкость растет и достигает при минус 143°С величины 720 Дж/(кг·К).
Жидкий хлор имеет удельную теплоемкость 918…949 Дж/(кг·К) в интервале от 0 до -90 градусов Цельсия. По данным таблицы видно, что удельная теплоемкость жидкого хлора выше чем газообразного и при увеличении температуры снижается.
| Твердый хлор | Жидкий хлор | ||
|---|---|---|---|
| t, °С | Cp, Дж/(кг·К) | t, °С | Cp, Дж/(кг·К) |
| -273 | 19 | -90 | 949 |
| -269 | 209 | -80 | 944 |
| -243 | 315 | -70 | 935 |
| -193 | 595 | -30 | 929 |
| -143 | 720 | 0 | 918 |
Теплопроводность хлора
В таблице представлены значения коэффициентов теплопроводности газообразного хлора при нормальном атмосферном давлении в интервале температуры от -70 до 400°С.
Коэффициент теплопроводности хлора при нормальных условиях составляет 0,0079 Вт/(м·град), что в 3 раза меньше чем у воздуха при тех же температуре и давлении. Нагревание хлора приводит к повышению его теплопроводности. Так, при температуре 100°С, значение этого физического свойства хлора увеличивается до 0,0114 Вт/(м·град).
| t, °С | λ, Вт/(м·град) | t, °С | λ, Вт/(м·град) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Вязкость хлора
Коэффициент динамической вязкости газообразного хлора в интервале температуры 20…500°С можно приближенно вычислить по формуле:
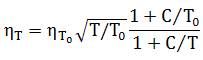
где ηT — коэффициент динамической вязкости хлора при заданной температуре T, К;
ηT0 — коэффициент динамической вязкости хлора при температуре T0=273 К (при н. у.);
С — константа Сюзерленда (для хлора С=351).
При нормальных условиях динамическая вязкость хлора равна 0,0123·10 -3 Па·с. При нагревании такое физическое свойство хлора, как вязкость, принимает более высокие значения.
| t, °С | η, 10 -3 Па·с | t, °С | η, 10 -3 Па·с |
|---|---|---|---|
| 0 | 0,0123 | 200 | 0,0209 |
| 20 | 0,0133 | 250 | 0,0229 |
| 25 | 0,0136 | 300 | 0,0249 |
| 50 | 0,0147 | 400 | 0,0287 |
| 100 | 0,0168 | 500 | 0,0333 |
| 150 | 0,0189 | 600 | 0,0373 |
Жидкий хлор имеет вязкость на порядок выше, чем газообразный. Например, при температуре 20°С динамическая вязкость жидкого хлора имеет величину 0,345·10 -3 Па·с и при росте температуры снижается.
| t, °С | η, 10 -3 Па·с | t, °С | η, 10 -3 Па·с |
|---|---|---|---|
| -53 | 0,569 | 20 | 0,345 |
| -45 | 0,53 | 35 | 0,323 |
| -35 | 0,494 | 50 | 0,3 |
| 0 | 0,385 | 75 | 0,275 |
| 10 | 0,365 | 100 | 0,249 |
- Барков С. А. Галогены и подгруппа марганца. Элементы VII группы периодической системы Д. И. Менделеева. Пособие для учащихся. М.: Просвещение, 1976 — 112 с.
- Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и жидкостей.
- Таблицы физических величин. Справочник. Под ред. акад. И. К. Кикоина. М.: Атомиздат, 1976 — 1008 с.
- Якименко Л. М., Пасманик М. И. Справочник по производству хлора, каустической соды и основных хлорпродуктов. Изд. 2-е, пер. и др. М.: Химия, 1976 — 440 с.
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Впервые газообразный безводный хлороводород собрал Дж. Присли в 1772г. (над жидкой ртутью). Впервые хлор был получен в 1774 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
В природе встречаются два изотопа хлора 35 Cl и 37 Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л [3] ). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
Некоторые физические свойства хлора
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å .
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода [8] (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl. При 1000 К равна 2,07×10 −4 %, а при 2500 К 0,909 %.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 10 22 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s 2 2s 2 2p 6 3s 2 3p 5 , поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие валентности. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
|---|---|---|---|
| I | +1, −1 | 3s 2 3p 5 | NaCl, NaClO |
| III | +3 | 3s 2 3p 4 3d 1 | NaClO2 |
| V | +5 | 3s 2 3p 3 3d 2 | KClO3 |
| VII | +7 | 3s 1 3p 3 3d 3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованиемхлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид:
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
При реакции с монооксидом углерода образуется фосген:
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли:
Хлорированием сухого гидроксида кальция получают хлорную известь:
Действие хлора на аммиак можно получить трёххлористый азот:
Хлор очень сильный окислитель.
С насыщенными соединениями:
Присоединяется к ненасыщенным соединениям по кратным связям:
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
2NaCl + 2H2О → H2↑ + Cl2↑ + 2NaOH Анод: 2Cl − — 2е − → Cl2 0 ↑ Катод: 2H2O + 2e − → H2↑ + 2OH −
Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом:
1,80 NaCl + 0,50 H2O → 1,00 Cl2↑ + 1,10 NaOH + 0,03 H2↑
Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита (раствора NaCl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия.
Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
Стандарты качества хлора
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения черезмембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. Вжелудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na + /K + — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3 − (кислотно-щелочной баланс).
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредствомлистопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхности от солнечного света.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной растворомсульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Читайте также:

