План обследования при остром лейкозе
Клинический анализ крови при остром лейкозе. У большинства больных острым лейкозом (ОЛ) на момент диагностики заболевания имеется нормохромная нормоцитарная анемия, в большей степени выраженная при остром миелобластном лейкозе. При развитии геморрагических осложнений может отмечаться гипохромия вследствие дефицита железа. Количество лейкоцитов периферической крови варьирует в очень широких пределах (от 1 • 10 9 /л до 200 • 10 9 /л), но чаще остается на сублейкемическом уровне и не превышает 20-30 • 10 9 /л.
У 20% пациентов количество бластных клеток превышает 50 • 109/л, а у 10% бласты в периферической крови отсутствуют (при этом обычно отмечаются панцитопения и относительный лимфоцитоз). При уровне лейкоцитов выше 100 • 10 9 /л резко повышается риск развития лейкостатических осложнений (неврологические нарушения, острый респираторный дистресс-синдром, у мужчин, кроме того, приапизм).
Тромбоцитопения выявляется у подавляющего числа больных острым лейкозом и более выражена при остром миелобластном лейкозе (ОМЛ) (у половины больных число тромбоцитов менее 50 • 10 9 /л). В то же время у 1-2% пациентов отмечается тромбоцитоз (более 400 • 10 9 /л).
У части больных может отмечаться увеличение протромбинового и парциального тромбопластинового времени; при остром промиелоцитарном лейкозе часто наблюдается снижение уровня фибриногена и другие признаки синдрома ДВС. Следует отметить, что развитие синдрома ДВС возможно при любом варианте острого лейкоза.
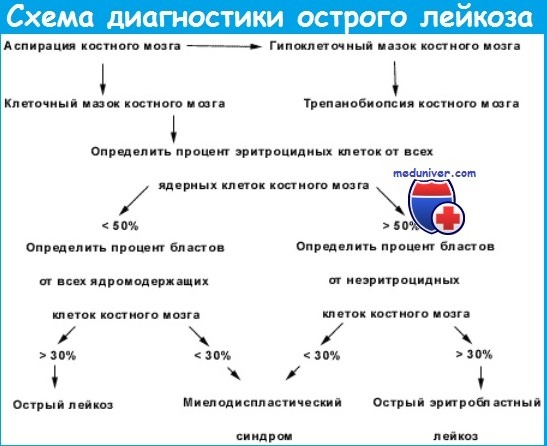
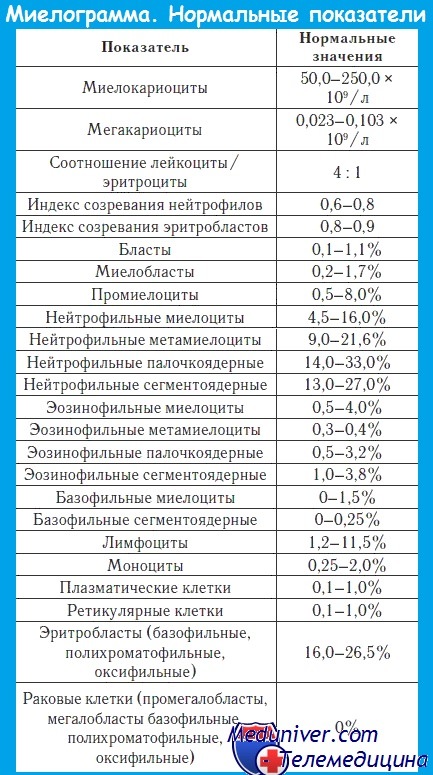
Миелограмма при остром лейкозе. Исследование аспирата костного мозга необходимо для диагностики и установления варианта острого лейкоза. Количество миелокариоцитов обычно повышено, мегакариоциты отсутствуют или их количество снижено. При подсчете миелограммы выявляется не менее 20% бластов, сужение нормальных ростков гемопоэза. Для верификации варианта острого лейкоза необходимо проведение цитохимических, иммунологических и цитогенетических исследований, результаты которых имеют прогностическое значение и позволяют планировать лечебную тактику.
Цитологическое исследование спинномозговой жидкости при остром лейкозе выполняется у всех больных острым лейкозом до начала лечения. При отсутствии патологии при остром лимфобластном лейкозе, миеломонобластных и монобластных острых лейкозов в дальнейшем проводится профилактика нейролейкоза. При развитии нейролейкоза проводят его лечение, результаты которого оцениваются на основании анализа клеточного состава спинномозговой жидкости.
Биохимические исследования при остром лейкозе. В большинстве случаев биохимические показатели находятся в пределах нормальных величин, однако при отдельных вариантах острого лейкоза (ОЛЛ, монобластный лейкоз) может отмечаться нарушение функции почек (повышение уровня креатинина) вследствие их инфильтрации опухолевыми клетками. Специфическая инфильтрация почек и/или их увеличение могут быть документированы с помощью УЗИ или компьютерной томографии. В ряде случаев (при остром лейкозе с гиперлейкоцитозом, острый лимфобластный лейкоз с органомегалией) уже в дебюте заболевания выявляется синдром лизиса опухоли.
Чаще, однако, этот синдром наблюдается при быстром лизисе клеток на фоне химиотерапии и характеризуется гипокальциемией, гиперкалиемией, повышением уровня ЛДГ и гиперурикемией с развитием почечной недостаточности.
Инструментальные исследования при остром лейкозе не имеют решающего значения при остром лейкозе, однако их результаты могут влиять на характер проводимого лечения и прогноз заболевания. Так, рентгенография органов грудной клетки позволяет выявить увеличение лимфатических узлов средостения, пневмонию; электрокардиография — нарушения ритма и/или проводимости, обусловленные специфической инфильтрацией миокарда, антрациклиновой кардиомиопатией и т. д.
Определение. Острый лейкоз – миелопролиферативная опухоль, субстратом которой являются бласты, лишенные способности дифференцироваться в зрелые клетки крови.
МКБ10: С91.0 – Острый лимфобластный лейкоз.
С92.0 – Острый миелоидный лейкоз.
С93.0 – Острый моноцитарный лейкоз.
Этиология. Латентная вирусная инфекция, предрасполагающая наследственность, воздействие ионизирующей радиации способны вызывать соматические мутации в кроветворной ткани. Среди мутантных полипотентных клеток, близких к стволовой клетке, может сформироваться клон нечувствительный к иммунорегуляторным воздействиям. Из мутантного клона формируется интенсивно пролиферирующая и метастазирующая за пределы костного мозга опухоль, состоящая из бластов одного вида. Отличительной особенностью опухолевых бластов является неспособность к дальнейшей дифференциации в зрелые клетки крови.
Патогенез. Важнейшим звеном патогенеза острого лейкоза является конкурентное метаболическое подавление аномальными бластами функциональной активности нормальной кроветворной ткани и вытеснение ее из костного мозга. В результате возникают апластическая анемия, агранулоцитоз, тромбоцитопения с характерными геморрагическим синдромом, тяжелыми инфекционными осложнениями вследствие глубоких нарушений во всех звеньях иммунитета, глубокими дистрофическими сдвигами в тканях внутренних органов.
Согласно классификации FAB (кооперативная группа гематологов Франции, Америки и Британии, 1990 г.) выделяют:
Острые лимфобластные лейкозы.
Острые нелимфобластные или миелогенные лейкозы.
Острые лимфобластные лейкозы подразделяются на 3 типа:
L1 - острый микролимфобластный тип. Антигенные маркеры бластов соответствуют нулевым ("ни Т, ни В") или тимусзависимым (Т) линиям лимфопоэза. Встречается главным образом у детей.
L2 - острый лимфобластный. Его с субстрат - типичные лимфобласты, антигенные маркеры которых такие же как и при L1 типе острого лейкоза. Чаще встречается у взрослых.
L3 - острый макролимфоцитарный и пролимфоцитарный лейкоз. Бласты имеют антигенные маркеры В-лимфоцитов, морфологически схожи с клетками лимфомы Беркитта. Этот тип встречается редко. Отличается очень плохим прогнозом.
Острые нелимфобластные (миелогенные) лейкозы делятся на 6 типов:
М0 - острый недифференцированный лейкоз.
М1 - острый миелобластный лейкоз без вызревания клеток.
М2 - острый миелобластный лейкоз с признаками вызревания клеток.
М3 - острый промиелоцитарный лейкоз.
М4 - острый миеломонобластный лейкоз.
М5 - острый монобластный лейкоз.
М6 - острый эритромиелоз.
Клиническая картина. В клиническом течении острых лейкозов выделяют следующие стадии:
Начальный период (первично-активная стадия).
У многих больных в начальный период ОЛ выявляется увеличение периферических лимфоузлов, умеренная спленомегалия.
Стадия развернутых клинико-гематологических проявлений (первая атака).
Характеризуется резким ухудшением общего состояния больных. Типичны жалобы на выраженную общую слабость, высокую лихорадку, боли в костях, в левом подреберье в области селезенки, кровоточивость. На этой стадии формируются клинические синдромы, типичные для ОЛ:
Гиперпластический (инфильтративный) синдром.
Увеличение лимфатических узлов и селезенки одно из самым типичных проявлений диссеминации лейкозной опухоли. Лейкозная инфильтрация нередко вызывает подкапсульные кровоизлияния, инфаркты, разрывы селезенки.
Печень и почки также бывают увеличенными вследствие лейкозной инфильтрации. Лейкозные фильтраты в легких, плевре, медиастинальных лимфоузлах проявляются симптомами пневмонии, экссудативного плеврита.
Лейкемическая инфильтрация десен с их набуханием, гиперемией, изъязвлениями обычное явление для острого моноцитарного лейкоза.
Локализованные опухолевые массы (лейкемиды) в коже, глазных яблоках, в других местах возникают при нелимфобластных (миелоидных) формах лейкоза на поздних стадиях заболевания. При некоторых миелобластных лейкозах лейкемиды могут иметь зеленоватый цвет ("хлорома") из-за присутствия в бластных клетках опухоли миелопероксидазы.
Анемический синдром.
Лейкозная инфильтрация и метаболическое угнетение нормальных ростков костномозгового кроветворения приводят к возникновению апластической анемии. Обычно анемия нормохромная. При остром эритромиелозе она может иметь гиперхромный мегалобластоидный характер с умеренно выраженным гемолитическим компонентом. При выраженной спленомегалии может возникать гемолитическая анемия.
Геморрагический синдром.
Обусловлен тромбоцитопенией, ДВС-синдромом. Проявляется подкожными кровоизлияниями (тромбоцитопеническая пурпура), кровоточивостью десен, носовыми, маточными кровотечениями. Возможны желудочно-кишечные, легочные кровотечения, макрогематурия. Наряду с геморрагиями нередко возникают тромбофлебиты, тромбоэмболии, другие гиперкоагуляционные нарушения, обусловленные ДВС-синдромом. Это одно из характерных проявлений острого промиелоцитарного и миеломонобластного лейкозов.
Синдром иммунодефицита.
Формирование иммунодефицитного состояния обусловлено вытеснением лейкозными бластами нормальных клонов иммунокомпетентных клеток из костного мозга. Клинически проявляется лихорадкой, нередко гектического типа. Появляются очаги хронической инфекции разной локализации. Характерно возникновение язвенно-некротической ангины, перитонзиллярных абсцессов, некротического гингивита, стоматита, пиодермии, параректальных абсцессов, пневмонии, пиелонефрита. Генерализация инфекции с развитием сепсиса, множественных абсцессов в печени, почках, гемолитической желтухи, ДВС-синдрома часто является причиной смерти больного.
Синдром нейролейкемии.
Характеризуется метастатическим распространением очагов бластной пролиферации в мозговые оболочки, вещество головного мозга, структуры спинного мозга, нервные стволы. Проявляется менингиальными симптомами - головной болью, тошнотой, рвотой, нарушениями зрения, ригидностью затылочных мышц. Формирование крупных опухолевидных лейкозных инфильтратов в головном мозге сопровождается очаговой симптоматикой, параличами черепно-мозговых нервов.
Ремиссия, достигнутая в результате проводимого лечения.
Под влиянием проводимого лечения происходит угасание (неполная ремиссия) или даже полное исчезновение (полная ремиссия) всех клинических проявлений заболевания.
Рецидив (вторая и последующие атаки).
Под влиянием противорецидивной терапии может вновь быть достигнута ремиссия. Оптимальная тактика лечения может привести к выздоровлению. При нечувствительности к проводимому лечению ОЛ переходит в терминальную стадию.
Выздоровление.
Больного считают выздоровевшим, если полная клиническая и гематологическая ремиссия сохраняется более 5 лет.
Терминальная стадия.
Характеризуется недостаточностью или полным отсутствием терапевтического контроля над разрастанием и метастазированием лейкозного клона опухоли. В результате диффузной инфильтрации костного мозга, внутренних органов лейкозными бластами тотально подавляется система нормального кроветворения, исчезает инфекционный иммунитет, возникают глубокие нарушения в системе гемостаза. Смерть наступает от диссеминированных инфекционных поражений, некупируемого кровотечения, тяжелой интоксикации.
Клинические особенности морфологических типов острого лейкоза.
Острый недифференцированный лейкоз (М0). Встречается редко. Очень быстро прогрессирует с усугублением тяжелой апластической анемии, выраженного геморрагического синдрома. Ремиссии достигаются редко. Средняя продолжительность жизни менее 1 года.
Острый миелобластный лейкоз (М1-М2). Наиболее распространенный вариант острого нелимфобластного лейкоза. Чаще болеют взрослые. Отличается тяжелым, упорно прогрессирующим течением с выраженными анемическим, геморрагическим, иммунодепрессивным синдромами. Характерны язвенно-некротические поражения кожи, слизистых оболочек. Добиться ремиссии оказывается возможным у 60-80% больных. Средняя продолжительность жизни около 1 года.
Острый промиелоцитарный лейкоз (М3). Один из наиболее злокачественных вариантов. Характеризуется выраженным геморрагическим синдромом, который чаще всего и приводит больного к смерти. Бурные геморрагические проявления связывают с ДВС-синдромом, причиной которого является повышение тромбопластиновой активности лейкозных промиелоцитов. На их поверхности и в цитоплазме содержится в 10-15 раз больше тромбопластина чем у нормальных клеток. Своевременное лечение позволяет достичь ремиссии почти у каждого второго больного. Средняя продолжительность жизни достигает 2 лет.
Острый миеломонобластный лейкоз (М4). Клиническая симптоматика этой формы заболевания близка к острому миелобластному лейкозу. Отличия заключаются в большей склонности к некрозам. Чаще возникает ДВС-синдром. У каждого десятого больного имеет место нейролейкоз. Болезнь быстро прогрессирует. Часто возникают тяжелые инфекционные осложнения. Средняя продолжительность жизни и частота стойких ремиссий в два раза меньше чем при остром миелобластном лейкозе.
Острый монобластный лейкоз (М5). Редкая форма. По клиническим проявлениям мало отличается от миеломонобластного лейкоза. Отличается большей склонностью к быстрому и упорному прогрессированию. Поэтому средняя продолжительность жизни больных с этой формой лейкоза еще меньше - около 9 месяцев.
Острый эритромиелоз (М6). Редкая формы. Отличительной особенностью этой формы является упорная, глубокая анемия. Анемия гиперхромная с явлениями нерезко выраженного гемолиза. В лейкозных эритробластах выявляются мегалобластоидные отклонения. Большинство случаев острого эритромиелоза резистентно к проводимой терапии. Продолжительность жизни больных редко превышает 7 месяцев.
Острый лимфобластный лейкоз (L1,L2,L3). Эта форма характеризуется умеренно прогрессирующим течением. Сопровождается увеличением периферических лимфоузлов, селезенки, печени. Геморрагический синдром, язвенно-некротические осложнения бывают редко. Продолжительность жизни при остром лимфобластном лейкозе от 1,5 до 3 лет.
Диагностика.
Стернальный пунктат: В костном мозге нелеченных больных бласты составляют более 50% всех ядросодержащих клеток. Подавлены эритроцитарный, гранулоцитарный, мегакариоцитарный ростки. Выявляются признаки мегалобластного эритрогенеза.
Исследование спинномозговой жидкости: высокий цитоз, выявляются бластные клетки, повышено содержание белка.
Гистохимическое исследование бластов: определяется морфологический вариант нелимфобластного ОЛ.
Иммунотипирование лейкозных клеток: выявляется принадлежность лимфобластов к популяциям Т- или В-лимфоцитов, или к неопределенному (ни Т, ни В) типу.
Обоснование диагноза ОЛ.
Клинические проявления в виде анемического, геморрагического, иммунодефицитного синдромов, менингеальных явлений позволяют заподозрить заболевание и служат поводом для проведения стернальной пункции. Диагноз ОЛ основывается на обнаружении при стернальной пункции и/или трепанобиопсии крыла подвздошной кости бластной инфильтрации костного мозга.
Дифференциальный диагноз. Дифференциальный диагноз проводится в первую очередь с лейкемоидными реакциями, агранулоцитозом, апластическими анемиями.
При выходе из агранулоцитоза, вызванного токсическими или иммунными факторами, в периферической крови появляются бластные клетки. Может возникнуть ситуация, когда в мазке будут видны единичные зрелые лейкоциты и бласты без промежуточных клеточных форм. Однако при динамическом исследовании мазков крови будет наблюдаться появление следующих за бластами промежуточных форм, чего никогда не наблюдается у больных ОЛ. При агранулоцитозе в отличие от ОЛ нет избыточного содержания бластных клеток в костном мозге.
В отличие от ОЛ для апластических анемий не характерно увеличение лимфатических узлов, селезенки. В противоположность ОЛ при апластических анемиях имеет место обеднение костного мозга, большое содержание в нем жировой ткани. В костном мозге резко снижено количество бластов, чего не бывает при ОЛ.
План обследования.
Общий анализ крови.
Стернальная пункция и/или трепанобиопсия крыла подвздошной кости.
Иммунотипирование популяционной (В или Т) принадлежности лейкозных лимфобластов.
Гистохимическое типирование бластов для определения морфологического варианта нелимфобластного лейкоза.
Применяются методы химиотерапии, и трансплантация костного мозга.
Химиотерапия острых лейкозов проводится следующими этапами:
На 1 этапе (индукция ремиссии) наиболее эффективной программой медикаментозной терапии оказалась схема "7+3", с введением цитозара и рубомицина: Цитозар 100 мг/м 2 в сутки внутривенно в течение 7 дней. Рубомицин 45 мг/м 2 внутривенно в первые три дня недели.
На 2 этапе (консолидация ремиссии): При нелимфобластных лейкозах проводятся 2 курса химиотерапии по схеме "7+3".
На 3 этапе (поддерживающая терапия) в течение 5 лет больным нелимфобластным лейкозом непрерывно вводят препараты по схеме "5+2": Цитозар 100 мг/м 2 внутривенно каждые 12 часов в течение 5 дней. Тиогуанин 100 мг/м 2 внутрь каждые 12 часов в течение 5 дней.
На 4 этапе (профилактика нейролейкоза) сразу после морфологической верификации диагноза острого лейкоза, затем спустя 2 недели от начала лечения и, далее, через каждые 2 недели до наступления ремиссии в спинномозговой канал вводят метотрексат в дозе 12,5 мг/м 2 . Химиотерапию комбинируют с локальным облучением головы. Суммарная доза 24 Гр. В фазу ремиссии метотрексат вводят эндолюмбально 1 раз в 3 месяца.
Пересадка костного мозга производится в фазе первой ремиссии острого нелимфобластного лейкоза и второй ремиссии острого лимфобластного лейкоза.
Перед аллогенной трансплантацией костного мозга, тщательно подобранного по антигенам гистосовместимости, проводится химиотерапевтическая и лучевая подготовка больного с целью тотального уничтожения всех ростков его собственного кроветворения. Парентерально вводят сублетальные дозы циклофосфана (60-120 мг/кг). Затем тотально облучают все тело гамма-источником дозой в 10 грей. У донора берут около 800 мл взвеси костного мозга путем множественной аспирации из гребня подвздошной кости. К взвеси добавляют питательную среду, ее гепаринизируют, фильтруют и переливают больному через подключичный катетер.
Кроме аллогенной трансплантации, можно выполнить и аутологичную трансплантацию костного мозга. В период полной клинико-гематологической ремиссии у больного производится забор его собственного костного мозга из гребня подвздошной кости. Полученная взвесь костного мозга подвергается очистке от опухолевых клонов. Для этого она разделяется на сепараторе, где выделяются стволовые клетки, обрабатывается раствором 4-гидропероксициклофосфамидом или подвергается иммунологической обработке моноклональными антителами. Затем костный мозг замораживают. Проводят стандартную предварительную подготовку больного назначением высоких доз циклофосфамида и тотального облучения. Через 48 часов после этой процедуры размораживают костный мозг и возвращают его пациенту через подключичный катетер.
С целью лечения и профилактики инфекционных осложнений ОЛ назначают антибиотики широкого спектра действия, противогрибковые препараты. Парентерально вводят альфа-интерферон в дозе 50 млн. МЕ/сутки в течение недели.
При тяжело протекающем обострении осуществляют дезинтоксикационную терапию с парентеральным введением реополиглюкина. С этой же целью применяют плазмоферез, гемосорбцию.
Для купирования кровоточивости, вызванной тромбоцитопенией, проводят трансфузии тромбоцитов, полученных от доноров – близких родственников больного. Дефицит плазменных факторов свертывания, возникающий при ДВС-синдроме, купируют внутривенным струйным введением свежезамороженной плазмы.
Прогноз. При естественном (без лечения) течении острых лейкозов продолжительность жизни больных не превышает 3 месяцев. Химиотерапия позволяет достичь продолжительности жизни 5 и более лет у более чем 60% больных с лимфобластной формой лейкоза. В первую очередь это касается детей. При нелимфобластных формах стойкая ремиссия достигается труднее. Только 10-20% таких больных живут больше 1 года. Лучшие результаты дает трансплантация костного мозга. После аллогенной пересадки костного мозга ремиссия длительностью более 5 лет наступает у 70% больных с лимфобластным, и у 50-60% больных с нелимфобластным ОЛ. У 45% больных перенесших аутологичную трансплантацию костного мозга также возникает стойкая, многолетняя ремиссия. Эти операции наиболее эффективны у больных с острым нелимфобластным лейкозом, у которых химиотерапия не дает удовлетворительных результатов.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Диагноз острого лимфобластного лейкоза ставят на основании данных анамнеза, физикального обследования и лабораторных исследований.
Общий анализ крови: количество лейкоцитов может быть нормальным, сниженным или повышенным; часто, хотя и не всегда, обнаруживают бластные клетки; характерны гипорегенераторная нормохромная анемия и тромбоцитопения.
Биохимический анализ крови: характерно повышение активности ЛДГ; определяют также показатели функций почек и печени.
Миелограмма: костномозговую пункцию необходимо проводить минимум из двух точек (у детей до 2 лет это пяточные кости или бугристости большеберцовых костей, у детей старшего возраста - задние и передние ости подвздошных костей) для забора достаточного количества диагностического материала. Забор материала желательно проводить под общей анестезией. Необходимо сделать 8-10 мазков из каждой точки, а также собрать материал для иммунофенотипирования, цитогенетического и молекулярно-генетического исследований.
Спинномозговая пункция - обязательное диагностическое мероприятие, проводимое специалистом в условиях седации и при наличии в периферической крови тромбоцитов в количестве не менее 30 000 в мкл (при необходимости перед пункцией проводят трансфузии тромбоцитарной массы). Для приготовления цитопрепарата необходимо не менее 2 мл спинномозговой жидкости.
Желательно (а при наличии неврологической симптоматики - обязательно) проведение КТ головного мозга.
Ультразвуковое исследование позволяет определить размеры инфильтрированных паренхиматозных органов и увеличенных лимфатических узлов брюшной полости, малого таза и забрюшинного пространства, размеры и структуру яичек.
Рентгенография грудной клетки позволяет обнаружить увеличение средостения, выпотной плеврит. Рентгенографию костей и суставов выполняют по показаниям.
Чтобы уточнить диагноз и исключить поражения сердца, проводят электрокардиографию и эхокардиографию. Показаны консультации окулиста, оториноларинголога (осмотр глазного дна, придаточных пазух носа).
Специальные методы диагностики
Диагностика острого лимфобластного лейкоза основана на оценке опухолевого субстрата - костного мозга, ликвора.
Цитологическое исследование костного мозга позволяет обнаружить гиперклеточность, сужение ростков нормального кроветворения и инфильтрацию властными клетками - от 25% до тотального замещения костного мозга опухолью.
Морфологическое сходство злокачественных лимфобластов и нормальных клеток-предшественников требует определения процентного соотношения лимфобластов в мазках костного мозга, окрашенных по Романовскому-Гимзе. Морфологическая классификация острого лимфобластного лейкоза, согласно критериям группы FAB (Франко-Американо-Британская кооперативная группа), предусматривает на основании определения размеров, строения ядра, наличия включений и других признаков подразделение бластов на группы L1, L2 и L3 Более 90% случаев острого лимфобластного лейкоза у детей относят к варианту L1, 5-15% - к L2, менее 1% - к L3. В настоящее время острый лейкоз со зрелым В-фенотипом (L3) относят к группе неходжкинских лимфом (в данном разделе этот вариант не рассматривается).
Цитохимическое исследование - следующий обязательный этап диагностики. С помощью цитохимического окрашивания выявляют принадлежность клеток к определённой линии дифференцировки. Обязательно используют окрашивание на миелопероксидазу (реакция клеток, принадлежащих к лимфоидной линии дифференцировки, отрицательна). ШИК-реакция на гликоген помогает дифференцировать лимфоидные бласты вследствие характерного гранулярного окрашивания цитоплазмы. Окраска Суданом чёрным положительна в миелоидных клетках с типичным расположением гранул. Кислую фосфатазу обнаруживают при Т-клеточном лейкозе.
Иммунофенотипирование - одно из основных исследований, определяющее клеточную принадлежность бластной популяции и прогноз заболевания. Специфические поверхностные и цитоплазматические антигены Т- и В-лимфоцитов используют в качестве маркёров для идентификации, определения происхождения и стадии дифференцировки лимфоидных клеток. Использование панели моноклональных антител к кластерам дифференцировки и определение процентного соотношения их экспрессии в властной популяции позволяет указать, к Т- или В-линии относится лейкемический клон у данного больного. На результатах иммунофенотипирования властных клеток, согласно современной классификации, основан диагноз острый лимфобластный лейкоз.
Цитогенетические и молекулярно-генетические методы в последние годы широко применяют для изучения лейкемических клеток. Методы позволяют оценить состояние хромосомного аппарата - количество хромосом и их структурные изменения (транслокации, инверсии, делеции). Цитогенетические аномалии и ДНК-индекс (соотношение количества ДНК в лейкемических клетках и в клетках с нормальным диплоидным кариотипом) - значимые прогностические факторы. Выявление клональных аномалий, характерных для клеток опухоли данного пациента, позволяет отслеживать количество этих клеток в динамике заболевания на молекулярно-генетическом уровне и определять минимальную резидуальную клеточную популяцию. Идентификация и молекулярная характеристика генов, регуляция или функция которых может быть повреждена в результате хромосомных изменений, способствует пониманию молекулярных основ злокачественной трансформации.
Важный прогностический фактор - оценка минимальной резидуальной болезни. то есть оценка количества остаточных лейкемических клеток у пациента в ремиссии. Техника выявления минимальной резидуальной болезни заключена в определении клеток с аномалиями кариотипа с помощью цитогенетических методов (можно обнаружить одну аномальную клетку на 100 нормальных) или полимеразной цепной реакции (ПЦР позволяет обнаружить одну патологическую клетку из 10 5 нормальных). Очень чувствительный метод - проточная цитофлюориметрия, позволяющая обнаружить клетки с аномальным иммунофенотипом. Высокий уровень минимальной резидуальной болезни после индукции ремиссии или перед поддерживающей терапией коррелирует с плохим прогнозом.
Прогностические факторы исхода терапии острого лимфобластного лейкоза
Для дальнейшего обследования больного необходимо:
-ОАК - для динамического наблюдения показателей,
-ОАМ - для динамического наблюдения показателей,
-рентгенологическое исследование органов грудной полости,
-стернальная пункция - для динамического наблюдения показателей,
-УЗИ внутренних органов.
-определение группы крови и резус - принадлежности
Острый миелобластный лейкоз, первая атака, острая фаза
Обоснование клинического диагноза
Ставится на основании:
-жалоб: на общую слабость, усталость, одышку в покое, беспричинные геморрагии по всему телу, потерю веса;
-анамнеза: считает себя больным с 13.01. 2012 г. когда впервые появились беспричинные геморрагии по всему телу, почувствовал сильную слабость, одышку, появилась субфебрильная температура, потеря в весе около 3-5 кг за месяц. Произошло кровоизлияние в левый глаз.
- лабораторных данных: в ОАК выраженный лейкоцитоз, анемия, тромбоцитопения, в стернальном пунктате 83,1% бластных клеток.
Ставиться на основании:
- жалоб: на внезапную общую слабость, усталость, одышку в покое, беспричинные геморрагии по всему телу, потерю веса;
- анамнеза: считает себя больным с 13.01. 2012 г. когда впервые появились беспричинные геморрагии по всему телу, почувствовал сильную слабость, одышку, появилась субфебрильная температура, потеря в весе около 3-5 кг за месяц. Произошло кровоизлияние в левый глаз;
- лабораторных данных: по данным ОАК - анемия, тромбоцитопения, лейкемический провал, по данны стернального пунктата - бласты 83,1% ядерного состава (средних, и мелких размеров, с округлыми ядрами, нежный стуктурный хроматин);
3. Миелоцитарный вариант ставится на основании анализа стернального пунктата от 20.01.12, по которому обнаружено 83,1% миелоцитарных бластов с положительной реакцией на МПО во всех бластных клетках.
Выставляется на основании:
- жалоб: на внезапную общую слабость, усталость, одышку в покое, беспричинные геморрагии по всему телу, потерю веса;
- анамнеза - считает себя больным с 13.01. 2012 г. когда впервые появились беспричинные геморрагии по всему телу, почувствовал сильную слабость, одышку, появилась субфебрильная температура, потеря в весе около 3-5 кг за месяц. Произошло кровоизлияние в левый глаз;
-лабораторных исследований: в стернальном пунктате высокий бластоз костного мозга (костный мозг гиперклеточный, красный и мегакариоцитарный ростки редуцированы).
Необходимо повести дифференциальную диагностику с хроническим лейкозом.
Субстратом острого лейкоза являются молодые (бластные) клетки. А при хронических же лейкозах основным клеточным субстратом являются созревающие и зрелые клетки. Что подтверждается результатами стернального пунктата от 20.01.12 в котором было обнаружено 83,1% бластных форм. И данное исследование так же позволяет определить вариант лейкоза как миелобластный. Так же в пользу острого течения процесса говорит внезапное начало процесса. И отсутствие в ОАК крови за этот же период времени переходных форм.
Этиология и патогенез
Этиология лейкозов окончательно не установлена. Вопрос об этиологии гемобластозов, как и других опухолей, сводится к определению наследственных и приобретенных условий, способствующих возникновению опухоли, с одной стороны, и к выяснению непосредственного события, запускающего одну клетку в безграничную пролиферацию,- с другой.
В группе лейкозов человека встречаются опухоли, закономерно возникающие под влиянием очевидных мутагенов.
В настоящее время установлены факторы, способствующие развитию острых лейкозов:
1. Ионизирующая радиация.
Анализ радиационных причин возникновения лейкозов показал, что существует отчетливая зависимость частоты острых лейкозов от дозы воздействия ионизирующей радиации. Доказана возможность прямого участия радиационного повреждения хромосом в развитии опухоли, так как клетки, составляющие субстрат опухоли, имели специфические радиационные повреждения. Вместе с тем обнаружена связь частоты индуцируемых лейкозов и возраста облучавшихся: острый лимфобластный лейкоз возникает под влиянием радиации у лиц моложе 19 лет, миелобластный - преимущественно у облученных в возрасте 30-44 лет.
2. Химические мутагены.
В последнее время стали накапливаться факты, подтверждающие роль химических веществ в развитии острых лейкозов. К перечню таких мутагенов относят: бензол, органические растворители, лаки, краски, пестициды, полициклические углеводороды. Возможна причастность к развитию острых лейкозов лекарственных препаратов: мелфалан, азатиоприн, лейкеран (хлорбутин), метотрексат, циклофосфан; единичные сообщения касаются миелосана (милерана). Наряду с этими препаратами цитостатического направления, используемыми в качестве иммунодепрессантов, препаратом, индуцирующим развитие острого миелобластного лейкоза, оказался и левомицетин. Существуют отдельные описания острых лейкозов у лиц, длительно применявших терапию бутадионом, который обладает некоторым миелотоксическим действием.
3. Онкогенные вирусы.
В процессе экспериментального исследования этой проблемы были выделены вирусные онкогены-гены, способные заставлять клетку непрерывно пролиферировать после встраивания в ее геном. Идентичность вирусных онкогенов клеточным онкогенам, найденным в опухолевых клетках, (в т.ч. лейкозных) животных и человека, дает основание предполагать, с одной стороны, связь онкогенов с опухолевым ростом, с другой-связь некоторых вирусов с лейкозогенезом. Среди таких вирусов выделяют вирус Эбштейна-Барр в качестве фактора, оказывающегося провокатором повышенной пролиферации клеток, в условиях которой они повышенно мутируют, и в них, вследствие высокой мутабельности, но не под действием вируса, возникают специфические мутации, приводящие к развитию патологического клона.
Как мутаген вирус не является специфическим этиологическим фактором. В пользу вирусной природы лейкозов человека приводятся случаи так называемого горизонтального распространения лейкозов в отдельных семьях, когда лейкозами заболевают некровные родственники или соседи.
Роль вирусов обсуждается при рецидиве лейкоза из донорских клеток трансплантированного костного мозга у больных острым лейкозом. Поскольку сохраняется форма лейкоза и тип хромосомной перестройки, то, вероятно, речь идет о переносе ДНК лейкозной клетки (трансформирующего гена) в геном донорской клетки.
В семьях лиц, больных острым лейкозом, риск развития заболевания повышается в 3-4 раза. При наличии острого лейкоза у одного из монозиготных близнецов вероятность заболевания другого составляет 25%. Особый интерес представляют наследственные заболевания с дефектами хромосом: болезнь Дауна, синдром Клайнфельтера, Шерешевского-Тернера или с их повышенной ломкостью: синдром Фанкони. Таким образом, к острому лейкозу ведут наследственные заболевания, сопровождающиеся нестабильностью генома. При болезни Дауна вероятность развития лейкоза увеличивается в 10-20 раз.
5. Предшествующие заболевания системы кроветворения: миелодисплазии, рефрактерные анемии, пароксизмальная ночная гемоглобинурия.
Этиологический фактор развития острого лейкоза у курируемой больной не известен, т.к. она не подвергалась воздействию ионизирующей радиации, не контактировала с химическими мутагенами, в т.ч. не принимала цитостатические препараты, не переносила вирусные заболевания, ее наследственность по лейкозам не является отягощенной, в анамнезе отсутствуют предшествующие заболевания системы кроветворения.
В настоящее время общепринятой является клоновая теория патогенеза лейкозов, которая представляется следующим образом: один из лейкозогенных агентов (вирус, ионизирующая радиация и т.д.), при условии наследственной нестабильности генетического аппарата, вызывает мутацию гемопоэтической клетки 1,2 или 3 класса, возможно стволовой клетки. Возникший патологический клон еще не в полной мере отошел от нормальных, он сохраняет способность к дифференцировке. Генетическая нестабильность его приводит к повторным мутациям (возможно на уровни предшественников 2-3 классов), в результате которых клетки патологического клона теряют способность к дифференцировки и выполнению своих нормальных функций. Таким образом, лейкозные клетки представляют собой клон-потомство одной мутированной клетки. Одна мутированная клетка дает после деления огромное количество клеток (за 3 месяца-1012 клеток-массой 1 кг.), и только тогда начинаются клинические проявления болезни.
Отличия лейкозной клеточной популяции от нормальной:
-в лейкозной популяции нарушаются соотношения между процессами пролиферациями и дифференцировки вследствие блокады последней.
-лейкозная клетка, утратившая способность к дифференцировке, сохраняет способность только к неконтролируемому делению. Опухолевая масса растет в геометрической прогрессии;
-происходит увеличение жизни лейкозных клеток;
-лейкозные клетки способны к избыточной продукции колониие-стимулирующего фактора, сильнее действующий на лейкозные клетки, чем на нормальные клетки-предшественники гемопоэза;
-опухолевые клетки тормозят нормальный гемопоэз за счет механического вытеснения нормального кроветворения или наличия конкуренции за питание нормальной и патологической групп клеток;- лейкозные клетки обладают способностью расти вне органов кроветворения: в коже, почках, мозговых оболочках-метастазировать. Появление метастазов отражает возникновение нового адаптированного к данной ткани субклона.
- в лейкозном клоне обнаруживают наличие двух клеточных популяций-пролифирирующей и непролифирирующей;
Опухолевый клон приводит к подавлению нормального кроветворения, что влечет за собой развитие анемии, тромбоцитопении, лейкопении, гранулоцитопении. Гранулоцитопения является причиной многих инфекционных осложнений: некротическая ангина, пневмония, абсцесс, сепсис.
Опухолевый клон-это большое количество клеток, и как бы долго они не жили, они распадаются, что приводит интоксикации, тяжелому нарушению пуринового обмена, подагрического синдрома, почечной недостаточности.
Лейкоз может происходить последовательно разные этапы, но иногда болезнь начинается с симптомов, свойственных конечному этапу: с угнетения нормальных ростков кроветворения, образования конгломератов из бластных клеток в разных органах или с резистентности к обычным цитостатическим препаратам. В связи с этим в терапии острого лейкоза в определенном проценте случаев бывают неудачи уже на первых пора
Схема патогенеза острого лейкоза
Мутагенное воздействие на Генетическая нестабильность.
Образование патологического клона клеток.
Пролиферация клона в лейкемическая инфильтрация пролиферация в
костном мозге. органов. лимфоидных органах
Вытеснение нормального кроветворения.
Анемия, тромбоцитопения, лейкопения.
Гепатоспленмегалия, нейролейкоз, лейкемиды.
Интоксикация, лихорадка, снижение массы тела, нарушение пуринового обмена.
Читайте также:

