Периоды развития зно понятие ранний рак
Метаплазия. Сущность метаплазии заключается в том, что камбиальные клетки тканей в необычных условиях начинают дифференцироваться в структуры, не свойственные данному органу, т.е. одна дифференцированная ткань замещается другой дифференцированной. При этом метаплазированная ткань и ее клетки не имеют признаков атипизма, а сама метаплазия обратима, что характеризует ее, в отличие от дисплазии, как доброкачественный процесс. Метаплазия обычно является реакцией на повреждающие воздействия и позволяет ткани выживать в неблагоприятных условиях. Например, появление филогенетически более древнего кишечного эпителия в желудке расценивается как приспособительный механизм в ответ на инфицирование желудка Н. pylori.
Принято считать, что в большинстве случаев нет прямой связи между метаплазией и раком. Однако в метапластических очагах могут в последующем появляться признаки неопластического развития - дисплазии, что и составляет повышенный риск возникновения рака. С этих позиций метаплазия обычно рассматривается как фоновое состояние.
Дисплазия. По рекомендации экспертов ВОЗ к предраковым изменениям относят дисплазию, которая характеризуется недостаточной и неполной дифференцировкой стволовых клеток, нарушениями координации между пролиферацией и созрёванием клеток. В большинстве органов дисплазия развивается на фоне предшествующей гиперплазии, связанной с хроническим воспалением или дисгормональными нарушениями, но может возникать и de novo, т.е. сразу как таковая.
Под термином ≪дисплазия≫ понимают отклонения от нормальной структуры всего тканевого комплекса (а не только появление клеток с признаками клеточной атипии).
Во всех органах при дисплазии эпителия всегда наблюдается расширение герминативных зон, сопровождающееся нарушением гистоструктуры и пролиферацией камбиальных, незрелых клеток с различной степенью атипии. Исходя из этого, эксперты ВОЗ определили дисплазию эпителия триадой: 1) клеточной атипией; 2) нарушенной дифференцировкой клеток; 3) нарушением архитектоники ткани.
В нормальном эпителии имеется четкая стратификация , т.е. расположение клеток упорядоченными слоями, а герминативная зона - базальный слой клеток эпителия - незначительной ширины.
При дисплазии I степени эпителий отличается от нормального лишь тенденцией к пролиферации базального слоя клеток (т.е. расширением герминативной зоны), а у клеток только намечаются признаки атипизма. Эпителиоциты начинают терять свою полярную ориентацию в архитектонике покровного пласта, что приводит к изменению стратификации.
При II степени дисплазии пролиферирующие базальные клетки занимают более половины высоты эпителиального пласта, атипия клеток наблюдается преимущественно в его средних слоях, т.е стратификация усугубляется и эпителий в таких очагах приобретает многорядно-многослойное строение. Ill степень дисплазии характеризуется замещением незрелыми клетками из базального слоя практически всего эпителиального пласта. Только в верхнем его ряду сохраняются зрелые клетки. Наблюдаются патологические митозы. Клеточный атипизм увеличивается, многослойный эпителий теряет зональное строение, приобретая ≪анархию архитектоники≫. Прогрессирует нарушение стратификации клеток и превращение эпителия в многорядно-многослоиный пласт. Базальная мембрана сохранена. Указанные изменения близки к уровню карциномы in situ,
При дисплазии обнаруживаются отчетливые изменения деятельности всех регуляторов межклеточных взаимоотношений: адгезивных молекул и их рецепторов, факторов роста, протоонкогенов и продуцируемых ими онкобелков. Более того, генетические перестройки могут значительно опережать морфологические изменения и служить ранними признаками предопухолевых изменений. С течением времени дисплазия может регрессировать, носить стабильный характер или прогрессировать. Динамика морфологических проявлений дисплазии эпителиев в значительной мере зависит от степени выраженности и длительности ее существования. Слабая степень дисплазии практически не имеет отношения к раку. Обратное развитие слабой и умеренной дисплазии наблюдается повсеместно. Поэтому дисплазию I -II степени часто относят к факультативному предраку.
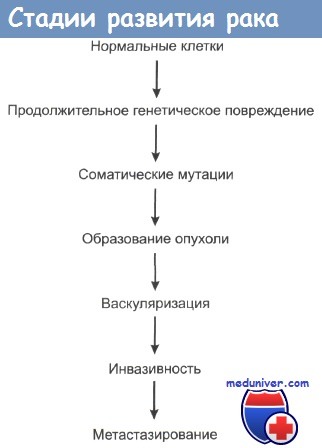
Этапы формирования опухоли: 1) гиперплазия ≫ 2) доброкачественные опухоли≫ 3) дисплазия ≫ 4) cancerinsitu≫ 5) инвазивный рак. Зачастую в этой цепочке может отсутствовать одно из звеньев, чаще всего второе. Данная цепь последовательных изменений называется еще морфологическим континуумом.
Термин ≪ранний рак впервые предложен для рака желудка. Позднее были сформулированы основные критерии раннего рака любой локализации. В основном, это высокодифференцированная опухоль в
пределах Т1, чаще с экзофитной формой роста, без регионарных и отдаленных метастазов, то есть это рак не выходящий за пределы слизистой, эпидермиса кожи, или другой ткани, на которой он возник. Практически опухоль не должна выходить за рамки T1NOMO.
Ранний рак - понятие клинико-морфологическое, основанное на тщательном изучении операционных данных и удаленного препарата. Точная характеристика раннего рака зависит от пораженного органа, но главный признак при раннемраке - ограничение опухоли пределами слизистой оболочки. Для некоторых
локализаций (слизистая губ и полости рта, пищевода, гортани, бронхов, шейки матки и др.) ранним раком является карцинома in situ. Для рака внутренних органов, выстланных железистым эпителием (желудок, кишечник, эндометрий) и паренхиматозных органов (молочная, щитовидная, предстательная железа и др.) понятие ≪ранний рак≫ может быть несколько шире и не совпадать с понятием ≪карцинома in situ≫ в силу особенностей архитектоники слизистых оболочек этих органов. В принципе ранним раком можно было бы назвать I стадию заболевания - опухоль в пределах паренхимы органа без метастазов. Однако в связи с отсутствием единообразия в биологическом поведении новообразований различных локализаций, а также в различии возможностей диагностики, термин ≪ранний рак≫ должен уточняться в каждой конкретной ситуации. В одном случае это может быть только carcinoma in situ, в другом - минимальный или малый рак без метастазов, в третьем - T1N0M0.
Малый рак - это инвазивный рак, наименьшая опухоль (чаще 1 см в диаметре), уверенно определяемая клиническими методами исследования.
Термин же ≪ранний≫ предполагает определенный этап малигнизации, когда опухоль локализована, отсутствуют метастазы и можно с большой достоверностью предсказать благоприятный исход радикального лечения.
Так, например, карцинома in situ желудка, являющаяся примером раннего рака, может занимать площадь до 10-12 см в диаметре; метастазы, как правило, отсутствуют, отдаленные результаты лечения самые благоприятные. С другой стороны, очень маленький по размерам рак желудка может обладать инвазивными свойствами и являться источником обширных метастазов (лимфо- и гематогенных).
Злокачественные новообразования характеризуется чрезвычайной вариабельностью клинического течения: от агрессивного до относительно доброкачественного.
≪Естественная история≫ развития рака - это период времени от гипотетической ≪первой≫ раковой клетки до смерти больного после достижения опухолью ≪критической≫ массы. Продолжительность ≪естественной истории≫ рака изучается методом математического моделирования в основном по показателю скорости роста опухоли и ее метастазов. Для количественной оценки темпов роста опухоли предложена условная единица - время удвоения (ВУ) - время, за которое опухоль удваивает свой объем.-Определяется ВУ на основании показателя скорости роста опухоли.
Для различия между возможной, когда отсутствуют клеточные потери, и действительной скоростью роста были предложены понятия потенциального и фактического ВУ опухоли.
Потенциальная скорость роста опухоли рассчитывается условно, по уровню ее пролиферативной активности.
Фактическая скорость отражает реальное увеличение объема опухоли за определенное время.
Темпы удвоения различных опухолей различны и зависят от целого ряда факторов. Общее правило заключается в том. что у недифференцированных опухолей скорость роста, как правило, выше. Среднее ВУ объема солидных новообразований, как показывают расчеты, составляет около 90 дней. Вместе с тем. Количественная характеристика ВУ положена в основу деления всех злокачественных новообразований на быстро растущие (ВУ менее 30 дней); умеренно растущие (ВУ 90-100 дней), которые составляют около 50% всех солидных опухолей, и медленно растущие (ВУ более 110 дней).
Исследования соотношения между параметрами фактической и потенциальной скорости роста показывают, что фактическая скорость всегда значительно ниже потенциальной. Это связано с тем, что в процессе роста опухоли всегда есть клеточные потери, которые достигают 80-96% и связаны с некрозом, метастазированием, переходом„клеток в фазу GO.
При описании динамики развития первичной опухоли используется ряд математических моделей ее роста. Среди них наибольшее признание получила модель, разработанная Шварцом. Она предложена для рака молочной железы, но, вероятно, может при определенных условиях использована и для других солидных опухолей. Согласно модели Швартца ≪естественная история≫ роста опухоли начинается от
гипотетической ≪первой≫ клетки диаметром примерно в 10 мкм и завершается гибелью организма после 40 удвоений ее объема, когда клеточная ПОПУЛЯЦИЯ достигает 10, г и опухолевая масса 1 кг. При этом предполагается, что опухоль растет экспоненциально (с постоянной скоростью)
Таким образом, на основе модели Швартца в ≪естественной истории≫ рака можно выделить два последовательных периода: доклинический и клинический.
Считается, что именно численность опухолевого клона в миллиард клеток (10R клеток) при весе опухоли 1 г и являются той минимальной, клинически распознаваемой массой для первично-локализованных (но не первично-системных) новообразований и находится на линии раздела этих периодов ее развития.
Доклинический период - длительный этап бессимптомного роста новообразования, в течение которого происходит 30 удвоений объема опухоли.
Клинический период - характеризуется проявлением многочисленных и разнообразных симптомов, обусловленных физическими и биологическими особенностями новообразований.
Модель Швартца позволяет также сделать очень важные с теоретической и практической точки зрения выводы. Во-первых, доклиническая фаза представляет собой подводную часть ≪айсберга≫ и доминирует в ≪ естественной истории развития рака над клинической. Следовательно, каким бы ≪ранним≫ ни был рак, с клинической точки зрения, с биологической - он всегда будет ≪поздним≫, так как существует уже в течение длительного времени.
На “основе данной модели, зная размеры опухоли и среднее время удвоения можно рассчитать продолжительность ее ≪естественной истории≫ роста до клинической манифестации.
Надо отметить, что слабой стороной рассуждений о ≪естественной истории≫ рака является фактическое исключение из ее продолжительности фазы карциномы in situ. Обычно все расчеты строятся на допущении, что с самого начала опухолевые клетки обладают ≪инвазивными≫ свойствами и могут даже попадать в сосуды и метастазировать. На самом же деле иногда опухоль может достигать достаточно больших размеров (50 мм в диаметре и 10’° клеток) и все еще сохранять черты карциномы in situ.
Обычно считается, что средние сроки перехода неинвазивного рака в инвазивный составляют около 9 лет. Однако, возможно, для части опухолей фаза in situ не является обязательной
Вторым по значимости событием в ≪естественной истории≫ после возникновения опухоли является начало метастаэирования. которое, в конечном счете, и определяет исход заболевания. Предполагается,
что формирование метастазов является длительным процессом, начинающимся на ранних этапах ≪естественной истории≫ и нарастающим со временем.
Принципиальная возможность метастаэирования появляется с началом ангиогенеза в опухоли При этом считается, что ангиогенез уже возможен после того, как количество опухолевых клеток превысит 1000 клеток, а диаметр опухоли будет 0,5 мм (. ), Однако недавно быта показано, что процесс формирования в опухоли сосудов может начинаться еще раньше - при 100-200 клетках
Клинический период ≪естественной истории≫ рака состоит из времени до появления клинически определяемых метастазов и времени клинических проявлений метастаирования, ведущих к смерти больного. Промежуток времени от операции до клинической манифестации метастазов называется без-рецидивным периодом. Его продолжительность определяется скоростью роста метастаза в доклинической фазе и после хирургического удаления.
Развитие опухоли в результате действия химических канцерогенов в настоящее время рассматривается как процесс не одномоментный, а многоэтапный. Многостадийность канцерогенеза может иметь два аспекта 1) этнологический — каждая стадия вызывается своим специфическим агентом, 2) морфологический — каждая стадия имеет только ей присущие морфологические и биологические проявления.
Рассмотрение первого аспекта имеет прямое отношение к пониманию этиологических факторов, играющих роль в возникновении и развитии злокачественных опухолей человека. Наиболее принятой схемой в настоящее время является двух стадийная на первой стадии (инициации) происходит описанное выше взаимодействие генотоксичесхого канцерогена с геномом клетки, приводящее к ее полной или частичной трансформации.
На второй стадии (промоции) происходит или превращение частично трансформированной клетки в опухолевую клетку, или пролиферация полностью трансформированной клетки с образованием опухоли. Эта гипотеза о двухстадийном развитии опухолей была предложена более 40 лет тому назад на основании опытов, проведенных на коже мышей, где в качестве инициатора применялась однократная субканиерогенная доза БП, MX или ДМБА (7,12-диметилбенз(а)антрацен), а в качестве промотора — длительное нанесение кротонового масла.
Были установлены определенные закономерности инициации — промоции комбинация инициатор — промотор эффективна лишь в указанной, а не в обратной последовательности; инициация необратима, а промоция до определенного момента обратима, т е отмена промотора может вести к регрессии возникших папиллом, инициатор может быть применен однократно, а промотор должен обязательно применяться длительно; эффект от комбинации инициатора с промотором во много раз превышает сумму эффектов каждого из них, взятого в отдельности, и т. д. Последнее было особенно демонстративно: если применявшаяся доза ПАУ и применявшаяся доза кротонового масла сами по себе или вовсе не вызывали папиллом кожи, или вызывали единичные опухоли, то их комбинация в указанной последовательности приводила к появлению множественных папиллом у всех или почти у всех мышей. При достаточно длительном нанесении кротонового масла часть папиллом малигнизировалась.
В течение трех десятилетий этот феномен воспроизводился лишь на коже мышей, поэтому его стали считать экспериментальным курьезом, не имеющим отношения ие только к человеку, но и к развитию опухолей в других органах животных Начиная с 70-х годов феномен инициации — промоции был воспроизведен на опухолях внутренних органов мышей, крыс и хомяков, вызванных самыми различными канцерогенами. Поскольку гипотеза двухстадий-ного канцерогенеза ныне постоянно используется при анализе возможных причин развития опухолей человека, следует вкратце остановиться на новых экспериментальных моделях инициации — промоции.
Использование этих моделей позволило выделить 2 группы стимуляторов канцерогенеза одни, влияющие на транспорт, метаболизм канцерогенов, их связывание с ДНК, т е на стадию инициации опухолей (их назвали коканцерогенами), и другие — промоторы, стимулирующие пролиферацию в уже возникших опухолевых клетках, т е ускоряющие рост опухоли, каким бы канцерогеном она ни была вызвана Модификаторы, тормозящие эти стадии канцерогенеза, называют актиканцерогеиами и антипромоторами соответственно. Таким образом, если модификатор вводится перед или одновременно с действием канцерогена, то он будет влиять на инициации Для изучения промоторной активности модификатор должен вводиться обязательно после прекращения действия канцерогена.
Индукция опухолей матки и молочной железы может быть ускорена эстрогенами, а опухолей железистого желудка у крыс — желчными кислотами, поваренной солью, опухолей щитовидной железы — метил- и пропилтиоурацилом, йод-дефицитной диетой, 3-амиио-1,2,4-триазолом, фенобарбиталом, 4,4'-диаминодифенилметаном
Известно, что большинство онкологических больных выявляется только после достижения опухолью массы в 1 г (30 удвоений — 109 клеток) и приблизительно размеров в 1 см.
Инвазивная опухоль такого диаметра обнаруживается визуально, пальпаторно, рентгенологически и эндоскопически.
Хотя вероятность метастазирования еще сравнительно невелика, ориентироваться только на размер опухоли нельзя.
Опухоль диаметром и до 1 см может иногда давать регионарные и отдаленные метастазы (до 12% наблюдений), тогда как при больших 1 см размерах этот показатель достигает 60-70%.
Помимо размеров, большое значение имеют такие биологические особенности, как локализация, гистологический вариант и степень дифференцировки, скорость и форма роста. При учете всех этих факторов прогноза можно выделить особую форму онкологической патологии — ранний рак, который может быть излечен с наибольшей долей вероятности.
Общие сведения о ранней онкологической патологии
Ранний рак — понятие клинико-морфологическое, основанное на тщательном изучении операционных данных и удаленного препарата. Точная характеристика раннего рака зависит от пораженного органа, но главный признак при раннем раке — ограничение опухоли пределами слизистой оболочки.
Биологическая агрессивность опухоли, метастазирование в расчет не принимаются. Хотя вероятность метастазирования в регионарные лимфатические узлы при уменьшении размеров первичного очага снижается, при малом раке она все же достигает 10-20%.
Так, например, карцинома in situ желудка, являющаяся примером раннего рака, может занимать площадь до 10-12 см в диаметре; метастазы, как правило, отсутствуют, отдаленные результаты лечения самые благоприятные.
С другой стороны, очень маленький по размерам рак желудка может обладать инвазивными свойствами и являться источником обширных метастазов (лимфо- и гематогенных). 5-летняя выживаемость после радикального лечения раннего рака составляет 95%, а малого рака с поражением лимфатических узлов — менее 78%.
Особенности диагностики ранней онкологической патологии
Это утверждение базируется на ряде положений. Во-первых, длительность биологического развития большинства новообразований максимальна в пределах I стадии, пока рак локализован и чем меньше размеры опухоли, тем медленнее прогрессия.
Это дает время для проведения диагностических мероприятий. Во-вторых, большинство существующих предраковых состояний и бессимптомный рак можно обнаружить доступными современными методами диагностики или соответствующими программами скрининга, участвовать в которых население психологически, вероятно, уже подготовлено.
В-третьих, в стране имеется достаточно квалифицированных специалистов и современной аппаратуры для проведения диагностических исследований. Очевидно также, что принципы диагностики для каждой нозологической формы рака будут иметь свои методологические особенности. В данном разделе излагаются общие подходы.
Для выявления I фазы ранней онкологической патологии — предболезни — онкологический скрининг еще мало разработан, а часто и невозможен. На сегодняшний день с определенной долей вероятности предположить эту стадию можно путем выявления факторов риска.
Предрак можно обнаружить на основании клинической симптоматики и подтвердить морфологическими методами. Цитологическое изучение смывов, отпечатков, мазков, пунктатов помогают установить степень дисплазии. При сомнениях в диагнозе показана биопсия для гистологического исследования.
Для выявления раннего рака в гастроэнтерологии, бронхологии используются высокоинформативные методы эндоскопической визуализации очагов малых размеров (0,5-1 см) с прицельным забором материала для цито- и гистологического исследований Высокой разрешающей способности достигли методы диагностики раннего рака молочной железы, шейки и тела матки, щитовидной железы и других локализаций.
Благодаря широкому использованию морфологических методов, ошибки при дифференциальной диагностике раннего рака встречаются редко, хотя распознать его значительно труднее, чем распространенные его формы.
Поэтому на сегодняшний день совершенно не допустимо популярное ранее динамическое наблюдение при небольших размерах первично выявленного подозрительного очага. Он должен быть исследован морфологически независимо от его размеров и чем раньше, тем лучше.
Значительную роль в диагностике раннего рака играют социальные факторы воспитания. Симптомы заболевания нередко проявляются на этапе не только раннего рака, но и предрака. Поэтому санитарно-просветительная работа среди населения — обязательный и важный компонент в организации своевременной диагностики новообразований.
И хотя психология людей меняется довольно медленно, но они должны быть осведомлены о том, при каких симптомах необходимо срочно обращаться к врачу, иметь представления о ранних этапах малигнизации и уверенность в возможности предотвращения рака.
И хотя преимущества скрининга достаточно очевидны, тем не менее, правильная оценка индивидуальных особенностей пациента в каждом конкретном случае, диагностика раннего рака на приеме у врача еще долго будут стоять на повестке дня, поскольку онкологически грамотный врач — тоже проблема воспитания.
Принципы лечения ранней онкологической патологии
При прединвазивном раке (carcinoma in situ) методом выбора в лечении должно быть удаление опухоли. При этом могут быть варианты в виде ее локального иссечения, электрокоагуляции, криодеструкции, обработки лазером. Но всегда должна быть полная уверенность в диагнозе, которую может дать только эксцизионная биопсия. Поэтому этот метод одновременной и диагностики, и печения должен применяться как можно шире.
При доказанном микроинвазивном раке применяется стандартный обьем хирургического лечения. Адъювантная лучевая или химиогормонотерапия не проводятся, поскольку 5-летняя выживаемость высока и без применения дополнительных воздействий.
Вопрос об органосохраняющих (секторальные, сегментарные и клиновидные резекции) хирургических вмешательствах должен решаться индивидуально. В основном, они применяются только в случае противопоказаний к радикальному хирургическому лечению.
Однако органосохраняющие операции обязательно дополняются облучением или химиогомонотерапией. В целом, практика показывает, что в настоящее время преобладает тенденция суживать объем хирургических операций. Более подробно лечение различных форм ранней онкологической патологии конкретных локализаций излагаются в соответствующих руководствах по частной онкологии.
Подводя итог данного раздела, нужно признать, что проблемы классификации, диагностики и лечения ранней онкологической патологии в настоящее время — решающее направление в совершенствовании общемедицинской и онкологической служб, которое позволит существенно снизить смертность от злокачественных новообразований.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
На сайте вы узнаете все о сестринском деле, уходе, манипуляциях
Синдромы рака. Течение рака. Доклинический период рака.
Течение рака
Раковые клетки в целом размножаются быстрее, чем нормальные клетки (исключая лейкоциты и клетки слизистой оболочки кишечника). По мере увеличения объема опухоли скорость размножения клеток снижается. Большинство опухолей существует в человеческом организме до момента их обнаружения клиническими методами от 1 года до 10 лет. Различают доклинический и клинический периоды опухолевого роста.
Под доклиническим периодом понимают длительный этап бессимптомного течения новообразования, когда опухоль может быть случайно обнаружена при проведении, например, профосмотра. На этот период приходится около ¾ общей продолжительности существования опухоли, ему соответствуют, как правило, 1-я и 2-я стадия ЗН.
Термин “ранний рак” впервые был предложен в 1956 г. R.Hess и характеризовал опухоль, не выходящую за пределы подслизистого слоя вне зависимости от поражения периорганных лимфоузлов.
Распознавание опухоли на стадии раннего рака представляет собой очень важный момент, поскольку существенно влияет на прогноз. Так, например, 5-летняя выживаемость после операций на желудке по поводу раннего рака составляет 70-90%, в то время как на стадии прогрессии она опускается ниже 10% (!)
Клинический период характеризует стадию прогрессии злокачественного новообразования, когда возникает разнообразная симптоматика, что соответствует запущенным (3-4) стадиям рака. Клиническая картина может быть специфичной или неспецифичной и проявляет себя определенными синдромами:
Синдром обтурации .
Наблюдается при опухолях большинства полых (трубчатых) или трубчатых структур некоторых паренхиматозных органов. Обусловлен постепенным сужением (либо сдавлением) просвета органа растущей опухолью. В различных органах феномен проявляется неодинаково.
Синдром деструкции .
Обусловлен распадом опухоли самопроизвольно, либо под воздействием механических факторов. Проявляется кровотечением, которое м.б. незначительным и не обнаруживаться визуально (оккультное кровотечение). Длительность может быть различной. При аррозии опухолью крупного сосуда может быть профузное кровотечение.
При наличии даже однократных кровянистых выделений необходимо заподозрить ЗН и тщательно исследовать соответствующий орган!
Синдром компрессии .
Проявляется таким симптомом как боль, возникающим вследствие увеличения размеров опухоли и прорастанием либо сдавлением нервных окончаний, стволов или сплетений. Развивается постепенно, усиливаясь с течением времени и приобретая постоянный характер, иногда становясь очень острой, а в поздних стадиях нестерпимой. Ведущий с-м при раке ПЖЖ, тела желудка, печени, опухолях почек, саркомах кости, реже – при раке легкого, пищевода и наружных органов.
Интоксикационный синдром .
Рост опухоли ведет к нарушению всех видов обмена, вызывая существенные сдвиги. Наиболее типичными симптомами являются общая слабость, похудание, снижение аппетита и нередко служат основанием для обращения к врачу. Данный синдром характерен для далеко зашедших стадий рака и наиболее выражен при раке желудка, ПЖЖ, печени. Практически может отсутствовать при опухолях матки, кожи и молочной железы.
Синдром “плюс-ткани” .
Является наиболее достоверным признаком опухоли, выявляемым клинически либо с помощью инструментальных методов. Характерны такие признаки, как бугристость, безболезненность, плотная консистенция, смещаемость вместе с окружающими тканями (при прорастании опухолью глубоких тканевых структур, подвижность ее теряется).
Синдром патологических выделений .
Характерен для рака прямой кишки, матки, иногда – молочной железы, кожи. Отделяемое м.б. кровянистым, сукровичным, иметь примеси слизи или гноя.
Синдром нарушения специфических функций органа .
Наиболее ярко выражен при опухолях эндокринной системы. При опухолях инсулярного аппарата ПЖЖ – гипо-(гипер)гликемия и нервные расстройства, при опухолях яичника – признаки вирилизации, при опухолях гипофиза – ожирение, признаки акромегалии и т.д.
Паранеопластические синдромы .
Клинические проявления, которые нельзя объяснить прямым влиянием опухоли или ее метастазов. При опухолях внутренних органов — тромбофлебиты, разнообразные кожные проявления, нарушения функции ССС, эндокринной, нервной систем и т.д. Обусловлены биохимическими сдвигами или результатами аутоиммунных реакций
При всех злокачественных опухолях применяются универсальные принципы стадирования, но при каждом типе рака они имеют определенные нюансы. Правильное определение стадии опухоли — одна из первостепенных задач, которая стоит перед онкологом на этапе обследования пациента.
Для чего нужно определять стадию рака?
Определение стадии злокачественной опухоли помогает решать важные задачи:
Стадии злокачественных опухолей TNM
TNM — основная система классификации стадий раковых заболеваний, она была разработана еще в середине прошлого столетия. Последняя, седьмая редакция Классификации TNM была принята в 2009 году. Она останется неизменной до тех пор, пока не накопятся новые технологии диагностики и лечения рака, из-за которых ее придется пересмотреть.
В классификации TNM учитываются три основные характеристики злокачественных опухолей, они соответствуют буквам аббревиатуры:
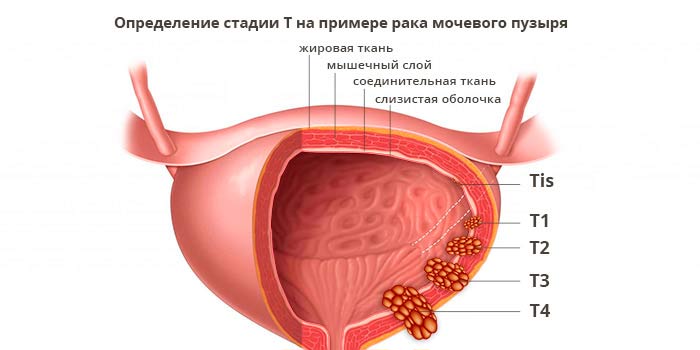
- T — tumor — характеристики первичной опухоли.
- N — nodus — распространение опухолевых клеток в регионарные лимфатические узлы.
- M — metastasis — наличие отдаленных метастазов.
В зависимости от характеристик конкретной злокачественной опухоли, при определении стадии к каждой букве приписывают цифру или специальное обозначение:
Характеристики первичной опухоли (T)
Если нужно уточнить стадию, к цифре дополнительно добавляют букву. Например, M1a при немелкоклеточном раке легкого означает, что опухолевые клетки распространились во второе легкое, либо присутствуют в плевральном выпоте (жидкости вокруг легких), либо в перикардиальном выпоте (жидкости вокруг сердца).
Иногда перед аббревиатурой TNM ставят букву, которая обозначает, каким образом был установлен диагноз:
- p — стадия рака была диагностирована патологоанатомами, после того как опухоль была удалена и оценена под микроскопом;
- c — клинический диагноз, установленный до проведения биопсии по данным обследования.
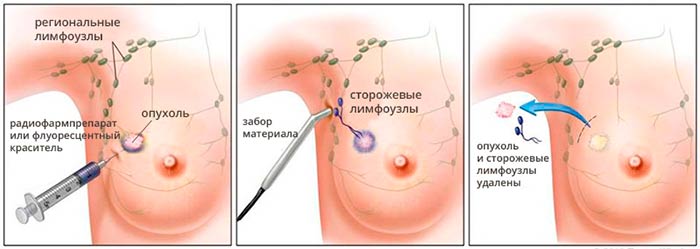
Оценивая результаты сентинель-биопсии, врачи применяют следующие обозначения:
- pNX(sn) — сторожевой лимфоузел не удалось оценить;
- pN0(sn) — в сторожевом лимфоузле не обнаружено метастазов;
- pN1(sn) — в сторожевом лимфоузле обнаружен метастаз.
Другие системы определений стадий опухолевого процесса
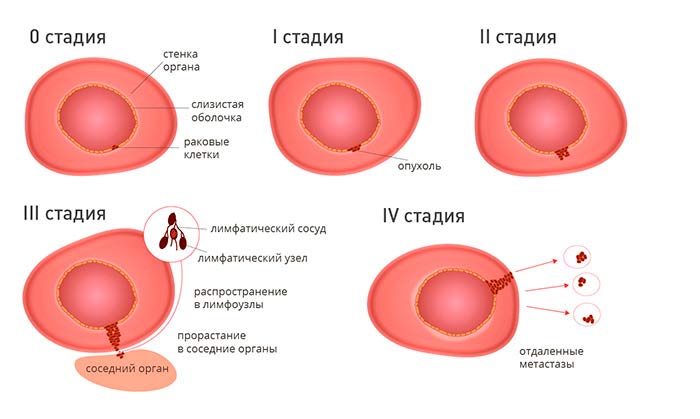
Врачи-онкологи часто используют упрощенную классификацию по стадиям злокачественных опухолевых образований. Она опирается на систему TNM, но в ней выделяют всего пять стадий, которые обозначаются римскими цифрами:
Под микроскопом раковые клетки отличаются от нормальных, и степень этого различия говорит о том, насколько агрессивно они себя ведут. В свою очередь, от этого зависит успешность лечения, вероятность рецидива, прогноз для пациента. Поэтому, наряду с общепринятой классификацией по стадиям, выделяют степени злокачественности рака. Их обозначают буквой G, к которой приписывают соответствующие индексы:
- GX — степень злокачественности онкологического заболевания не удалось оценить.
- G1 — высокодифференцированные опухоли. Опухолевая ткань сильно похожа на нормальную. Такой рак ведет себя наименее агрессивно, редко метастазирует. Прогноз для пациента наиболее благоприятный.
- G2 — умеренно дифференцированная опухоль. Раковые клетки уже довольно сильно отличаются от нормальных и ведут себя более агрессивно.
- G3 и G4 — низкодифференцированные и недифференцированные опухоли. Они отличаются наибольшей степенью злокачественности, ведут себя очень агрессивно, плохо реагируют на лечение.
Для того чтобы оценить, насколько успешно прошло хирургическое лечение рака, иногда онкологи используют специальную постоперационную классификацию:
- RX — сложно проверить, осталась ли опухолевая ткань в организме пациента после хирургического лечения.
- R0 — опухоль в организме пациента после операции отсутствует.
- R1 — обнаружена остаточная опухоль по данным микроскопического исследования.
- R2 — оставшаяся опухоль настолько большая, что обнаруживается при осмотре, без микроскопии.
Некоторые онкологические заболевания не укладываются в рамки общепринятой системы TNM:
- Опухоли у детей — это отдельная категория онкологических заболеваний. Они сильно отличаются от злокачественных опухолей, которые обнаруживаются у взрослых. Для них разработаны специальные системы классификаций, мы не будем их рассматривать в этой статье.
- Рак крови. Такие онкологические заболевания, как лимфома, лейкемия, множественная миелома не могут быть описаны системой TNM, потому что при них чаще всего нет солидной (плотной) опухоли с определенной локализацией. В каждом случае применяется своя специфическая классификация по стадиям.
- Опухоли нервной системы обычно не распространяются за пределы головного и спинного мозга. В настоящее время для них нет единой общепринятой классификации. Чаще всего, определяя стадию при таких онкологических заболеваниях, врачи используют только букву T.
Как определяют стадию онкологического заболевания?
В онкологии применяется много разных методов диагностики. Они обладают разной информативностью, позволяют установить диагноз с разной степенью точности. Соответственно, определить стадию можно тоже разными способами, с разной степенью достоверности. Для этого применяют специальные обозначения:
- C1 — стадия рака определена с помощью стандартных диагностических процедур — осмотра пациента врачом, рентгенографии, эндоскопического исследования. Это наименее точный метод.
- C2 — диагноз установлен на основании специальных, более точных методов диагностики: компьютерной томографии, МРТ, ПЭТ-сканирования, специальных разновидностей рентгенографии, эндосонографии, биопсии и др.
- C3 — выполнено диагностическое хирургическое вмешательство, получен фрагмент патологически измененной ткани, проведено цитологическое и гистологическое исследование.
- C4 — стадия опухоли установлена после полноценного хирургического вмешательства и исследования удаленной опухоли.
Важно понимать: стадия рака не меняется в процессе лечения
Стадию заболевания при раке устанавливают на момент первичного обследования — то есть сразу после того, как диагностировано онкологическое заболевание. Даже если в будущем опухоль уменьшится или, напротив, будет прогрессировать, стадия не изменится. Это важно понимать. Выживаемость и прогноз рассчитываются именно по стадии, которая диагностирована изначально.
Как быстро развивается рак?
За сколько времени рак переходит в 4 стадию? Здесь сроки тоже сильно различаются. Это зависит от агрессивности опухоли, от того, насколько рано больной обратился к врачу, какое проводилось лечение. Например, есть меланома, которая метастазирует очень быстро, а есть базальноклеточный рак кожи — он очень редко дает метастазы.
В онкологии есть такой показатель — время удвоения объема опухоли. Исследования показали, что масса быстрорастущих опухолей легких увеличивается вдвое примерно за 223 дня, а медленнорастущих — за 545 дней. Для аденокарцином этот срок составляет в среднем 303 дня, для плоскоклеточного рака — 77 дней, мелкоклеточного рака легких — 70.
Для того чтобы узнать, за какое время опухоль достигнет объема 1 см3, нужно время удвоения объема умножить на 30. Нехитрые расчеты показывают, что зачастую на это уходят годы.
На какой стадии можно излечиться от рака?
Вероятность ремиссии наиболее высока при стадиях рака 0 и I. Пятилетняя выживаемость таких пациентов приближается к 100%. При II стадии прогноз серьезнее, но у многих пациентов все еще можно добиться ремиссии. При III стадии некоторых больных все еще можно вылечить, остальным показано паллиативное лечение, которое помогает затормозить прогрессирование рака, справиться с мучительными симптомами, продлить жизнь. На IV стадии ремиссия возможна лишь в крайне редких случаях, ее вероятность ничтожно мала. У таких пациентов в основном проводится паллиативное лечение.
Конечно же, это очень обобщенные данные. Всегда нужно говорить не о раке в целом, а о его конкретных типах. Потому что рак бывает разным.
Читайте также:

