Перерождение в раковые клетки
Статей: 46
Категорий: 6

Известно, что опухолевый процесс в организме начинается с мутации клеток, которые затем начинают бесконтрольно делиться и превращаться в опухоль. Мутировавшие клетки, споcобные положить начало развитию опухоли, называются онкогенами. Каков механизм превращения нормальной клетки в онкогенную?
Существует теория, что нормальная клетка поражается особым онкогенным вирусом. Когда обычный вирус поражает клетку, то она погибает, давая возможность вирусу дать свое потомство. При поражении клетки онкогенным вирусом клетка не погибает, она меняет свой генетический код и сама становится строительным материалом опухоли.
Онкогенные вирусы отличаются от остальных вирусов тем, что имеют в своем геноме особые раковый ген, который и называется онкогеном. В настоящее время науке известно около 20 онкогенов.
Однако выяснилось, что онкогены не привносятся в организм человека извне, они существуют в клетках здорового человека изначально, не вызывая мутации его здоровых клеток. И только в результате воздействия канцерогенных услових (внешних химических и физических канцерогенных факторов окружающей среды), иногда в результате поражения клетки обычными инфекционными вирасами онкогены начинают производить особый низкомолекулярный онкобелок, который и приводит к опухолевым процессам в следствии его злокачественного роста.
Напрашивается вопрос, каким образом получилось, что природа не удалила из организма ненужные и даже опасные онкогены, а оставила их в теле всех позвоночных и человека в дремлющем состоянии?
Открытия английских ученых проливают некоторый свет на это явление. Дело в том, в что в белке крови содержится специальный белок ТФР. Он предназначен для экстренного деления клеток в особых условиях, например, в ранах при свертывании крови начинается быстрый рост клеток, благодаря которому происходит ее заживление. Им удалось также доказать, что ген этого белка является аналогом вирусного онкогена. Таким образом, становится очевидным, что собственный белок клетки может, при определенных обстоятельствах играть ведущую роль в размножении опухолевых клеток некоторых видов.
Все клетки человеческого организма имееют ген белка ТФР. Обычно этот ген как бы выключен, однако случайная мутация может его включить, и он начнет действовать в условиях, когда этого процесса быть не должно. Такие мутации, как мы уже знаем, могут возникнуть под действием радиации, химических веществ, сигаретного дыма и других. Вот что вероятнее всего лежит в основе перерождения здоровых клеток в опухолевые. Это безусловно заставляет нас другими глазами посмотреть на роль внешних канцерогенных факторов, ведь получается, что физические и химические внешние канцерогены просто запускают опухолевый процесс в собственных и совершенно здоровых клетках организма. Причем, такая возможность таится в каждой без исключения клетке здорового организма человека.
Совершенно очевидно, что невозможно защитить каждую клетку организма от всех химических и физических влияний, ведь для этого пришлось бы вмешаться в работу каждой клетки организма, нарушая ее природное, установленное эволюцией функционирование. Невозможно ни исключить все 20 онкогенов, находящихся в каждой клетке, из ее функционирования, ни защитить от возможных вариантов активизации онкогенов каждую клетку организма. Понятно, что, если "выключить" активность гена, вырабатывающего белок ТФР, то человечеству грозит гибель от кровотечений.
Это открытие делает беспочвенными надежды на профилактику и лечение рака лекарственными средствами. Количество клеток, подвергающихся мутации огромно. В каждый момент жизни в теле здорового человека существует не менее 10 млн мутировавших клеток, каждая из которых способна стать опухолевой. Очевидно, что для каждой такой клетки потребуется свое лекарство. Невозможно обеспечить каждую мутировавшую клетку собственным лекарством, не повредив остальные клетки организма. Подобные средства могут уничтожать одни опухолевые клетки, но порождать при этом другие.
Что же касается иммунной системы, то теоретически она способна распознать перерожденные клетки и обезвредить их, однако практически она не в состоянии этого делать, так как особенности развития опухоли таковы, что опухоль долгие годы развивается в условиях изоляции от клеток иммунной системы и встречается с ними только когда становится раковой. К этому времени ее скорость развития такова, что имеющихся у иммунной системы фагоцитов (пожирателей чужеродных клеток) абсолютно недостаточно для того, чтобы обезвредить ее.
Даже если бы у иммунной системы была возможность контактировать с опухолевыми клетками с самого начала их возникновения, все равно имеющихся у нее клеток-фагоцитов было бы количественно совершенно недостаточно для полного их уничтожения.
Следует знать, что иммунная система играет не основную роль в антираковой защите, а второстепенную и только на этапе, когда опухоль превращается в раковую, когда силы ее антираковой защиты значительно уступают возможностям развития раковой опухоли.
Однако тот факт, что 83% людей планеты остаются защищены от раковых заболеваний, говорит о том, у организма все-таки существует защитный антираковый механизм, существование которого высвобождают возможности иммунной системы, сосредоточив их на инфекционных и других природных угрозах здоровью человека.
Есть мнение, что таким защитным механизмом может быть естественный отбор на клеточном уровне, так как только этот механизм обладает возможностью вступить в борьбу с мутировавшими клетками сразу же или в самом начале их появления в результате мутации.
Высказывается предположение, что естественный отбор на клеточном уровне успешно защищает организм от рака в подавляющем большинстве случаев. Известно, что если люди не подвергались чрезмерному воздействию канцерогенных факторов окружающей среды, то в 83% случаев их организм может противостоять раковым заболеваниям. Люди, у которых этот механизм по каким-то причинам не работает или ослаблен, вынуждены пока терпеть поражение перед этими заболеваниями.
Каким образом можно поддерживать естественный отбор на клеточном уровне в бездеффектном состоянии, мы расскажем в статье "Профилактика рака. Как предотвратить рак. Что делать, если обнаружена злокачественная опухоль".
Действие первое. Гены здоровых клеток под действием веществ, стимулирующих рак, так называемых канцерогенов, испытывают хроническое (как при курении) или острое поражение. Большинство из нарушений поначалу безобидно и практически не влияет на функционирование клеток. Вредные воздействия могут подавляться клеточной восстановительной системой. Процесс восстановления подкрепляется вторичными растительными веществами, такими, как каротин или флавоноиды. Эти вещества способны обезвредить канцерогены (см. с. 94). Витамин А также обладает этими защитными свойствами (см. с. 92). За восстановление и при необходимости уничтожение поврежденных клеток отвечает ряд контрольных генов. Лишь в случае повреждения последних ситуация осложняется. •
Действие второе. В организме накапливается все больше таких поврежденных клеток. У многих из них к тому же отсутствуют и некоторые контрольные гены. Пораженные клетки обладают способностью делиться, передавая генное повреждение дочерним клеткам. Так разворачивается предраковая стадия. По оценкам специалистов, нужно, чтобы отказали не менее полудюжины генов, чтобы клетка окончательно стала на путь перерождения.
Действие третье. Предраковая клетка все быстрее превращается в злокачественную. Когда исчезает всякий контроль, она начинает беспрепятственно делиться. При этом так называемые раковые гены играют зловещую роль. Эти гены всегда принадлежали к числу генов живого существа. Поэтому в здоровой клетке их легко подавляют другие гены. Но при переходе их предраковой стадии в раковую такая блокада каким-то образом снимается. Раковый ген захватывает в клетке власть и приказывает: делись, делись, делись! Такие раковые гены обнаружены во многих видах опухолей. Еще не выясненную до конца роль играет так называемый ген самоубийства р53. Ему, так сказать, принадлежит в клетке последнее слово. В нормальном состоянии он обеспечивает отмирание непоправимо пораженных или угрожающих жизни клеток. Почему этот ген не дает (по крайней мере в большинстве случаев) импульса к самоубийству раковых клеток, является предметом исследований во всем мире. Если удастся активизировать описанный процесс в клетках опухоли, многое можно решить.

12 апреля 2017, 12:34
Компания Germanklinik с 2017 года бесплатно предоставляет пациентам с онкозаболеваниями услуги по организации лечения в Германии и.

11 ноября 2016, 10:42
Финляндия занимает лидирующие позиции в Европе по результатам лечения ряда онкологических заболеваний, к примеру: - первое.

05 сентября 2016, 10:26
Пациенты, у которых был диагностирован рак, в большинстве случаев сталкиваются с необходимостью приобретения различных препаратов.


Генетическая природа
За более чем 100 лет было доказано, что повреждение генов вызывает перерождение (трансформацию) нормальных клеток человеческого организма в злокачественные, определено, какие именно гены участвуют в этом процессе, открыты наследственные формы рака. Поочередное присоединение мутаций, приводящих к злокачественному перерождению клетки, называют канцерогенезом. И ключевым моментом для новых методов профилактики и терапии онкозаболеваний является именно раскрытие этих механизмов. На сегодняшний день специалисты в области онкологии рассматривают рак как болезнь, вызванную нарушениями в генетическом аппарате клетки, из-за которых она приобретает ряд способностей, приводящих к злокачественной трансформации.

Из-за большого количества происходящих подряд делений опухолевой клетке нужно большое количество энергетических ресурсов и строительных материалов. Ускоренный обмен веществ — это четвертая способность опухолевых клеток. При этом для получения необходимых ей веществ, опухолевая клетка начинает выделять в пространство вокруг себя молекулы, способствующие росту сосудов вокруг опухоли.

Кроме этого, бесконечное деление не дает клетке развиваться и проходить специализацию (функции клетки — прим.ред.). Она оказывается неспособной выполнять какую-либо функцию и поддерживать контакты с другими клетками, из-за чего приобретает способность к инвазии (проникновению вглубь — прим.ред.) и метастазированию.

Своевременное определение
В процесс канцерогенеза вовлечены два класса генов: протоонкогены, мутации в которых превращают их в онкогены, и гены-супрессоры, подавляющие рост опухолевых клеток. В настоящее время известно более 100 онкогенов и онко-супрессоров. Мутации в них могут не только возникать в отдельной клетке организма, но и наследоваться. В этом случае мы говорим о наличии у пациента наследственной предрасположенности к развитию той или иной опухоли. Выявлять таких людей крайне важно. С учетом их генетических особенностей и высоких рисков заболеть раком пока еще здоровым людям можно предложить специальную программу профилактики и наблюдения, которая позволит снизить риски развития злокачественных новообразований или выявить их на ранних стадиях, когда лечение максимально эффективно.
Если у человека уже выявлена опухоль, то, во-первых, необходимо проводить лечение с учетом наследственной природы заболевания, во-вторых, рассчитать риск развития других опухолей. Унаследованная мутация затрагивает все клетки организма человека, а это значит, что опухоль может возникнуть не только в одном органе. Кроме того, человек рискует передать мутацию, унаследованную от родителей, своим детям.
Рак – это злокачественное заболевание, которое вызывает формирование в организме атипичных клеток с неправильным набором генного ряда ДНК. Болезнь часто заканчивается смертью пациента. Больные клетки появляются из-за мутации здоровых патогенов под влиянием внешних или внутренних враждебных факторов. Неправильные геномы начинают активно делиться и не поддаются процессу апоптоза. Это приводит к формированию опухоли злокачественного характера. Раковые клетки активно изучаются учёными и врачами-практиками.
Характеристика раковых клеток
Нормальная клетка в процессе жизни проходит ряд этапов – зарождение, этап созревания, жизнь и последующая гибель под воздействием естественного механизма (апоптоза). Деление идёт по чётко установленному внутреннему порядку. Развитие клеток подчинено точно расписанному графику, изменение которого приводит к неприятным последствиям.
Раковые клетки – это геномы с нарушенным генетическим развитием, образованные из нормальных здоровых тканей. Мутации происходят под влиянием внешних факторов или внутренних патологий в организме человека. Точных причин подобных мутаций учёные до конца не выяснили. Исследование болезни продолжается до сих пор. Больные клетки не реагируют на поступающие сигналы от головного мозга, что сопровождается внешними изменениями в строении и виде патогена. До перерождения в злокачественную форму внутри клетки происходит до 60 разных мутаций. В процессе мутирования часть погибает, остальная выживает и начинает активно делиться. Так рождаются раковые патогены.
Мутации приводят к внутренним изменениям. Организм не реагирует на такие формы, что провоцирует формирование опухоли в определённом участке тела. Клетки становятся бессмертны из-за невосприимчивости к внутренним сигналам, требующим смены этапа жизни. Нормальный цикл нарушается и вызывает опасные заболевания у человека. Перерождение идёт в течение нескольких лет. Иногда злокачественное новообразование выявляется после смерти человека, но это происходит редко. Первые симптомы появляются при большой концентрации больных клеток и больших размерах уплотнения.
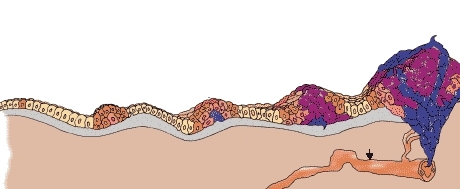
Раковые частицы образуются в лимфоузлах, на коже, на слизистой внутренних органов, в тканях головного мозга, поражают костную ткань и кровеносную и лимфатическую систему. Женский организм подвергается изменениям со стороны молочной железы, матки, придатков и яичников. В группе риска люди, у которых на теле обилие родинок.
Причины развития патологии
Причина трансформации здоровой клетки учёным неизвестна. Спровоцировать процесс перерождения может любой фактор, нарушающий естественное функционирование генома.
Врачи выделяют неблагоприятные воздействия окружающей среды и внутренних патологий, способных привести к мутации:
- болезни печени – гепатит С, В;
- наличие у человека папилломы или вируса герпеса;
- гормональный дисбаланс;
- метаболические нарушения:
- воздействие на организм канцерогенных веществ и химических соединений;
- несбалансированное питание – дефицит растительной клетчатки с избытком белка и углеводов;
- употребление большого количества алкогольных напитков;
- образование опухолей у курильщиков встречается чаще в 50-70%;
- наследственная предрасположенность;
- генетические мутации при формировании хромосомы ДНК;
- наличие патологий хронического характера;
- заболевание эндокринной системы – сахарный диабет, панкреатит;
- присутствие доброкачественных новообразований – фибром, аденомы, кисты или липомы;
- радиоактивные вещества с влиянием магнитного поля;
- нахождение под прямыми солнечными лучами продолжительное время.
В теле человека происходят сложные процессы, отвечающие за нормальное функционирование организма. Учёные описали теоретически ряд версий внутренних патологических изменений, стимулирующие образование онкологии.
Внутреннее строение и внешний вид патогена
Каждый патоген выглядит в зависимости от вида тканевого эпителия, участвующего в формировании. Рассмотреть строение можно под микроскопом. Есть раковые клетки, которые не формируют узелковые формы, к примеру, лейкозные образования в крови. Размеры, форма и состав хромосомного ряда зависит от типа ткани. Развиваются все патогены индивидуально – это позволяет отличить виды патологии. Все виды состоят из разного вида тканевого эпителия.
Аномальные клетки отличаются от здоровых по ряду внешних и внутренних свойств. Внешне злокачественная частица показывает овальную форму с наличием на поверхности большого количества светлых ворсинок.
Под микроскопом в разрезе заметно ядро с множеством генов, отвечающих за признаки и отличительные качества от нормальных частиц. Ядро имеет крупный размер, структура напоминает губку с вдавленными сегментами мембраны. Протеины находятся внутри клетки и теряют способность переносить питательные продукты, преобразующиеся в энергию.
Измененные рецепторы не способны определить проявления внешней среды, что ускоряет развитие опухоли в организме человека. Строение отличается неправильной формой и патологическим составом.
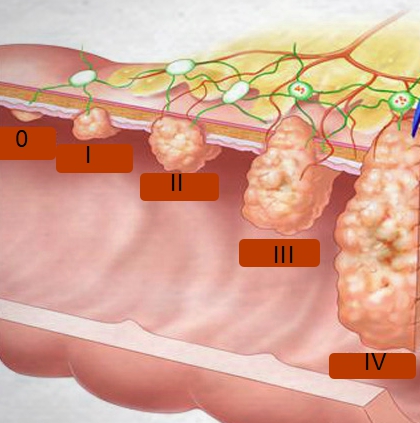
Развитие злокачественного образования
Злокачественная частица растёт поэтапно. На начальной стадии отмечается незначительное внутреннее изменение в строении ядра и внешней мембраны. Определить мутацию здесь сложно. Возможно только при помощи мощного микроскопа.
На второй стадии происходит активное деление аномальной клетки и увеличение в размерах уплотнения. Здесь опухоль может начинать выделять в кровь патологичные вещества, вызывающие соответствующие симптомы.
На третьем этапе присутствуют характерные признаки болезни. Злокачественная опухоль выделяет в кровь атипичные продукты жизнедеятельности.
Четвёртый цикл клетки называется неоперабельным, т.к. опухоль разрастается до крупных размеров, присутствуют аномальные ростки в других участках тела. В организме накапливается большая концентрация раковых веществ, что приводит к интоксикации. Раковая интоксикация – это перенасыщение организма атипичными клетками, приводящее к смерти человека.
Типы раковых генов
У всех нас в организме есть ряд генов, способных перейти в определённый вид патологии. Предрасположенность к болезни зависит от многих факторов. Человек может прожить всю жизнь, не испытав влияния подобных геномов.
Известны типы генов, вырабатывающих аномальные частицы:
- Гены-супрессоры отличаются способностью остановить развитие атипичных патогенов. Препятствующие росту больных клеток частицы уничтожают опасные ядра, что помогает контролировать болезнь. Трансформация таких частиц приводит к бесконтрольному разрастанию злокачественных элементов. При онкологии указанного типа естественное восстановление организма невозможно, требуется медицинская помощь.
- Гены репараций ДНК напоминают гены-супрессоры по механизму функциональных действий. Мутация наблюдается на стадии формирования метастазных ростков.
- Онкогены возникают на месте клеточного соединения. Перерождение одного гена приводит к трансформации всей частицы. Отличается врождённым развитием патологии.
Отличия ракового элемента от здоровой клетки
Отличить злокачественную частицу от нормальной можно по ряду присутствующих свойств – внешнему виду, внутреннему строению, функциональным особенностям.
- деление происходит постоянно, не достигая телофазы;
- жизнь короче здоровой, но быстрый рост наносит сильный вред организму;
- разрастание осуществляется при любых условиях, препятствующих росту нормального генома;
- отсутствует природная регенерация;
- внешне напоминает узелок овальной или округлой формы, возможна капсула с жидкой субстанцией.
По данным признакам врачи отличают раковые элементы и могут определить тип заболевания.
Выявление патологии
При появлении подозрительных симптомов и ухудшении в здоровье нужно провериться на присутствие злокачественного новообразования. Особенно рекомендуется регулярная проверка организма на раковые опухоли людям, у которых есть родинки на теле и светлая кожа. Диагностика включает лабораторное обследование и использование инструментальных методов исследования.
Пациенту требуется пройти некоторые процедуры:
Выявление патологии на раннем этапе формирования раковой клетки увеличивает шанс на полное выздоровление. Поэтому стоит регулярно обследоваться в поликлинике – это позволит предотвратить развитие тяжелых последствий злокачественного новообразования.
Получив результаты исследований, врач оценивает состояние больного. Есть норма показателей, характеризующая отсутствие раковых клеток. Присутствие разницы в параметрах значит, что присутствует постороннее образование злокачественного характера.
Борьба с раковым образованием
Медицина постоянно развивается и находит новые методы, останавливающие разрастание онкологического узла. На начальном этапе формирования патологии присутствует естественная борьба организма. Если победить болезнь не удаётся, требуется медицинская помощь.

Бороться с заболеванием можно разными способами – зависит от степени поражения организма и типа опухоли. Рак боится химиотерапии, где применяются сильные препараты из группы цитостатиков. Используют медикаменты, подавляющие и предотвращающие размножение атипичной клетки. Организм остро реагирует на курсы химиотерапии, поэтому лечение проходит в несколько этапов. Пациенту требуется отдых для восстановления. Дозировка против раковых образований подбирается индивидуально.
Борются с раковыми патогенами и с помощью облучения гамма-лучами. Данная терапия помогает затормозить рост новообразования. Полное уничтожение достигается редко, только при раке кожи. Здесь требуется комплексное лечение с применением нескольких способов.
Удаление возможно хирургическим путем. В этом случае применяют несколько методов – традиционный скальпель, лазерное иссечение, лапароскопия, криодеструкция, электрокоагуляция и другие. Вырезанная опухоль отправляется в лабораторию. Там проверяются ткани на определение типа патологии. Иссечение узла проводят с захватом здорового участка ткани, чтобы предотвратить образование рецидива.
Сейчас активно используется метод таргетной терапии – пациент принимает лекарственные препараты, замедляющие разрастание опухоли. Эффективность всегда индивидуальна. Влияет много внешних и внутренних факторов. Часто проходит совместно с применением рецептов нетрадиционной медицины – человек пьёт лекарственные отвары из трав, настойки, применяет мази, компрессы.
Больные во время лечения питаются по специальной диете. Врач составляет индивидуальное меню. Требуется подбор питательных продуктов, не нагружающих органы пищеварения. Повышается содержание растительной клетчатки с набором полезных микроэлементов.
Прогнозы зависят от стадии выявления патологии. Больные с онкологией на 2-3 стадии живут в среднем 5-10 лет. Влияет вид рака и физическое состояние человека. Смерть от раковой опухоли часто наступает на 4 стадии болезни – она считается неоперабельной формой болезни. Перед смертью применяются методы паллиативной терапии – пациенту создаются комфортные условия для существования. Подбирается курс лекарственных препаратов, снижающих болевые симптомы, и составляется рацион питания.
После каждого проведенного курса лечения больные сдают повторные анализы на выявление рецидива заболевания. Надо сдать мочу и кровь, а также провести ультразвуковое обследование. Результат диагностики показывает изменение состава крови и прооперированного участка. При появлении нового очага применяется повторное лечение.
- 1467
- 1,1
- 1
- 5
Малигнизация — один из самых загадочных процессов. Что же на самом деле направляет клетку на тернистый путь перерождения?
![]()
Анна Батуева



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Гончие еще играют во дворе, но дичи не уйти,
как ни мчится она уже сейчас по лесам.
Франц Кафка
Под малигнизацией понимают приобретение здоровыми клетками черт злокачественности, которые мы подробно рассмотрим ниже. Процесс злокачественного изменения можно уподобить дичи из цитаты Кафки, ведь клетка, однажды встав на этот путь, не сможет вернуться и получить свое клеточное здоровье обратно. Важную роль в понимании основ перерождения клеток и их дальнейшего функционирования сыграла медицина, а следом за ней и молекулярная биология. Но начнем с истоков истории рака.
Часть 1. Биография рака
Первые упоминания о раке встречаются в папирусе Эдвина Смита, датируемом 16 веком до нашей эры [1]. Там же отмечается, что данное заболевание не поддается лечению.
Во времена Гиппократа, около 400 года до нашей эры, появилось специальное обозначение рака — karkinos. Разросшаяся опухоль напомнила Гиппократу краба, окутывающего все вокруг клешнями. Современное название онкологии произошло от греческого слова onkos, которое греки использовали для описания опухолей. Однако врачи того времени не различали доброкачественные и злокачественные новообразования, и karkinos Гиппократа не имеет ничего общего с истинным раком.
Гиппократ выдвинул гуморальную теорию, суть которой состояла в том, что каждый недуг является следствием переизбытка одного из четырех гуморов: крови, слизи, желтой желчи и черной желчи.
Первая половина XX века породила еще одну теорию канцерогенеза, недалеко ушедшую от истины. В 1911 году Пейтон Раус, работая в Рокфеллеровском университете в Нью-Йорке, открыл вирус, способный вызывать опухоли у кур. Ученые по всему свету бросились искать вирусы, ответственные за рак именно у человека, однако ничего не могли найти. В 1974 году в Medical World News вирус рака у человека ставили в один ряд с НЛО, снежным человеком и лохнесским чудовищем. Вирус СВ-40 и вирус папилломы человека, вызывающие рак у людей, были открыты в 1960 и 1983 годах соответственно.
В 1970 году генетик Говард Темин, работавший в лаборатории Макардла в Висконсине и изучавший вирус саркомы Рауса (ВСР, или VSR), представил свою работу на Десятом Международном онкологическом конгрессе. Он открыл у ВСР обратную транскрипцию — синтез ДНК по РНК — и положил начало изучениям ретровирусов. Позднее он отказался от вирусной теории канцерогенеза, а в 1979 году ученые Майкл Бишоп и Харолд Вармус открыли первый протоонкоген — src (сарк), содержащийся в ВСР. Это положило начало новому этапу в истории онкологии, люди наконец-то поняли, как запускается процесс канцерогенеза. Но этого бы не произошло без изучения раковой клетки и ее странной физиологии.
Часть 2. Что заставляет клетку измениться?
В этой главе мы разберем причины злокачественного перерождения клетки. Первым толчком к началу этого изменения является мутация в ДНК.
Важными факторами, вызывающими мутации и провоцирующими раковое перерождение, являются ионизирующее излучение, воздействие ультрафиолетовых лучей, влияние цитотоксических веществ, повреждающих ДНК (к ним относятся наркотические вещества и некоторые лекарственные препараты — например, цисплатин, повреждающий структуру двойной спирали) и органические яды.
Но не всякие повреждения ДНК обязательно приведут к появлению раковой клетки, а лишь те, что затронут определенные гены. Наиболее важную роль в канцерогенезе играют три группы генов: протоонкогены, онкогены и гены — супрессоры опухолей.
Основные изменения, происходящие с протоонкогенами:
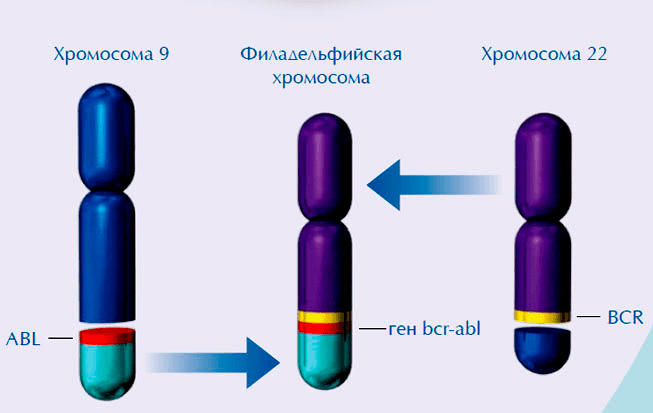
Рисунок 1. Химерный ген BCR-ABL образуется при слиянии участка 9 хромосомы, несущей ген ABL, с участком 22 хромосомы, несущей ген BCR
В некоторых случаях канцерогенез запускается вирусами. Онкогены в геноме вирусов являются ранее захваченными в клетках-хозяевах нормальными генами, которые со временем превратились в злокачественные. Когда такие онкогенные вирусы попадают в клетку, начинается считывание информации с вирусной ДНК или РНК, в цитоплазме накапливаются онкогенные белки и начинается процесс перерождения.
Онкогены — это гены, активность которых стимулирует образование и развитие злокачественной опухоли. Как уже было упомянуто выше, первый вирусный онкоген был открыт в 1979 году.
Онкогены кодируют белки с различной структурой и функциями. К основным продуктам деятельности онкогенов относят:
- Факторы роста. Раковые клетки продуцируют белки, способные вызывать пролиферацию и дифференцировку клеток. Наиболее известным фактором роста является HER2, кодируемый геном ERBB2. Мутации и гиперэкспрессия этого гена обнаружены при раке молочной железы и ассоциированы с крайней агрессивностью опухоли. Суперэкспрессия гена приводит к запуску белковых каскадов, ответственных за клеточное деление. Постоянные сигналы к делению вызывают неконтролируемую пролиферативную активность клеток и их злокачественное перерождение.
- ГТФ-связывающие белки. Гуанозинтрифосфат-связывающие белки участвуют во многих клеточных процессах: передача сигналов, транспорт метаболитов внутри клетки и др. Первыми открытыми ГТФ-связывающими белками были белки семейства Ras — продукты онкогена RAS. При постоянном производстве они вызывают злокачественный рост. Наиболее изученный эффектор Ras — это RAF, который запускает белковый каскад MAPK, отвечающий за клеточное деление и пролиферацию [6].
- Мембранные рецепторы. В онкогенезе основную роль играют рецепторы с тирозинкиназной активностью. Они служат для связывания с ростовыми факторами. К ним относится рецептор эпидермального фактора роста, повышенный синтез которого приводит к перерождению клетки.
- Онкогенные протеинкиназы. Протеинкиназы — это группа ферментов, которые модифицируют белки путем фосфорилирования (присоединения остатка фосфорной кислоты). Протеинкиназы регулируют апоптоз, процессы роста и дифференцировки клеток. Нарушения в их работе приводят к сбою в клеточном цикле и, как следствие, к развитию рака. Например, протеинкиназа AKT1, ответственная за ингибирование апоптоза, при перепроизводстве способна вызывать перерождение клеток. Также, она связана с ростом сосудов в опухоли, что помогает раковым клеткам расселяться по организму и давать метастазы.
Все вышеперечисленные продукты онкогенов являются сигналами к запуску неконтролируемого клеточного деления. Внешние факторы больше не играют никакой роли в жизни клетки, потому что пролиферацию запускают внутренние сигнальные белки.
В здоровой клетке существуют защитные механизмы, следящие за процессами и регулирующие клеточный цикл. К таким механизмам относят деятельность белков — супрессоров опухолей: p21, p53, pRb, PTEN и др.
Белок p53 — наиболее изученный белок-супрессор. Он является продуктом гена TP53, мутации которого обнаруживаются в клетках многих опухолей [7]. p53 синтезируется во всех клетках организма, но активируется только при повреждениях ДНК. Этот белок способен остановить клеточный цикл и не допускать дальнейшее деление клетки, пока не произойдет репарация ДНК. При сильных повреждениях он также может запускать процесс апоптоза.
Одной из главных функций p53 является сохранение генетической идентичности всех клеток организма. При неправильной работе этого белка клетка получает возможность делиться даже при поврежденной ДНК, что увеличивает вероятность мутаций и накопления дефектных онкогенов. Важную роль в подавлении p53 играет белок MDM2, который в норме регулирует активность p53. Однако при повышенном синтезе он связывается с p53 и ингибирует его противоопухолевое действие.
Важными факторами канцерогенеза являются эпигенетические события. Эпигенетика изучает процессы, затрагивающие активность генов, но не изменяющие структуру ДНК. К ним относится изменение метилирования ДНК.
Метилирование — это присоединение метильной группы к нуклеотидам в особых, строго определенных участках генома, называемых CpG-островками. Такое изменение не влияет на структуру молекулы, однако может влиять на экспрессию отдельных генов. В частности, если в участке ДНК много метильных групп, то транскрипция этого участка прекращается.
Особенно активно метилирование проходит в эмбриональный период жизни, а у взрослого человека метилировано около 2% генома. В норме баланс между метилированием и деметилированием строго регулируется и соблюдается, однако в старости начинают преобладать процессы метилирования, что может в итоге привести к канцерогенезу. В процессе онкогенеза происходит гиперметилирование CpG-островков, что приводит к общей геномной нестабильности и накоплению еще большего количества мутаций. В большинстве случаев метилированные участки являются промоторами и влияют на активацию или, наоборот, инактивацию генов, что с виду похоже на действие точечных мутаций.
Однако хотя нарушения в эпигенетической регуляции сопровождают развитие злокачественного перерождения, они, как правило, не являются его первопричиной, а лишь одним из сопутствующих факторов.
Рисунок 2. Раковый геном. В процессе жизнедеятельности раковая клетка накапливает огромное количество мутаций и нередко характиризуется полиплоидностью.
Часть 3. Физиологические последствия малигнизации
Основное последствие малигнизации — клеточное бессмертие. Оно может поддерживаться несколькими способами: активацией фермента теломеразы, блокировкой регуляторов митохондриального пути апоптоза и в некоторых случаях активацией механизма ALT (alternative lengthening of telomeres, альтернативного удлинения теломер [14]).
Впервые клеточное бессмертие раковых клеток было продемонстрировано в 1951 году на клеточной линии HeLa, взятой у Генриетты Лакс, вскоре скончавшейся от рака шейки матки (рис. 3) [9].

Как правило, малигнизация сопровождается активацией фермента теломеразы. На концах хромосом находятся короткие повторяющиеся участки ДНК, названные теломерами [10]. После каждого деления теломеры укорачиваются, что в итоге приводит к их полному исчезновению и невозможности продолжать деление. Количество возможных делений для клетки названо пределом Хейфлика. Действие теломеразы заключается в восстановлении теломер и превращении клетки в фактически бессмертную, позволяя ей делиться бесконечно долго. Существуют нормальные клетки, в которых также экспрессируется теломераза. Это клетки, которым надо часто делиться: половые, стволовые и клетки эпителия кишечника. Однако теломераза активна в подавляющем большинстве раковых клеток, что играет важную роль в их жизненном цикле.
С другой стороны, в некоторых злокачественных клетках, наравне с активной теломеразой, существует так называемое альтернативное удлинение теломер, или сокращенно ALT [11]. При ALT происходит гомологичная рекомбинация концевых участков хромосом (рис. 4). В норме рекомбинация происходит в процессе мейоза, однако раковые клетки научились достраивать теломеры, используя теломеры другой хромосомы как матрицу [12].
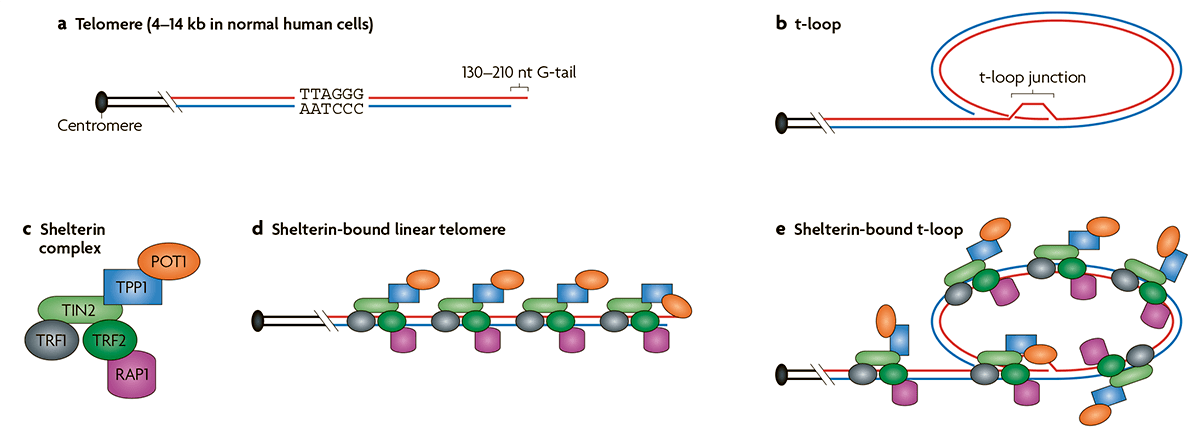
Важно отметить, что раковое бессмертие контролируется не только теломерами, но и ингибированием путей апоптоза, главным из которых является митохондриальный путь. В норме, из митохондрий в цитоплазму выходят митохондриальные белки и образуют апоптотический комплекс — апоптосому, которая и запускает апоптоз. При неправильной работе регуляторных белков, а к ним относятся белки семейства BCL-2, нарушается выход апоптотических белков, что приводит к сбою в процессе апоптоза. В раковых клетках обнаружены нарушения в работе белков BAX и BAK, а также экспрессия ингибиторов клеточной смерти.
Часть 4. Заключение
Читайте также:


