Что такое мезодермальные смешанные опухоли
Лейомиосаркома злокачественная мышечно-клеточная опухоль. Растет чаще интрамурально, может возникнуть в предсуществовавшей лейомиоме (чаще в центральных отделах одного из узлов множественной лейомиомы) или возникнуть непосредственно из мышечной ткани стенки матки. Часто обнаруживают некрозы и кровоизлияния. Гистологически аналогична соответствующей опухоли мягких тканей.
Эндометриальная стромальная саркома встречается значительно реже, чем лейомиосаркома. Возраст больных в среднем на 10 лет моложе, чем при лейомиосаркоме, и составляет в среднем 45 лет. Выделяют 3 варианта опухоли.
Первый вариант истинная эндометриальная стромальная саркома — может наблюдаться в двух формах: отграниченной (полиповидной), которая исходит чаще из дна матки; диффузной, захватывающей всю или большую часть эндометрия. Макроскопически опухоль мягкая, серовато-белого цвета с кровоизлияниями и обширными участками распада, местами инфильтрирующим ростом в миометрии. Прогноз плохой.
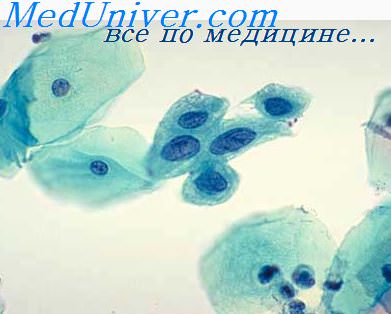
Эндометриальную стромальную саркому следует отличать от псевдосаркоматозной реакции стромы (стромальной гиперплазии) эндометрия, которая, хотя и очень редко, может наблюдаться в результате лечения железисто-кистозной (железистой) гиперплазии гестагенами. В таких случаях клетки стромы становятся крупными, ядра полиморфными и гаперхромными, а железы атрофичными. Подобная же картина в редких случаях может обнаруживаться в строме очагов внутреннего и наружного эндометриоза при длительном лечении его гестагенами. От истинной саркомы эти изменения отличаются отсутствием митозов. Редко, хотя и чаще, чем после гормональной терапии, может возникать очаговая стромальная гиперплазия эндометрия как результат длительного применения оральных контрацептивов.
Аденоматоидная опухоль относится к доброкачественным новообразованиям. Макроскопически опухоль овоидная, желтоватого цвета, чаще до 2—3 см в диаметре, располагается в наружной части миометрйя, в боковых отделах матки и/или в области ее дна. В части наблюдений приобретает лимфангиоматозный вид. Опухоль состоит из тубулярных структур неправильной формы. Цитоплазма клеток не содержит липиды, ШИК-отрицательна. Новообразование аналогично таким же опухолям маточных труб и яичников.
Смешанная мюллерова опухоль встречается редко, в любом возрасте, но чаще в постменопаузе. Опухоли полипозного или дольчатого вида чаще исходят из слизистой оболочки дна матки, заполняя ее полость. Опухоль отличается мягкой консистенцией, белесоватым цветом, располагается на широком основании; по периферии ткань ее в состоянии отека и распада, с наличием кровоизлияний. Большая часть этих опухолей является высокозлокачественной. В зависимости от гистологического строения выделяют 2 основных типа опухолей—карциносаркома и мезодермальная смешанная опухоль.
Карциносаркома эндометрия представлена элементами рака, главным образом аденокарцивомой (но могут быть и другие формы карцином), и саркомы. Опухоль отличается глубоким инфильтрирующим ростом в миометрий. Саркоматозные элементы обычно преобладают над раковыми. Их клетки разной формы и величины с гаперхромными уродливыми ядрами, многочисленными фигурами митозов, в том числе патологических. Раковые клетки, смешиваясь с саркоматозной тканью, могут быть приняты за мезенхимальные.
Мезодермальная смешанная опухоль (гетерологичная мезодермальная опухоль)—основной ее тканью является эмбриональная саркоматозного характера, отличающаяся склонностью к миксоматозному превращению. Представлена часто звездчатыми и округлыми атипичными клетками. Митозы единичные. В составе опухоли встречаются ткани, являющиеся производными эмбриональной мезодермы: гиалиновый хрящ, поперечно исчерченная мышца, жировая, костная и другие ткани. В этих опухолях можно встретить участки, построенные преимущественно по типу эмбриональной рабдомиосаркомы. Эмбриональные рабдомиобласты богаты эозинофильной цитоплазмой с крупными гаперхромными ядрами. Кроме злокачественного варианта мезодермальных смешанных опухолей выделяют и доброкачественные.
Описан также другой вариант смешанной мюллеровой опухоли, названный мюллеровой аденосаркомой матки. Отличительная особенность—наличие в составе опухоли, основой которой является гомологичная саркоматозная ткань, морфологически зрелых эпителиальных элементов, что отличает аденосаркому от карциносаркомы. Прогноз аденосаркомы лучше.

Случай из практики. Больная
А. поступила в гинекологическое отделение НИИ (ныне РНПЦ) онкологии и медрадиологии им. Н. Н. Александрова с маточным кровотечением, 3 недели назад родила доношенного ребенка. В послеродовый период беспокоили субфебрильная температура тела и умеренные кровянистые выделения, ставшие обильными. Заподозрена хориокарцинома матки, больная госпитализирована в онкологический стационар.
Матка увеличена до 14-недельного срока беременности. Наружный зев шейки пропускал палец, и при вагинальном исследовании в нижнем сегменте матки определялся миоматозный узел. В придатках методом пальпации изменений не отмечено. При УЗИ диагностированы опухоль матки и киста правого яичника. В аспирате и соскобе из слизистой опухолевых клеток не найдено. Клинические данные и результаты гистологического исследования показали субмукозную миому матки, кисту левого яичника, менометроррагию.
При операции в малом тазу обнаружена цианотичная и увеличенная до 14-недельного срока беременности матка. В нижнем ее полюсе локализовался субмукозный узел, в левом яичнике — киста диаметром 6 см.
По данным цитолога и гистолога, а также ревизионной лапаротомии
клеток злокачественного новообразования не найдено. Проведена экстирпация матки с левыми придатками.
Удаленная матка размером 1412,5 см рассечена. Полость ее заполнена серым миоматозным узлом над внутренним зевом величиной 975 см. В нем видны очаги некроза и ослизнения, рисунок смазан, консистенция мягкая. Заподозрено злокачественное новообразование. Препарат передан в патоморфологическую лабораторию. Гистологически опухоль матки представлена субмукозной лейомиомой с очагами малигнизации по типу лейомио-саркомы, в яичнике обнаружена сероз-
ная киста. Поскольку правые придатки сразу не удалили из-за молодого возраста больной, вмешательство дополнено правосторонней аднексэктомией.
Послеоперационный период протекал
без осложнений. После снятия швов проведен интенсивный курс химиотерапии карминомицином и циклофосфамидом. Т. к. опухолевый процесс выявлен в начальной стадии, хирургическое лечение, дополненное химиотерапией, признано радикальным. В течение 5 лет признаков рецидивирования опухоли нет.
При сообщениях о саркомах следует помнить, что ни один из медицинских центров не имеет большого опыта в этой области. Все наблюдения носят ретроспективный характер.
Эти коварные лейомиосаркомы
Обычно их обнаруживают в 0,13% случаев экстирпированных маток по поводу лейомиом.
Саркомы развиваются из мышечной и соединительной ткани миометрия. Лейосаркомы мышечного слоя чаще представляют собой единичные узлы, располагающиеся интрамурально, субсерозно либо субмукозно. Субмукозные лейомиомы встречаются в 2 формах: ограниченной (полиповидной) и диффузной. В зависимости от гистологического строения лейомиосарком различают фибробластические, веретеноклеточные, полиморфноклеточные, круглоклеточные и др. структуры. Существует также деление лейомиосарком на высоко-, умеренно- и низкодифференцированные гистологические подтипы.
Лейомиосаркомы, как и рак, чаще встречаются в период климактерия (средний возраст женщин — 50 лет). Клинические проявления зависят от локализации и темпа
роста опухоли. При субмукозных узлах характерные симптомы — ациклические кровотечения, боли внизу живота, бели; при интрамуральном расположении узлов в основном мучают боли, ациклические кровотечения бывают реже.
Каждая третья больная с лейомиосаркомой подвергается нера-дикальной операции из-за врачебных ошибок, неосведомленности гинекологов об особенностях метастазирования сарком, игнорирования жалоб пациенток на нарастающую слабость и анемию, не связанные с кровотечением. Не придается значения быстрому росту матки, появлению менометроррагии.
Тактические и лечебные ошибки в вышеописанном случае привели к неадекватному объему хирургического вмешательства. Женщину лечили в гинекологическом отделении общеклинической сети, где у врачей, осуществлявших диспансеризацию больной в течение года, отсутствовали онкологические знания.
Инфицирование опухоли может вести к появлению гнойных, гнойно-кровянистых выделений и нарушению общего состояния с развитием анемии, кахексии. У большинства пациенток выявляют I стадию заболевания.
Для лейомиосарком матки характерна склонность к метастазированию в легкие и печень. Метастазы при этой опухоли наблюдаются чаще (75%), чем при саркоме слизистой (25%).
Случай из практики. Больная К., 50 лет. На диспансерном учете по поводу миомы матки, размеры которой не превышали 9-недельного срока беременности, состояла 6 лет. В последующем врач зафиксировал рост матки. Проведена надвлагалищная ампутация детородного органа с придатками. Накануне операции специальных исследований не проводили. Через год отмечено увеличение неудаленной культи шейки матки. Рост был значительным: за 3 месяца культя достигла размеров 20-недельного срока беременности.
При поступлении в стационар больную беспокоили кашель, одышка, затрудненное дыхание. В легких прослушивались влажные и сухие хрипы. Температура повышена. Живот увеличен за счет новообразования, исходившего из малого таза и верхним уровнем достигавшего подреберья. Опухоль спаяна с петлями кишечника, малосмещаемая, неоднородной консистенции, плотные очаги чередовались с участками размягчения. Гинекологическим исследованием подтверждена опухоль культи шейки матки, занимавшая весь малый таз и выступавшая в свободную брюшную полость. При экскреторной урографии обнаружены пиелоэктазия и уретерогидронефроз.
Рентгенографически в легких диагностированы метастазы. В пересмотренных микропрепаратах, изготовленных из ранее удаленной опухоли матки, морфологически установлена пролиферирующая лейомиома с очагами атипии и малигнизации.
Распространенность процесса и значительные размеры опухоли, сращенной со смежными органами, исключали возможность радикального лечения. Через 2 месяца больная умерла.
Опухоль растет — врач медлит
Случай из практики. Больная С., 63 года. Направлена в НИИ (ныне РНПЦ) онкологии и медрадиологии им. Н. Н. Александрова по поводу рака яичников. На основании данных визуального обследования этот диагноз исключили, а обнаружили опухолевидное выпячивание в нижней части передней брюшной стенки слева, предположительно — пред-брюшинную липому. Для уточнения диагноза и выбора метода лечения проведена лапаротомия. При вскрытии брюшной полости установлено, что большой сальник по левому боковому каналу на значительном протяжении расслоил косую мышцу живота и через растянутый апоневроз передней брюшной стенки сформировался в округлое с четкими контурами опухолевидное образование. Сальник резецирован. Макропрепарат представлен отечной, мутного цвета распадающейся жировой тканью — липосаркомой.
Внимательный осмотр формы живота может оказаться более информативным, чем результаты
интраскопических, рентгенологических, эндоскопических и др. методов.
Опухолевидные образования, исходящие из забрюшинных тканей, бывают различной природы. Злокачественные встречаются в 5 раз чаще. На первом месте стоят липосаркомы, на втором — саркомы, исходящие из соединительной и мышечной ткани.
Все удаленные препараты надо разрезать сразу в операционной и срочно отправлять на гистологическое исследование. Это следует делать со всеми удаленными из полости матки, влагалищной части шейки полипами, миоматозными узлами.
Прогноз более благоприятен, ко-
гда саркома возникает на почве озлокачествления миомы, и сомнителен, если на слизистой оболочке.
Анализ данных рентгенологических исследований свидетельствует о том, что лимфосаркома лимфатических узлов таза, проявляющаяся их увеличением, относится к числу заболеваний, способных симулировать опухоли яичников. Рентгеносемиотика таких поражений весьма специфична. На снимках видны резко увеличенные и деформированные лимфатические узлы или бесформенные контрастные пятна, рассеянные в проекции лимфатических сплетений таза либо смещенные в том или ином направлении.
Случай из практики. Больная Л.,
38 лет. Поступила в радиогинекологическое отделение по поводу рака яичников. Считала себя больной в течение 3 мес., когда появились общая слабость и боли внизу живота. Каких-либо изменений со стороны органов брюшной полости при осмотре хирургом не выявлено. Через месяц консультирована гинекологом. Диагностирован рак яичников, пациентку направили в онкодиспансер.
Пахово-бедренные лимфатические узлы увеличены, мягкой консистенции. Матка обычных размеров. В области придатков с обеих сторон определялись плотные опухолевидные образования неоднородной консистенции, ограниченной подвижности, фиксированные к стенкам таза.
Заподозрено системное поражение подвздошных и паховых лимфатических узлов. Проведена прямая двусторонняя лимфография. На рентгенограммах контрастированы все группы лимфатических узлов. Подвздошные лимфоузлы резко увеличены. Объем одного из них составлял 30 460 мм3. Структура других крупнозернистая.
Рентгенологическое заключение: системное заболевание лимфатических узлов (лимфосаркома) с преимущественным поражением подвздошных коллекторов. Диагноз подтвержден результатами гистологического исследования одного из удаленных увеличенных паховых лимфатических узлов (плазмоцитарная лимфосаркома).
Применение лимфографии и
биопсии позволяет провести дифференциальную диагностику между злокачественным поражением яичников и системным заболеванием лимфатических узлов. Это важно для выбора адекватного метода лечения (отказ от операции, назначение лучевой терапии).
Лечение лейомиосарком матки
I стадии — хирургическое. Наиболее
рациональна тотальная экстирпация матки с придатками. Эффективность вспомогательной лучевой терапии при этом заболевании достоверно не определена (Gordon, Kaufman, 1988; Leppien et al., 1991). Поэтому при I и II стадиях после-операционное лучевое лечение не используется.
Химиотерапия при лейомиосаркомах до недавнего времени считалась бесперспективной. Но из-за агрессивности сарком и их высокой способности к гематогенному метастазированию после операции стали применять химиотерапию карминомицином (А. Ф. Урманчеева, 1993). Схема с 90-х годов: 6 мг/м2 внутривенно 2 раза в неделю, суммарная доза — 50 мг, всего 6 лечебных курсов.
При II стадии заболевания лечение проводят примерно по такой же методике, как и при I. Эффективность лучевой терапии при этом распространении процесса не доказана (Я. В. Бохман, 1993). Показатель 5-летней выживаемости пациенток после операции с последующей химиотерапией варьирует от 20% до 60% (Leppien, Schmidt–Mattiesen, 1997).
Лечение женщин с лейомиосаркомой матки III стадии на первом этапе предусматривает тотальную гистерэктомию, на втором — равномерное дистанционное облучение таза с 2 полей в дозе 50 Гр, на третьем — 6 курсов полихимиотерапии по схеме VAC, САР.
Для IV стадии заболевания стандартных методов лечения нет.
В целом врачевание больных с распространенными формами лейомиосарком тела матки должно состоять из рационального применения хирургического и лекарственного компонентов, а по показаниям — и лучевого.
Эндометриальные
стромальные саркомы
Такие обычно возникают в слизистой эндометрия, встречаются в 15% наблюдений. Их злокачественные разновидности нелегко отличить от доброкачественных. Важный критерий — степень инфильтрации окружающей ткани и число митозов в клетках опухоли. В группу стромальных опухолей входят эндометриальные стромальные саркомы, карциносаркомы и смешанные мезодермальные новообразования.
Эндометриальные саркомы состоят из круглых веретенообразных опухолевых клеток. Внешне напоминают нарост или полиповидные узлы на широком основании.
Отличаются наличием в опухоли эпителиального (аденокарцинома) и мезенхимального (саркома) компонентов. Среди полиморфно- или веретеноклеточной саркоматозной ткани в карциносаркоме выделяют очаги аденокарциномы различной степени зрелости. Анатомические формы — узловатые и диффузные.
Мезодермальные смешанные опухоли матки
Случаи редкие. Возникают в любом возрасте, чаще в период менопаузы. Отличаются высокой злокачественностью. Основой служат клеточные элементы мезодермы, смещенные в процессе эмбрионального развития в стенку матки. Поэтому такие опухоли называют еще гетерологическими. Некоторые ученые именуют их смешанными, т. к. они состоят из нескольких компонентов. В мезодермальных опухолях встречаются гиалиновый хрящ, костная и жировая ткань, поперечнополосатая и гладкая мускулатура и др. Опухоли, сформировавшиеся из зрелых тканей, являются доброкачественными. В основном это узловатые образования со множественными округлыми или лентовидными полипообразными разрастаниями.
Злокачественные имеют узловатую и диффузную форму, исходят из эндометрия, располагаются у дна или задней стенки матки; как правило, быстро растут, часто рецидивируют, дают метастазы — пре-имущественно в параметральные отделы клетчатки.
Клинически мезодермальные смешанные опухоли, как и эндометриальные стромальные саркомы, карциносаркомы, диагностируются на ранних этапах чаще,
чем лейомиосаркомы. Основной признак заболевания — кровотечение типа метроррагий, обусловленное ранним распадом опухоли. Ему обычно предшествуют бели — водянистые, иногда с примесью крови и крошковатых опухолевых масс. Частый симптом — выраженное увеличение матки. Этот признак особенно патогномоничен при заболевании в менопаузе. Лишь немногие пациентки жалуются на боли, локализующиеся внизу живота и в крестце.
В отличие от лейомиосарком, при карциносаркомах и эндометриальных стромальных саркомах опухоль располагается в эндометрии. По гистологическому исследованию эндометриального соскоба можно на раннем этапе определить ее природу.
Окончательный диагноз устанавливают только после гистологического исследования соскоба эндометрия или удаленной при операции опухоли. Значительна и помощь УЗИ; к сожалению, оно не позволяет уточнить природу новообразования. Оценить степень распространенности мезодермальной опухоли в матке можно с помощью гистерографии и гистероскопии. В целом указанные методы способствуют достоверному прогнозу.
У молодых женщин дифференциальную диагностику эндометриальных сарком матки следует проводить с миомой, плацентарным полипом, хориокарциномой.
Основные методы лечения — хирургический, комбинированный и комплексный.
При доброкачественных гетерологических мезодермальных опухолях показана экстирпация матки с придатками, при злокачественных — расширенная гистерэктомия по Вертгейму с пред- и послеоперационным облучением. Предоперационное проводят в виде внутриполостной гамма-терапии разовой дозой 10 Гр, суммарной — 20 Гр, послеоперационное — дистанционным методом, в режиме обычного фракционирования дозы. Его осуществляют по тем же принципу и методике, что и после радикального вмешательства при РШМ. Суммарные дозы облучения после операции составляют 45–50 Гр. Основанием для включения в план лечения лучевой терапией эндометриальных стромальных сарком, смешанных мезодермальных опухолей и карциносарком является их относительная радиочувствительность. Установлено, что лучевая терапия позволяет снизить частоту рецидивов опухоли в полости таза. Использование при комбинированном методе адъювантной послеоперационной лучевой терапии в дозе 40–50 Гр позволило, по данным Я. В. Бохмана, улучшить результаты лечения больных с эндометриальной саркомой на 13%, карциносаркомой — на 17,8%, при мезодермальной опухоли — на 5%.
Как самостоятельный метод лечения лучевая терапия назначается при неоперабельных или опухолях, сочетающихся с некомпенсированными сопутствующими заболеваниями.
5-летняя выживаемость зависит от стадии заболевания и степени злокачественности. Так, для пациенток с уровнем митоза клеток опухоли, не превышающим 10 митотических ед./НРЕ, этот показатель составляет 100%, но когда он более 10 ед./НРЕ, то выживаемость уже 50% (Gordon, Kaufman, 1988).
В качестве вспомогательного метода лечения карциносарком матки используют гормонотерапию гестагенами. Назначают ОПК по схеме, принятой для больных с метастазами РТМ. Целесообразны даже высокие дозы прогестерона при стромальных саркомах низкой степени злокачественности (Н. И. Переводчикова, 2000).
Из химиотерапевтических препаратов при различных гистотипах диссеминированных форм стромальных сарком хорошо зарекомендовал себя карминомицин. Его доза — 6 мг/м2 2 раза в неделю, суммарно — 30 мг/м2 (50 мг). Циклы повторяют с интервалом от 3 до
5 недель в зависимости от общего состояния и показателей периферической крови.
Цисплатин эффективен при 1-й линии химиотерапии, минимально активен во 2-й линии при смешанных мезодермальных саркомах и бесполезен при лейомиосаркомах. Ифосфамид эффективен у 32,2% больных со смешанными мезодермальными опухолями, у 33% — при стромальных саркомах, у 17,2% — при лейомиосаркомах. Можно использовать и карминомицин.
5-летняя выживаемость пациенток, получающих адъювантную химиотерапию, составляет 59,6%, в контрольной группе — 40%. Есть сообщения об использовании полихимиотерапии при диссеминированных формах сарком с включением в схемы адриамицина и фторурацила.
В целом лечение больных стромальными саркомами тела матки должно быть комплексным и состоять из рационального объема хирургического вмешательства, оптимального вида лучевой терапии и применения цитостатиков.
А. Опухоли из жировой ткани:
1. доброкачественные – липома
2. злокачественные – липосаркома
Б. Опухоли из соединительной тканей:
1. доброкачественные – фиброма
2. злокачественные – фибросаркома
В. Опухоли из гладкой мускулатуры:
1. доброкачественные – лейомиома
2. злокачественные – лейомиосаркома
Г. Опухоли из поперечно-полосатых мышц:
1. доброкачественные – рабдомиома
2. злокачественные – рабдомиосаркома
Д. Опухоли из лимфатических сосудов:
1. доброкачественные – Лимфангиома
2. злокачественные – лимфангиосаркома
Е. Опухоли из кровеносных сосудов:
1. доброкачественные – гемангиома и доброкачественная гемангиоперицитома
2. злокачественные – гемангиосаркома и злокачественная гемангиоперицитома
Ж. Опухоли из первичной мезенхимы:
1. доброкачественные – миксома
2. злокачественные – миксосаркома
3. опухоли неясного происхождения (недифференцированная) – ксантогранулём
II. Опухоли неврогенного происхождения:
A. Опухоли из зачатков нервных влагалищ:
1. нейрофиброма без капсулы
2. инкапсулированная нейролеммома
3. злокачественная шваннома
Б. Опухоли из симпатической нервной системы:
B. Опухоли из гетеротопных тканей коры надпочечников и хромаффинных тканей:
1. рак коры надпочечника
2. злокачественная нехромаффинная параганглиома
4. активная феохромоцитома
III. Эмбриональные остатки бластемы почки (нефробластома, опухоль Вилмса)
IV. Опухоли из эмбриональных остатков:
А. Тератоидные опухоли:
1. доброкачественные – тератомы
2. злокачественные – тератобластомы
Б. Хордомы
V. Злокачественные опухоли системного происхождения (лимфо- и ретикулосаркома, лимфогранулематоз) и метастатические опухоли.
Классификации, предложенные позже, не имели принципиальных отличий, и лишь предусматривали деление новообразований на первичные и вторичные, органные (почки и надпочечники) и внеорганные (из различных тканей забрюшинного пространства), доброкачественные и злокачественные.
Вследствие дизонтогенетического происхождения большинства новообразований забрюшинного пространства у детей, в отличие от взрослых, опухоли почек (нефробластомы) занимают в этой локализации первое место и составляют 76% среди всех опухолей забрюшинного пространства. Нейрогенные опухоли составляют 20%. Следовательно, остальные 4% представлены редкими в детском возрасте видами опухолей типа гипернефроидного рака, рака коры надпочечников, феохромоцитомы, а также тератом, липом и прочих опухолей. В связи с такой статистикой мы, в первую очередь, должны обсудить проблему нефро- и нейробластом.
Нефробластомы
Нефробластома, или опухоль Вильмса, занимает первое место среди новообразований живота у детей и составляет 7% от числа всех опухолей в детском возрасте.
В отечественной литературе опухоль почки у ребёнка была впервые описана в 1882 г педиатром Н.Ф.Филатовым. В литературе известны 53 названия этой опухоли. Вот некоторые из них: аденосаркома, аденомиосаркома, карциносаркома, эмбриональная саркома почки, нефробластома и т.д. В настоящее время наиболее часто используется 2 названия: нефробластома и опухоль Вилмса - по имени автора, впервые описавшего её в 1899 г. Опухоль Вилмса является дизонтогенетической опухолью, поэтому она чаще всего встречается у детей младшей возрастной группы. По данным Л.А.Дурнова: до 3 лет. - в 33,3%, до 6 лет - в 51,2%, до 9 лет - в 11,8% и старше 9 лет - в 3,7%.
Следовательно, заболеваемость у детей до 6 лет составляет 84,5% и крайне редко эта опухоль встречается у детей старшей возрастной группы. В литературе несколько чаще заболевание зарегистрировано у мальчиков, поражение левой почки отмечено в 51,4%, правой в 42,3%, обеих почек - в 6,3%. Опухоли почек нередко сочетаются с пороками развития (аниридией, удвоением почек, подковообразной почкой, поликистозом почек, гипоспадией и т.д.)
Этиопатогенез опухолей
В настоящее время все теории происхождения опухолей могут быть обобщены в две точки зрения. Сторонники полиэтиологической теории считают, что под воздействием канцерогенных веществ экзо- и эндогенного характера (ионизирующее излучение, химические вещества, гормоны, вирусы и пр.) в клетках происходят глубокие обменные и структурные изменения, приводящие к бурному, неконтролируемому организмом, автономному росту опухоли. Приверженцы другой точки зрения, моноэтиологической, предполагают что патогенез опухолей различен, а этиология всегда одна - это скрытый вирус, или провирус, который представляет собой паразитирующий комплекс нуклеопротеидов, под воздействием которых ядру клетки кодируются новые генетические свойства. Скрытый вирус может передаваться по наследству и может быть активирован любым канцерогеном. Согласно первой теории, канцерогенные факторы играют первичную, ведущую роль, согласно второй - первичным является латентный вирус, который активизируется канцерогенами. Обе точки зрения признают в основе опухолевого процесса клеточную мутацию. При этом мутированный ген передаётся прямым потомкам мутированной клетки, что даёт основание для клоновой теории образования опухолей. Для объяснения возникновения опухолей в детском возрасте важную роль следует отвести теории эмбриональных зачатков Конгейма, которая трактует происхождение опухолей из персистирующих эктопированных эмбриональных зачатков, клетки которых не были использованы при "строительстве" органа. Опухолевой рост при этом, возможно, стимулируется канцерогенами или провирусом.
Не утратила своего значения и теория Фишера - Вазельса, по которой большая роль в возникновении опухолевого роста отводится условиям, при которых ткань в течение длительного времени получает мощные физиологические или патологические импульсы к росту вследствие повторной гибели или регенерации клеток (например, при хроническом воспалении, под воздействием рентгеновских лучей и т.д.).
При изучении генетики нефробластом (Л.М. Шабад и соавт.,1984) выявлены достоверная закономерность увеличения частоты нефробластом у детей в семьях, где имели место злокачественные новообразования (причём при наличии злокачественной опухоли по материнской линии нефробластома у ребёнка наблюдалась в 32%, по отцовской линии - в 19%), а также у матерей старше 30 лет и чаще у городских, чем у сельских жителей. Наследственный фактор подтверждается многочисленными примерами нефробластом в одной семье и сочетанием нефробластом с пороками развития.
Широкое распространение получила также теория иммунологического контроля. Согласно ей, возможность злокачественного превращения клеток сдерживается защитными силами здорового организма. При ослаблении защитных сил в условиях иммунодефицита может развиться злокачественная опухоль.
И, наконец, во второй половине 20го столетия для объяснения онкозаболеваний в раннем детском возрасте предложена теория трансплацентарного бластомогенеза, по которой канцерогенные вещества проходят через плаценту и способствуют развитию в организме ребёнка злокачественного, процесса.
Патанатомия нефробластом
Опухоль может возникнуть в верхнем или нижнем полюсе, но наиболее часто поражается средний отдел.
Опухоль, как правило, имеет капсулу, отделяющую её от паренхимы почки. Поверхность опухоли гладкая или крупнобугристая, консистенция тестоватая или эластическая, при распаде может появиться флюктуация. Опухоль состоит из белесоватой бесструктурной или волокнистой ткани, имеющей на разрезе вид "рыбьего мяса". Иногда опухоль пёстрая, состоит из чередующихся полей белесоватой, розово-белой волокнистой ткани, тёмно-красных полосок и гладкостенных полостей различных размеров, заполненных розовой или тёмно-коричневой жидкостью. Паренхима почки, сдавленная опухолью, располагается вокруг неё в виде тонкой полулунной полоски. Опухоль характеризуется быстрым ростом, но довольно долго остаётся в капсуле.
Прорастая капсулу, она распространяется на паранефральную клетчатку и париетальную брюшину, прорастает соседние органы. Различают 6 гистологических типов опухоли Вилмса в зависимости от степени дифференцировки опухолевой ткани. Первый тип – опухоль состоит, преимущественно, из нефрогенной ткани с высокой степенью дифференцировки. Пятый тип включает опухоль с резко выраженным атипизмом, отсутствием дифференцировки. Второй, третий и четвёртый типы – промежуточные, с уменьшающейся степенью зрелости опухолевой ткани. Шестой тип – смешанный, включающий опухоли нескольких типов. В каждом варианте гистологического типа опухоли Вилмса могут присутствовать элементы гладкой и поперечно-полосатой мускулатуры, нервная и хрящевая ткань, жир и т.д. Можно провести определённые клинико-морфологические параллели между гистологическим строением опухоли и характером течения заболевания: по мере уменьшения зрелости, дифференцировки опухоли, возрастает её злокачественность. Метастазирование опухоли Вилмса отмечается в 60-80% и зависит не от величины опухоли, а от характера её роста. Диссеминация опухоли происходит, преимущественно, гематогенным путём, чаще в лёгкие, а также в регионарные и отдалённые лимфоузлы, парааортальную клетчатку, печень, селезёнку, кости, щитовидную железу, другую почку, яичко, мочевой пузырь.
Различают 5 стадий опухоли Вилмса.
Первая стадия – опухоль не выходит за пределы почки и не прорастает собственную капсулу, T1 N0 M0
Вторая стадия – опухоль выходит за пределы почки, но не прорастает собственную капсулу, T1 N0 M0
Третья стадия – опухоль прорастает собственную капсулу, околопочечную клетчатку, поясничные мышцы и прилежащие органы. Имеется поражение регионарных лимфоузлов, может наступить разрыв опухоли до или во время операции. Отдалённых метастазов нет, T3 N1 M0.
Четвертая стадия характеризуется наличием отдалённых метастазов в лёгкие, печень, кости и т.д.,T3 Nх Mх.
Пятая стадия – это одновременное двустороннее поражение почек опухолевым процессом.
Последнее изменение этой страницы: 2016-08-16; Нарушение авторского права страницы
Читайте также:

