Парастернальные лимфатические узлы на узи при раке молочной железы
Важнейшей частью комбинированного и комплексного лечения рака молочной железы является хирургическое вмешательство, которое предполагает удаление не только первичной опухоли, но и лимфатических коллекторов первого уровня.
На сегодняшний день рак молочной железы в РФ занимает первое место в структуре заболеваемости женского населения – 19,5%.
В 2000 г. заболеваемость составила 44 840 случаев, смертность – 21 707 случаев, из них летальность на первом году с момента установления диагноза – 11,8% .
Важнейшей частью комбинированного и комплексного лечения рака молочной железы является хирургическое вмешательство, которое предполагает удаление не только первичной опухоли, но и лимфатических коллекторов первого уровня . В 1959 г. R. TurnerWarwick в эксперименте с радиоактивным золотом изучал пути оттока лимфы в зависимости от места введения препарата в молочную железу и установил, что независимо от места инъекции 75% вещества распространялось в направлении подмышечных лимфатических узлов, а 25% – в парастернальные узлы .
Таким образом,как подмышечные, так и парастернальные лимфатические узлы получают лимфу из любого квадранта молочной железы и являются первым этапом регионарного лимфогенного метастазирования.
Согласно классическим представлениям,парастернальные лимфатические узлы являются одним из важнейших барьеров на пути оттока лимфы из ткани молочной железы. По данным литературы, метастатическое поражение этого коллектора выявляется у 15,7–55% радикально оперированных больных [3–5]. Достоверная информация о состоянии парастернальной зоны имеет принципиальное значение, так как метастатическое поражение последней по международной классификации ТNM расценивается как N3, а стадия процесса вне зависимости от категории Т или поражения аксиллярной группы лимфоузлов – как III Б .
Среди многочисленных факторов прогноза (безрецидивное течение болезни, продолжительность и качество жизни) стадия опухолевого процесса является наиболее значимой и в большей части практически определяет выбор лечебной тактики .
Топографоанатомические особенности парастернального лимфатического коллектора(малые размеры и близкое расположение к жизненно важным органам) создают объективные трудности в диагностике его реального состояния на этапе предоперационного обследования.
Метод непрямой радиоизотопной лимфосцинтиграфии парастернальной зоны впервые предложен Rossi R. et al. в 1962 г. Коллоидное золото 198Au вводилось в клетчатку под мечевидный отросток грудины. Задержка коллоидных частиц в лимфатических узлах парастернальной зоны обусловливает их визуализацию через 24 ч после введения. При отсутствии метастатического поражения лимфатических узлов происходит равномерное накопление препарата. Напротив, в случае развития метастазов накопления препарата не происходит .
Метод легко переносился больными, не имел побочных реакций и осложнений. Однако полидисперсность радиоактивного коллоидного золота приводила к его неравномерному распределению, что снижало достоверность получаемых результатов.
Помимо коллоидного золота 198 Au для проведения лимфосцинтиграфии использовался радиоактивный технеций 99m Тс. Этот препарат обладал преимуществом более быстрого накопления в лимфатических узлах (2–3 ч), что позволяло сократить время исследования .
В 1977 г. E.N. Gunes проанализировал результаты предоперационной парастернальной лимфосцинтиграфии, выполненной 99m Tcколлоидом у 1072 больных раком молочной железы. Метастатическое поражение лимфатических узлов подтвердилось гистологическим исследованием в 16% при I стадии заболевания.
В 1979 г. M.P. Osborne et al. вводили 99m Тсколлоид во влагалища прямых мышц живота 34 больным раком молочной железы I стадии. Поражение парастернального коллектора выявлено у 13 больных, из них в 12 случаях данные лимфосцинтиграфии совпадали с результатами гистологического исследования .
По данным Л.Д. Островцева, В.З. Аграната (1983), из 112 больных с центральной и медиальной локализацией опухоли молочной железы метастазы в парастернальные лимфатические узлы, подвержденные в последующем гистологически, выявлены в 64,7% случаев с помощью лимфосцинтиграфии. Авторы считали,что сочетание методов лимфосцинтиграфии и чрезгрудинной флебографии повышает достоверность оценки состояния парастернального коллектора у исследуемой группы больных до 82,3%.
По данным различных исследователей, достоверность радиоизотопной лимфосцинтиграфии колеблется в пределах 50–98% . Разброс показателей обусловлен отсутствием четкой сцинтиграфической семиотики патологически измененных лимфатических узлов,сходностью данных при реактивной гиперплазии, липоматозе, фиброзе лимфатического узла с его метастатическим поражением. Достоверность полученных данных снижается помере уменьшения размеров метастазов, что делает недоступным определение микрометастатического поражения парастернальных лимфатических узлов.
Различие между раковыми и здоровыми клетками качественно и количественно может быть продемонстри ровано с помощью моноклональных антител,направленных против специфических, связанных с опухолью антигенов, экспрессированных на поверхности раковых клеток. Техника использования меченых моноклональных антител для отображения in vivo называется радиоиммуновизуализацией .
Первая работа, посвященная использованию иммуносцинтиграфии с поликлональными антителами к раковоэмбриональному антигену (РЭА) при раке молочной железы, была издана в 1979 г. F. DeLand, D.M. Goldenberg .P. Lind et аl. (1997) исследовали диагностические возможности радиоиммуносцинтиграфии (РИС) с мечеными 99m Тс моноклональными антителами в выявлении злокачественных опухолей молочной железы, а также возможность получения дополнительной информации по данным обычных методов. 27 больным были проведены исследования методами планарной сцинтиграфии и однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
Диагноз верифицировался морфологически.
Показано, что чувствительность и специфичность РИС составили 88 и 75% для первичных и рецидивных опухолей соответственно, а выявляемость метастазов составила 67%.
Сделан вывод: РИС позволяет получать дополнительную информацию, важную для выбора плана адекватного лечения.
Поликлональные антитела не полностью тумороспецифичны. Они также экспрессируются нормальными клетками молочной железы. Другой факт, снижающий возможность применения моноклональных антител, – это их низкая способность к проникновению в опухоль и неспособность достигать всех ее зон в адекватном для визуализации количестве.
Лимфоиммуносцинтиграфия(лимфосцинтиграфия с мечеными моноклональными антителами – MABs). Эксперименты на животных подтвердили, что введение MABs в лимфатические сосуды способно выявить наличие метастазов в лимфатических узлах. Несмотря на высокий уровень чувствительности (80–86%) и специфичности (88–92%), лимфоиммуносцинтиграфия не получила широкого распространения в клинической практике в связи с медленной кинетикой и биораспределением РФП .
Имеются сообщения об успешном использовании компьютерной томографии (КТ) как для диагностики метастатического поражения лимфоузлов парастернальной зоны, так и для более точного расчета дозы лучевой терапии во избежание лучевых повреждений органов средостения.
Нормальные размеры парастернальных лимфатических узлов колеблются от 0,2 до 1,0 см. Разрешающая способность метода КТ не позволяет выявлять лимфатические узлы диаметром менее 0,5 см. В то же время при диаметре лимфатического узла до 1 см не исключается его микрометастатическое поражение. КТ признаки, характерные для метастати ческого поражения регионарных лимфатических узлов при раке молочной железы, разработаны Н.Ф. Шишмаревой (1997): увеличение размеров лимфатических узлов более 1,5 см, увеличение количества лимфатических узлов на стороне поражения, слияние лимфатических узлов в конгломераты, нарушение четкости контуров лимфатических узлов или их конгломератов.
Более точная информация о состоянии парастернального коллектора достигается сочетанием компьютерной томографии с боковой рентгенографией легких, ультразвуковой эхографией с высоким разрешением, магнитно резонансной томографией и радиоизотопной лимфосцинтиграфией .
Магнитнорезонансная томография (МРТ) в последние годы стала одним из ведущих методов диагностики. К основным достоинствам МРТ относятся: трехмерный характер получаемых изображений, естественный контраст от движущейся крови, отсутствие артефактов от костных тканей, высокая дифференциация мягких тканей, неинвазивность, безвредность.
МРТ молочных желез является высокоинформативным методом диагностики опухолей: чувствительность метода приближается к 95%, но специфичность остается низкой (67–80%) и зависит от состояния железистой ткани. Для повышения специфичности применяется контрастирование .
Диагностика метастазов рака молочной железы в парастернальные лимфатические узлы диаметром менее 10 мм затруднительна.
В 1997 г. E. Breitenhuber et al. у 29 пациенток c раком молочной железы провели сравнение диагностических характеристик планарной сцинтиграфии (ПС) с 99m Tcтетрофосмином и динамической МРТ с гадолиниевым контрастированием. Показано, что чувствительность и специфичность ПС с 99m Tcтетрофосмином составила 86 и 86% соответственно, ОФЭКТ с тем же РФП – 93 и 71%, а МРТ – 93 и 86%.
Сделан вывод, что ПС с 99m Tcтетрофосмином и МРТ контрастированием являются ценными диагностическими дополнениями к стандартной маммографии .
К основным недостаткам МРТ относят: достаточно большое время, необходимое для получения изображений, что приводит к появлению артефактов от дыхательных движений; невозможность обследования больных с клаустрофобией, искусственными водителями ритма.
Высокая стоимость оборудования и его эксплуатации, специальные требования к помещениям, в которых находятся приборы (экранирование от помех), ограничивают возможность широкого использования данного исследования.
Позитронная эмиссионная томография (ПЭТ) – метод радионуклидной диагностики,основанный на использовании различных агентов (моносахаридов, жирных кислот, аминокислот, гормонов, антител, пептидов и т.д.), меченых позитронизлучающими радиоизотопами.
Первое использование ПЭТ для обследования больных раком молочной железы было основано на изучении утилизации кислорода опухолью исходя из того, что кровоснабжение опухоли в молочной железе активнее и общее потребление кислорода выше, чем в здоровой ткани. В настоящее время наиболее популярным РФП для ПЭТ является 18 Fфтордеокси глюкоза (18 FФДГ), при использовании которой возможно определение повышенного потребления глюкозы раковыми клетками.
Среди многообразия диагностических методов ядерной медицины ПЭТ предоставляет уникальную возможность визуализации результатов биологических процессов in vivo с высоким пространственным разрешением.
Используя изотопы элементов, постоянно присутствующих в человеческом организме(11С, 13N, 15O, 18F), можно получать РФП.
К ним относятся меченые моносахариды,аминокислоты, гормоны и др.
Позитронный эмиссионный томограф позволяет установить местоположение меченого агента на клеточном уровне и получить его изображение, отражающее биологическую активность опухоли.
ПЭТ отражает локальные процессы метаболизма в тканях. При использовании 18 Fфтор деоксиглюкозы в качестве маркера РФП накапливается в клетках в виде фосфатов. Через 40 мин после введения определяют локальный внутриклеточный гликолиз.
В 1997 г. J. Ruhlmann et al. выполняли ПЭТ молочных желез с использованием 18 Fфтор деоксиглюкозы 104 больным с регионарными метастазами рака молочной железы. По сравнению с другими методами исследования ПЭТ обладала большей чувствительностью, чем УЗИ, рентгеновская КТ и МРТ.
ПЭТ отличается бYольшими возможностями ранней диагностики метастазов в лимфатические узлы благодаря выявлению метаболически активных тканей. Ограничением чувствительности метода является диаметр метастаза менее 1 см. ПЭТ позволяет визуализировать как первичную опухоль, так и метастазы, тем самым представляя собой эффективную методику определения стадии рака молочной железы .
Для широкого внедрения ПЭТ в повседневную клиническую практику существует ряд препятствий. Прежде всего ФДГ является короткоживущим нуклидом, и поэтому ПЭТ может проводиться только в медицинских центрах, расположенных достаточно близко от циклотронов, производящих позитронизлучающие РФП, а высокая дороговизна используемой аппаратуры ставит под сомнение экономическую целесообразность данного исследования в повседневной клинической практике.
Современным диагностическим методом ядерной медицины является сцинтимаммография(СММ), основанная на распределении диагностических радиофармпрепаратов (РФП), обладающих повышенной тропностью к злокачественным новообразованиям молочной железы. СММ выполняется с помощью гамма камеры (планарного сканирования и эмиссионной гамматомографии). Наиболее широко используемым РФП для гаммасцинтиграфии на сегодня является 99m Тстехнетрил. Механизм включения 99m Тсметоксиизобутилизонитрила (МИБИ) в раковые клетки в настоящее время достаточно хорошо изучен. Поступление 99m ТсМИБИ в злокачественные клетки происходит по электрическому градиенту.
Chiuet al. показали, что 99m ТсМИБИ является не большим липофильным катионом, который захватывается цитоплазмой и митохондриями в соответствии с отрицательным трансмембранным потенциалом, этот процесс энергозависим. DelmonMoingeon et al. впервые показали, что 99m ТсМИБИ активнее включается в раковые клетки. Возможно, при использовании других катионных липофильных РФП,меченых 99m Тс, включение происходит изза их сродства к митохондриям (тетрофосмин, фурифосмин, тебороксим).
99m ТсМИБИ включается в опухоли различных локализаций. В начале 90х годов впервые были получены изображения рака легких, остеосарком, гиперплазии лимфатических узлов и глиомы мозга с помощью 99m ТсМИБИ. Исследования с 99m ТсМИБИ или тетрофосмином продемонстрировали высокую чувствительность (90%),но вариабельную специфичность при пальпируемых поражениях. Сцинтиграфия хорошо дополняет данные маммографии и позволяет выявлять поражения подмышечных лимфоузлов.
По данным E. Piperkova et al. (1996), 30 больным раком молочной железы проведены исследования методами планарной радионуклидной маммографии (ПМ) и ОФЭКТ.
Оценивали соотношение накопления радионуклида на стороне поражения регионарных лимфатических узлов и в контрлатеральных симметричных областях.
Накопление РФП в первичной опухоли сравнивалось с накоплением в другой молочной железе и миокарде.
Сравнительный анализ методов ПМ и ОФЭКТ выявил чувствительность – 69%; специфичность – 93% и точность – 76% для ПМ и 97; 93 и 96% соответственно для ОФЭКТ.
ПМ и ОФЭКТ с 99m TcMIBI – неинвазивные методы, улучшающие диагностику рака молочной железы и позволяющие осуществить послеоперационный контроль радикальности хирургического вмешательства и выявить рецидивы и метастазы при динамическом наблюдении.
В работе, опубликованной W.Yu. Ussov et al.(1997), 26 больным с раком молочной железы стадии T 1–3 N 1–3 M 0–1 проведены сравнительные исследования ОФЭКТ с 99m TcMIBI и МРТ грудной клетки для выявления отдаленных метастазов в подмышечные, над и подключичные, верхние и нижние парастернальные лимфоузлы.
ОФЭКТ выполнялась по стандартному протоколу, а трехмерная МРТ проводилась через 1 сут после ОФЭКТ в режиме взвешивания по T1, T2 и протонной плотности. Полученные обоими методами изображения совмещались с помощью компьютера. ОФЭКТ позволила обнаружить 112 лимфоузлов с повышенным накоплением РФП. Из них МРТ оказалась негативной в 43 случаях. Наибольшее расхождение данных было для парастернальных метастазов. Сделан вывод, что ОФЭКТ предпочтительнее МРТ в выявлении метастазов рака молочной железы.
По данным V. Ivancevic et al. (1997), 35 пациенток с раком молочной железы подверглись планарной сцинтиграфии и ОФЭКТ с 99m Tcтетрофосмином в дозе 750 МБк и с 18 FФДГ в дозе 370 МБк. Поражения лимфоузлов были выявлены у 11 больных. Показано, что общая чувствительность обнаружения первичных и метастатических очагов методом планарной сцинтиграфии с ФДГ и тетрофосмином составила 59 и 63% соответственно, а ОФЭКТ с теми же РФП – 81 и 63% соответственно. Сделан вывод, что ОФЭКТ с 18 FФДГ обладает наиболее высокой чувствительностью выявления первичных и метастатических опухолей молочной железы среди 4 исследованных методов .
В работе H. Palmedo et al. (1996) 17 больным проведены сравнительные исследования точности выявления опухолей молочной железы методами ПЭТ с 18 FФДГ и сцинтимаммографии с 99m TcMIBI, проводимыми в режимах ПМ или ОФЭКТ в положении “лежа на животе”. Поправки на ослабление излучения при ПЭТ и ОФЭКТ вводились по результатам трансмиссионных измерений.
Полученные обоими методами данные верифицировались при гистологическом исследовании. Из 11 первичных опухолей 8 были визуализированы с помощью ПЭТ и ОФЭКТ с одинаковой чувствительностью – 91%. В 2 случаях при рецидивах малых размеров оба метода оказались не эффективными. У 6 больных с доброкачественными опухолями оба метода дали ложно положительный результат (специфичность 83%). Сделан вывод, что ПЭТ с 18 FФДГ и ОФЭКТ с 99m TcMIBI обладают примерно одинаковой точностью в выявлении опухолей молочной железы .
В 2000–2002 годах в отделении радиохирургии РОНЦ 102 пациенткам с раком молочной железы проведен ряд исследований, которые состояли из следующих последовательно проводимых этапов:
•планарная сцинтимаммография (СММ);
•оперативное лечение, включающее радикальную резекцию молочной железы или мастэктомию с торакоскопической парастернальной лимфодиссекцией. СММ проводилась РФП 99m Тстехнетрил (MIBI) путем внутривенного введения в дозе 370–540 МБк. Через 10–15 мин после введения в положении “висящей молочной железы” выполнялась статическая полипозиционная сцинтиграфия. Сразу после статического исследования производилась эмиссионная компьютерная томография грудной клетки.
Интерпретация полученных данных заключалась в определении очагов повышенного накопления РФП в молочной железе и областях регионарных лимфатических узлов.
Из 102 больных у 58 (56,9%) метастазы в аксиллярные лимфоузлы были подтверждены гистологическим исследованием. При планарном исследовании было получено два ложно отрицательных результата, один из которых был визуализирован в режиме ОФЭКТ. Обработка материала по общепринятой формуле расчета чувствительности и специфичности
продемонстрировала чувствительность 96,5% и специфичность 95,4%.
Соответственно для ОФЭКТ эти результаты были 98,2 и 97,7%.
В 24 случаях из 102 (23,5%) метастазы в парастернальные лимфоузлы подтверждены гистологическим исследованием. Пять ложноотрицательных результатов было получено по данным планарной СММ (чувствительность –79,1%, специфичность – 100%), ни одного ложноположительного результата не было.
Чувствительность ОФЭКТ в обнаружении метастазов в парастернальный лимфатический коллектор составила 95,8%, специфичность – 100%.
Следовательно, диагностическая ценность планарной и однофотонной эмиссионной компьютерной томографии позволяет оценивать их как информативно важные и высоко чувствительные методы выявления метастазов в подмышечные и парастернальные лимфоузлы. Однако очевидно, что ОФЭКТ выходит на первый план как более чувствительный и специфичный метод при визуализации метастатически измененных аксиллярных и особенно парастернальных лимфоузлов.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.

Молочная железа женщины имеет сложную анатомию строения. Лежит она на большой грудной мышце и частично на передней зубчатой. Орган способен легко смещаться благодаря связыванию с подлежащими тканями рыхлой клетчатки. В анатомию строения входят и лимфатические узлы молочных желез.

[1], [2], [3], [4], [5], [6], [7], [8]
Строение лимфатических узлов молочных желез
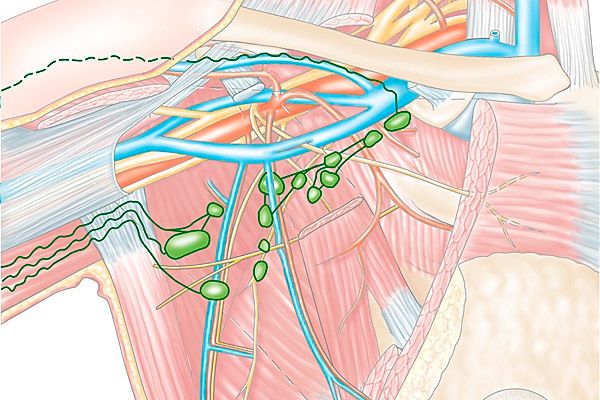
Парамаммарные лимфатические узлы расположены на большой грудной мышце, по ее наружному краю. Именно они являются основными узлами первого этапа. Выносящие сосуды, которые составляют основу строения лимфатических узлов молочных желез, впадают в аксиллярные лимфатические узлы. Они же в свою очередь являются лимфатическими узлами первого этапа. Локализуются на четвертом зубце, иногда называются узлом Бартельса.
Основной и самой крупной группой лимфатических узлов являются подмышечные группы. Часть их находится на поверхности, они разделены на три подгруппы. Сюда включают наружные, центральные и подлопаточные узлы. Наружные или латеральные подмышечные узлы расположены возле боковой грудной артерии. Центральные узлы находятся вдоль подмышечной вены. К ним происходит отток лимфы от наружных квадрантов молочной железы. Задние подмышечные узлы имеют несколько другое расположение и проходят вдоль подлопаточной артерии.
Еще одна группа лимфатических узлов включает в себя лимфоузлы расположенные под ключицей. Располагаются они в области под ключицей. Их относят к узлам первого этапа, которые включаются в верхние квадранты молочных желез. В них впадают лимфатические сосуды. Одновременно они относятся к узлам первого этапа верхнего отдела молочной железы.
Парастернальные лимфатические узлы расположились по внутренней грудной артерии. Находятся они в первом-седьмом межреберном промежутках. Самое большое скопление их наблюдается в пределах второго-четвертого промежутков. Парастернальные лимфатические узлы, расположены на втором-четвертом межреберье. Их относят к числу узлов первого этапа оттока от молочной железы. К узлам второго этапа относят выносящие сосуды подмышечных лимфатических узлов.
Железы лимфатических сосудов от своего основания следуют к лимфатическим узлам ретромаммарного пространства. После чего они пронизывают большую грудную мышцу и проходят в межпекторальные узлы. С этого участка лимфа начинает оттекать в центральные подмышечные лимфатические узлы.
Некоторая часть сосудов проходит не только через большую, но и малую грудную мышцы. Затем через ребра они проникают к парастернальным лимфатическим узлам, то бишь первому этапу. В молочной железе имеются и непостоянные лимфатические узлы. Они располагаются в области между малой и большой грудной мышцей.
Регионарные лимфатические узлы молочной железы
К регионарным лимфатическим узлам относят и внутренние. Находятся они на стороне поражения, то бишь чаще всего страдают при раке груди. Более того, их обозначают даже специальным символом М.
Аксиллярные лимфатические узлы в молочной железе
Иногда эти лимфатические узлы обнаруживают путем маммографии на латеральном отделе, который располагается вверху квадранта молочной железы. Он способствует появлению небольшой округлой тени. Благодаря такой особенности аксиллярных лимфатических узлов в молочной железе можно заметить участки просветления. Заметны они из-за скопления жира.
Аксиллярная лимфаденопатия представляет собой нарушенное функционирование подмышечных узлов. Этот процесс влечет за собой увеличение лимфоузлов. При пальпации ощущается неприятная боль. Данное явление может быть признаком развития серьезного заболевания. В том числе рака молочной железы, туберкулеза и многих других болезней. Аксиллярные лимфоузлы страдают чаще остальных. Поэтому при их увеличении необходимо приступить к поиску причины, которая вызвала этот процесс. Самым простым способом осмотра в данном случае является проведение биопсии.

[9], [10], [11], [12], [13], [14], [15]
Интрамаммарный лимфатический узел молочной железы
Под интрамаммарными лимфатическими узлами кодируют аксиллярные или подмышечные лимфоузлы. В виду своего расположения они чаще всего страдают от серьезных заболеваний, в том числе и рака груди. При подозрении на поражение молочной железы интрамаммарные лимфатические узел исследуется первым. Обследование проводят по средствам маммографии.
Как упоминалось выше, интрамаммарный узел относится к числу подмышечных. Они же в свою очередь делятся на несколько уровней, разделяющихся по-своему расположению. Подробная информация о подмышечных лимфатических узлах была представлена выше.
При нарушении функциональности интрамаммарного лифатического узла происходит значительное его увеличение. В некоторых случаях процесс сопровождается болью. Увеличение лимфоузла является серьезной проблемой, и требует немедленного обследования. Для исследования этого лимфатического узла прибегают к помощи биопсии.
Исследование лимфатических узлов молочной железы
На сегодняшний день можно выделить массу методов для исследования. Первым делом проводится клиническая диагностика. Такой способ исследования лимфатических узлов молочной железы позволяет собрать все данные о пациентке, а также провести осмотр и пальпацию. При сборе анамнеза необходимо особое внимание уделять длительности течения заболевания, а также развитию симптоматики.
Физикальное обследование представляет собой осмотр и пальпацию молочной железы. Проводить процедуру нужно при дневном свете. Особое внимание уделяется симметричности молочных желез, наличию деформаций вокруг сосков и ареол. После осмотра и пальпации прибегают к морфологической диагностике. Верификация диагноза с помощью данного исследования является важным мероприятием, если есть риск развития злокачественного процесса в молочной железе.
- Цитологическое исследование чаще всего используют в онкологии. Для него характерно проведение диагностической пункции с помощью тонких игл. Кончиком иглы определяют самое уплотненное место на груди и прокалывают его. Шприцем производится набор исследуемого материала, после чего он переносится на стекло. Данный метод исследования позволят определить характер процесса, а также степень дифференцировки клеток. Методика не так распространена, ее применяют только лишь для уточнения лимфогенного распространения рака.
- Лучевая диагностика. На сегодняшний день этот вид исследования играет ведущую роль. Основными методами лучевой диагностики считают рентгенологический и ультразвуковой способ осмотра. Включают сюда и другие мероприятия, такие как компьютерную томографию, магнитно-резонансную томографию, термографию и радионуклидный метод. Используют их исключительно по специальным показаниям.
- Рентгенологическое исследование. Этот способ позволит сделать снимки пораженного участка и по затемнениям на них понять расположение патологического процесса. В некоторых случаях прибегают к помощи рентгенограммы в нестандартных проекциях.
- Аксиллография. Это способ исследования позволяет выявить поражения лимфатические узлов. Он дает полную картинку происходящего.
- Дуктография проводится в случае подозрения наличия патологической секреции из соска. Для этого в млечные протоки молочной железы вводит 0,5-2 мо водорастворимого контрастного вещества на основе йода.
- Пневмокистография. Эта методика заключается в проведении пункции кисты, в результате которой можно заметить ее очертания.
- УЗИ. Этот метод исследования является самым распространенным. Он обладает рядом преимуществ и позволяет в точности определить наличие патологического процесса. Причем исследование является безвредным и безопасным.
- Термография. Этот принцип заключается в дистанционной регистрации с поверхности тела человека тепловизоров инфракрасного излучения. Они отражают степень биоэнергетических процессов которые происходят в различных участках того или иного органа. Результат исследования можно получить в виде термограммы.
- Компьютерная томография. Это способ исследования применяют для обнаружения метастазов при раке молочной железы, а также для оценки распространенности патологического процесса.
- Магнитно - резонансная томография. Этот метод исследования обладает скромными возможностями. Его редко применяют как отдельный способ диагностирования заболевания.
- Радионуклидное исследование молочной железы. Даная методика применяется в качестве дополнительной. Она позволяет определить злокачественность патологического процесса, а также оценить эффективность назначенного противоопухолевого лечения. Этот способ исследования является высокоэффективным.
УЗИ молочных желез и лимфатических узлов
Применяют данный метод исследования из-за его эффективности и безопасности. Он не имеет никаких противопоказаний и считается абсолютно безвредным. На сегодняшний день узи молочных желез и лимфатических узлов применяют довольно часто. Его рекомендуют при общем обследовании женщины с жалобами на болезненность молочных желез. Узи безопасно даже для беременных и пациенток молодого возраста.
Этот способ позволяет определить точную причину болезненности и провести наблюдение за состоянием молочных желез в целом. На ранних стадиях оно позволяет выявить рак и начать его своевременное лечение. Прибегать к помощи Узи необходимо при постоянной болезненности молочных желез, особенно в период предменструальной фазы. При выделениях из соска, изменении цвета кожи и увеличение подмышечных лимфатических узлов обследование нужно обязательно проводить. Рекомендуется делать УЗИ не реже 2-х раз в год. Проведение процедуры не требует особой подготовки. Приходить на осмотр желательно в первой фазе менструального цикла.
Читайте также:

