Острый лимфобластный лейкоз патофизиология
Лейкозы - представляют собой опухоли, диффузно поражающие
гемопоэтическую ткань костного мозга. Уровень заболеваемости
лейкозами в разных странах мира колеблется в широком диапазоне: от 3
до 10 человек на 100 000 населения. При этом мужчины болеют
различными формами лейкоза примерно в 1,5 раза чаще, чем женщины.
Максимальный уровень заболеваемости хроническими лейкозами
наблюдается у людей старше 40-50 лет, а острыми - в возрасте до 10-18
лет. Лейкозы относятся к группе заболеваний, называемых
гемабластозами. Гемабластозы - это опухолевый процесс,
новообразования, возникающие из клеток кроветворной ткани.
Гемабластозы подразделяются на 2 группы: 1) системные заболевания,
диффузно поражающие кроветворную ткань, - лейкозы; 2) регионарные
заболевания - гематосаркомы - образуют солидные опухоли.
Гематосаркомы также происходят из кроветворных клеток, однако
находящихся вне костного мозга. Кроме того, гематосаркомы в отличие
от лейкозов характеризуются местным, локальным ростом. Их клетки
первоначально не распространяются по системе кроветворения. Однако,
учитывая единую опухолевую сущность обеих групп гемабластозов,
лейкозы и гематосаркомы могут "переходить" друг в друга:
метастазирование лейкозных клеток за пределы костного мозга приводит
к развитию гематосарком, и наоборот, попадание клеток гематосарком в
кроветворную ткань костного мозга обуславливает развитие лейкоза.
Для лейкозов характерны: 1) безграничный рост, неконтролируемое
размножение клеток - гиперплазия; 2) морфологическая анаплазия -
потеря способности клетки к дифференцировке, созреванию, незрелость;
степень омоложения клеток коррелирует со злокачественностью процесса;
3) угнетение номального кроветворения за счет быстрого разрастания
опухолевых элементов, "вытеснения" ими, замещения нормальных ростков
кроветворения. Это явление носит название метаплазии.
Принято считать, что поражение организма при лейкозах происходит
на ранних этапах развития и дифференцировки клеток-предшественниц
гемопоеза. Возможно повреждение отдельных ростков кроветворной ткани.
Существует несколько принципов классификаций лейкозов:
1. Лейкозы подразделяют на острые и хронические. Это деление
основывается не на длительности течения заболевания, а на
морфофункциональных особенностях лейкозных клеток.
Острые лейкозы - это те формы лейкозов, при которых основной
субстрат опухолевых разрастаний в костном мозге, а также клетки,
циркулирующие в периферической крови, представленны
низкодифференцированными, незрелыми элементами (бластными клетками).
Проходит нарушение (остановка), дифференцировки клеток на одном из
ранних этапов гемопоэза. Костный мозг и периферическая кровь
перенасыщенны восновном клетками 2-го, 3-го, 4-го классов.
При развернутой форме острого лейкоза количество бластных клеток
в костном мозге и периферической крови состовляет от 40% до 100%. При
хронических лейкозах дифференцировка клеток нарушена не столь
значительно. Субстрат опухоли представлен созревающими и зрелыми
клетками. Создается видимость благополучия в коветворном механизме.
Однако это не так, эти клетки значительно отличаются от нормальных
генетическими свойствами, особенностями метаболизма, нарушениями
функциональных особенностей. Это по сути - злокачественные клетки.
2. Иной принцип классификации лейкозов - по типу лейкозных
клеток: а) миелобластный; б) лимфобластный; в) монобластный; г)
эритромиелобластный; д) промиелоцитарный; е) недиференцированный.
Названия даны по нормальным предшественникам лейкозных клеток, но на
этом сходство с нормальными клетками заканчивается.
Так как все "бластные" лейкозные клетки морфологически сходны,
морфологические признаки не могут служить надежным критерием их
идентификации. Более четким и стабильным критерием, позволяющим
определить происхождение лейкозной клетки, является их химический и
ферментативный субстрат, отражающий направление дифференцировки.
Хронические лейкозы в зависимости от типа лейкозных клеток,
состовляющих субстрат опухоли, подразделяют на: а) хронические
миелолейкозы; б) хронические лимфолейкозы; в) хронические
моноцитарные лейкозы; г) эритремию - болезнь Вакеза; д) миеломную
Принято классифицировать лейкозы по количеству клеток в
периферической крови: а) при лейкемическом лейкозе, лейкемии
количество лейкоцитов в периферической крови достигает сотен тысяч в
1 мкл; б) при сублейкемическом лейкозе число лейкоцитов увеличенно до
десятков тысяч в 1 мкл; в) при аллергическом лейкозе их колличество
не изменено или даже снижено. Алейкемический лейкоз рассматривается
как начальная фаза развития заболевания, переходящая в дальнейшем в
сублейкемическую или лейкемическую форму. Это проявление опухолевой
В большинстве случаев лейкозу сопутствуют анемия и
тромбоцитопения, возникающие в результате метаплазии - замещения
нормальных очагов кроветворения лейкозными элементами. Анемический
синдром сопровождается развитием гипоксии. Следствием тромбоцитопении
являются геморраргические диатезы. Особенно опастны кровоизлияния в
мозг, которые могут стать причиной гибели больного. Однако основным
осложнением лейкоза и непосредственной причиной гибели чаще всего
являются инфекции. Язвенно-некротические ангины, стоматиты, пневмонии
и другие инфекционные поражения, принимающие генерализованный
характер, а ткаже сепсис связаны при лейкозах с резким снижением
защитных свойств неполноценных низкодифференцирующихся лейкоцитов,
развитие синдрома беззащитности, имунодефицит - главная опасность при
Часто при лейкозах возникают внекостномозговые (экстрамедулярные)
очаги кроветворения, лейкемические инфильтраты в коже, легких,
плевре, печени. Особенно грозным осложнением является нейролейкемия -
поражение лейкозными инфильтратами оболочек головного мозга и
отдельных черепных нервов. При остром лимфобластном лейкозе они
наблюдаются у 32-80% больных, при миелобластном - всего у 8%.
В настоящее время опухолевая природа лейкозов является
общепризнаной, а следовательно, этиологические факторы для опухолей и
лейкозов едины. Выделяют три основные группы факторов: 1)
ионизирующее излучение; 2) химические канцерогены; 3) вирусы.
Так же имеется так называемая генетическая предрасположенность к
лейкозам, это может быть вызвано сниженной резистентностью хромасом к
действию мутагенных агентов, а также недостаточной активностью
ферментных систем репаративного синтеза нуклеиновых кислот. Другим
существенным условием, способствующим реализации действия
канцерогенных факторов и возникновению гемобластозов, является низкая
активность антиканцерогенных механизмов противоопухолевой
резистентности организма. Эти механизмы препядствуют реализации
эффектов канцерогенных агентов, инактивируя или элиминируя их.
Литература используемая в работе
1. Физиология человека. Р.Шмидт 1996
2. Патологическая физиология. А.Д. Адо 1973
3. Патофизиология. П.Ф. Ливитский 1995
4. Избранные лекции по курсу "Патологическая физиология"
Что такое острый лимфобластный лейкоз?
Острый лимфобластный лейкоз (или острый лимфолейкоз, сокр. ОЛЛ) — это опасное для жизни заболевание, при котором клетки, в нормальных условиях развивающиеся в лимфоциты, становятся злокачественными и быстро замещают нормальные клетки в костном мозге.
- В связи с недостатком нормальных клеток крови у больных могут появляться такие симптомы, как повышение температуры, слабость и бледность.
- Как правило, в таких случаях выполняются анализы крови и исследование костного мозга.
- Проводится химиотерапия, которая часто оказывается эффективной.
Острый лимфолейкоз (ОЛЛ) встречается у больных любого возраста, но является самым распространенным типом онкологических заболеваний у детей и составляет 75% всех случаев лейкоза у детей до 15 лет. ОЛЛ наиболее часто поражает детей младшего возраста (от 2 до 5 лет). Среди людей среднего возраста это заболевание встречается немного чаще, чем у больных старше 45 лет.
При ОЛЛ очень незрелые лейкозные клетки скапливаются в костном мозге, разрушая и замещая клетки, которые производят нормальные клетки крови. Лейкозные клетки переносятся с кровотоком в печень, селезенку, лимфатические узлы, головной мозг и яички, где могут продолжать расти и делиться. При этом клетки ОЛЛ могут скапливаться в любой части организма. Они могут проникать в оболочки, покрывающие головной и спинной мозг (лейкозный менингит), и приводить к анемии, печеночной и почечной недостаточности и повреждению других органов.
Симптомы острого лимфобластного лейкоза

Ранние симптомы ОЛЛ возникают в результате неспособности костного мозга вырабатывать достаточное количество нормальных клеток крови.
- Повышение температуры и чрезмерное потоотделение могут указывать на наличие инфекции. Высокий риск инфекции связан со слишком малым количеством нормальных лейкоцитов.
- Слабость, утомляемость и бледность, свидетельствующие об анемии, могут появляться из-за недостаточного количества эритроцитов. У некоторых больных может наблюдаться затрудненное дыхание, учащенное сердцебиение и боль в груди.
- Быстро появляющиеся кровоподтеки и кровотечения, иногда в форме носовых кровотечений или кровотечений из десен, возникают из-за слишком малого количества тромбоцитов. В некоторых случаях может возникать кровоизлияние в головной мозг или внутрибрюшное кровотечение.
При проникновении лейкозных клеток в другие органы возникают соответствующие симптомы.
- Лейкозные клетки в головном мозге могут вызывать головные боли, рвоту, инсульт и нарушения зрения, равновесия, слуха и лицевых мышц.
- Лейкозные клетки в костном мозге могут приводить к болям в костях и суставах.
- Если лейкозные клетки вызывают увеличение печени и селезенки, может появляться ощущение переполнения желудка и в некоторых случаях боль.
Причины острого лимфобластного лейкоза
Основная причина ОЛЛ остается неизвестной, но существуют факторы риска, которые могут быть экологическими или вторичными по отношению к наследственным и/или приобретенным предрасполагающим условиям. Факторами риска окружающей среды являются прошлое облучение ионизирующим излучением, химическими веществами (бензол, гербициды и пестициды) и химиотерапевтическими агентами.
К наследственным предрасполагающим состояниям относятся синдром Дауна, наследственные расстройства, характеризующиеся дефектом процессов репарации ДНК и регуляции клеточного цикла (анемия Фанкони, синдром Блума и атаксия-телеангиэктазия), наследственные расстройства, характеризующиеся изменением передачи сигнала в процессах пролиферация клеток и апоптоз (синдром Костмана, синдром Швахмана–Даймонда, анемия Даймонда–Блекфена и нейрофиброматоз типа I) и синдром Ли-Фраумени.
Существуют также приобретенные предрасполагающие состояния, такие как апластическая анемия, пароксизмальная ночная гемоглобинурия и миелодиспластический синдром.
Диагностика
Первые признаки острого лимфобластного лейкоза можно обнаружить при помощи анализов крови, таких, как общий анализ крови. Общее количество лейкоцитов может быть сниженным, нормальным или повышенным, но количество эритроцитов и тромбоцитов почти всегда оказывается сниженным. Кроме того, в крови обнаруживаются очень незрелые лейкоциты (бласты).
Чтобы подтвердить диагноз и отличить ОЛЛ от других типов лейкозов, практически во всех случаях проводится исследование костного мозга. Бласты анализируют на наличие хромосомных аномалий, что помогает врачам определить точный тип лейкоза и подобрать подходящие препараты для лечения.
Анализы крови и мочи назначаются для выявления других отклонений, включая электролитные нарушения.
Также могут потребоваться визуализирующие исследования. При выявлении симптомов, позволяющих заподозрить наличие лейкозных клеток в головном мозге, проводится компьютерная томография (КТ) или магнитно-резонансная томография (МРТ). Для выявления лейкозных клеток в области вокруг легких может выполняться КТ органов грудной клетки. При увеличении внутренних органов могут проводиться КТ, МРТ или ультразвуковое исследование брюшной полости. Перед началом химиотерапии может быть выполнена эхокардиография (ультразвуковое исследование сердца), поскольку иногда химиотерапия оказывает отрицательное воздействие на сердце.
Лечение острого лимфобластного лейкоза
Лечение ОЛЛ включает:
- химиотерапию;
- другие препараты, такие как иммунотерапия и/или таргетная терапия;
- в редких случаях трансплантация стволовых клеток или лучевая терапия.
Химиотерапия является высокоэффективной и состоит из следующих фаз:
- индукция;
- лечение головного мозга;
- консолидация и интенсификация;
- поддерживающая терапия.
Индукционная химиотерапия — это первая фаза лечения. Задача индукционной терапии состоит в достижении состояния ремиссии посредством уничтожения лейкозных клеток, что восстанавливает способность нормальных клеток развиваться в костном мозге. В некоторых случаях требуется пребывание в больнице в течение нескольких дней или недель (это зависит от того, насколько быстро восстанавливается костный мозг).
Применяется одна из нескольких комбинаций лекарственных препаратов, дозы которых вводятся повторно в течение нескольких дней или недель. Выбор конкретной комбинации зависит от результатов диагностических анализов. Одна из комбинаций состоит из преднизона (кортикостероида), принимающегося внутрь, и еженедельных доз винкристина (химиотерапевтического препарата), назначаемого вместе с препаратом антрациклина (обычно даунорубицином), аспарагиназой и иногда циклофосфамидом, для внутривенного введения. У некоторых пациентов с острым лимфолейкозом могут использоваться новые препараты, такие как иммунотерапия (лечение, которое использует собственную иммунную систему человека для уничтожения опухолевых клеток) и таргетная терапия (препараты, которые атакуют внутренние биологические механизмы опухолевых клеток).
Лечение головного мозга обычно начинается во время индукции и может продолжаться на всех этапах лечения. Поскольку ОЛЛ часто распространяется и на головной мозг, эта фаза также направлена на лечение лейкоза, уже распространившегося в головной мозг, либо на профилактику распространения лейкозных клеток в головной мозг. Для воздействия на лейкозные клетки в слоях ткани, покрывающих головной и спинной мозг (мозговых оболочках), применяются лекарственные препараты, такие, как метотрексат, цитарабин, кортикостероиды или их комбинации, которые обычно вводятся прямо в спинномозговую жидкость, либо высокие дозы этих препаратов могут вводиться внутривенно. Такая химиотерапия может проводиться в сочетании с лучевой терапией головного мозга.
В фазе консолидации и интенсификации продолжается лечение заболевания костного мозга. Дополнительные химиотерапевтические препараты или те же препараты, что и во время фазы индукции, могут применяться несколько раз за период, который продолжается в течение нескольких недель. Некоторым больным с высоким риском рецидива в связи с определенными хромосомными изменениями в лейкозных клетках назначают пересадку стволовых клеток после достижения ремиссии.
Дальнейшая поддерживающая химиотерапия, которая обычно заключается в приеме меньшего количества препаратов (в некоторых случаях в меньших дозах), продолжается, как правило, в течение 2–3 лет.
Пожилые люди с ОЛЛ могут быть не способны перенести интенсивную схему лечения, используемую у молодых людей. У таких больных может быть использован более щадящий вариант лечения с применением только режимов индукционной терапии (без последующей консолидации, интенсификации или поддерживающей терапии). Иногда у некоторых пожилых людей может назначаться иммунотерапия или более щадящая форма трансплантации стволовых клеток.
Во время всех вышеуказанных фаз для лечения анемии и предотвращения кровотечений может потребоваться переливание крови и тромбоцитов, а для лечения инфекций — прием противомикробных препаратов. Чтобы помочь избавить организм от вредных веществ (таких как мочевая кислота), которые образуются при разрушении лейкозных клеток, могут проводиться внутривенные вливания жидкостей и лечение препаратами аллопуринол либо расбуриказа.
Лейкозные клетки могут начать появляться снова (такое состояние называют рецидивом). Часто они образуются в крови, костном мозге, головном мозге или яичках. Раннее повторное появление таких клеток в костном мозге является особенно серьезным. Химиотерапия проводится еще раз, и, хотя многим больным помогает такое повторное лечение, существует большая вероятность повторного рецидива заболевания, особенно у детей первого года жизни и взрослых. Если лейкозные клетки повторно появляются в головном мозге, химиотерапевтические препараты 1 или 2 раза в неделю вводятся в спинномозговую жидкость. Если лейкозные клетки повторно появляются в яичках, то наряду с химиотерапией проводится лучевая терапия на область яичек.
У некоторых пациентов с рецидивирующим ОЛЛ используются новые перспективные методы лечения с использованием моноклональных антител (белков, которые специфически связываются с лейкозными клетками, маркируя их для уничтожения). Еще более новая терапия, которую можно применять у некоторых пациентов с рецидивом острого лимфобластного лейкоза, называется Т-клеточная терапия с химерным антигенным рецептором (CAR-T). Эта терапия предусматривает модификацию определенного вида лимфоцитов (Т-лимфоцитов, также называемых Т-клетками) от больного лейкозом таким образом, чтобы эти новые Т-лимфоциты лучше распознавали и атаковали лейкозные клетки.
После рецидива у больных, неспособных перенести пересадку стволовых клеток, дополнительная терапия часто оказывается плохо переносимой и неэффективной и обычно приводит к серьезному ухудшению самочувствия. Тем не менее, могут случаться ремиссии. В отношении пациентов, которым не помогает лечение, должен рассматриваться вариант ухода за неизлечимо больными людьми.
Прогноз жизни
До появления лечения большинство больных с острым лимфолейкозом умирали в течение нескольких месяцев с момента постановки диагноза. Теперь ОЛЛ удается излечить примерно у 80% детей и у 30–40% взрослых. У большинства больных первый курс химиотерапии позволяет взять заболевание под контроль (полная ремиссия). Лучшие прогнозы на излечение имеются у детей в возрасте 3-9 лет. Прогнозы для детей первого года жизни и пожилых больных менее благоприятны. Количество лейкоцитов на момент установления диагноза, наличие или отсутствие распространения лейкоза в головной мозг и хромосомные аномалии в лейкозных клетках также влияют на результат лечения.
Опухолевые клетки при острой лимфобластной лейкемии/лимфоме (ОЛЛ) представляют собой незрелые В-клетки (пре-В-клетки) или Т-клетки (пре-Т-клетки), называемые лимфобластами. Около 85% всех ОЛЛ — это В-клеточная ОЛЛ (В-ОЛЛ), в типичных случаях проявляющаяся как детская острая лейкемия. Реже встречающаяся Т-клеточная ОЛЛ (Т-ОЛЛ) наблюдается преимущественно у подростков в виде тимусной лимфомы. Клиническая картина В-ОЛЛ и Т-ОЛЛ близка: например, В-ОЛЛ может принимать необычную форму опухолевой массы в коже или костях, а Т-ОЛЛ во многих случаях изначально или со временем дает клиническую картину лейкемии. Из-за морфологического и клинического сходства различные формы ОЛЛ рассмотрены вместе.
Острый лимфобластный лейкоз (ОЛЛ) — наиболее частая злокачественная опухоль у детей. Ежегодно в США диагностируют 2500 новых случаев, и большинство из них регистрируют у детей до 15 лет. Частота острого лимфобластного лейкоза (ОЛЛ) у лиц с белым цветом кожи в 3 раза выше, чем у лиц с темным цветом кожи. Заболевание чаще встречается у мальчиков. Из всех этнических групп наибольшая частота отмечена у испаноязычных американцев. Пик заболеваемости приходится на 3-летний возраст, возможно потому, что количество пре-В-клеток в нормальном костном мозге больше всего именно в этом возрасте. Пик заболеваемости Т-ОЛЛ наблюдается в подростковом возрасте, когда тимус достигает максимального размера. В-ОЛЛ и Т-ОЛЛ у взрослых регистрируют реже.
Вследствие неодинаковой реакции опухолей на химиотерапию ОЛЛ необходимо отличать от острой миелоидной лейкемии (ОМЛ) — неоплазии, состоящей из незрелых миелоидных клеток, но которая может иметь идентичные признаки и симптомы. По сравнению с миелобластами лимфобласты имеют более конденсированный ядерный хроматин, менее заметные ядрышки и меньшее количество цитоплазмы, в которой обычно отсутствуют гранулы. Однако эти морфологические различия неабсолютны и окончательный диагноз базируется на окрашивании с помощью антител, специфичных для антигенов В- и Т-клеток.
Гистохимический метод позволяет установить, что в отличие от миелобластов лимфобласты дают отрицательную реакцию на миелопероксидазу и часто содержат PAS-положительный цитоплазматический материал.
б) Иммунофенотип. Иммуноокрашивание для выявления терминальной дезоксинуклеотидилтрансферазы (специализированной ДНК-полимеразы, экспрессированной только пре-В- и пре-Т-лимфобластами) дает положительный результат в 95% случаев. В-ОЛЛ и Т-ОЛЛ различают по окрашиванию специфических В- и Т-клеточных маркеров (см. далее).
В-ОЛЛ останавливается на разных стадиях развития пре-В-клеток. Лимфобласты обычно экспрессируют общий В-клеточный маркер CD19 и фактор транскрипции РАХ5, а также CD10. При очень незрелых В-клетках CD10 отсутствует. С другой стороны, более зрелые пре-В-клетки ОЛЛ экспрессируют CD10, CD19, CD20 и цитоплазматическую тяжелую цепь IgM (u-цепь).
Т-ОЛЛ также останавливается на разных стадиях развития Т-клеток. В большинстве случаев эти клетки дают положительную реакцию на CD1, CD2, CD5 и CD7. Незрелые пре-Т-клеточные опухоли обычно лишены поверхностных CD3, CD4 и CD8, тогда как более зрелые Т-клетки эти маркеры экспрессируют.
в) Молекулярный патогенез. Около 90% ОЛЛ характеризуются количественными или структурными изменениями хромосом. Наиболее часто встречается гиперплоидия (> 50 хромосом), однако возможны также гипоплоидия и сбалансированные хромосомные транслокации. Эти изменения нередко коррелируют с иммунофенотипом и иногда имеют прогностическое значение. Так, гипер- и гиподиплоидия присутствуют только при В-ОЛЛ. Кроме того, В-ОЛЛ и Т-ОЛЛ ассоциируются с разными наборами транслокаций, что указывает на патогенетические различия. Профиль РНК, определяемый с помощью генных чипов, свидетельствует о корреляции определенных хромосомных транслокаций с уникальными формами экспрессии генов.
Многие из хромосомных аберраций, обнаруживаемых при ОЛЛ, нарушают регуляцию экспрессии и функции факторов транскрипции, необходимых для нормального развития В- и Т-клеток. До 70% Т-ОЛЛ характеризуются мутациями с усилением функции NOTCH1, гена, важного для развития Т-клеток. С другой стороны, при В-ОЛЛ нередко обнаруживаются мутации с утратой функции генов, необходимых для развития В-клеток, например РЛХ5, Е2А и EBF, или сбалансированная транслокация t(12;21) генов TEL и AML1, необходимых для очень ранних гемопоэтических клеток-предшественников. Все эти мутации, видимо, нарушают дифференцировку лимфоидных клеток-предшественников и способствуют остановке созревания. Как будет описано далее, подобное происходит и при генезе ОМЛ.
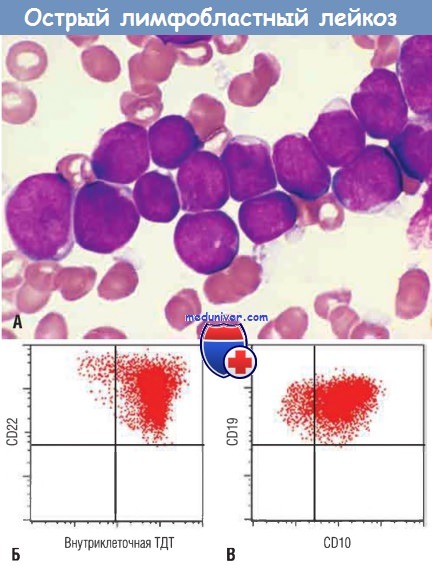
(А) Острая лимфобластная лейкемия/лимфома.
Лимфобласты с конденсированным ядерным хроматином, небольшими ядрышками и скудной агранулярной базофильной цитоплазмой.
(Б) Фенотип ОЛЛ определен с помощью проточной цитометрии.
Обратите внимание, что лимфобласты (красные точки) экспрессируют терминальную дезоксинуклеотидилтрансферазу (ТДТ) и В-клеточный маркер CD22.
(В) Те же клетки несут два других маркера — CD10 и CD19, обычно экспрессируемые пре-В-лимфобластами. Следовательно, это В-ОЛЛ.
г) Клинические признаки. Хотя ОЛЛ и ОМЛ генетически и иммунофенотипически различаются, клинически они очень сходны. В обоих случаях накопление неопластических бластов в костном мозге подавляет нормальный гемопоэз в результате физического сдавления, конкуренции за факторы роста и других малоизученных механизмов.
Общие проявления и признаки острого лимфобластного лейкоза (ОЛЛ) и острого миелобластного лейкоза (ОМЛ):
- резкое, бурное начало с появлением первых симптомов в течение нескольких дней или недель;
- симптомы, связанные с угнетением функции костного мозга, включая утомляемость, обусловленную анемией; лихорадка, вызванная инфекцией вследствие нейтропении; кровоточивость вследствие тромбоцитопении;
- проявления, обусловленные ростом опухоли и неопластической инфильтрацией (чаще наблюдаются при ОЛЛ), включая боль в костях вследствие экспансии костного мозга и инфильтрации поднадкостничного пространства; генерализованная лимфаденопатия, спленомегалия и гепатомегалия; увеличение тестикул; осложнения, связанные со сдавливанием крупных сосудов и дыхательных путей в средостении (при Т-ОЛЛ);
- проявления со стороны центральной нервной системы, например головная боль, рвота и парезы, возникающие в результате распространения процесса на оболочки головного мозга (эти проявления более характерны для ОЛЛ).
С плохим прогнозом ассоциируются следующие факторы:
(1) возраст до 2 лет (в значительной степени из-за связи ОЛЛ у детей с транслокацией гена MLL);
(2) манифестация в подростковом или взрослом возрасте;
(3) количество бластов в периферической крови свыше 100 тыс., что, вероятно, отражает опухолевую активность;
(4) наличие особых хромосомных аберраций, в частности транслокации t(9;22) (филадельфийской хромосомы), которая присутствует лишь у 3% детей с ОЛЛ, однако у взрослых частота достигает 25%. О плохом прогнозе свидетельствует наличие после лечения В-ОЛЛ и Т-ОЛЛ остаточного заболевания на молекулярном уровне, что стимулирует проведение новых клинических исследований.
Благоприятные прогностические факторы:
(1) возраст от 2 до 10 лет;
(2) низкое количество лейкоцитов;
(3) гиперплоидия;
(4) трисомия по 4, 7 и 10-й хромосомам;
(5) присутствие транслокации t(12;21).
Большинство хромосомных аберраций при остром лимфобластном лейкозе (ОЛЛ) изменяет функцию факторов транскрипции, но транслокация t(9;22) создает гибридный ген, кодирующий конститутивно активную тирозинкиназу BCR-ABL. При В-ОЛЛ тирозинкиназа BCR-ABL с молекулярной массой 190 кДа обладает более высокой активностью, чем тирозинкиназа BCR-ABL с молекулярной массой 210 кДа, обнаруживаемая при хронической миелоидной лейкемии. Лечение ОЛЛ с транслокацией t(9;22) ингибиторами тирозинкиназы BCR-ABL эффективно, однако быстро следует рецидив, поскольку приобретенные мутации BCR-ABL делают опухолевые клетки лекарственно резистентными. При В-ОЛЛ мутации BCR-ABL происходят часто. Этот феномен приписывают геномной нестабильности, способствующей клиническому прогрессированию болезни и резистентности к терапии у многих агрессивных злокачественных опухолей.
Лейкозы (лейкемии, гемобластозы) относятся к одной из самых тяжелых категорий заболеваний, причем значимость этого вида патологии постоянно нарастает.
Несмотря на значительный прогресс, достигнутый за последние десятилетия в области разработки различных методов лечения лейкозов, смертность при данных заболеваниях по-прежнему остается высокой.
Характерно увеличение частоты возникновения лейкозов, что в определенной степени можно объяснить ухудшением экологической обстановки в экономически развитых странах мира. В частности, в связи с ростом промышленного производства концентрация канцерогенных (лейкемогенных) химических веществ в окружающей среде стала значительно выше, чем раньше.
Также претерпевает изменения и радиационный фон Земли. Следует отметить, что лейкемии — злокачественные новообразования, которые возникают у значительного количества детей и лиц молодого трудоспособного возраста и представляют собой, таким образом, особенно острую социальную проблему.
Определение понятия и классификация
В настоящее время принято следующее определение этого заболевания.
Лейкоз — это системное заболевание крови, характеризующееся бес контрольной пролиферацией и омоложением кроветворных элементов с нарушением их созревания и метаплазией кроветворной ткани.
В данном определении необходимо выделить несколько важных положений:
• будучи системными заболеваниями крови, лейкозы поражают, как правило, всю кроветворную систему, включая эритропоэтический, лейкопоэтический и тромбопоэтический ростки костного мозга;
• в основе лейкозов лежит бесконтрольный рост и нарушение диф-ференцировки (созревания) кроветворных клеток, что, как известно, наблюдается при злокачественных опухолях;
• при лейкемиях развивается метаплазия кроветворной ткани, при которой один из кроветворных ростков начинает развиваться в нетипичной для него ткани, например: миелоидные клетки появляются в лимфоидных органах, лимфоидные клетки — в костном мозге. Существует несколько классификаций лейкозов, каждая из которых основана на соответствующих критериях, определяющих особенности заболевания.
I. По течению процесса:
В настоящее время при качественной терапии острые лейкозы нередко протекают более благоприятно, чем хронические. Более того, при агрессивной химиотерапии острого лимфолейкоза у детей в 70 % случаев наступает полное выздоровление, а в 90 % — стойкая ремиссия.
II. По источнику образования опухолевого клона лейкемии:
III. По количеству лейкоцитов в периферической крови пациента:
• лейкемическая (количество лейкоцитов больше 50 тыс./мкл крови);
• сублейкемическая (от 10 до 50 тыс./мкл крови);
• алейкемическая (количество лейкоцитов находится в границах нормы);
• лейкопеническая (менее 4 тыс./1 мкл крови).
Отличия острых и хронических лейкозов
Можно выделить несколько признаков, выявляемых по анализу периферической крови, по которым отличаются между собой острые к хронические формы лейкозов:
1. Для острых лейкозов характерен разрыв между недифференцированными и зрелыми клетками белой крови, именуемый, hiatus leucemicus (лейкемическое зияние). Так, при остром миелолейкозе одна (или более) промежуточная форма отсутствует (например, промиелоциты или миелоциты). При хроническом миелолейкозе в периферической крови находят клеточные элементы, соответствующие всем стадиям созревания гранулоцитов: миелобласты — промиелоциты — миелоциты — метамиелоциты — зрелые клетки (нейтрофилы, базофилы, эозинофилы). Аналогичное отличие будет характерно для хронического и острого лимфолейкоза. При остром лимфолейкозе отсутствуют пролимфоциты (hiatus leucemicus). При хроническом лимфолейкозе в периферической крови присутствуют все клетки лимфоидного ряда: лимфобласты — пролимфоциты — лимфоциты.
2. При хроническом лейкозе наблюдается более глубокая анемия по сравнению с острым.
3. Для острого лейкоза чаще всего характерен менее выраженный лейкоцитоз, нежели для хронического.
4. При острых лейкозах уже в начале заболевания в крови обнаруживаются в значительном количестве властные (незрелые, низкодифференцированные) клетки. При хронических лейкозах подобная картина крови развивается лишь в терминальной стадии (так называемый властный криз) и то не всегда. Как правило, при хроническом лейкозе выявляется менее 5 % властных клеток в периферической крови, а при остром, напротив, больше 5 %.
Этиология и патогенез
Как и в случае с другими злокачественными опухолями, говорить о непосредственных причинах развития лейкозов довольно трудно. Вместе с тем существует ряд факторов риска, для которых установлена определенная связь с возникновением заболевания. Их можно объединить в несколько групп:
1. Физические факторы. Прежде всего, к ним относится ионизирующее излучение. У жителей японских городов Хиросимы и Нагасаки, выживших после атомной бомбардировки 1945 г., частота возникновения лейкемии была существенно выше, чем в других городах Японии. Также роль облучения в развитии лейкозов была доказана в эксперименте на животных.
2. Химические вещества. Было установлено, что в ряде случаев возникновение лейкозов связано с воздействием на организм тех же веществ, которые могут играть роль в развитии других злокачественных новообразований: метилхолантрен, бензпирен, нитраты, пестициды, ароматические углеводороды, а также некоторые лекарственные препараты (левомицетин, цитостатики и др.).
3. Биологические факторы. Пациенты, страдающие некоторыми формами лейкозов, являются носителями определенных вирусов. Так, например, при лимфоме Беркитта практически во всех случаях у больных обнаруживается вирус Эпштейна—Барр, являющийся возбудителем инфекционного мононуклеоза. Последний представляет собой инфекционное заболевание, как правило не имеющее при обычном течении серьезных последствий для организма. Также известно, что такое заболевание, как Т-клеточная лейкемия — лимфома взрослых, — вызывается HTLV- в ирусом (от англ, human T-lymphocyte virus), относящимся к семейству ретровирусов.
4. Генетические факторы. Ряд форм лейкозов имеет наследственную предрасположенность, что подтверждается случаями аналогичных заболеваний у родственников.
Говоря о патогенезе опухолей кроветворной системы, следует прежде всего отметить, что роль перечисленных выше факторов риска удается установить лишь у незначительного числа пациентов. В остальных случаях заболевание возникает спонтанно, т. е. без четко установленной связи с причинным фактором. При этом непосредственный механизм, приводящий к появлению лейкозной клетки, известен — это мутация.
Последняя, как правило, возникает в геноме полипотентной клетки кроветворной системы, приобретающей в результате этого опухолевые свойства, а именно способность к бесконтрольному делению и нарушение процесса дифференцировки (созревания). Все опухолевые клетки являются моно-клональными, т. е. продуктами деления одной злокачественной клетки.
Для некоторых форм лейкемии основным механизмом появления опухолевых клеток служит хромосомная перестройка — транслокация, т. е. перенос части одной хромосомы на другую. Так происходит, в частности, при хроническом миелолейкозе. При этом заболевании в гранулоци-тах обнаруживается так называемая филадельфийская хромосома (Ph-хромосома) — результат переноса части хромосомы с 22-й пары на 9-ю.
На определенной стадии развития лейкоза в клоне лейкозных клеток возможно возникновение новых мутаций, в результате чего появляются опухолевые клетки с более злокачественными свойствами (менее зрелые клетки), которые постепенно вытесняют старые клетки (с менее злокачественными свойствами). Таким образом, внутри старого клона появляется новый, более агрессивный клон. На этой стадии опухоль становится поликлональной. Клинически опухолевая прогрессия проявляется в виде так называемого властного криза, когда на поздней стадии хронического лейкоза в крови начинают преобладать бластные клетки. Хронический лейкоз приобретает черты острого.
Особенности кроветворения при лейкозах
1. Нарушение процесса созревания кроветворных клеток (анаплазия). Резкое увеличение доли недифференцированных клеток в костном мозге. Появление незрелых (в том числе бластных) клеток в периферической крови.
2. При многих формах лейкемии развиваются анемия и тромбоци-топения на поздних стадиях заболевания.
3. Появление так называемых экстрамедуллярных очагов кроветворения, когда клетки крови начинают появляться не в костном мозге, а в других органах и тканях (например, в селезенке или в стенке кровеносных сосудов.
Основные причины смерти при лейкозах
1. Тяжелая анемия. В большинстве случаев при хронических лейкозах развивается глубокая анемия, которая может стать причиной смерти.
2. Геморрагический синдром. При многих формах лейкозов отмечается тромбоцитопения, в результате чего даже при незначительном повреждении какого-либо кровеносного сосуда возникают тяжелые кровотечения или кровоизлияния (например, желудочно-кишечное кровотечение или кровоизлияние в головной мозг). Геморрагическим осложнениям лейкозов также способствует появление упомянутых выше экстрамедуллярных очагов кроветворения в стенке кровеносных сосудов, в результате чего они становятся особенно хрупкими и легко подвергаются сквозному разрыву.
3. Вторичные инфекции. При лейкемиях количество лейкоцитов в периферической крови может достигать очень высокого уровня. Однако большая часть этих клеток не созревает до своих конечных форм. Такие незрелые клетки не в состоянии выполнять свою защитную функцию, что проявляется в виде резко повышенной восприимчивости организма к любым инфекциям.
4. Тромбоэмболические осложнения. При некоторых формах лейкозов, сопровождающихся тромбоцитемией, полицитемией и др., значительно увеличивается гематокрит и количество тромбоцитов в единице объема крови, что на фоне даже незначительных изменений в стенке артериальных сосудов приводит к появлению тромбов, их отрыву и переносу с током крови в различные органы.
5. Кахексия. На поздних стадиях развития лейкемии нередко развивается кахексия, т. е. крайняя степень истощения. Вместе с тем как таковая она довольно редко становится непосредственной причиной смерти, поскольку чаще пациенты умирают раньше от причин, указанных в предыдущих пунктах.
Читайте также:

