Ошибки в биопсии рака простаты
С. Х. Аль-Шукри, С. Ю. Боровец, М. А. Рыбалов
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
В данном обзоре оцениваются преимущества и недостатки основных методов диагностики и стадирования рака предстательной железы, приводятся сведения о современных высокотехнологичных методах стадирования и номограммах. Рассматриваются причины ошибок, возникающих при диагностике и стадировании рака предстательной железы.
Ключевые слова: рак предстательной железы; диагностика; стадирование.
Введение
Повышение эффективности лечения рака предстательной железы (РПЖ) является одной из наиболее актуальных проблем современной урологии. В мире РПЖ занимает 3–4 место в структуре заболеваемости злокачественными новообразованиями. В России заболеваемость РПЖ в 2004 году составляла 6,9 %, а в 2009 году — уже 10,7 % [1]. При этом за последние три десятилетия возросло число мужчин, умерших от этого заболевания [2].
I. МЕТОДЫ ДИАГНОСТИКИ РПЖ
Методы диагностики рпж — включают оценку результатов пальцевого ректального исследования (ПРИ), определении уровня ПСА в плазме крови. Окончательный диагноз РПЖ может быть установлен только по результатам биопсии предстательной железы, которую целесообразно выполнять под ТРУЗ-контролем. При клиническом стадировании для уточнения границ местного распространения новообразования предстательной железы и для выявления местных и отдаленных метастазов в дополнение используют различные методы, позволяющие получить изображение: компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), сцинтиграфию костей скелета и др. Однако результаты этих методов могут быть интерпретированы ошибочно как в пользу гипо, так и гипердиагностики. Работы многих исследователей посвящены оптимизации скрининга и ранней диагностики РПЖ [3–5].
1.1. ПРИ. До внедрения в широкую клиническую практику ПСА, ПРИ было единственным методом диагностики РПЖ. Большинство злокачественных новообразований РПЖ располагаются в периферической зоне простаты и могут быть выявлены с помощью ПРИ, если их объем превышает 0,2 см 3. Положительная прогностическая ценность ПРИ варьирует от 4 % до 11 % у мужчин с уровнем ПСА от 0 до 2,9 нг/мл, и от 33 % до 83 % — от 3 до 9,9 нг/мл и выше [6]. В связи с тем, что оба этих метода имеют независимую друг от друга диагностическую ценность, рекомендовано применять их комбинацию.
1.2. ПСА и его производные. Несмотря на то, что уровень ПСА в плазме крови повышается при различных заболеваниях предстательной железы — РПЖ, доброкачественной гиперплазии предстательной железы (ДГПЖ) и простатите, ПСА остается практически единственным маркером, применяемым в целях ранней диагностики РПЖ. Однако единых общепринятых международных стандартов в отношении пороговых значений ПСА, которые могли бы использоваться для диагностики РПЖ, не существует [7]. Результаты недавнего исследования по профилактике РПЖ, проведенного в США, подтвердили, что у многих мужчин РПЖ может присутствовать, несмотря на низкий уровень ПСА крови [8] (см. табл. 1).
При использовании более высоких условных границ уровня ПСА (>4 нг/мл) для принятия решения о целесообразности проведении биопсии простаты повышается и риск пропустить клинически значимый РПЖ; в тоже время при снижении этого показателя ( 10 частота выявляемости РПЖ на превышает 8 % [12].
1.3. PCA3. Относительно новый и интенсивно исследуемый в настоящее время маркер — PCA3 (простатоспецифический некодирующий мРНК), который определяют в осадке мочи после массажа простаты. Этот маркер имеет более высокую чувствительность и специфичность по сравнению с ПСА, не зависит от объема простаты и наличия простатита у больного [13]. Сравнительно небольшое число опубликованных работ по анализу диагностической ценности этого маркера не позволяет рекомендовать его для широкого использования в клинической практике. В связи с этим в настоящее время этот маркер можно рассматривать как экспериментальный метод диагностики РПЖ.
1.4. ТРУЗИ. Классическая картина гипоэхогенного образования, расположенного в периферической зоне простаты, встречается не всегда, поэтому ТРУЗИне относят к методам, позволяющим достоверно определять наличие РПЖ. ТРУЗ-контроль получил широкое распространение при выполнении биопсии простаты.
1.5. Биопсия простаты. Биопсия предстательной железы является достоверным методом верификации диагноза РПЖ. Многими авторами были предложены различные методики выполнения этого исследования, отличающиеся по количеству и участкам расположения биопсийных вколов. При объёме ПЖ 30–40 см3 необходимо проводить биопсию не менее чем из 8 точек. С увеличением количества точек более 12, точность анализа существенно не изменяется [14]. На основании результатов Британского исследования по диагностике и лечению РПЖ была рекомендована биопсия из 10 точек [15].
II. МЕТОДЫ СТАДИРОВАНИЯ РПЖ
2.1. ПРИ. Принято выделять клиническое стадирование, основанное на данных ПРИ, определении уровня ПСА, рентгенологических, радиоизотопных и других клинических методах исследования, а также патологоанатомическое стадирование, которое становится возможным после морфологического анализа удаленной предстательной железы, семенных пузырьков и лимфатических узлов. Патологоанатомическое стадирование более точно позволяет оценить распространение болезни и судить о ее прогнозе. Наиболее важными патологоанатомическими прогностическим факторами после радикальной простатэктомии являются степень дифференцировки новообразования, позитивный хирургический край, экстракапсулярное распространение опухоли, ее инвазия в семенные пузырьки и метастазирование в тазовые лимфатические узлы. Сведения об ошибках патологоанатомического стадирования не включены в настоящий обзор литературы.
ПРИ позволяет определить не только наличие РПЖ, но и степень его местного распространения. Пальпируемая опухоль в простате — это признак, характерный для низкодифференцированного РПЖ (степень злокачественности по Gleason — 8–10 баллов). Чувствительность и воспроизводимость ПРИ весьма низкие, что приводит как к недооценке, так и к переоценке степени распространения РПЖ. Чувствительность метода при определении клинической стадии РПЖ не превышает 30 % [16]. Стадия рака простаты правильно диагностируется с помощью данного исследования менее чем в 50 % случаев [17].
2.2. ПСА. Более высокий уровень ПСА в плазме крови косвенно указывает на большую степень распространения РПЖ, но не позволяет достоверно предсказать ни клиническую, ни патоморфологическую его стадию [18, 19].
2.3. ТРУЗИ позволяет выявить только 60 % опухолей простаты, остальные не распознаются из-за эхогенности, сходной с таковой у окружающих здоровых тканях. При этом остаются недиагностированными более 60 % РПЖ на стадии рТ3 [20]. ТРУЗИ в комбинации с цветной допплерографией позволяет визуализировать проходящие через капсулу кровеносные сосуды, что типично при экстракапсулярном распространении новообразования [21, 22]. Однако эта методика имеет низкую воспроизводимость, в связи с чем ее относят к категории вспомогательных.
2.4. Биопсия простаты. По результатам биопсии простаты можно оценить степень местного распространения РПЖ, а также степень злокачественности новообразования в баллах по шкале Gleason. Процент пораженной ткани — наиболее надежный прогностический фактор риска инвазии опухоли в семенные пузырьки и экстракапсулярного распространения новообразования.
2.5. КТ и МРТ недостаточно надежно позволяют судить о степени распространения РПЖ, чтобы рекомендовать их как обязательные методы обследования. МРТ с эндоректальной катушкой позволяет более точно определить стадию РПЖ и прорастание опухоли в семенные пузырьки. Однако на фоне геморроидальных и воспалительных изменений ПЖ или после ее биопсии интерпретация данных может быть затруднена [9]. Сочетание контрастной МРТ и МРТ в Т2‑режиме усиления и применение МРТспектроскопии позволяет лучше верифицировать опухолевую ткань и диагностировать экстракапсулярное распространение опухоли [23].
Недостатки методов визуализации при РПЖ:
- Ложноотрицательные результаты из-за постбиопсийной крови.
- Артефакты от газа в прямой кишке, перистальтики.
- Ложноположительные очаги.
- Ложноотрицательные результаты ЭМРТ при РПЖ с инвазией в прямую кишку.
- Выявление РПЖ в центральной зоне.
- Невыявляемые очаги рака.
- Высокая зависимость от опыта рентгенолога. Пути решения:
- МРТ до биопсии или через 4 недели после нее.
- Подготовка пациента (микроклизма).
- Динамическое контрастирование.
- МРТ с поверхностной катушкой.
- МР-спектроскопия.
- Субспециализация.
2.6. Высокотехнологичные методы стадирования РПЖ. К новым перспективным методам, позволяющим получить изображение, можно отнести ПЭТ, при помощи которого диагностируют около 70 % РПЖ на стадии рТ2 и pT3a‑4 [9]. При этом очаг рака и микрометастазы 100 нг/мл практически у всех больных имеют место отдаленные метастазы РПЖ [29].
III. Причины ошибок при диагностике и стадировании РПЖ
Среди причин, приводящих к ошибкам при диагностике и стадировании РПЖ можно выделить субъективные и объективные.
- Недостаточная квалификация специалистов.
- Неправильная интерпретация данных обследования.
- Отсутствие высоко специфичных методов диагностики.
- Недостаточное использование современных методов диагностики.
- Неиспользование стандартных рекомендаций, предложенных Европейской ассоциацией урологов.
В заключении следует отметить, что в последние годы предпринимаются попытки совершенствования методов ранней диагностики и стадирования РПЖ.
Однако существует потребность в создании новых, более точных методов, позволяющих выявлять клинически значимый РПЖ. К перспективным методам, позволяющим оптимизировать процессы диагностики и стадирования, можно отнести ПЭТ/КТ, диффузионную МРТ, МР-спектроскопию, динамическую МРТ с повышением контраста. Необходима дальнейшая разработка специфичных для РПЖ радиофармпрепаратов. Кроме того, важна унификация при интерпретации полученных данных — использование рекомендаций Европейской ассоциации урологов.
Список литературы
- Чиссов В. И., Русаков И. Г. Заболеваемость раком предстательной железы в Российской Федерации // Экспериментальная и клиническая урология. — 2011. — № 2–3. — С. 6–7.
- Quinn M., Babb P. Patterns and trends in prostate cancer incidence, survival, prevalence and mortality. Part I: international comparisons // B. J. U. Int. — 2002. — Vol. 90, N 2. — P. 162–173.
- Ilic D., O’Connor D., Green S., Wilt T. J. Screening for prostate cancer: a Cochrane systematic review // Cancer Causes Control. — 2007. — Vol. 18, N 3. — P. 279–285.
- Andriole G. L., Crawford E. D., Grubb R. L. 3rd. et al. Mortality results from a randomized prostate-cancer screening trial // N. Engl. J. Med. — 2009. — Vol. 360, N 13. — P. 1310–1319.
- Schröder F. H., Hugosson J., Roobol M. J. et al. Screening and prostate-cancer mortality in a randomized European study // N. Engl. J. Med. — 2009. — Vol. 360, N 13. — P. 1320–1328.
- Schröder F. H., van der Maas P., Beemsterboer P. et al. Evaluation of the digital rectal examination as a screening test for prostate cancer. Rotterdam section of the European Randomized Study of Screening for Prostate Cancer // J. Natl. Cancer Inst. — 1998. — Vol. 90, N 23. — P. 1817–1823.
- Semjonow A., Brandt B., Oberpenning F. et al. Discordance of assay methods creates pitfalls for the interpretation of prostatespecific antigen values // Prostate. — 1996. — Suppl. 7. — P. 3–16.
- Thompson I. M., Pauler D. K., Goodman P. J. et al. Prevalence of prostate cancer among men with a prostate-specific antigen level


Результаты гистопатологического исследования позволяют врачу не только подтвердить или исключить рак простаты, но и установить распространенность рака, стадию злокачественного процесса, выбрать тактику лечения и оценить прогноз заболевания. Урологу важно знать точное расположение и распространенность патологического процесса. Эта информация может помочь в принятии решения об объеме оперативного вмешательства на предстательной железе или же определить место биопсии для повторной сайт-специфической биопсии.
Патологические аспекты: число, локализация и длина столбиков ткани простаты Многочисленные исследования, проводимые в США и Европе, подтверждают факт того, что секстантная биопсия простаты нередко дает ложно-отрицательные результаты. Согласно рекомендациям европейской ассоциации урологов в настоящее время проводится биопсия не менее чем из 8 точек, дополнительно проводят забор столбиков ткани из обнаруженных при ультразвуковом исследовании гипоэхогенных зон, расположенных на периферии предстательной железы. Таким образом, при биопсии простаты получают 10 столбиков ткани (секстантная биопсия + по 2 столбика ткани с периферической зоны каждой стороны предстательной железы).

Длина и диаметр столбиков ткани важны для обеспечения достаточного количества биопсийного материала для гистопатологического исследования. Длина и диаметр кусочков ткани напрямую зависят от типа используемых игл и умений оперирующего уролога, тем не менее, минимальная длина столбика ткани должна составлять 15 мм, а диаметр - 2 мм.
Полученный при биопсии материал попадает в лабораторию для гистопатологического исследования. Согласно рекомендациям европейской ассоциации урологов, полученные кусочки ткани с разных участков простаты направляются в лабораторию в отдельных пробирках.
Биопсийный материал подвергается специальной обработке (фиксация, нарезка, окраска), после чего рассматривается врачом-гистологом под микроскопом.

Диагноз
Риск рака простаты
ПИН низкой степени
Согласно рекомендациям европейской ассоциации урологов выделяют:
Риск рака простаты
ПИН высокой степени

Если установлен диагноз аденокарцинома, то должен быть указан гистопатологический тип опухоли (мелкоацинарный, паппилярный и др.), также для клинициста будет важно знать, сколько позитивных столбиков ткани было обнаружено при исследовании и их локализацию. Гистолог должен в миллиметрах указать протяженность и процент (%) опухоли в каждом столбике ткани, что позволит оценить распространенность злокачественного процесса, выбрать тактику лечения и определить прогноз. Согласно данным европейской ассоциации урологов протяженность и процент опухоли, обнаруженной в биопсийном материале, имеют одинаковую прогностическую ценность.
Для интерпретации результатов биопсии простаты рекомендовано использовать индекс Глисона. Шкала Глисона предназначена для стадирования аденокарциномы предстательной железы по результатам гистопатологического исследования. Преимуществом индекса Глисона является то, что он находит распространенное применение во всем мире и обладает высокой точностью и прогностической ценностью, позволяет оценить насколько агрессивно злокачественное новообразование. Клетки рака простаты могут быть высоко-, средне- и низко дифференцированными. Клеточная дифференцировка – термин, обозначающий, насколько раковые клетки отличаются по строению от нормальных клеток при микроскопическом исследовании. Высокодифференцированные раковые клетки – клетки морфологически практически не отличающиеся от нормальных клеток. Опухоли, состоящие из таких клеток, не склонны к быстрому росту и метастазированию. Низко дифференцированные клетки под микроскопом выглядят аномально, а опухоли из таких клеток склонны к быстрому росту и раннему метастазированию.

Патолог при гистопатологическом исследовании оценивает столбики ткани по 5-ти бальной системе от 1 до 5. Низший балл 1 – обозначает наименее агрессивную опухоль, а 5 – наиболее агрессивную. Индекс Глисона получают при сложении баллов двух наиболее распространенных по объему измененных тканей простаты.
Таким образом, результат оценки биопсийного материала по шкале Глисона может выглядеть так:
3+4=7 или 4+5=9 или 5+4=9
Необходимо понимать, что последовательность цифр имеет большое значение и может влиять на выбор и исход лечения. Первая цифра – обозначает превалирующий балл, т.е. изменения ткани предстательной железы, соответствующие данному баллу, занимают более 51% объема морфологического материала. Второй балл характеризует изменения тканей предстательной железы, занимающие от 5% до 50% биопсийного материала. Европейской ассоциацией урологов рекомендовано, не включать в индекс Глисона балл, характеризующий участок опухоли менее 5%. Теперь понятно, что сумма 4+5=9 и 5+4=9 имеют разное значение, и пациенты с индексом Глисона 4+3=7 имеют более агрессивное новообразование.
Таким образом, индекс Глисона варьирует от 2 до 10:
- Индекс Глисона от 2 до 6 означает медленнорастущую высокодифференцированную опухоль, не склонную к быстрому росту и раннему метастазированию.
- Индекс Глисона более 7 характеризует средне дифференцированную аденокарциному.
- 8-10 по шкале Глисона обозначает низко дифференцированную опухоль, характеризующуюся быстрым ростом и ранним метастазированием.
Индекс Глисона менее 4 в заключении по биопсии простаты не указывается.
Реже может использоваться следующая шкала стадирования опухолевого процесса:
GX: стадия не может быть установлена
G1: высокодифференцированные нормальные клетки опухоли (Индекс Глисона от 2 до 4)
G2: средне дифференцированные нормальные клетки опухоли (Индекс Глисона от 5 до 7)
G3: низко дифференцированные опухолевые клетки ( 8-10 по шкале Глисона).
Иммуногистохимия не является рутинным методом исследования и применяется в случае необходимости дифференциальной диагностики. Таким образом, иммуногистохимическое исследование применяется:
- При дифференциальной диагностике аденокарциномы и доброкачественного новообразования имитирующего рак.
- При дифференциальной диагностике низкодифференцированной аденокарциномы и переходно-клеточного рака или рака толстой кишки и др.
Результаты биопсии простаты излагаются врачом-гистологом в специальном заключении гистологического исследования. Европейской ассоциацией урологов разработана специальная сводная таблица, которая должна заполняться врачом при составлении заключения гистопатологического исследования биопсийного материала. Если выявлено злокачественное новообразование, в таблице указывается следующая информация:
- Гистопатологический тип аденокарциномы
- Индекс Глисона
- Локализация и распространенность опухоли
- Состояние хирургического края (край может быть положительным или отрицательным) влияет на вероятность биохимического рецидива опухоли
- Наличие экстрапростратического распространения, его степень и локализация.
- Кроме того указывается наличие лимфоваскулярной или периневральной инвазии.
Для патоморфологического стадирования опухолевого процесса используется система TNM (T-tumor – первичный опухолевый процесс; N – nodes – вовлеченность лимфатических узлов, M – metastasis – наличие метастазов). Упрощенную систему TNM для стадирования рака простаты можно представить следующим образом:

Т1 – опухоль не обнаруживается при ректальном пальцевом исследовании или визуализирующих методах исследований (ультрасонография, компьютерная томография), но при гистологическом исследовании биопсийного материала обнаруживаются раковые клетки;
Т2 – опухоль обнаруживается при пальцевом исследовании и может занимать от одной доли простаты до вовлечения в патологический процесс обеих долей простаты;
Т3 – опухоль прорастает капсулу простаты и/или семенные пузырьки
Т4 – опухоль распространяется на рядом расположенные ткани (но не семенные пузырьки)
N0 – регионарные лимфатические узлы не поражены
N1 – опухолевый процесс захватывает один регионарный лимфоузел, узел в диаметре не более 2 см
N2 – опухоль распространяется на один или более лимфатических узлов, узлы достигают размеров от 2 до 5 см.
N3 – опухолевый процесс поражает регионарные лимфатические узлы, которые достигают размеров более 5 см.
М0 – опухолевый процесс не распространяется за пределы регионарных лимфатических узлов
М1 – наличие метастазов в не регионарных лимфатических узлах, костях, легких, печени или головном мозге.
Таким образом, полученные при гистопатологическом исследовании результаты биопсии простаты позволяют:
- Подтвердить или исключить диагноз рака предстательной железы
- Решить вопрос о назначении повторной биопсии простаты
- В случае диагноза аденокарциномы определить локализацию, распространенность и стадию опухолевого процесса и выбрать тактику лечения
- Составить прогноз заболевания и др.
Результаты анализа биопсии предстательной железы выдаются пациенту в течение недели после процедуры при подозрении на рак простаты. Это документ, в котором указана таблица с разными числами и индексами. Каждая цифра или буква указывает на изменения клеточной структуры органа или на здоровую железу в целом. Определяются степень развития новообразования, локализация и распространенность процесса. Только уролог может грамотно расшифровать результат и оценить степень злокачественности процесса, чтобы подобрать адекватную терапию.
- Подготовка к проведению: что может повлиять на результат
- Сколько ждать результат и в каком виде он предоставляется
- Расшифровка по шкале Глисона
- Иммуногистохимическое исследование
- Расшифрока онкологии по системе TNM
Подготовка к проведению: что может повлиять на результат
Результаты зависят от полноценности подготовки мужчины. Для постановки диагноза пациенту перед манипуляцией необходимо:
- Отказаться от приема антикоагулянтов за неделю до взятия анализа ткани (для лучшей свертываемости крови).
- За 7 дней до процедуры составить список лекарственных форм, которые он принимает (цитостатики, глюкокортикоиды искажают результаты).
- За одну неделю отменить лечение народными методами.
- Поставить в известность врача об имеющихся аллергиях на медикаменты.

Если процедура диагностики рака простаты выполняется под контролем МРТ, пациенту необходимо избавиться от металлических предметов. За пять дней до начала процедуры требуется принимать антибактериальные препараты по назначению специалиста. Это поможет избежать инфицирования органа после биопсии.
Сколько ждать результат и в каком виде он предоставляется
Средний срок ожидания результатов составляет 5–7 дней после взятия материала. Это зависит от скорости работы лаборатории, наличия дополнительного иммуногистохимического метода. Если дополнительный метод включается, то время ожидания увеличивается на два-три дня. Результаты биопсии предстательной железы выдаются на руки пациенту в качестве гистологического исследования. Эту бумагу можно получить в лаборатории или у лечащего уролога. На ней специалистом-гистологом будет заполнена специальная табличка, в которой указываются полученные данные:
- индекс Глисона;
- гистопатологический тип аденокарциномы (если выявлена);
- локализация новообразования.
Задайте вопрос врачу-урологу!

Дополнительно указывается информация о наличии экстрапростатического распространения (возможны метастазы за пределами органа). Записывается степень лимфоваскулярной или периневральной инвазии. Для определения стадии новообразования применяется система TNM.
Расшифровка по шкале Глисона
Расшифровка биопсии простаты проводится по разработанной шкале Глисона. Она составлена из пяти степеней. Каждая характеризует злокачественность клетки и уровень ее дифференцирования. Из пяти образцов врач-гистолог выбирает два самых злокачественных и присваивает им значение от одного до пяти баллов. При этом цифра 1 указывает на минимальные изменения, а 5 – на максимальную злокачественность. Показатели суммируются и образуют результат – цифру от 2 до 10.
Поэтому показателем нормы по шкале считается цифра 2 или две единицы. То есть в двух представленных образцах находились здоровые клетки органа. Показатель от двух до шести указывает на низкую степень злокачественности или агрессивности опухоли. Цифра семь по шкале указывает на среднюю степень развития и дифференцирование аденокарциномы. Показатель от 8 до 10 свидетельствует о быстром прогрессировании опухоли, ее высокой злокачественности и раннем метастазировании.
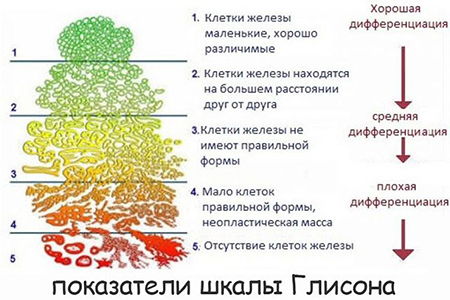
В шкале имеют значение не только сумма показателей, но и их последовательность. От этого зависит методика лечения пациента. То есть первая цифра из образцов характеризует процесс, происходящий в 51% объема полученной ткани. Второй балл определяет изменения в 49 % оставшихся клеток. Поэтому, результаты 5+3=8 и 3+5 =8 – разные. Вариант 5+3 – более агрессивный.
Иммуногистохимическое исследование
Результаты биопсии простаты могут содержать дополнительные подтверждения наличия аденокарциномы. Иммуногистохимическое исследование выполняется для дифференциации доброкачественной гиперплазии предстательной железы и злокачественного образования. Этим методом можно отличить метастазы рака другого органа в простате от злокачественной опухоли самой предстательной железы. В случае фиксирования специалистом повышения таких веществ увеличивается риск злокачественного новообразования в простате:
- цитокератины и р63 в базальном эпителии;
- уровень ПСА в крови;
- простатическая кислая фосфатаза;
- простатспецифический мембранный антиген;
- гены и белки Ki-67, bcl-2 и р53, p21 и p27.
В норме количество вышеперечисленных веществ не повышается. В доброкачественных опухолях можно установить потенциал злокачественности благодаря этому виду исследования. Можно понять, насколько опасна имеющаяся опухоль, и заранее её устранить.
Расшифрока онкологии по системе TNM
Расшифровка результатов биопсии сопровождается по патогистологическим показателям и системе TNM. Вариант отсутствия патологии — Т0N0M0. Нужно знать, что означает каждая буква и цифра возле нее. Это международная классификация новообразований, где:
- Т – непосредственно опухоль.
Т1 – раковые клетки только на биопсии, без подтверждения другими методиками (трансректальное ультразвуковое исследование, сонография). Т2 – новообразование обнаруживается при пальцевом ректальном исследовании органа через анальное отверстие. Т3 – опухоль затрагивает капсулу органа и семенные пузырьки. Т4 – образование переходит близлежащие ткани.

- N – изменения близлежащих (регионарных) лимфоузлов.
N0 – без затягивания в процесс лимфоузлов. N1 – включение в процесс одного узла с диаметром не больше 2 см. N2 – подключается в процесс один или больше узлов с диаметром от 2 до 5 см. N3 – выявляются два и больше узлов с диаметром от 5 см.
- М – отдаленные метастазы.
М0 – отсутствие метастазирования в органы. М1 – метастазы в дальних лимфоузлах, костных структурах. Иногда поражаются легкие, мочевой пузырь, головной мозг или печень.
Полные результаты биопсии органа позволяют определить наличие или отсутствие злокачественной опухоли простаты. Если такая имеется, можно узнать ее степень развития, определить возможность метастазирования. По итогам составляется прогноз, подбирается терапия и контролируется ее эффективность.
Если у вас остались вопросы, задайте их в комментариях (это абсолютно анонимно и бесплатно). По возможности, я или другие посетители сайта помогут вам.
Согласно международной статистике около миллиона человек каждый год направляются на биопсию предстательной железы. Известно, что эта манипуляция сопряжена с рисками, может быть неприятна для пациента и причинять ему определенные неудобства. К тому же точность результатов не всегда на высоте.
В статье постараемся рассмотреть все недостатки и опасности биопсии предстательной железы. Также расскажем, какие есть современные методы диагностики рака простаты и какие вопросы можно задать врачу, в связи с направлением.
Зачем, вообще, нужна биопсия простаты?
По современным диагностическим стандартам мужчину, у которого подозревают рак простаты, направляют на сдачу крови для выявления уровня простатического специфического антигена ПСА. В норме количество этого вещества не должно превышать 2,5-4,5 нг/мл, при больших показателях нужно провести дополнительный тест, чтобы подтвердить или опровергнуть подозрения врача. Чаще всего для этих целей и используют трансректальную, трансуретральную или промежностную биопсию предстательной железы.
С помощью этой методики можно:
- обнаружить раковые клетки в начальной стадии развития;
- выявить агрессивные формы рака;
- начать терапию как можно раньше;
- определить стадию заболевания.
Установлено, что если начать терапию рака простаты на ранней стадии развития, шанс полностью победить онкологию составляет 99 %. С этим и связана высокая популярность биопсии. Однако в бочке меда часто находят ложку дегтя.

Недостатки у биопсии простаты
Недостатки биопсии простаты
Методика не лишена некоторых минусов, которые могут привести к серьезным последствиям. Если подойти к вопросу непредвзято – можно определить три основных недостатка:
- Плохая переносимость некоторыми группами пациентов. Биопсия может быть болезненной и потому часть мужчин серьезно переживают при подготовке и во время проведения манипуляции, что негативно сказывается на состоянии нервной системы.
- Относительно низкая точность – 80 %. Это означает, что у двух из десяти мужчин рак не будет выявлен сразу. Биопсию придется повторять несколько раз.
- Риск заражения инфекцией. Около 7 % мужчин в течение месяца после проведения биопсии попадают в больницу с различными инфекционными осложнениями. При повторной биопсии риск повышается.
Не исключены и кровотечения из-за повреждения кровеносных сосудов. Они также могут быть серьезными и угрожать жизни мужчины.
Опасности биопсии простаты
Когда речь заходит об опасностях – большинство представителей клиник предпочитает молчать или отвечают туманными фразами. Между тем риск развития осложнений достаточно высок. Чаще всего после биопсии начинаются:
- кровотечения;
- воспалительные процессы;
- аллергические реакции.
При неправильном введении иглы возможны серьезные повреждения тканей.
В большинстве случаев осложнений можно избежать, но есть исключения из правил. Не всегда врачи могут контролировать ситуацию, многое зависит от самого пациента, а также от его организма.
Как защитить себя от опасностей?
Пациент должен знать, что ни один врач не вправе заставлять проходить то или иное обследование. То есть от биопсии простаты, если она назначена, можно отказаться. Больной мужчина вправе задать врачу ряд вопросов.
- На сколько повышен PSA, какого значения он достигает? Биопсия целесообразна лишь при значении ПСА от 10 нг/мл.
- Относится ли он к группе риска развития рака простаты?
- Что показало УЗИ и о чем врач получил представление при исследовании органа пальцем?
- Будет ли проводиться вторая пункция?
- Можно ли найти альтернативу биопсии?
Врач обязан ответить на вопросы. Если есть сомнения, можно на биопсию не ходить, а настоять на другой методике. При этом необходимо учитывать, что отказ от биопсии может оттянуть начало лечения, что при раке простаты способно снизить шанс на выздоровление.

Обсудите с врачом проблему простаты
Что может заменить биопсию?
Прогресс не стоит на месте. В онкологии постоянно разрабатываются новые методики диагностики, внедряются современные способы обследования больного. В случае с раком предстательной железы биопсию могут заменить следующие варианты:
- Контроль роста PSA. Если значение неизменно на протяжении определенного времени – скорее всего онкологическое заболевание отсутствует.
- МРТ. Точность магнитно-резонансной томографии составляет 98 %, что намного выше аналогичного значения биопсии. Применение нескольких методов МРТ увеличивает точность постановки диагноза.
- 4Kscore анализ. Инновационная методика лабораторной диагностики, позволяющая выявлять ферменты, выделяемые раковыми опухолями. На Западе применяется в комплексной диагностике онкологических заболеваний.
Не исключено, что представитель клиники начнет убеждать в том, что без биопсии не обойтись. В этом случае лучше посоветоваться с компетентными независимыми врачами и только потом принимать решение.
Заключение
Биопсия простаты, как и другие инвазивные методы диагностики, не лишена серьезных недостатков. Часть из них сопряжена с риском развития осложнений, являющихся опасными для жизни обследуемого мужчины. Если вы сомневаетесь в целесообразности такого обследования – лучше найти компетентного онколога и проконсультироваться с ним. В случае, если ваши опасения оправданы – сделайте выбор в пользу других методов выявления рака предстательной железы, а биопсию оставьте в качестве запасного варианта.
Читайте также:

