Опухоли с местнодеструирующим ростом метастазируют

Метастазирование — сложный процесс, включающий в себя распространение опухоли из первичного очага в отдаленные участки организма.
Этапы метастазирования включают в себя:
- Отсоединение группы клеток от опухолевого узла.
- Проникновение раковых клеток путем прободения базальных мембран близлежащих тканей в кровеносное русло (гематогенный путь распространения), брюшину или лимфатические сосуды (лимфогенный путь распространения).
- Распространение с током крови (или лимфы) в отдаленные органы — печень, легкие, кости.
- Ангиогенез — образование сосудов для питания новых опухолевых узлов.
Такие условия наиболее благоприятны для роста опухоли, которому также способствуют различные механизмы, направленные на ускользание раковых клеток от действия иммунитета.
Пути метастазирования
- Лимфогенный — распространение с лимфой по лимфатическим сосудам. Этот путь является предпочтительным для большинства карцином.
- Гематогенный — по кровеносным сосудам, наиболее часто таким путем происходит распространение сарком и карциномы почки, что связано с особенностью анатомического строения.
- Имплантационный путь — распространение по серозной оболочке, что позволяет клеткам активно размножаться в брюшине, плевральной (покрывающей легкое) полости, полости перикарда (сердечной сумки) или субарахноидальном пространстве (мозговые оболочки).
- Переносной путь — механическое распространение фрагментов опухоли в процессе диагностических процедур и хирургических вмешательств.
Чем опасны метастазы?
Метастатический процесс играет огромную роль в течении болезни, так как множественное распространение опухолевых клеток по всем организму ведет к мультиорганной недостаточности и летальному исходу. Пациенты с локализованной болезнью имеют более благоприятные прогнозы выживаемости.
По последним данным у 60–70% пациентов метастатический процесс уже инициирован на этапе диагностики. Даже если на момент выявления болезни нет данных по отдаленным проявлениям, необходимо немедленно начать лечение во избежание прогрессирования.
Какие органы являются основными мишенями для метастазирования?
Метастазы являются одним из основным признаков отличия злокачественного образования от доброкачественного. Все раковые опухоли обладают тенденцией к метастазированию. Однако способность к распространению у разных заболеваний отличается.
Согласно теории, предложенной Стефаном Паджетом в 1889 году, отдельным клеткам трудно выживать вдали от первичного узла. Для жизнедеятельности им необходимо найти участок организма со схожими морфологическими и физиологическими характеристиками. Например, клеткам опухоли молочной железы требуется кальций, содержащийся в грудном молоке, для размножения. Поэтому предпочтительнее рак молочной железы метастазирует в кости. Клетки меланомы кожи хорошо себя чувствуют в меланоцитах и нервных клетках, путешествуя с этой целью в головной мозг, так как меланоциты и нервные клетки развиваются из одного органа эмбриональной закладки.
Локальное распространение болезни в лимфатические узлы не считается проявлением метастатической болезни, но значительно ухудшает прогноз заболевания.
В зависимости от клинико-морфологических особенностей поведения опухоли разделяют на:
- доброкачественные;
- злокачественные;
- опухоли с местнодеструирующим ростом.
Злокачественные , или незрелые, опухоли состоят из мало- или недифференцированных клеток; они утрачивают сходство с тканью (органом), из которой исходят (гетерологичные опухоли). Характерны инфильтрирующий и быстрый рост опухоли. Выделяют дифференцированные (высоко-, умеренно- и низкодифференцированные) - менее злокачественные и недифференцированные - более злокачественные опухоли. Уста¬новление степени дифференцировки, а значит, и степени злокачественности опухоли имеет большое прогностическое значение.
Злокачественные опухоли дают метастазы, рецидивируют, оказывают не только местное, но и общее влияние на организм.
Метастазы могут быть гематогенными, лимфогенными, имплантационными и смешанными. Для одних злокачественных опухолей (например, сарком) характерны гематогенные метастазы, для других (например, рака) -лимфогенные. Об имплантационных (контактных) метастазах говорят при распространении клеток по серозным оболочкам, прилежащим к узлу опухоли.
Чаще в метастазах опухоль имеет то же строение, что и в основном узле. Клетки метастаза могут продуцировать те же секреты и инкреты, что и клетки основного узла опухоли. Однако опухолевые клетки в метастазах могут становиться более зрелыми или, напротив, приобретать большую степень катаплазии по сравнению с первичным узлом опухоли. В таких случаях по гистологической структуре метастаза установить природу и локализацию первичного узла опухоли очень трудно. В метастазах нередко возникают вторичные изменения (некроз, кровоизлияние и др.). Метастатические узлы, как правило, растут быстрее, чем основной узел опухоли, и поэтому нередко крупнее его.
Время, необходимое для развития метастаза, может быть различным. В одних случаях метастазы появляются очень быстро, вслед за возникновением первичного узла, в других - они развиваются через несколько лет после его возникновения. Возможны так называемые поздние латентные, или дремлющие, метастазы, которые возникают через много (7-10) лет после радикального удаления первичного узла опухоли. Такого рода метастазы особенно характерны для рака молочной железы.
Рецидив опухоли - появление ее на прежнем месте после хирургического удаления или лучевого лечения. Опухоль развивается из отдельных опухолевых клеток, оставшихся в области опухолевого поля. Рецидивы опухоли могут возникать и из ближайших лимфогенных метастазов, которые не были удалены во время операции.
Влияние опухоли на организм может быть местным и общим. Местное влияние опухоли зависит от ее характера: доброкачественная опухоль лишь сдавливает окружающие ткани и соседние органы, злокачественная- разрушает их, приводит к тяжелым последствиям. Общее влияние на организм особенно характерно для злокачественных опухолей. Оно выражается в нарушениях обмена веществ, развитии кахексии (раковая кахексия).
Опухоли с местнодеструирующим ростом занимают как бы промежуточное положение между доброкачественными и злокачественными: они имеют признаки инфильтрирующего роста, но не метастазируют
РОСТ ОПУХОЛИ
В зависимости от степени дифференцировки различают три вида роста опухоли: экспансивный, аппозиционный, инфильтрирующий (инвазивный).
2) Аппозиционный рост опухоли происходит за счет неопластической трансформации нормальных клеток в опухолевые, что наблюдается в опухолевом поле.
3) Инфильтрирующий, или инвазивный, рост характеризуется тем, что клетки опухоли врастают за ее пределами в окружающие ткани и разрушают их. Инвазия обычно происходит в направлении наименьшего сопротивления по мсжткансвым щелям, по ходу нервных волокон, кровеносных и лимфатических сосудов. Комплексы клеток опухоли разрушают их, проникают в ток крови и лимфы, врастают в рыхлую соединительную ткань. Если по пути инвазии клеток опухоли встречаются капсула органа, мембраны и другие плотные ткани, то клетки опухоли вначале распространяются по их поверхности, а затем, прорастая капсулу и мембраны, проникают в глубь органа. Понятно, что границы опухоли при инфильтрирующем ее росте, нечеткие, стертые.
Инфильтрирующий рост опухоли быстрый, он характерен для незрелых, злокачественных опухолей.
В зависимости от числа очагов возникновения опухоли говорят об уницентрическом (один очаг) и мультицентрическом (множественные очаги) росте.
По отношению к просвету полого органа рост опухоли может быть эндофитным или экзофитным.
Эндофитный рост - инфильтрирующий рост опухоли в глубь стенки органа. При этом опухоль с поверхности слизистой оболочки (например, желудка, мочевого пузыря, бронха, кишки) может быть почти незаметна, в то время как на разрезе стенки видно, что она проросла опухолью.
Экзофитный рост - экспансивный рост опухоли в полость органа (например, желудка, мочевого пузыря, бронха, кишки). Опухоль при этом может целиком заполнить полость, будучи соединенной со стенкой ее небольшой ножкой.
В клиническом отношении опухоли неравнозначны.
1) - Доброкачественные, или зрелые опухоли состоят из клеток, в такой мере дифференцированных, что почти всегда представляется возможным определить, из какой ткани они растут (гомологичные опухоли). Нарушена лишь органотипическая и гисто-типическая дифференцировка. Характерен тканевый атипизм опухоли, рост ее экспансивный и медленный. Опухоль не оказывает гибельного влияния на организм, как правило, не дает метастазов.
В связи с особенностью локализации доброкачественные опухоли иногда могут оказаться опасными. Так, доброкачественная опухоль твердой мозговой оболочки, сдавливая головной или спинной мозг, может вызвать серьезные нарушения деятельности ЦНС.
Доброкачественная опухоль может малигнизироваться т.е. превратиться в злокачественную.
2) - 3локачественные, или незрелые, опухоли состоят из мало- или недифференцированных клеток; они утрачивают сходство с тканью, из которой исходят (гетерологичные опухоли). Нарушена не только органотипическая и гистотипическая, но и цитотипичсекая дифференцирова. Характерен клеточный атипизм, сочетающийся с тканевым, рост опухоли инфильтрирующй и быстрый.
Злокачественные опухоли, бедные стромой, растут быстро, богатые стромой - более медленно, но все же быстрее, чем доброкачественные. Иногда злокачественные опухоли растут неравномерно: рост их ускоряется после травмы, при беременности, но замедляется при развитии воспаления в области опухоли.
Выделяют дифференцированные (высоко-, умеренно- и низкодифферецированные) — менее злокачественные и недифференцирванные — более злокачественные опухоли. Установление степени дифференцировки, а значит и степени злокачественности опухоли имеет большое практическое значение.
Злокачественные опухоли дают метастазы - рецидивируют, оказывают не только местное, но и общее влияние на организм.
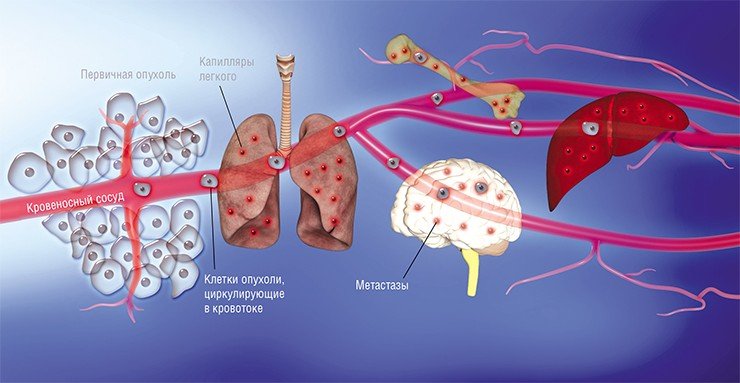
Метастазирование проявляется в том, что опухолевые клетки попадают в кровеносные и лимфатические сосуды, образуют опухолевые эмболы, уносятся током крови и лимфы от основного узла, задерживаются в капиллярах органов или в лимфатических уздах и там размножаются. Так возникают метастазы, или вторичные (дочерние) опухолевые узлы, в лимфатических узлах, печени, легких, головном мозге и других органах.
Различают гематогенные, лимфогенные, имплантационные и смешанные метастазы.
Одни злокачественные опухоли (например, саркома) метастазируют главным образом по току крови — гематогенные метастазы, другие (например, рак) — по току лимфы в лимфатические узлы — лимфогенные метастазы, а затем уже раковые клетки попадают в ток крови. Об имплантационных (контактных) метастазах говорят при распространении клеток по серозным оболочкам, прилежащим к узлу опухоли.
Чаще в метастазах опухоль имеет то же строение, что и в основном узле. Клетки метастаза могут продуцировать те же секреты и инкреты, что и клетки основного узла. Однако опухолевые клетки в метастазах могут дифференцироваться и становиться более зрелыми, или, напротив – приобретать большую степень катаплазии по сравнению с первичным узлом опухоли. В таких случаях по гистологической структуре метастаза установить природу и локализацию первичного узла опухоли очень трудно.
В метастазах нередко возникают вторичные изменения (некроз кровоизлияние и др.). Метастатические узлы, как правило, растут быстрее, чем основной узел опухоли, поэтому нередко крупнее его. Так, например, диаметр раковой опухоли желудка может достигать 1—2 см. а диаметр ее гематогенных метастазов в печени — 10—20 см. Естественно, что клинической картине болезни на первое место выступают изменения печени.
Время, необходимое для развития метастаза может быть различным. В одних случаях метастазы появляются очень быстро, вслед за возникновением первичною узла, в других — они развиваются через 1—2 года. Возможны так называемые поздние латентные, или дремлющие, метастазы, которые возникают через много (7—10) лет после радикально удаления первичною узла опухоли. Такого рода метастазы особенно характерны для рака молочной железы.
Рецидивирование опухоли - появление ее на том месте, откуда она была удалена хирургическим путем или с помощью лучевой терапии. Опухоль развивается из отдельных опухолевых клеток, оставшихся в зоне опухолевого поля. Рецидивы опухоли иногда возникают из ближайших лимфогенных метастазов, которые не были удалены во время операции.
Влияние опухоли на организм может быть местным и общим.
Местное влияние опухоли зависит от ее характера: доброкачественная опухоль лишь сдавливает окружающие ткани и соседние органы, злокачественная — разрушает их, приводя к тяжелым последствиям.
Общее влияние на организм особенно характерно для злокачественных опухолей. Оно выражается в нарушениях обмена веществ, развитии кахексии. Так, при злокачественных опухолях происходит изменение активности ферментов в крови, уменьшение содержания белков и липидов, увеличение СОЭ, уменьшение, числа эритроцитов в крови и другие.
3) - Опухоли с местнодеструирующим ростом занимают как бы промежуточное положение между доброкачественными и злокачественными: они имеют признаки инфильтрирующего роста, но не метастазируют.
Морфогенез опухолей, или механизм их развития в морфологическом освещении, можно разделить на стадию предопухолевых изменений и стадию формирования и роста опухоли.
Предопухолевые изменения являются обязательной стадией развития опухоли. Выявление таких изменений имеет не только теоретическое, но и большое практическое значение. Оно позволяет выделять группы повышенного риска в отношении возможности развития опухоли того или иного органа, предупреждать возникновение опухоли и диагностировать ее как можно раньше.
Среди предопухолевых морфологи выделяют так называемые фоновые изменения, проявляющиеся дистрофией и атрофией, гиперплазией и метаплазией. Эти изменения, ведущие к структурной перестройке органов и тканей, становятся основой для возникновения очагов гиперплазии и дисплазии, которые и рассматриваются как собственно предопухолевые.
Наибольшее значение среди предопухолевых изменений в последнее время придают клеточной дисплазии, под которой понимают нарастание атипизма клеток в связи с нарушением координации между их пролиферацией и дифференцировкой. Выделяют несколько степеней дисплазии клеток, причем крайнюю степень ее трудно отграничить от опухоли.
Исходя из того, что одни предраковые состояния обязательно переходят в рак, а другие –
не переходят, их делят на облигатный и факультативный предрак.
Облигатный предрак, т.е. предрак, обязательно завершающийся развитием рака, чаше связан с наследственным предрасположением. Это врожденный полипоз толстой кишки, пигментная ксеродерма, нейрофиброматоз (болезнь Реклингхаузсна), нейробластома сетчатки и др. К факультативному прсдраку относят гиперпластически-диспластические процессы, а также некоторые дисэмбриоплазии.
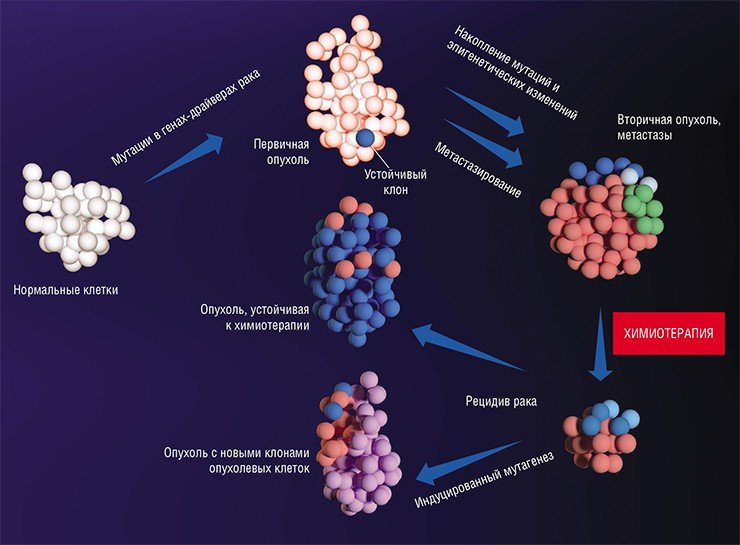
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких лет
До сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
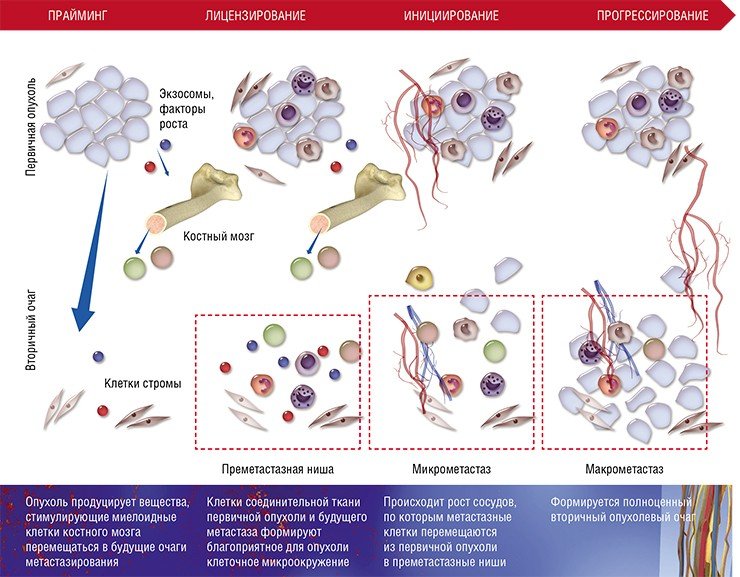
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7
Общеизвестно, что дистантное распространение по лимфатическим и кровеносным сосудам (метастазирование) — это высшее выражение автономности опухоли, главный отличительный признак злокачественного процесса и наиболее частая причина смерти больных.
Способность к метастазированию позволяет опухолевым клеткам покидать первичную опухоль и колонизировать новые территории, где, по крайней мере, вначале нутриенты и пространство для роста не ограничены.
Важным и необходимым условием метастазирования является способность опухоли формировать собственную сосудистую сеть. Образование сосудов в опухоли, а следовательно, и процесс метастазирования может начаться, когда количество неоппастических клеток составит более 10 3 (1-2 мм).
Однако на практике опухоли разного гистогенеза имеют различную критическую массу, необходимую для метастазирования. В целом, считается, что более крупные и менее дифференцированные опухоли обладают большим инвазивно-метастатическим потенциалом, хотя это и не абсолютная закономерность.
Довольно часто при очень больших размерах, глубокой инвазии опухоли и даже при наличии карцинемии как отдаленные, так и регионарные метастазы могут и не выявляться.
Данный факт объясняется отсутствием гено- и фенотипических свойств инвазивности опухолевых клеток и соответствующей протйвомтастатической сопротивляемостью организма. Не вся опухоль а лишь субклон(ы) клеток внутри нее в ходе опухолевой профессии приобретают способностью к метастазированию и для этого должно пройти достаточное время.
Метастазирование (греч. metastasis — перемена места, перемещение, перенос) — это перенос по сосудам (лимфатическим, кровеносным) неоппастических клеток за пределы первичной опухоли в различные органы и ткани с образованием вторичных опухолевых узлов той же гистологической структуры. Понятно, что интравазальное распространение или обсеменение клетками естественных полостей имеет большое прогностическое значение.
Метастазирование — это сложный биологический процесс, результат взаимодействия опухоли и организма и абсолютный признак злокачественности, его мопекулярно-генетические механизмы изложены ранее. В данном разделе представлены клинические аспекты данной проблемы.
Феномен метастазирования опухолей впервые описал Жан Клод Рекамье (1829) на примере метастаза рака молочной железы в головной мозг; он же впервые ввел терминологию, которой мы пользуемся до настоящего времени.
Приблизительно 30% впервые выявленных злокачественных опухолей уже имеют метастазы. Такое развитие событий выражается в многократном увеличении негативного клинического эффекта, оказываемого первичным узлом, сильно ограничивает возможности лечения и нередко, в гораздо большей мере, способствует наступлению смерти, чем существование первичной опухоли.
По сути, метастаз — это спонтанный аутотрансплантат опухоли в виде опухолевых эмболов, которые не всегда могут быть источником метастазов и часто погибают от недостатка питания или под действием иммунной системы.
Вновь сформированные метастазы появляются как симбиоз опухолевых и поддерживающих клеток из нормальных тканей. Пути распространения злокачественных клеток из первичного очага могут быть различными. Чаще всего они распространяются по лимфатической системе.
Лимфогенное метастазирование
После осуществления метастатического каскада злокачественные клетки могут проникать в лимфатический сосуд и с током лимфы попадают в первые (регионарные и/или нерегионарные) на их пути лимфатические узлы (органные и/или внеорганные). В норме узлы выполняют две антиметастатические функции. Первая (кратковременная) — механическая, барьерная — заключается в чисто механическом ограничении диссеминации опухолевых клеток.
Вторая — иммунологическая — обусловлена усиленной продукцией иммунокомпетентных клеток, способных лизироватъ поступающие в узел опухолевые клетки, что, однако, далеко не всегда служит препятствием к их росту.
В случае преодоления этих барьеров и прогрессирующего размножения злокачественных клеток, в лимфатических узлах формируются типичные лимфогенные метастазы. Такой механизм их формирования называется классическим, ортоградным. Однако в лимфатических сосудах опухолевые клетки могут перемещаться в разных направлениях.
В частности, при поражении всех лимфатических путей органа происходит блокада лимфооттока на уровне лимфатических сосудов и регионарных узлов При этом в зависимости от градиента давления лимфы и в связи с отсутствием клапанов внутри капилляров возможно распространение опухолевых клеток по лимфатическим сосудам в обратном направлении (ретроградные метастазы), что свидетельствует о плохом прогнозе.
Наконец, опухолевая блокада типичных путей лимфооттока может сопровождаться возникновением парадоксальных направлений лимфогенного метастазирования и поражением лимфатических узлов, не регионарных для органа, где находится первичная опухоль.
Например, появление метастазов рака грудного отдела пищевода в кардиальные лимфоузлы объясняется не ретроградной циркуляцией, а эмболией раковых клеток книзу по лимфатическим капиллярам стенки пищевода.
Лимфогенное метастазирование типично дпя рака и меланомы. Саркомы хотя и могут давать лимфогенные метастазы, но используют этот путь реже и позже и в тоже время — это прогностически крайне неблагоприятно. Возможность образования, а тем более наличие в регионарных лимфоузлах метастазов, обосновывает необходимость их удаления при радикальных операциях для достижения абластичности оперирования.
Гематогенное метастазирование называют еще отдаленным и связано оно с проникновением опухолевых клеток в кровеносные сосуды, где они формируют микротромбоэмболы.
Вирховские законы эмболии, в целом, действуют и при эмболии опухолевой. Так, колоректальные раки метастазируют ортоградно (по току крови) по системе воротной вены в печень. Однако, не только пассивный перенос опухолевых клеток важен при эмболии. Метастатические очаги могут возникать из эмболов, минующих малый круг (например, в мозге) через анастомозы и позвоночные сосуды (при раке легкого).
Избирательность метастазирования не всегда связана с анатомией его сосудистых путей. Например, многие карциномы (легкого, простаты, почек, щитовидной и молочной железы) часто метастазируют в кости. Установлена возможность ретроградного распространения по сосудам злокачественных клеток, связанная с их активной локомоцией и блоком венозных путей оттока.
Доказано, что количество метастазов коррелирует со степенью развития кровеносной системы опухоли. Так, меланома, не выходящая за пределы базальной мембраны эпидермиса и не васкуляризированная, не проявляет склонности к метастазированию.
В целом, для злокачественных новообразований характерна последовательность распространения злокачественных клеток — вначале лимфогенного, затем гематогенного. Объясняется это рядом морфологических обстоятельств.
Во-первых, общеизвестно, что многие карциномы возникают в органах, изначально богатых лимфатическими сосудами (легкие, молочная железа, кишечник и др.), и поэтому они метастазируют в первую очередь лимфогенным путем, а в органах, бедных такими сосудами (печень, почки) — сразу же гематогенно.
В тоже время, необходимо отметить, что органы и ткани, которые исключительно редко затрагиваются метастатическим процессом, — единичны. К ним относятся, например, селезенка (но не при лимфомах и лейкемиях), скелетная мускулатура, а также миокард.
В-четвертых, в последовательности метастазирования играют определенную роль и биохимические различия лимфы и крови, определяющие циркуляцию, адгезию и другие процессы.
Имплантационное метастазирование
Имплантационное метастазирование происходит в случае, если опухоль прорастает в плевральную, перикардиальную, перитонеальную полость или субарахноидальное пространство. Так возникает карциноматоз брюшины, плевры и т.д. (типичный пример — метастаз Шницлера в брюшину дугласова пространства при раке желудка). Более редко наблюдаются другие формы метастазирования злокачественных опухолей.
Прививочные метастазы — возникновение опухоли в послеоперационных рубцах после удаления злокачественного новообразования. Наиболее частой причиной таких метастазов является нарушение правил абластики и антибпастики во время операции.
Метастазирование по продолжению (per contituitatem). Примером такого метастазирования является периневральное распространение опухолевых клеток при раке предстательной железы, прямой кишки и т.д. Для данного вида метастазирования характерны постоянные, сильные и трудно купируемые боли.
Вместе с тем они способны возвращаться в клеточный цикл в любое время и, таким образом, давать начало выявляемым клинически метастазам, иногда через весьма продолжительное время после обнаружения и/или удаления первичной опухоли.
Таким образом, в настоящее время достаточно полно изучены механизмы и маршруты метастазирования, локализация регионарных и отдаленных метастазов (которые в значительной мере определяются особенностями лимфо- и гемодинамики пораженного опухолью органа); время возникновения (хронология метастазирования); частота.
Эти сведения необходимо учитывать при диагностике, классификации по стадиям и по системе TNM, планировании и осуществлении специального лечения, определении индивидуального прогноза. Значительно меньше изучен вопрос, какие причины обусловливают развитие метастазов.
Клинические особенности метастазирования
1. Не вызывает сомнения, что метастазирование — это функция времени. Считается, что карцинемия является основным признаком и условием метастазирования опухопи. В 80-90% случаев опухолевые клетки можно обнаружить в крови даже в ранние сроки опухолевого процесса.
Однако большинство опухолевых клеток до определенного времени вследствие воздействия противоопухолевых механизмов защиты организма погибает. Поэтому нахождение опухолевых эмболов в кровеносных сосудах стромы опухоли имеет существенно более неблагоприятное прогностическое значение, чем карцинемия.
Полагают, что избирательность метастазирования связана с рядом факторов: анатомические особенности кровоснабжения опухоли; общность антигенных свойств опухоли и органа, где развился метастаз; способность раковых клеток реагировать на характерные для того или иного органа местные цитокины, обеспечивающие соответствующую направленную миграцию и успешное приживление метастаза; особенности метаболизма и местного иммунитета в органах, что определяет их противоопухолевые свойства.
Из особенностей кровоснабжения необходимо, например, указать на возможность быстрого метастазирования дифференцированного рака щитовидной железы вследствие отрицательного давления в системе вен и лимфатических сосудов железы в норме.
Установлено, что избирательная локализация метастазов рака молочной железы в легком обусловлена способностью раковых клеток железы отвечать пролиферацией на цитокины легочного происхождения.
С другой стороны, хотя главными в инвазии представляются все же свойства самих опухолевых клеток, не все нормальные ткани подвержены опухолевой инвазии в одинаковой степени. Например, капсулы печени и почки, периост часто ограничивают распространение опухолей при непосредственном контакте с ними. Существенным барьером на пути опухолевой инвазии является хрящ, стенка артерий, фиброзная ткань.
3. Более раннее и обширное метастазирование чаще наблюдается у лиц молодого возраста.
4. Склонность злокачественных опухолей метастазировать определяется их морфологией: недифференцированные обычно метастазируют чаще, чем высокодифференцированные. Однако из этого правила имеются исключения. Так, независимо от степени дифференцировки. базалиомы, тимомы, хондросаркомы и глиомы метастазируют редко, в то же время как высокодифференцированные опухоли щитовидной железы и надпочечников метастазы дают часто.
5. Метастазирование учащается по мере роста опухоли. Чем больше размеры опухоли, тем выше вероятность отделения и миграции отдельных клеток или их комплексов.
Существуют, однако, и многочисленные исключения из этого правила: широкая лимфогенная и гематогенная диссеминация небольших по объему опухолей (Т1) и отсутствие метастазов при далеко зашедшем раке (Т4). Более того, у некоторых больных вначале клинически проявляются метастазы и лишь спустя несколько лет — первичная опухоль (оккультные формы рака).
6. Часто метастазы выявляются после травмы опухоли или ее удаления. При этом распространение клеток из первичной опухоли через лимфатические пути осуществляется в течение нескольких секунд. Вероятно, различные манипуляции могут способствовать поступлению (выталкиванию) опухолевых клеток в лимфатические пути.
7. Общей закономерностью является преобладание лимфогенного, лимфогематогенного и имплантационного путей метастазирования злокачественных эпителиальных опухолей (раки) и гематогенного — злокачественных неэпителиальных опухолей (саркомы).
Лишь саркомы матки, имеющей развитую лимфатическую сеть, могут вначале распространяться лимфогенным, а затем гематогенным путем. При одинаковой инвазирующей активности в отношении лимфатических структур саркоматозных и раковых клеток, преимущественно гематогенное метастазирование при саркомах пока не имеет убедительного объяснения.
Отчасти это можно объяснить различиями в строении поверхностных мембран опухолевых клеток. Предполагается также, что саркомы обычно возникают в органах, бедных лимфатической сетью (кости, мышцы и др.). и именно поэтому им характерны почти исключительно гематогенные метастазы.
8. Стресс и метастазирование. В последние годы большое внимание в механизмах противометастатической сопротивляемости организма уделяется стрессу, как реакции организма на злокачественную опухоль.
В общем виде постулируется, что к усилению метастазирования приводит повышение активности гипоталамо-гипофизарного комплекса и коры надпочечников. Нормальная функция эпифиза, вилочковой железы и лимфоидной ткани препятствует метастазированию.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Читайте также:

