Толуол с хлором в присутствии хлорида алюминия
Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
1. Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
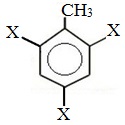
а) галогениерование
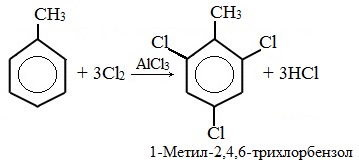
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
б) нитрование
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
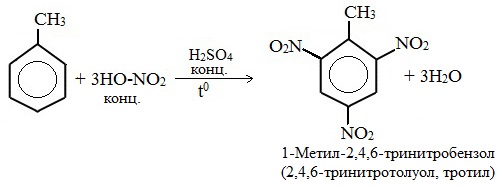
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
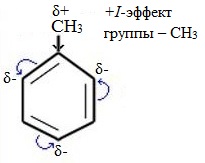
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование

г) алкилирование
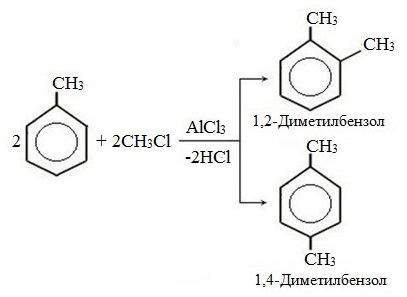

2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
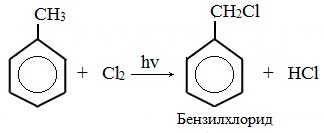
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
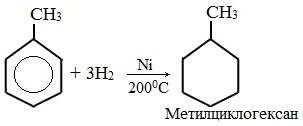
а) гидрирование
а) горение
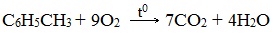
б) неполное окисление
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
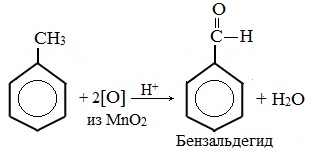
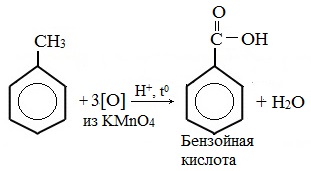
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
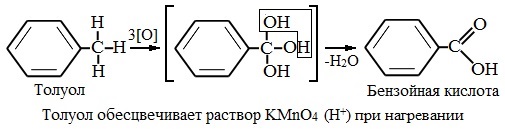
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
Выполнил
| 1. Арены | Стр. 3 |
| 2. Толуол – формула, строение. | Стр. 4 |
| 3. Физические свойства. | Стр. 5 |
| 4. Химические свойства | Стр. 6 |
| 5. Получение | Стр. 9 |
| 6. Применение | Стр. 10 |
| 7. Список литературы | Стр. 11 |
Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
Простейшими представителями класса являются бензол и толуол:
Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в циклической системе.
Критерии ароматичности аренов:
1. Атомы углерода в sp 2 -гибридизованном состоянии образуют циклическую систему.
2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит
4n+2p-электронов (n – целое число).
Толуол по своему строению подобен бензолу, отличием является лишь замещение одного атома водорода на группу (CH3).
Рассмотрим строение бензола.
В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C6Н6. Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая - ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
3. Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Физические свойства некоторых аренов представлены в таблице.
| Название | Формула | t°.пл., °C | t°.кип., °C | d4 20 |
| Бензол | C6H6 | +5,5 | 80,1 | 0,8790 |
| Толуол (метилбензол) | С6Н5СH3 | -95,0 | 110,6 | 0,8669 |
| Этилбензол | С6Н5С2H5 | -95,0 | 136,2 | 0,8670 |
| Ксилол (диметилбензол) | С6Н4(СH3)2 | |||
| орто- | -25,18 | 144,41 | 0,8802 | |
| мета- | -47,87 | 139,10 | 0,8642 | |
| пара- | 13,26 | 138,35 | 0,8611 | |
| Пропилбензол | С6Н5(CH2)2CH3 | -99,0 | 159,20 | 0,8610 |
| Кумол (изопропилбензол) | C6H5CH(CH3)2 | -96,0 | 152,39 | 0,8618 |
| Стирол (винилбензол) | С6Н5CH=СН2 | -30,6 | 145,2 | 0,9060 |
4. Химические свойства.
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
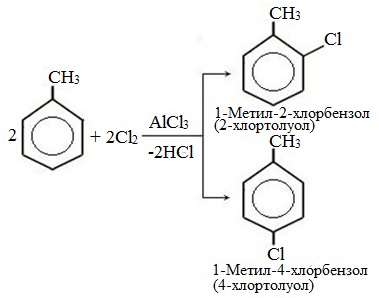
2) Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола. В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
Реакции в боковой цепи. Метильная группа в метилбензоле может вступать в определённые реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов.
Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений.
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
Известны следующие способы получения ароматических углеводородов.
По физическим свойствам метилбензол (толуол) сходен с бензолом. При нормальных условиях он представляет собой бесцветную жидкость, нерастворимую в воде, но растворимую в органических растворителях. Подобно бензолу, он является хорошим растворителем органических соединений. В настоящее время толуол шире используют в качестве растворителя, чем бензол, из-за гораздо меньшей токсичности.
Все реакции метилбензола можно подразделить на два типа: а) реакции, затрагивающие бензольное кольцо, и б) реакции, затрагивающие метильную группу.
Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного замещения, которые были описаны выше для бензола, а именно: в реакции нитрования, галогенирования, сульфирования и реакции Фриделя-Крафтса. Во всех этих реакциях метилбензол обнаруживает более высокую реакционную способность, и его реакции протекают с большей скоростью.
Нитрование метилбензола может осуществляться таким же способом, как и бензола. Продуктом нитрования метилбензола является смесь двух изомеров метилнитробензола:
Хлорирование толуола (метилбензола) в бензольное кольцо может проводиться путем пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуются 2- и 4-замещенный изомеры:
Сульфирование метилбензола концентрированной серной кислотой тоже приводит к образованию смеси 2- и 4-замещенного изомеров:
Механизм всех этих реакций электрофильного замещения подобен механизму соответствующих реакций бензола. В этих реакциях 3-замещенные изомеры образуются в столь незначительных количествах, что ими можно пренебречь. Ниже эта особенность будет подробно обсуждена при рассмотрении направляющей (ориентирующей) способности замещающих групп.
Реакции в боковой цепи. Метильная группа в метилбензоле может вступать в определенные реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов. Рассмотрим по одному примеру каждой из таких реакций.
Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения. Отметим, что галогенирование бензольного кольца в метилбензоле требует совершенно иных условий.
Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещениых соединений.
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
Выше мы уже указывали, что электрофильное замещение метилбензола приводит к образованию 2- и 4-замещенного изомеров метилбензола. Поэтому метальную группу в метилбензоле называют 2,4-направляющей (или, иначе, ориентирующей в положения 2 и 4). Существуют и другие заместители на бензольном кольце, которые тоже обладают 2,4-направляющим действием в реакциях электрофильного замещения. Для таких реакций можно записать следующее общее уравнение:
Реакции электрофильного замещения в положения 2 и 4 обычно имеют большую скорость, чем соответствующие реакции бензола.
Ненасыщенные заместители, как правило, являются 3-направляющими:
Направляющая (ориентирующая) способность заместителей зависит от того, являются ли они донорами электронов для бензольного кольца или же, наоборот,
Итак, повторим еще раз!
1. Ароматические соединения обладают следующими общими свойствами: а) горят с образованием дымного пламени;
Рис. 18.7. Важнейшие реакции бензола.
Рис. 18.8. Важнейшие реакции метилбензола (толуола).
б) вступают в реакции замещения,
в) с трудом вступают в реакции присоединения.
2. Молекула бензола может рассматриваться как резонансный гибрид, образованный двумя предельными резонансными структурами.
3. Важнейшие химические реакции бензола указаны на рис. 18.7.
4. Важнейшие химические реакции метилбензола указаны на рис. 18.8.
5. В реакциях конденсации происходит соединение двух реагирующих молекул в новую молекулу с одновременным отщеплением небольшой молекулы какого-либо простого соединения, например воды или хлороводорода.
6. Насыщенные заместители на бензольном кольце обладают 2,4-направляющим (ориентирующим) действием.
7. Ненасыщенные заместители на бензольном кольце обладают З-иаправляю-щим (ориентирующим) действием.
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:

Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С—С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120 о . Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:

Бензол при обычных условиях — бесцветная жидкость; t o пл= 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
1.Галогенирование

2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование


Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):

1.Гидрирование

2.Присоединение хлора

2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
1) переработка нефти и угля;
2) дегидрирование циклогексана:

3) дегидроциклизация (ароматизация) гексана:


В лаборатории:
Сплавление солей бензойной кислоты со щелочами:

Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.



Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:

а) галогенирование

При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:

б) нитрование

в) сульфирование

г) алкилирование

2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:

При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:

Гидрирование

2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
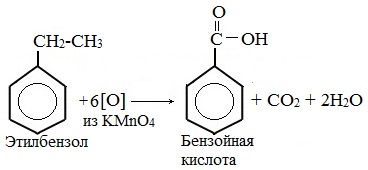
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:

В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:

3) дегидроциклизация гептана:

В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):

Добро пожаловать на сайт! Здесь вы найдете самую полную информацию об истории химии и ее развитии как науки, а также интересные статьи о всех химических элементах известных на сегодняшний день и о соединениях, которые они образуют.

CI

CI
CI

CI
Взаимодействие бензола с хлором с образованием гексахлорциклогексана, относится к реакциям:
Реакции замещения для гомологов бензола (алкилбензолов) преимущественно протекают по орто - и пара -положениям потому, что они содержат в молекуле:
а заместители I рода
б циклическую систему
в заместители II рода
г электроноакцепторные заместители
д бензольное кольцо
Основными органическими продуктами взаимодействия толуола с хлором в присутствии хлорида алюминия являются оба вещества в ряду:

При взаимодействии толуола с хлором под действием УФ-облучения образуется:
а орто -хлортолуол
б пара -хлортолуол
в мета -хлортолуол
В уравнении реакции:


CH 2 CH 3
вещество А преимущественно имеет строение:
а 

CH 2 CH 2 Br


CH 2 CH 3


CH 2 CH 3


CH 2 CH 3

При действии на этилбензол смеси концентрированных азотной и серной кислот преимущественно образуются:
а смесь 1 - нитро-2-этилбензола и 1-нитро-4-этилбензола
только -1 - нитро-3-этилбензол
г только 1-нитро-2-фенилэтан
д смесь 1 - нитро-3-этилбензола и 1-нитро-1-фенилэтан
Моноалкилбензолы окисляются раствором перманганата калия до
г уксусной кислоты
д фенилуксусной кислоты
В уравнении реакции:
вещество А имеет название:
Органическое вещество, которое образуется в результате взаимодействия изопропилбензола с раствором KMnO 4 , называется:
а салициловая кислота
б фенилуксусная кислота в бензойная кислота г уксусная кислота
д фталевая кислота
В уравнении реакции:
1) KMnO 4 , OH - ; 2) H +
A + 4 H 2 O + 2 CO 2
вещество А имеет формулу:



COOH


CH 2 COOH

OH
Гидрированием нафталина в присутствии никеля в качестве катализатора можно получить:
Преимущественный продукт сульфирования нафталина при 80ºС имеет структурную формулу:

Сульфирование нафталина, при 160ºС, приводит к преимущественному образованию:
а нафталин-1-сульфоновой кислоты б нафталин-2-сульфоновой кислоты
в фталевого ангидрида
г 1,4-дигидронафталин- 1-сульфоновой кислоты
д 1,4-дигидронафталин-2-сульфоновой кислоты
Одним из продуктов окисления нафталина кислородом в присутствии оксида ванадия (V) является:
а бензол-1,2-дикарбоновая кислота
б бензолкарбоновая кислота
в нафталин-2-карбоновая кислота
г нафталин-1,2-дикарбоновая кислота
д бензол-1,4 дикарбоновая кислота
РАЗДЕЛ 15 (получение галогенопроизводных)
Способом, которым в одну стадию нельзя получить галогеналканы является взаимодействие:
а спиртов с разбавленными галогеноводородными кислотами
б пиртов с галогеноводородами
в алканов с галогенами под действием УФ-облучения
Читайте также:

