Опухоли печени у плода
Опухоли печени у плода могут быть доброкачественными и злокачественными и представляют собой объемные печеночные образования. Частота врожденных опухолей печени неизвестна. Среди доброкачественных и злокачественных опухолей печени в пренатальном периоде были диагностированы гамартомы, гемангиомы, очаговая узловая гиперплазия, гемангиоэндотелиома, гепатобластома и метастатическое поражение печени при нейробластоме надпочечников. Наиболее частой злокачественной опухолью является гепатобластома, а самой частой опухолью среди всех новообразований печени - мезенхимальная гамартома.
Опухоли печени могут быть пропущены при скрининговом ультразвуковом исследовании плода в случаях, когда их эхогенность схожа с эхогенностью неизмененной печени. Первым признаком, позволяющим заподозрить опухоль печени, является увеличение размеров живота плода, которые могут опережать на 3-4 нед средние значения, соответствующие конкретному сроку беременности. Опухоли печени у плода диагностируются преимущественно только в III триместре беременности.
К настоящему времени среди опухолей печени наиболее часто пренатально в ходе ультразвукового исследования плода была диагностирована мезенхимальная гамартома. Среди 9 случаев пренатальной ультразвуковой диагностики мезенхимальной гамартомы печени опухоль в отличие от кисты была представлена образованиями солидной, солидно-кистозной структуры или многокамерным кистозным образованием.
S. Bejvan и соавт. сообщили о случае наиболее ранней диагностики мезенхимальной гамартомы печени больших размеров. В 26 нед беременности у плода было обнаружено многокамерное кистозное образование размерами 8x8x7 см. Печень и диафрагма были смещены кпереди, а почки кзади. Применение энергетического допплеровского картирования позволило установить, что образование печени было гиповаскуляризировано. При повторном исследовании через неделю отмечено увеличение размера образования до 10,9x10,6x7,5 см. С целью декомпрессии произведена аспирация опухоли и установлены два катетера: первый катетер - между двумя наибольшими полостями, второй - между одной из них и амниотической полостью. Однако из-за множественных внутренних перегородок дренаж не был адекватным и в 30 нед была произведена операция кесарева сечения. В возрасте 21 дня ребенокбыл прооперирован. В ходе операции былоудалено большое кистозное образование, исходящее из нижнего края правой доли печени. При гистологическом исследовании опухоль расценена как мезенхимальная гамартома.
Второй по частоте диагностированных пренатально опухолей печени при ультразвуковом исследовании плода, является гемангиома. Большинство случаев гемангиомы печени протекают бессимптомно и обнаруживаются после рождения или при патологоанатомическом исследовании. Однако в некоторых случаях гемангиома может приводить к гепатомегалии и кардиомиопатии уже в пренатальном периоде. Эхографическая картина гемангиомы печени у плода схожа с мезенхимальной гамартомой. Впервые пренатально гемангиому печени удалось диагностировать S. Nakamoto и соавт. в 1983 г. В последующие годы в литературе было представлено описание еще 6 случаев.
Гемангиома печени у плода может иметь гиперэхогенную, гипоэхогенную или смешанную эхоструктуру, нередко в ней выявляются кальцификаты. Отличительным признаком от мезенхимальной гамартомы является только степень васкуляризации. Наиболее часто отмечаются кавернозные гемангиомы с/без артериовенозных фистул. Поэтому при использовании цветового допплеровского картирования (ЦДК) в случаях гемангиомы печени выявляется высокая степень васкуляризации, нередко с признаками турбулентного характера кровотока, что позволяет дифференцировать гемангиому от других образований печени плода. Гемангиома печени часто сочетается с многоводием. Размеры опухоли у плода, согласно опубликованным наблюдениям, достаточно варьируют; максимальный размер составил 7,8x6,4 см.
Е. Jones и соавт. при ультразвуковом исследовании плода в 35 нед беременности обнаружили увеличение печени за счет образования размером 5,6x3,8 см. При использовании ЦДК был установлен сосудистый генез образования. Дополнительно у плода была выявлена кардиомегалия со снижением сократительной функции миокарда. В 36 нед пациентка была родоразрешена путем операции кесарева сечения в региональном перинатальном центре. После рождения у ребенка развилась острая почечная недостаточность, легочная гипертензия, застойная сердечная недостаточность и коагулопатия. При ультразвуковом исследовании и компьютерной томографии был подтвержден пренатальный диагноз гемангиомы печени. Через 2 дня была произведена эмболизация печеночной артерии и двух задних люмбальных артерий для редукции кровотока к гемангиоме и разгрузки сердца. Хотя эмболизация была успешной, коллатеральные сосуды печени реваскуляризировались, что привело к ухудшению состояния ребенка. От повторной операции родители отказались, спустя сутки ребенок умер.
В литературе также опубликовано клиническое наблюдение спонтанного исчезновения гемангиомы печени при динамическом эхографическом наблюдении в постнатальном периоде. Гемангиома печени у плода была обнаружена в III триместре беременности и подтверждена в ходе ЦДК. Структура опухоли была неоднородная, столстыми перегородками и кальцификатами; общий размер гемангиомы составил 5x6 см.
В случае обнаружения множественных образований в печени плода необходимо исключить возможность метастатического поражения. В литературе описан случай пренатальной диагностики метастатического поражения печени при нейробластоме надпочечников. При очаговой узловой гиперплазии в образованиях печени плода были обнаружены кривые скоростей кровотока, характерные для доброкачественных поражений.
A. Olavarria и соавт. сообщают о редкой опухоли печени у плода - лимфангиоме, проявившейся только в 32 нед беременности. Отличительной особенностью этого случая является тот факт, что за плодом осуществлялось динамическое наблюдение в связи с диагностированной хириоангиомой плаценты, диагностированной в 20 нед. При дальнейшем наблюдении была обнаружена задержка внутриутробного развития и зарегистрировано отсутствие диастолического кровотока в артерии пуповины. Пациентка была досрочно родоразрешена, а новорожденная девочка успешно прооперирована. При гистологическом исследовании была установлена лимфангиома печени.
В нашем наблюдении опухоль печени была диагностирована в 25-26 нед беременности. Ее размер составил 35x28x43 мм. Структура опухоли была однородной сниженной эхогенности с выраженным внутриопухолевых кровотоком. После рождения пренатальный диагноз был подтвержден.
Естественное течение опухолей печени у плода зависит от их типа, локализации, размеров и распространенности, которая в большинстве случаев не может быть точно установлена до периода постнатального обследования и оперативного лечения. Прогноз для детей с гамартомами печени в целом благоприятный в случае, если проводится хирургическое лечение. Летальные исходы обычно отмечаются в случаяххирургическихосложнений или осложнений, вызываемых интенсивным ростом опухоли до операции. Неблагоприятными прогностическими признаками в пренатальном периоде являются сердечная недостаточность и водянка плода, при которых перинатальная смертность значительно выше. Важное дополнительное значение для прогноза имеет ЦДК, позволяющее детально оценить особенности внутриопухолевого кровотока. При динамическом эхографическом наблюдении за плодом следует оценивать темпы роста опухоли печени, а также осуществлять исключение признаков неиммунной водянки и многоводия. Кроме этого, необходимо в III триместре беременности для оценки функционального состояния плода проводить кардиотокографическое наблюдение, так как при опухолях печени описаны случаи внутриутробной гибели. При выраженных признаках страдания плода показано досрочное родоразрешение, хотя оптимальным следует считать родоразрешение ближе к доношенному сроку, так как новорожденные с опухолями печени требуют оперативного лечения. Лечение опухолей печени в неонатальном периоде обычно включает эмболизацию или резекцию опухоли.
Опухоли печени у плода могут быть доброкачественными и злокачественными и представляют собой объемные печеночные образования. Частота врожденных опухолей печени неизвестна. Среди доброкачественных и злокачественных опухолей печени в пренатальном периоде были диагностированы гамартомы, гемангиомы, очаговая узловая гиперплазия, гемангиоэндотелиома, гепатобластома и метастатическое поражение печени при нейроблас- томе надпочечников [38, 39]. Наиболее частой злокачественной опухолью является гепатобластома
[40] , а самой частой опухолью среди всех новообразований печени - мезенхимальная гамартома.
Опухоли печени могут быть пропущены при скрининговом ультразвуковом исследовании плода в случаях, когда их эхогенность схожа с эхогенностью неизмененной печени. Первым признаком, позволяющим заподозрить опухоль печени, является увеличение размеров живота плода, которые могут опережать на 3-4 нед средние значения, соответствующие конкретному сроку беременности. Опухоли печени у плода диагностируются преимущественно только в III триместре беременности.
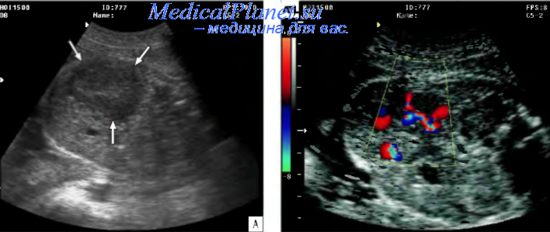
К настоящему времени среди опухолей печени наиболее часто пренатально в ходе ультразвукового исследования плода была диагностирована мезенхимальная гамартома. Среди 9 случаев пренатальной ультразвуковой диагностики мезенхимальной гамартомы печени опухоль в отличие от кисты была представлена образованиями солидной, солиднокистозной структуры или многокамерным кистозным образованием (рис. 17.33) 41.
80mm f E’AL CCHO
Рис. 17.33. Косое сечение туловища плода при мезенхимальной гамартоме печени.

Рис. 17.34. Поперечное сечение брюшной полости плода при гемангиоме печени. А - В-режим. Стрелкой указаны сосуды печени, питающие гемангиому. Б - режим энергетического допплеровского кодирования [54].

размера образования до 10,9x10,6x7,5 см. С целью декомпрессии произведена аспирация опухоли и установлены два катетера: первый катетер - между двумя наибольшими полостями, второй - между одной из них и амниотической полостью. Однако из-за множественных внутренних перегородок дренаж не был адекватным и в 30 нед была произведена операция кесарева сечения. В возрасте 21 дня ребенокбыл прооперирован. В ходе операции былоудапено большое кистозное образование, исходящее из нижнего края правой доли печени. При гистологическом исследовании опухоль расценена как мезенхимальная гамартома.
Второй по частоте диагностированных пренатально опухолей печени при ультразвуковом исследовании плода, является гемангиома.
Гемангиома печени у плода может иметь гипер- эхогенную, гипоэхогенную или смешанную эхострук- туру, нередко в ней выявляются капьцификаты. Отличительным признаком от мезенхимальной гамартомы является только степень васкуляризации. Наиболее часто отмечаются кавернозные гемангиомы с/без артериовенозных фистул. Поэтому при использовании цветового допплеровского картирования (ЦДК) в случаях гемангиомы печени выявляется высокая степень васкуляризации, нередко с признаками турбулентного характера кровотока, что позволяет дифференци- ровать гемангиому от других образований печени плода. Гемангиома печени часто сочетается с многоводием. Размеры опухоли у плода, согласно опубликованным наблюдениям, достаточно варьируют; максимальный размер составил 7,8x6,4 см [53].
Е. Jones и соавт. [54] при ультразвуковом исследовании плода в 35 нед беременности обнаружили увеличение печени за счет образования размером 5,6x3,8 см (рис. 17.34). При использовании ЦДК был установлен сосудистый генез образования. Дополнительно у плода была выявлена кардиомегалия со снижением сократительной функции миокарда. В 36 нед пациентка была родоразрешена путем операции кесарева сечения в региональном перинатальном центре. После рождения у ребенка развилась острая почечная недостаточность, легочная гипертензия, застойная сердечная недостаточность и коагулопа- тия. При ультразвуковом исследовании и компьютерной томографии был подтвержден пренатальный диагноз гемангиомы печени. Через 2 дня была произведена эмболизация печеночной артерии и двух задних люмбальных артерий для редукции кровотока к гемангиоме и разгрузки сердца. Хотя эмболизация была успешной, коллатеральные сосуды печени реваскуляризировапись, что привело к ухудшению состояния ребенка. От повторной операции родители отказались, спустя сутки ребенок умер.
В литературе также опубликовано клиническое наблюдение спонтанного исчезновения гемангиомы печени при динамическом эхографическом наблюдении в постнатальном периоде [55]. Гемангиома печени у плода была обнаружена в III триместре беременности и подтверждена в ходе ЦДК. Структура опухоли была неоднородная, столстыми перегородками и капьцификатами; общий размер гемангиомы составил 5x6 см.
В случае обнаружения множественных образований в печени плода необходимо исключить возможность метастатического поражения. В литературе описан случай пренатальной диагностики метастатического поражения печени при нейробластоме надпочечников [56]. При очаговой узловой гиперплазии в образованиях печени плода были обнаружены кривые скоростей кровотока, характерные для доброкачественных поражений.
A. Olavarria и соавт. [57] сообщают о редкой опухоли печени у плода - лимфангиоме, проявившейся только в 32 нед беременности (рис. 17.35). Отличи-

- эхограммы печени плода в 32 нед беременности. В - фотография лимфангиомы


тельной особенностью этого случая является тот факт, что за плодом осуществлялось динамическое наблюдение в связи с диагностированной хириоан- гиомой плаценты, диагностированной в 20 нед. При дальнейшем наблюдении была обнаружена задержка внутриутробного развития и зарегистрировано отсутствие диастолического кровотока в артерии пуповины. Пациентка была досрочно родоразрешена, а новорожденная девочка успешно прооперирована. При гистологическом исследовании была установлена лимфангиома печени.
В нашем наблюдении опухоль печени была диагностирована в 25-26 нед беременности. Ее размер составил 35x28x43 мм. Структура опухоли была однородной сниженной эхогенности с выраженным внутриопухолевых кровотоком (рис. 17.36). После рождения пренатальный диагноз был подтвержден.
Естественное течение опухолей печени у плода зависит от их типа, локализации, размеров и распространенности, которая в большинстве случаев не может быть точно установлена до периода постнатального обследования и оперативного лечения. Прогноз для детей с гамартомами печени в целом благоприятный в случае, если проводится хирургическое лечение. Летальные исходы обычно отмечаются в случаяххирургическихосложнений или осложнений, вызываемых интенсивным ростом опухоли до операции. Неблагоприятными прогностическими признаками в пренатальном периоде являются сердечная недостаточность и водянка плода, при которых перинатальная смертность значительно выше. Важное дополнительное значение для прогноза имеет ЦДК, позволяющее детально оценить особенности внутриопухолевого кровотока. При динамическом эхографическом наблюдении за плодом следует оценивать темпы роста опухоли печени, атакже осуществлять исключение признаков неиммунной водянки и многоводия. Кроме этого, необходимо в III триместре беременности для оценки функционального состояния плода проводить кардиотокографическое наблюдение, так как при опухолях печени описаны случаи внутриутробной гибели. При выраженных признаках страдания плода показано досрочное родоразрешение, хотя оптимальным следует считать родоразрешение ближе к доношенному сроку, так как новорожденные с опухолями печени требуют оперативного лечения. Лечение опухолей печени в неонатальном периоде обычно включает эмболизацию или резекцию опухоли.
1. Стыгар А.М., Демидов В.Н. Ультразвуковая оценка состояния органов пищеварительной системы плода // Клиническое руководство по ультразвуковой диагностике / Под ред. Митько- ва В.В., Медведева М.В. М.: Видар, 1996. II том. С. 181-204.
2. Гордиенко И.Ю. Ультразвуковая биометрия в динамике нормально развивающейся беременности. Клиническая лекция // Ультразвук. Пренат. Диагн. 1992. Выпуск 1. С. 15-24.
3. Медведев М.В., Юдина Е.В. Дифференциальная ультразвуковая диагностика в акушерстве. М.: Видар, 1997.
4. Zipursky A., Brown Е., Christiansen Н. et al. Leukemia and/or myeloproliferative syndrome in neonates with Down's syndrome // Semin. Perinatol. 1997. V. 21. P. 97-101.
5. Macones G.A., Johnson A., Tilley D. etal. Fetal hepatosplenomegaly associated with transient myeloproliferative disorder in trisomy 21 // Fetal Diagn. Ther. 1995. V. 10. P. 131-133.
6. Hartung J., Chaoui R., Wauer R., Bollmann R. Fetal hepatosplenomegaly: an isolated sonographic sign of trisomy 21 in a case of myeloproliferative disorder // Ultrasound Obstet. Gynecol. 1998. V. 11. P. 453-455.
7. Siva S., Smoleniec J. Antenatal diagnosis of transient abnormal myelopoiesis associated with Down's syndrome // Aust. N.Z. J. Obstet. Gynaecol. 1999. V. 39. P. 119-120.
8. Smrcek J.M., Baschat A.A., Germer U. et al. Fetal hydrops and hepatosplenomegaly in the second half of pregnancy: a sign of myeloproliferative disorder in fetuses with trisomy 21 // Ultrasound Obstet. Gynecol. 2001. V. 17. P. 403-409.
9. Ogawa М., Hosoya N., Sato A., Tanaka T. Is the degree of fetal hepatosplenomegaly with transient abnormal myelopoiesis closely related to the postnatal severity of hematological abnormalities in Down syndrome?// Ultrasound Obstet. Gynecol. 2004. V. 24. P. 83-85.
10. Hamada H., Yamada N., Watanabe H. et al. Hypoechoic hepatomegaly associated with transient abnormal myelopoiesis provides clues to trisomy 21 in the third-trimester fetus // Ultrasound Obstet. Gynecol. 2001. V. 17. P. 442-444.
11. Achiron R., Seidman D.S., AfekA. etal. Prenatal ultrasonographic diagnosis of fetal hepatic hyperechogenicities: clinical significance and implications for management // Ultrasound Obstet. Gynecol.
1996. Vol. 7. № 4. P. 251 -255.
12. Carroll S.G., Maxwell D.J. The significance of echogenic areas in the fetal abdomen // Ultrasound Obstet. Gynecol. 1996. Vol. 7. № 4. P. 293-298.
13. Koopman E., Wladimiroff J.W. Fetal intrahepatic hyperechogenic foci: prenatal ultrasound diagnosis and outcome //Prenat. Diagn.
1998. V. 18. № 4. P. 339-342.
14. Bronshtein M., Blazer S. Prenatal diagnosis of liver calcificationss // Obstet. Gynecol. 1995. V. 86. P. 739-743.
15. РудькоГ.Г., Медведев М.В., Юдина Е.В. Гиперэхогенные включения в печени плода: ультразвуковая диагностика и перинатальные исходы //Эхография. 2001. Т. 2. № 1. С. 105-108.
16. Hawass N.D., Badawi M.G., Fatani J.A. et al. Fetal hepatic calcification //Pediatr. Radiol. 1990. V. 20. P. 528-535.
17. Stein B., Bromley B., Michlewitz H. et al. Fetal liver calcifications: sonographic appearance and postnatal outcome // Radiology.
1995. V. 197. P. 489-492.
18. Юдина E.B., Медведев М.В., СыпченкоЕ.В. и др. Гиперэхогенные включения в печени плода //Ультразвук. Диагн. 1997. № 3. С. 34-36.
19. Liecuru F., Taurelle R., Bernard J.P. et al. Varicella zoster virus infection during pregnancy: the limits of prenatal diagnosis // Eur. J. Obstet. Gynecol. Reprod. Biol. 1994. V. 56. P. 67-68.
20. Herman T.E. Extensive hepatic calcification secondary to fulminant neonatal syphilitic hepatitis// Pediatr. Radiol. 1995. V. 25. P. 120-122.
21. Pretorius D.H., Hayward I., Jones K.L., Stamm E. Sonographic evaluation of pregnancies with maternal varicella infection // J. Ultrasound Med. 1992. Vol. 11. P. 459-463.
22. Stage D., Gasser B., GenixA. etal. Hepatic calcifications in afetus with trisomy 9 that underwent cordocentesis// Prenat. Diagn. 1994. Vol. 14. P. 303-306.
23. McDuffie R.S.Jr. Complete trisomy 9: case report with ultrasound findings //Amer. J. Perinatol. 1994. V. 56. P. 80-84.
24. Macken M.B., Wright J.R.Jr., Lau H. etal. Prenatal sonographic detection of congenital hepatic cyst in third trimester after normal second-trimester sonographic examination //J. Clin. Ultrasound.
2000. V. 28. № 6. P. 307-310.
25. Avni E.F., Rypens F., Donner C. et al. Hepatic cysts and hyperechogenicities: perinatal assessment and unifying theory on their origin // Pediatr. Radiol. 1994. V. 24. № 8. P. 569-572.
26. Michel W., Albig M., Waldschmidt J., Weitzel H. Prenatal ultrasonic diagnosisofacystic abdominal tumor- liver cyst and its differential diagnosis//Z. Geburtshife Perinatol. 1986. V. 190. P. 172-174.
27. Chung W.M. Antenatal detection of hepatic cyst // J. Clin. Ultrasound. 1986. V. 14. P. 217-219.
28. Baunin C, Mechinaud Puget C, Fajadet P, et al. Management of a biliary cyst disclosed prenatally. Apropos of 2 cases // Chir. Pediatr.
1990. V. 31. P. 160-163.
29. Dyon J.F., Sabatier E., JoukP.S. etal. Prenatal diagnostic imaging of abdominal cysts. Report of 9 cases // Pediatrie. 1990. V. 45. P. 857-868.
30. Alcacay М., Dan U., Kessler A. et al. Prenatal ultrasonic diagnosis of hepatic cyst // Pediatr. Surg. 1991. V. 6. P. 146-147.
31. Tsao L., Jeanty Ph. Liver cyst // TheFetus. net, 1993.
32. Ito М., Yoshimura K., Toyoda N., Tanaka H. Aspiration of giant hepatic cyst in the fetus in utero // Fetal Diagn. Ther. 1997. V. 12. №4. P. 221-225.
33. Arzt W., Stock М., Yaman C. Prenatal diagnosis and therapy of a fetal hepatic cyst in the 2nd trimester//Geburtsh. Frauenh. 1998. V. 58. P. 129-131.
34. Hackmon-Ram R., Wiznitzer A., Gohar J., Mazor M. Prenatal diagnosis of a fetal abdominal cyst // Eur. J. Obstet. Gynecol. Reprod. Biol. 2000. V. 91. P. 79-82.
35. Shankar S. R., ParelkarS.V., Das S. A., Mathure A.B. An antena tally diagnosed solitary, non-parasitic hepatic cyst with duodenal obstruction //Pediatr. Surg. Int. 2000. V. 16. P. 214-215.
36. Riano M.S. Liver cyst, spontaneous resolution //TheFetus.net, 2001.
37. Berg C., Baschat A. A., Geipel A. et al. First-trimester diagnosis of fetal hepatic cyst// Ultrasound Obstet. Gynecol. 2002. V. 19. № 3. P. 287-289.
38. Petrikovsky B.M., Cohen H.L., Scimeca P.H., Bellucci E. Prenatal diagnosis of focal nodular hyperplasia of the liver//Prenat. Diagn. 1994. V. 14. P. 406-409.
39. МедведевM.B., АлтынникH.А. Применение допплерэхографии при экстракардиальных аномалиях у плода //Допплерография в акушерстве/Под ред. Медведева М. В., КурьякаА., Юдиной Е.В. М.: РАВУЗДПГ, Реальное Время, 1999. С. 113-144.
40. Brunnelle F., Chaumont P., Hepatic tumors in children: ultrasonic differentiation of malignant from benign lesions // Radiology. 1984. V. 150. P. 695-699.
41. Foucar E., Williamson R.A., Yiu Chiu V. et al. Mesenchymal hamartoma of the liver identified by fetal sonography //Amer. J. Radiol. 1983. V. 140. P. 970-972.
42. HirataG.L, Matsunaga M. L., MedearisA.L. etal. Ultrasonographic diagnosis of fetal abdominal mass: a case of mesenchymal liver hamartoma and a review of the literature // Prenat. Diagn. 1990. V. 10. P. 507-512.
43. Bartho S., Schulz H.J., Bollmann R. etal. Prenatally diagnosed mesenchymal hamartoma of the liver // Zentralblatt. Pathol. 1992. V. 138. P. 141.
44. Hansen G.C., Ragavendra N. Atipical mesenchymal hamartoma of the liver: prenatal sonographic diagnosis //Amer. J. Radiol. 1992. V. 158. P. 921-922.
45. Mason B.A., Hodges W., Goodman J.R. Antenatal sonographic detection of a rare solid hepatic mesenchymal hamartoma // J. Maternal Fetal Med. 1992. V. 1. P. 134-136.
46. Bessho Т., Kubota K., Komori S. et al. Prenatally detected hepatic hamartoma: another cause of non-immune hydrops // Prenat. Diagn. 1996. V. 16. P. 337-341.
47. Bejvan S. М., Winter Т. C., Shields L.E. etal. Prenatal evaluation of mesenchymal hamartoma of the liver: grayscale and power Doppler sonographic imaging // J. Ultrasound Med. 1997. V. 16. № 3. P. 227-229.
48. Tovbin J., Segal М., Tavori I. et al. Hepatic mesenchymal hamartoma: a pediatric tumor that may be diagnosed prenatally // Ultrasound Obstet. Gynecol. 1997. V. 10. № 1. P. 63-65.
49. Dickinson J.E., Knowles S., Phillips J.M. Prenatal diagnosis of hepatic mesenchymal hamartoma // Prenat. Diagn. 1999. V. 19. №1. P. 81-84.
50. Nakamoto S.K., Dreilinger A., Dattel B. et al. The sonographic appearance of hepatic hemangioma in utero // J. Ultrasound Med. 1983.V.2. P. 239-241.
51. HubinontC., Bernard P., Khalil N. etal. Fetal liver hemangioma and chorioangioma: two unusual cases of severe fetal anemia detected by ultrasonography and its perinatal management // Ultrasound Obstet. Gynecol. 1994. V. 4. № 4. P. 330-331.
52. Abuhamad A.Z., Lewis D., Inati M.N. et al. The use of color flow Doppler in the diagnosis of fetal hepatic hemangioma // J. Ultrasound Med. 1993. V. 12. P. 223-226.
53. PetrovicQ., Haller H., Rukavina B. etal. Prenatal diagnosis of large liver cavernous hemangioma associated with polyhydramnios // Prenat. Diagn. 1992. V. 12. P. 70-71.
54. Jones E.D., Wallin S., Jones D. Fetal hepatic hemangioma: prenatal diagnosis //J. Diagn. Med. Sonography. 2001. V. 17. № 2. P. 99-103.
55. Dreyfus М., Baldauf J.J., Dadoun К. et al. Prenatal diagnosis of hepatic hemangioma // Fetal. Diagn. Ther. 1996. V. 11. №1. P. 57-60.
56. Liyanage I., Katoch D. Ultrasonic prenatal diagnosis of liver metastases from adrenal neuroblastoma // J. Clin. Ultrasound. 1992. V. 20. P. 401-403.


Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Нейробластома плода - опухоль, возникающая из недифференцированной невральной ткани надпочечников в забрюшинном пространстве или из симпатических ганглиев в брюшной полости, грудной клетке, малом тазу, в области головы и шеи. Более 90% нейробластом у плодов возникают в надпочечниках [1]. Это одна из наиболее частых экстракраниальных опухолей детского возраста, встречающаяся с частотой от 1:10 000 до 1:30 000 живорожденных [2, 3]. Нейробластомы составляют 50% всех опухолей первого года жизни [4]. При этом злокачественные опухоли надпочечников у детей занимают третье место по частоте после лейкемии и опухолей центральной нервной системы, составляя 8-10% всех злокачественных заболеваний у детей, являясь причиной 15% смертей от рака в педиатрической популяции. Этиология нейробластом неясна, большинство случаев возникает спорадически.
Обычно поражение изолированное, с вовлечением одного надпочечника, двустороннее поражение встречается редко [5]. Иногда антенатально появляются метастазы в печень, кожу, костный мозг и редко в ворсинки плаценты [6]. В этом случае плацента выглядит объемной, но метастатические очаги могут не определяться макроскопически, а диагностируются лишь при гистологическом исследовании. Сосуды ворсинок плаценты содержат скопления клеток нейробластомы, но инвазия стромы наблюдается исключительно редко [7]. Описаны случаи метастазирования в пуповину с последующей гибелью плода [8]. Нейробластомы преимущественно состоят из нейробластов. Макроскопически очаги опухоли хорошо очерчены, но могут инфильтрировать окружающие ткани, капсула отсутствует.
Известно сочетание нейробластом с различными состояниями, в частности с болезнью Гиршпрунга, фетальным алкогольным синдромом, синдромом ДиДжорджа, болезнью Вон Реклинхаузена, синдромом Беквита - Видеманна.
В литературе описан ранний случай диагностики нейробластомы в 19 нед беременности, однако обычно пренатальный диагноз устанавливается при ультразвуковом исследовании в промежутке от 26 до 39 нед гестации [8].
Первое сообщение о пренатальной диагностике нейробластомы датировано 1983 г. [9]. Ультразвуковая картина зависит от размеров, локализации и секреторной активности опухоли. Нейробластомы часто не диагностируются пренатально из-за их малых размеров. При ультразвуковом исследовании нейробластома визуализируется как образование, расположенное забрюшинно, между почкой и диафрагмой, смещающее почку книзу и латерально. Структура ее смешанная, с солидными и кистозными компонентами [10, 11]. В очагах больших размеров могут определяться дегенеративные признаки: кистозные изменения, кровоизлияния, кальцификаты [11, 12]. Иногда имеют место гидронефроз и многоводие, а также водянка плода.
Смещение нижней полой вены визуализирующимся образованием кпереди следует расценивать как признак забрюшинного происхождения этого образования [13]. Кроме того, при больших размерах опухоль надпочечника может смещать окружающие органы.
Цветовое допплеровское картирование помогает идентифицировать питающий опухоль сосуд, отходящий непосредственно от аорты, однако такой единственный сосуд может и не визуализироваться [13].
Как правило, антенатальная диагностика метастазов возможна исключительно редко, так как специфических поражений плаценты при ультразвуковом исследовании не отмечается, описано лишь неспецифическое ее утолщение [14]. В диагностике метастазов может быть информативной МРТ плода.
Геморрагические опухоли надпочечников могут осложняться анемией плода, неиммунной водянкой плода или массивной инвазией печени [10]. Предложены различные объяснения этиологии развития водянки плода: избыточная продукция катехоламинов, приводящая к гипертензии и сердечной недостаточности у плода; вовлечение в патологический процесс печени, вызывающее нарушение венозного возврата и развитие гипопротеинемии [14]; инвазия эритропоэтической ткани клетками опухоли, приводящая к развитию тяжелой анемии или даже гиперсекреции альдостерона корой надпочечников. Кроме того, описано возникновение водянки плода вторично к появлению метастазов в плаценту. Отек плаценты вследствие механического эффекта большого образования может развиваться в некоторых случаях нейробластомы без метастазирования в плаценту [6].
Кроме того, опухоли надпочечников больших размеров могут приводить к дистоции во время родов [8].
Следует помнить и о материнских осложнениях. Очень редко гиперпродукция катехоламинов опухолью надпочечников плода может вызывать избыточное потоотделение, развитие гипертензии и преэклампсии у матери, материнского миррор-синдрома при поражении плаценты [12, 14, 15]. Кроме того, развитие таких материнских осложнений, как правило, связано с высоким уровнем неонатальной смертности, достигающим 70% [1].
Сонографическое установление стадии опухолевого процесса у плода затруднено, но есть сообщения, что при отсутствии симптомов преэклампсии у матери риск широко диссеминированного процесса невысок [8].
Прогноз при нейробластоме зависит от времени диагностики, локализации первичного очага и стадии заболевания. Прогноз лучше у детей до 1 года жизни при низких стадиях опухоли (выживает около 90%) [16]. При нейробластоме, диагностированной пренатально, прогноз, как правило, благоприятный, выживает 90-96% детей [1]. Однако при поражении плаценты прогноз неблагоприятный, часто происходит антенатальная гибель плода или смерть ребенка вскоре после рождения [12, 14].
Обнаружение кальцификатов в опухоли при ультразвуковом исследовании сочетается с лучшим прогнозом, вероятно, вследствие того, что кальцификаты являются свидетельством произошедшего некроза опухоли [12].
Нейробластома in situ может не проявлять себя клинически и даже подвергаться спонтанной регрессии [17, 18].
Течение заболевания у пациентов с нейробластомой, диагностированной пренатально, обычно благоприятное, особенно при изолированном поражении надпочечников [8]. Методом лечения (с хорошими результатами) является хирургическое удаление опухоли непосредственно после рождения [19], химиотерапия показана только в случаях существенного прогрессирования заболевания [20]. Пациенты с "благоприятными" признаками заболевания (небольшие размеры опухоли, ее кистозная структура, отсутствие прогрессирования) должны тщательно наблюдаться и подвергаться хирургическому лечению только при отсутствии регресса образования [11].
В качестве иллюстрации приводим одно из наших клинических наблюдений.
Клиническое наблюдение
Пациентка Т., 40 лет, обратилась для проведения планового скринингового ультразвукового исследования в 32 нед. В ходе предыдущих исследований в 13 и 19 нед патологии не было выявлено.
Супруги здоровы, профессиональных вредностей не имеют. Наследственность не отягощена. Настоящая беременность пятая. В анамнезе двое нормальных родов, два медаборта. На учете в женской консультации пациентка состояла с 6 нед. Беременность протекала без существенных осложнений. Лишь в срок 6-7 нед была диагностирована угроза невынашивания.
Ультразвуковое обследование проводилось на УЗ-сканере SonoAce-X8 (Medison).
При ультразвуковом исследовании обнаружен один живой плод мужского пола. Гестационный срок составил 31 нед 4 дня. Фетометрические показатели соответствовали данному сроку, за исключением окружности живота, превышающей 95-й процентиль за счет гепатомегалии. Нарушений фето-плацентарного кровотока не было выявлено. Патологических изменений плаценты и околоплодных вод не отмечено.
Под диафрагмой справа визуализировалось гиперэхогенное опухолевидное образование несколько неоднородной солидной структуры, с четкими ровными контурами, размером 50x38x35 мм. К нижнему полюсу данного образования прилежала правая почка, имеющая нормальные размеры, форму и структуру. Нижняя полая вена была смещена кпереди и влево. Обращала на себя внимание выраженная гепатомегалия, причем структура печени не была однородной. Она содержала множественные гиперэхогенные включения размерами до 17 мм, окруженные тонким гипоэхогенным периферическим ободком. Цветовое допплеровское картирование(ЦДК) демонстрировало интенсивную периферическую васкуляризацию опухоли (рис. 1-3).

Рис. 1. Нейробластома правого надпочечника плода. Беременность 31 нед 4 дня.

Рис. 2. Кровоток в нейробластоме плода. Цветовое допплеровское картирование. Отчетливо виден питающий сосуд, огибающий образование по его периферии. К нижнему полюсу образования прилежит интактная почка плода.

Рис. 3. Метастазы в печени плода. Поперечное сечение брюшной полости плода. Гепатомегалия. В структуре печени плода определяются округлые включения несколько повышенной эхогенности (стрелки), с гипоэхогенным ободком - метастазы.
Был поставлен диагноз: беременность 31 нед 4 дня. Опухоль правого надпочечника плода с метастазами в печень. Рекомендовано динамическое ультразвуковое наблюдение за темпами роста новообразования и возникновением возможных осложнений.
В срок 32 нед 4 дня была диагностирована антенатальная гибель плода. Родился мертвый ребенок, мужского пола весом 2480 г, длиной 45 см.
В представленном наблюдении картина нейробластомы надпочечника была не совсем классической. То, что это супраренальное образование - очевидно, так как оно прилежало к почке, имеющей нормальную форму, размеры и структуру. Опухоль имела капсулу, однородную гиперэхогенную структуру, что не характерно для нейробластомы надпочечника. Поэтому дифференциальную диагностику проводили с кровоизлиянием в надпочечники, опухолью Вильмса, экстралобарным легочным секвестром, ретроперитонеальной тератомой.
Кровоизлияние в надпочечники, как правило, выглядит эхогенным или неоднородной структуры образованием, иногда может быть полностью анэхогенным и характеризуется изменением ультразвуковой картины при динамическом исследовании, постепенно превращаясь в анэхогенное кистозное образование, в котором с течением времени отмечается утолщение его стенки [13] и образуются кальцификаты. Энергетический допплер демонстрирует полную аваскулярность такого образования. В нашем случае образование имело повышенную эхогенность, несколько неоднородную структуру. При ЦДК в опухоли регистрировался преимущественно периферический кровоток.
Опухоль Вильмса поражает почку (чаще правую), которая в представленном случае была интактна.
Экстралобарная легочная секвестрация является преимущественно левосторонним супраренальным образованием с четким наружным контуром, как правило, гиперэхогенной однородной структурой неправильной формы. Выявляется эта патология уже во II триместре беременности, при ЦДК определяется питающий сосуд.
Тератомы (в том числе и забрюшинной локализации) всегда представлены образованиями неоднородной солиднокистозной структуры вследствие их гистологического строения.
Таким образом, обнаруженное нами образование было отнесено к опухоли надпочечника даже при отсутствии классической картины нейробластомы. Обращали на себя внимание большой размер опухоли и отсутствие выраженных осложнений в виде многоводия, застойной сердечной недостаточности, нарушения фето-плацентарного кровотока. При этом относительно ранняя манифестация (выявление данного комплекса изменений уже в 31 нед), не совсем типичная ультразвуковая морфология опухоли, наличие выраженной гепатомегалии и множественных метастазов позволяли сделать вывод о злокачественном течении заболевания, что, видимо, и обусловило антенатальную гибель плода. В итоге диагноз был подтвержден патоморфологическим исследованием. У недоношенного плода мужского пола живот увеличен в объеме. Справа в забрюшинном пространстве определяется округлое образование (опухоль) размером 50?35?30 мм, эластичной консистенции. Спереди и снизу к опухоли прилежит почка, плотно с ней спаянная. Опухоль исходит из правого надпочечника, который находится на ее верхнем полюсе в виде "шапочки". На разрезе опухоль однородная, желтовато-серая. Левые надпочечники и почка обычного вида. Печень значительно увеличена, занимает около 1/2 объема брюшной полости, доли четко не дифференцируются. Поверхность печени коричневато-красная. На разрезах определяются множественные плотные эластичные узлы диаметром до 15 мм бледно-желтого цвета (рис. 4, 5).

Рис. 4. Органокомплекс, вид спереди.
1 - печень;
2 - опухоль с правым надпочечником;
3 - сердце.
Читайте также:

