Опухоли из клеток стромы
ГИСТОГЕНЕЗ И ЦИТОГЕНЕЗ ОПУХОЛЕЙ
МОРФОЛОГИЯ ОПУХОЛЕВОГО РОСТА
● Трансформации подвержены только пролиферирующие соматические клетки (поли- или унипотентные клетки-предшественники).
● Опухолевая клетка способна повторять в извращённой форме признаки дифференцировки (фенотип), заложенные в её клетке-предшественнице.
● В опухолевых клетках извращение дифференцировки вызвано её блоком. При блоке дифференцировки на уровне унипотентных клеток опухолевые клетки обладают минимальной фенотипической гетерогенностью. При блоке на уровне полипотентных клеток выражена фенотипическая гетерогенность опухолевых клеток, возникают клетки-химеры с множественной дифференцировкой.
● Дифференцировка опухолевых клеток зависит от уровня малигнизации клетки-предшественницы и уровня блока дифференцировки. Доброкачественные опухоли развиваются при трансформации унипотентных клеток с низким блоком дифференцировки, поэтому они построены из зрелых клеточных элементов. Для злокачественных опухолей характерен меньший уровень дифференцировки клеток по сравнению с доброкачественными, что связано с их развитием из полипотентных клеток, наличием высокого блока дифференцировки. Чем выше уровень малигнизации и блока дифференцировки, тем менее дифференцированная злокачественная опухоль возникает.
Опухоли состоят из паренхимы и стромы. Паренхима опухоли — собственно опухолевые клетки, возникшие в результате злокачественной трансформации исходной клетки и её клональной пролиферации. Строма в опухоли, как и в нормальной ткани, в основном, выполняет трофическую, модулирующую и опорную функции. Стромальные элементы опухоли представлены клетками и межклеточным матриксом соединительной ткани, сосудами, нервными окончаниями.
Межклеточный матрикс состоит из базальных мембран и собственно соединительнотканного матрикса.
● Базальные мембраны содержат коллагены типов IV, VI и VII, гликопротеины (ламинин, фибронектин, витронектин), протеогликаны (гепарансульфат и др.).
● Собственно соединительнотканный матрикс содержит коллагены типов I и III, фибронектин, протеогликаны и гликозаминогликаны.
В зависимости от развитости стромы различают опухоли органоидные и гистиоидные.
● Органоидные опухоли имеют паренхиму и развитую строму. Пример органоидных опухолей — опухоли из эпителия. При этом степень развитости стромы может быть различной: от узких редких фиброзных прослоек и сосудов капиллярного типа (медуллярный рак) до мощных полей фиброзной ткани с едва различимыми эпителиальными опухолевыми цепочками (фиброзный рак, или скирр).
● Гистиоидные опухоли. Преобладает паренхима, строма практически отсутствует, так как представлена лишь тонкостенными капиллярами, необходимыми для питания. По гистиоидному типу построены опухоли из соединительной ткани.
Роль стромы для опухоли не ограничена только трофическими и опорными функциями. Строма влияет на пролиферацию и дифференцировку опухолевых клеток, возможности инвазивного роста и метастазирования. Модифицирующее воздействие стромы на опухоль возможно благодаря наличию на клеточных мембранах опухолевых клеток интегринов, участвующих в передаче сигналов на элементы цитоскелета и далее — в ядро опухолевой клетки. Интегрины обеспечивают межклеточные взаимодействия между опухолевыми клетками, с клетками и межклеточным матриксом стромы, определяя способность опухоли к инвазивному росту и метастазированию.
Молекулы адгезии — важный компонент клеточных мембран опухолевых клеток, обеспечивающий их взаимодействие между собой и с компонентами стромы. При опухолевой трансформации происходит изменение структуры и экспрессии молекул адгезии, входящих в состав клеточных мембран. Это приводит к нарушению взаимосвязи между опухолевыми клетками, следовательно, к инвазивному росту и метастазированию.
Происхождение стромы опухоли. Получены убедительные данные о возникновении клеточных элементов стромы опухолей из нормальных соединительнотканных предшественников окружающих тканей. В 1971 г было показано, что клетки злокачественных опухолей синтезируют фактор, стимулирующий пролиферацию элементов сосудистой стенки и рост сосудов (фактор Фолькмана). Это вещество белковой природы — группа факторов роста фибробластов. Фолькман первым показал, что образование стромы опухоли — результат сложных взаимодействий между опухолевой клеткой и клетками соединительной ткани.
Важную роль в образовании стромы опухоли выполняют соединительнотканные клетки местного (гистиогенного) и гематогенного происхождения. Стромальные клетки синтезируют факторы роста, стимулирующие пролиферацию клеток мезенхимального происхождения (фактор роста фибробластов, ФНО-α, фибронектин, инсулиноподобные факторы роста — соматомедины и др.), онкобелки (c-sis, c-myc). Одновременно клетки стромы экспрессируют рецепторы, связывающие факторы роста и онкобелки. Это стимулирует пролиферацию клеток как по аутокринному, так и по паракринному пути. Кроме того, сами клетки стромы способны выделять разнообразные протеолитические ферменты, приводящие к деградации межклеточного матрикса.
Опухолевые клетки активно участвуют в образовании стромы. Трансформированные клетки стимулируют пролиферацию соединительнотканных клеток по паракринному регуляторному механизму, синтезируют факторы роста и онкопротеины. Клетки опухоли синтезируют сами и стимулируют клетки соединительной ткани к синтезу компонентов межклеточного матрикса. Компоненты матрикса имеют характерный состав, что можно использовать при дифференциальной диагностике опухолей. Кроме того, опухолевые клетки синтезируют ферменты (коллагеназы и др.), их ингибиторы и активаторы, способствующие или препятствующие инфильтрирующему и инвазивному росту злокачественных опухолей. Динамическое равновесие между коллагеназами, их активаторами и ингибиторами обеспечивает стабильное состояние опухоли и препятствует её прорастанию в прилежащие ткани. В момент роста опухолевые клетки активно синтезируют коллагеназы, эластазы и их ингибиторы.
Злокачественные опухоли часто образуют строму, где преобладает эмбриональный тип коллагена стромы соответствующего органа. Например, в строме рака лёгкого преобладает коллаген типа III, характерный для эмбрионального лёгкого. Разные опухоли имеют разный состав коллагенов стромы. В карциномах, как правило, преобладают коллагены типа III (рак лёгкого), IV (почечно-клеточный рак, нефробластомы), в саркомах — интерстициальные коллагены. Однако в хондросаркоме много коллагена II, а в синовиальной саркоме — коллагена IV. Описанные различия состава стромы важно учитывать при дифференциальной диагностике сарком.
Образование стромы в опухоли — сложный процесс, включающий следующие стадии.
● Секреция опухолевыми клетками митогенных цитокинов — факторов роста и онкопротеинов, стимулирующих пролиферацию соединительнотканных клеток, прежде всего, эндотелия, фибробластов, миофибробластов, гладкомышечных клеток.
● Синтез опухолевыми клетками компонентов межклеточного матрикса: коллагенов, ламинина, фибронектина и др.
● Пролиферация и дифференцировка клеток-предшественниц соединительнотканного происхождения, секреция ими компонентов межклеточного матрикса, формирование тонкостенных сосудов капиллярного типа, в совокупности составляющих строму опухоли.
● Миграция в строму опухоли клеток гематогенного происхождения: моноцитов, плазмоцитов, лимфоцитов, тучных клеток и др.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
— Рак (карцинома) развивается из эпителия. Этот вид опухолей составляет 85-90% всех злокачественных новообразований яичника. Рак яичников чаще развивается у женщин старше 50 лет.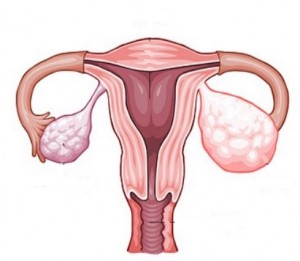
— Герминоклеточные опухоли происходят из эмбриональных предшественников половых клеток. У взрослых эти новообразования встречаются редко.
Стромальные опухоли яичников — опухоли низкой степени злокачественности (растут и распространяются достаточно медленно). Эти новообразования составляют до 7% всех злокачественных опухолей яичника. В большинстве случаев они развиваются у женщин младше 40 лет, иногда встречаются у девочек-подростков и молодых девушек.
— Гранулёзоклеточная опухоль – самая частая (90%) из стромальных опухолей яичников. Большинство гранулёзоклеточных опухолей возникает в репродуктивном возрасте. Выделяют гранулёзоклеточную опухоль взрослого типа, чаще эта опухоль возникает у женщин в период менопаузы. Второй тип – ювенильная гранулёзоклеточная опухоль, встречается у детей и подростков.
— Опухоли из клеток Сертоли (также известные как андробластомы, опухоли Сертоли-Лейдига) могут состоять только из клеток Сертоли или из клеток Сертоли и клеток Лейдига. Первые чаще выявляются у молодых женщин, вторые у подростков, причём эти опухоли продуцируют большое количество мужских половых гормонов (андрогенов), что приводит к огрубению голоса и избыточному оволосению.
— Опухоли из стромы полового тяжа с аннулярными трубочками очень редки. Эта группа представляет собой отдельный вид опухолей, подразделяющийся на два подтипа – один из них ассоциирован с синдромом Пейтца-Егерса, такие опухоли, как правило, отличаются доброкачественным поведением и обнаруживаются в обоих яичниках. Второй подтип не связан с синдромом Пейтца-Егерса, а опухоли обычно имеют более крупный размер и чаще являются злокачественными.
— Гинандробластомы — обычно крупные опухоли, сочетающие в себе компоненты гранулёзы и клетки Сертоли. Это очень редкий вид опухолей, гинандробластомы составляют менее 1% от всех стромальных опухолей яичников. Чаще их обнаруживают у женщин от 20 до 50 лет.
— Стероидноклеточные опухоли очень редки, составляют менее 0,1% от всех опухолей яичников. Их подразделяют на 3 типа в зависимости от гистологического строения : доброкачественные стромальная лютеома и опухоль из клеток Лейдига, злокачественная неспецифицированная стероидноклеточная опухоль.
Симптомы стромальных опухолей яичников могут быть такими же, как и при остальных новообразованиях этой локализации: аномальные маточные кровотечения, пальпируемое образование в брюшной полости, частое мочеиспускание, запоры, изменение аппетита, тошнота, изжога, слабость, чувство распирания в животе, боль в ногах, спине, тазу или животе, болезненность при половом акте.
Кроме того, признаками, характерными именно для стромальных опухолей яичников, являются 
преждевременное половое созревание, напряженность и увеличение молочных желез, нерегулярные менструации, кровотечения после менопаузы, появление мужских вторичных половых признаков (избыточное оволосение лица и тела, огрубение голоса, облысение по мужскому типу, увеличение клитора).
Обследование при стромальных опухолях яичника аналогично таковому при раке яичника.
Считается, что прогноз при данном виде новообразований более благоприятный, чем при раке. Поэтому иногда (при I стадии опухоли при условии, что ее размер менее 10 см) лечение включает в себя только операцию. Во всех остальных случаях проводится химиотерапия , а в отдельных случаях и лучевая терапия.
Смешанные герминогенные опухоли
В эту группу входят новообразования, состоящие из нескольких элементов герминогенных опухолей, один или более из которых не представляют собой семиному.
В таком случае диагноз семиномы неправомерен, даже если опухоль преимущественно представлена этим компонентом.
Смешанные опухоли встречаются в 69% случаев.
Самые распространенные комбинации: тератома и эмбриональный рак; семинома и эмбриональный рак; тератома, эмбриональный рак, опухоль желтого мешка; эмбриональный рак, тератома, хориокарцинома; эмбриональный рак, тератома, семинома; тератома и семинома. Несмотря на то что семинома с клетками синцитиотрофобласта смешанная опухоль, она классифицируется как вариант семиномы из-за сходного течения и терапии.
Поверхность смешанных герминогенных опухолей часто пестрая с очагами некроза и кровоизлияния. Микроскопически опухоль представлена различными участками. Часто опухоль желточного мешка граничит с очагами эмбрионального рака.
Полиэмбриома — одна из форм смешанных опухолей, которая содержит мелкие эмбриональные тельца. Тельца состоят из кубических или призматических эмбриональных стромальных клеток, иногда располагающихся в несколько рядов, клеток эмбрионального рака, вентрального и дорсального компонентов желточного мешка, формирующих желточный пузырек и амниотическое пространство.
Эмбриональные тельца окружены миксоматозной хорошо васкуляризованной тканью, что также характерно для опухолей желточного мешка. В некоторых случаях амниотический эпителий имеет признаки плоскоклеточной или кишечной дифференцировки, а в зоне мешка — гепатоидной.
В смешанных герминогенных опухолях можно обнаружить не полностью сформировавшиеся эмбриональные тельца. Диффузная эмбриома представлена полями эмбрионального рака и опухоли желточного мешка.
Опухоли стромы полового тяжа
Опухоль из клеток Лейдига составляет 1-3% тестикулярных опухолей. Клинически данная опухоль может сопровождаться гинекомастией у 30% пациентов, может быть повышен уровень эстрогенов и эстрадиола в сыворотке. Около 10% лейдигом представлены злокачественными формами.
Критериями злокачественности считаются размер более 5 см, клеточная атипия, митозы (более 3 в 10 полях зрения), некроз и сосудистая инвазия. Злокачественные лейдигомы нечувствительны к лучевой и химиотерапии, и многие пациенты умирают от метастазов.
Большинство опухолей имеет вид желтых, коричневых или желто-бурых узлов солидного строения, часто с очагами некроза и кровоизлияния. Диаметр опухоли варьирует от 2 до 5 см, но может быть более 10 см. Распространение за пределы яичка наблюдается приблизительно в 10% случаев.
Описано несколько микроскопических вариантов роста опухоли: солидный, трабекулярный, псевдожелезистый, компактными гнездами. Часто разные варианты сочетаются в одной опухоли. Изредка выявляются микрокистозные участки, что придает сходство с опухолями желточного мешка. Также могут встречаться участки веретеновидного строения.
Гнезда опухолевых клеток обычно отделены от окружающей ткани яичка отечной или фиброзированной стромой. Опухолевые клетки имеют полигональную форму, обильную эозинофильную цитоплазму, круглые ядра разного размера, заметное центрально расположенное ядрышко (рис. 4.31).

Рис. 4.31. Доброкачественная опухоль из клеток Лейдига. Опухолевые клетки полигональной формы с обильной эозинофильной цитоплазмой, круглым ядром и заметным центрально расположенным ядрышком. Окраска гематоксилином и эозином. х400
В цитоплазме опухолевых клеток у пациентов постпубертатного возраста можно обнаружить липофусцин, придающий буро-коричневую окраску. Примерно в 40% случаев выявляются мелкие красные кристаллы Reinke. Скопления клеток с обилием липидов в цитоплазме формируют участки, напоминающие сетчатую зону коры надпочечника, в некоторых случаях в опухолях могут быть клетки с оптически пустой цитоплазмой (рис. 4 32).

Рис. 4.32. Доброкачественная опухоль из клеток Лейдига. Клетки с обильным содержанием липидов в цитоплазме, напоминающие сетчатую зону коры надпочечников. Окраска гематоксилином и эозином. х400
Часто в качестве компонента опухоли из клеток Лейдига присутствуют жировые клетки, могут выявляться кальцинаты и оссификаты. Митозы нехарактерны, наличие более 3 в 10 полях зрения — признак злокачественности.
При иммуногистохимическом (ИГХ) исследовании в подавляющем большинстве опухолей выявляется ингибин-а, кальретинин, Melan-A. В 67% лейдигом экспрессируется CD99, р53 выявляется редко и может быть признаком злокачественности процесса. Редко опухоли из клеток Лейдига окрашиваются плацентарной щелочной фосфатазой (PLAP). Большинство клеток опухоли экспрессирует виментин, но возможна и экспрессия цитокератинов
Опухоль необходимо дифференцировать с очаговой гиперплазией клеток Лейдига, наблюдающейся у пациентов с повышенным уровнем гонадотропинов. в т. ч. и человеческий хорионический гонадотропин (hCG). Часто гиперплазия клеток Лейдига наблюдается на фоне атрофии яичка: нормальное количество клеток при снижении объема яичка.
Нередко гиперплазия клеток Лейдига сопровождает адреногенитальный синдром и синдром Нельсона. От опухоли из клеток Лейдига гиперпластические состояния отличает преимущественно двустороннее поражение, отсутствие кристаллов Reinke, выраженный фиброз. Гиперпластические состояния хорошо отвечают на лечение.
Опухоль из клеток Сертоли отличается от лейдигомы отсутствием кристаллов Reinke, более выраженной кальцификацией, более выраженным отеком стромы, нейтрофильной инфильтрацией. При ИГХ-исследовании в опухоли из клеток Сертоли отмечается фокальная экспрессия Melan-A и CD10.
Составляет менее 1 % всех тестикулярных новообразований, большинство опухолей спорадические, но бывают и связанные с генетическими синдромами. Макроскопически опухоль представлена солидным желтовато белым или бурым узлом обычно более 4 см в диаметре, иногда с кистозными изменениями.
При микроскопическом исследовании выявляются сформированные протоковые структуры. Могут быть солидные, трабекулярные структуры и гнезда или отдельные клетки, строма обычно фиброзированная или отечная (рис. 4.33 и 4.34).

Рис. 4.33. Опухоль из клеток Сертоли. Клетки формируют трубочки, расположенные в отечной строме. Окраска гематоксилином и эозином. х200

Рис. 4.34. Опухоль из клеток Сертоли. Гнезда светлых клеток в фиброзированной строме. Окраска гематоксилином и эозином. х200
Цитоплазма опухолевых клеток, как правило, скудная и светлая. Прозрачность цитоплазмы обусловлена скоплением липидов. Выраженная ее вакуолизация может создавать впечатление микрокистозного строения.
Ядра круглой или овальной формы, преимущественно мономорфные. Злокачественный вариант составляет около 10% всех опухолей из клеток Сертоли, на сегодня в литературе описано менее 50 случаев. Морфологические признаки злокачественности включают размер опухоли более 5 см, выраженную клеточную атипию, плеоморфизм клеток, инвазивный рост, некрозы, более 5 митозов на 10 полей зрения, уровень пролиферативной активности по MIB-1 более 30%.
При 14ГХ-исследовании 30-90% опухолей из клеток Сертоли экспрессируют ингибин-а. 60-80% — цитокератин. 90-100% — виментин, 30-64% — S-100, 70-82% — хромогранин. 45% — синаптофизин; большинство опухолей не содержат эпителиальный мембранный антиген (ЕМА). Отмечена фокальная экспрессия Melan-A и CD10.
Опухоль из клеток Сертоли необходимо дифференцировать с семиномой с тубулярным компонентом. При нечувствительности к андрогенам могут развиваться гамартомные узлы в яичке, представленные компактно расположенными протоками, выстланными клетками Сертоли.
Отличить их от истинной опухоли помогают клетки Лейдига, всегда присутствующие в таких узлах. При дифференциальном диагнозе с лейдигомой стоит ориентироваться на отсутствие кристаллов Reinke и наличие протоковых структур.
Макроскопически опухоль представлена узлами солидного строения от желтого до бурого цвета, микроскопически — тяжами или полями пустых протоков и скоплением клеток Сертоли в плотной коллагенизированной строме. Ядра варьируют от крупных с хорошо выраженными ядрышками до мелких с конденсированным хроматином. Цитоплазма бледная, иногда вакуолизированная.
Протоковый компонент может быть оценен как трабекулярный рак, но большинство первичных карцином яичка сочетается с тератомой. Присутствие вакуолизированных клеток может навести на мысль об аденоматоидной опухоли, но в отличие от опухолей из клеток Сертоли они не экспрессируют ингибин и дают выраженную реакцию с ЕМА.
Микроскопически выявляются гнезда и тяжи клеток с обильной эозинофильной цитоплазмой в отечной или коллагенизированной строме с выра женной нейтрофильной инфильтрацией; кальцификация или оссификация стромы наблюдаются в 50% случаев. Ядра опухолевых клеток округлой формы с хорошо выраженными ядрышками, митозы редки (рис. 4.35).

Рис. 4.35. Крупноклеточная опухоль из клеток Сертоли. Кальцинаты в опухоли. Окраска гематоксилином и эозином. х200
Опухоль может озлокачествляться. К признакам злокачественности относят диаметр поражения более 4 см, внеяичковую локализацию опухоли, очаги некроза, высокую степень атипии, инвазию сосудов, более 3 митозов на 10 полей зрения.
При ИГХ-исследовании крупноклеточная сертолиома экспрессирует виментин, S-100, нейронспецифическую енолазу (NSE), десмин, ЕМА, фокально — цитокератин. Дифференциальная диагностика проводится с опухолью из клеток Лейдига.
Редкая опухоль яичка. Возраст больных от 16 до 76 лет. Характерно повышение уровня ингибинов в сыворотке. У 25% пациентов выявляется гинекомастия Метастазы обнаруживаются более чем у 20% больных.
Макроскопически опухоль представлена участками солидного строения или кистами, возможно сочетание этих компонентов. Нередки обширные поля некроза и кровоизлияния.
Микроскопически выявляются компоненты, аналогичные гранулезоклеточной опухоли яичника, в т. ч. микрофолликулярный, макрофолликулярный, трабекулярный, мозговидный, диффузный. Тельца Кала-Экснера характерны для микрофолликулярного варианта. Опухолевые клетки имеют скудную бледно окрашиваемую цитоплазму, округлые ядра (рис. 4.38).

Рис. 4.38. Гранулезоклеточная опухоль яичка. Опухолевые клетки со скудной цитоплазмой и округлыми ядрами. Окраска гематоксилином и эозином. х400
Число митозов обычно не превышает 6 на 10 полей зрения. Гранулезоклеточная опухоль экспрессирует ингибин, виментин, кальретинин, СК8, СК18, CD99.
Развивается преимущественно у младенцев. Макроскопически опухоль представлена узлами солидного или кистозного строения, кисты заполнены прозрачной жидкой слизью Микроскопически можно выделить солидную целлюлярную зону, окруженную фолликулоподобными кистозными структурами, которые содержат жидкость, окрашивающуюся муцикармином. Фолликулы выстланы несколькими слоями опухолевых клеток и окружены веретеновидными клетками стромы, иногда гиалинизированной.
Цитоплазма опухолевых клеток обильная, бледная; ядра круглые, гиперхромные с заметным ядрышком. Могут присутствовать митозы и апоптотические тельца, но злокачественное течение опухоли не описано. Иммуногистохимически выявляется ингибин, виментин, CD99, цитокератин (фокально), гладкомышечный актин, десмин, AFP не экспрессируется.
Опухоли, напоминающие фиброму яичника или текому, в яичке встречаются не часто. Описано 3 подобных случая. Все они имели доброкачественное течение.
Микроскопически опухоль представлена участками разной клеточности, построена из веретеновидных элементов (рис. 4.39). Митозов менее 5 на 10 полей зрения. Иммуногистохимически выявляется виментин, актин, десмин; S-100, CD34 и цитокератин не экспрессируются.

Рис. 4.39. Фиброма яичка. Опухоль построена из веретеновидных элементов. Окраска гематоксилином и эозином. х200
Достаточно большая группа опухолей из клеток стромы полового тяжа представлена компонентами разной степени дифференцировки или сочетанием различных форм. Такие опухоли относят к смешанноклеточным или неклассифицируемым. Например, опухоль из гранулезных клеток с трубочками, выстланными клетками Сертоли.
При развитии в детском возрасте опухоли имеют преимущественно доброкачественное течение, у взрослых могут быть злокачественными и метастазироватъ. Появление клеточной атипии, полиморфизма, некроза, инвазивный характер роста, высокая митотическая активность, большой размер опухоли — признаки, встречающиеся редко, но позволяющие отнести пациента к группе риска по развитию метастазов.
Неклассифицируемые варианты опухолей представлены пролиферацией низкодифференцированных клеток стромы полового тяжа или стромальными элементами, которые невозможно определить при световой микроскопии.
Большинство опухолей поражает строму яичка Макроскопически представлены серыми или желтыми узлами солидного строения. При микроскопическом исследовании в таких опухолях определи ются как эпителиальные, так и стромальные компоненты. Иммуногистохимически может выявляется экспрессия S-100, гладкомышечного актина, CD99, ингибина.
Встречается у пациентов в возрасте от 27 до 69 лет. Макроскопически опухоль формирует узлы солидного строения желтого или бурого цвета. Микроскопически представлена хорошо ограниченными округлыми гнездами крупных бледных семиномоподобных клеток, окруженных мелкими темными вытянутыми клетками стромы полового тяжа, клетки могут формировать палисадообразные структуры по периферии гнезд светлых клеток; обнаруживаются кальцинаты.
В клетках Лейдига, расположенных рядом, могут присутствовать кристаллы Re-inke. Дифференциальная диагностика проводится с узлами клеток Сертоли. Различить эти состояния помогает клиническая картина, макроскопическая характеристика и FISH.
В группу опухолей стромы полового тяжа входят опухоли яичников, содержащие гранулезные клетки, текаклетки, лютеинизирующие производные, клетки Сертоли, клетки Лейдига и фибробласты стромы гонад. Эти опухоли возникают из матрикса яичника и содержат клетки эмбрионального полового тяжа и мезенхимы. Как отдельная группа опухоли стромы полового тяжа наблюдаются в любом возрасте, но увеличение заболеваемости происходит в течение пятой, шестой и седьмой декаджизни.
Эти опухоли составляют примерно 5 % всех новообразований яичников, однако злокачественные опухоли в этой группе составляют только 2 %. В категорию опухолей стромы полового тяжа входит примерно 90 % гормонально-активных опухолей яичников, которые сопровождаются физиологическими и патологическими симптомами избытка эстрогенов и/или андрогенов. Эти проявления выражаются в преждевременном половом созревании изосексуального типа, гирсутизме, маточных кровотечениях, гиперплазии или раке эндометрия (РЭ) и риске РМЖ.
Среди злокачественных опухолей яичников 5—10 % приходятся на опухоли стромы полового тяжа, большинство из которых (70 %) гранулезоклеточные высокодифференцированные с частотой рецидивов 10—33 %. Для опухолей стромы полового тяжа характерны медленный рост и позднее рецидивирование. Последнее происходит в среднем через 5— 10 лет после установления диагноза, а в некоторых случаях — через 20 лет. По данным большинства авторов, 10-летняя выживаемость при I стадии заболевания составляет 90 %, а при III — 0—22 %.
Установленные при многофакторном анализе прогностические факторы, влияющие на выживаемость, — возраст моложе 50 лет, диаметр опухоли менее 10 см и отсутствие остаточной опухоли после хирургического лечения. Стадирование этих опухолей проводят во время лапаротомии в соответствии с рекомендациями FIGO и критериями для рака яичника (РЯ).

Лечение опухолей стромы полового тяжа зависит от результатов полного хирургического стадирования, желания больной сохранить репродуктивную функцию и гистологического типа новообразования.
Большая часть этих опухолей доброкачественные или низкой степени злокачественности, поэтому во многих случаях достаточно одного хирургического лечения. При необходимости сохранения фертильности у пациенток с Iа стадией проводят одностороннюю аднексэктомию с сохранением матки и контралатерального яичника.
При поздних стадиях заболевания и у пациенток старшего возраста проводят полное стадирование и гистерэктомию с двусторонней аднексэктомией. Хотя научное объяснение преимуществ такой тактики отсутствует, большинство авторов при распространенном, метастатическом процессе и объемных опухолях рекомендуют добиваться полной циторедукции, т. е. удалять максимально возможный объем опухолевых масс.
Необходимость повторной циторедуктивной операции спорна, хотя она может способствовать выживаемости или быть паллиативной операцией у пациенток с локальными рецидивами.
Существует две особых клинических ситуации, при которых необходимы дополнительные инвазивные методы обследования. При эстрогенсекретирующих опухолях яичников гиперплазию эндометрия выявляют в 25—50 % случаев, а рак эндометрия (РЭ) — в 5—10 %, поэтому необходимо выскабливание слизистой оболочки матки независимо от доброкачественности или злокачественности первичной опухоли. При диагностике злокачественного процесса в матке проводят соответствующее лечение. Кроме того, при опухолях стромы полового тяжа с кольцевидными трубочками, сочетающихся с синдромом Пейтца—Егерса, может быть обнаружена злокачественная аденома шейки матки, поэтому обязательно выскабливание эндоцервикса.
Несмотря на доброкачественность этих опухолей яичников, необходимо регулярное послеоперационное наблюдение и обследование шейки матки. При ранних стадиях (Iа и Ib) можно ограничиться хирургическим лечением и надеяться на хороший прогноз. Однако при Iс и более высокой стадии заболевания необходима адъювантная терапия — ЛТ или XT. Эффективность ЛТ при опухолях стромы полового тяжа спорна и неизвестна. Несмотря на то что опыт применения XT также ограничен, активной схемой лечения считается ВЕР или VAC. Недавно Brown и соавт. опубликовали результаты, демонстрирующие активность таксанов при этом заболевании: при рецидивных опухолях, размер которых доступен измерению, частота ответов составила 42 %.
Специфическая адъювантная терапия отдельных морфологических вариантов опухоли обсуждается ниже. В следующем исследовании Brown и соавт. сравнили эффективность схемы ВЕР с таксанами при опухолях стромы полового тяжа. Отличий в безрецидивной и общей выживаемости, а также частоте ответов у больных с впервые установленным диагнозом не обнаружили. При рецидивных опухолях, размер которых доступен измерению, схема ВЕР по сравнению с таксанами дала большую частоту ответов (71 vs 37 %), но результаты были статистически незначимыми. Это исследование показало, что ответы коррелировали с наличием производных платины в схеме XT с таксанами. Данный факт подтверждает одинаковую эффективность комбинации одного из препаратов платины с таксанами и стандартной схемы ВЕР при более низкой токсичности первой схемы.
Читайте также:

