Опухоли головы и шеи реабилитация
Специалисты отделения опухолей головы и шеи НМИЦ онкологии имени Н.Н. Петрова подготовили ответы на самые частые вопросы пациентов, проходящих лучевую терапию. Они рассказали, с какими побочными эффектами можно столкнуться во время этого длительного и непростого лечения, как их избежать или облегчить.
Что такое лучевая терапия? В каком случае она назначается?
Лучевая терапия (радиотерапия, облучение) — современный метод лечения с помощью ионизирующего излучения. В качестве ионизирующего излучения в зависимости от видов и задач лучевой терапии могут быть использованы разные виды лучей (рентгеновские или гамма-лучи). Они вызывают сходные биологические эффекты в клетках и тканях, определяя лечебное действие облучения.

Количество полученного облучения называется дозой и измеряется в греях (Гр). Доза облучения при разных типах лучевой терапии назначается индивидуально с учётом многих факторов — особенностей как самого заболевания (вид, стадия, локализация), так и пациента.
Лучевая терапия проводится только при наличии показаний в результате взвешенного решения. При этом специалисты всегда руководствуются важной целью — оказать наилучшую помощь пациенту в лечении его заболевания. Обязательно оцениваются риски и выгоды, устанавливается соотношение пользы и вреда от облучения.
Всегда ли возникают осложнения?
Многие пациенты волнуются, ожидая тяжёлых осложнений от лучевого лечения. Следует помнить, что каждый человек — индивидуален. Нежелательные эффекты могут быть почти незаметными или временными, не все из них будут у конкретного пациента.
Но надо помнить, что как у любого метода лечения, у лучевой терапии есть побочные эффекты. Большинство из них возникает постепенно обычно к концу второй недели облучения. Они делятся на ранние лучевые реакции и поздние лучевые реакции, проявляются в органах, расположенных непосредственно в поле облучения.
Во время лечения могут проявиться тошнота, снижение аппетита, покраснения на коже, потеря концентрации внимания, выпадение волос, слабость и прочее.
Какие осложнения при проведении лучевой терапии у пациентов с опухолями головы и шеи бывают и как с ними справиться?
Проблемы с питанием и потеря веса
Для успешного прохождения лечения необходимо качественно и сбалансировано питаться. Лечение – не время диет для похудения. В этот период организм нуждается в дополнительной энергии для борьбы с болезнью. К сожалению, именно в этот момент возникают побочные эффекты, из-за которых принимать достаточное количество пищи не получается, что и ведёт к потере веса и нарушению работы всех органов и систем организма.
В далеко зашедших случаях приходится прерывать лучевую терапию. Поэтому пациенту необходимо очень внимательно отнестись к своему рациону, количеству и качеству съедаемой пищи в день.
Какие проблемы могут возникать?
Они разные, но встречаются почти у всех:
- снижение или потеря аппетита,
- нарушение вкусовых ощущений и запаха,
- сухость во рту,
- тошнота,
- нарушение глотания,
- боль в ротовой полости.
Что может помочь?
Принимайте пищу дробно. По 6-8 раз в день. Порции должны быть небольшие, а еда негорячая.
Не допускайте длительных перерывов без пищи. Всегда имейте под рукой то, чем можно перекусить.
Не ешьте бесполезной, пустой еды. Каждый кусочек должен нести пользу. Выбирайте высококалорийные продукты, богатые белком.

Переходите на мягкую или измельчённую пищу. Можно самостоятельно использовать блендер.
Не отчаивайтесь, если любимое блюдо перестало быть вкусным, ищите альтернативные варианты. Это временное явление, после лечения вкус еды постепенно вернётся.
Пейте достаточное количество жидкости.
Контролируйте свой вес: взвешивайтесь каждые два дня.
Не употребляйте алкоголь, он раздражает и дополнительно сушит слизистую рта. Алкоголь оказывает общее токсическое действие на организм.
Каждый день необходимо наблюдать за собой. Если наступает момент, когда количество потребляемой пищи и жидкости заметно уменьшилось, а вышеперечисленные советы не помогают, не надо скрывать это от лечащего врача.
В этом случае он назначит дополнительно специализированное питание и инфузионную терапию.
В некоторых ситуациях лечащий врач принимает решение установить назогастральный зонд, и тогда питание происходит через него, а ротовая полость изолируется от контакта с пищей, это даёт возможность сохранить целостность слизистых оболочек в ротовой полости, не происходит травматизация обожжённых тканей. Многие пациенты боятся и всячески избегают этой процедуры, но, по отзывам тех, кому пришлось с этим столкнуться, зонд — это спасение. Как, чем и в каком режиме питаться через зонд обучает медицинская сестра стационара, где пациент проходит лечение.
В некоторых ситуациях пациентам показано формирование гастростомы: при обширном распространении опухоли на шее, при невозможности питаться, когда пища совсем не проходит. Гастростома чаще всего устанавливается эндоскопически, что позволяет избежать травматизации и своевременно начать питание.
Трудности с дыханием
В некоторых ситуациях у пациентов возникает необходимость формирования превентивной трахеостомы. Она нужна в случае, когда пациенту трудно дышать из-за опухоли в области шеи и в ситуации, когда врач понимает, что во время лучевой терапии возникнет отёк мягких тканей, который может привести к удушью.
Одна из частых проблем — это воспалительное или язвенное поражение ротовой полости и, связанная с этим осложнением, боль.
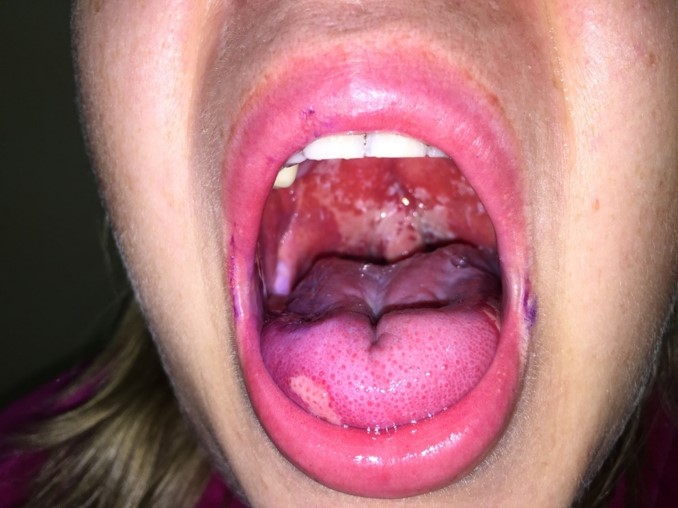
Пациент может заметить уменьшение слюноотделения, изменение вкуса, боль (она может быть острой), жжение, язвочки на слизистой полости рта, затруднение в приёме пищи и глотании.
С самого начала лечения рекомендуется соблюдать тщательную гигиену полости рта:
- использовать мягкую зубную щётку,
- чистить зубы после каждого приёма пищи,
- полоскать ротовую полость физиологическим раствором или другими растворами по назначению врача.
- Необходимо избегать приёма горячей, кислой, раздражающей, грубой пищи, а также горячих напитков.
При развитии вышеперечисленных симптомов лечащий врач назначает соответствующую терапию, в том числе противоболевую, облегчающую возникшее осложнение.
Осложнения со стороны ЖКТ
Запоры являются частой проблемой во время лечения. Причинами могут быть снижение двигательной активности, изменение рациона. Стул должен быть регулярным, ежедневным или через день. При задержке до трёх дней об этом необходимо сообщить врачу.
Диарея — это также осложнение от лечения, о ней обязательно нужно сообщить врачу. Последствия от потери жидкости в организме во время лечения могут быть невосполнимыми, а осложнения очень серьёзными.
Кожные осложнения
Кожные реакции в зоне облучения беспокоят многих пациентов. Лечащий врач назначит специальные средства для ухода за кожей.
Общие рекомендации:
- используйте мягкие, щадящие моющие средства для ежедневной гигиены;
- исключайте любое раздражение: воротнички, украшения, мочалки;
- после умывания высушивайте кожу промакивающими движениями;
- носите одежду с мягкой, свободной горловиной;
- закрывайте кожу от прямых солнечных лучей, используйте солнцезащитные средства SPF50;
- увлажняйте кожу и наносите кремы после сеанса радиотерапии.
Выпадение волос
Выпадение волос — неприятное осложнение, настигающее часть пациентов в процессе лечения.

Общие рекомендации: если выпадение сильное, то необходимо сбрить волосы полностью в парикмахерской. Волосы отрастут. Во время лечения необходимо избегать окрашивания и осветления волос. Для психологического комфорта можно использовать парики, шарфы, банданы или шапочки.
Это наиболее частые проблемы, с которыми может столкнуться пациент, а также способы их решения.
Вот ещё несколько советов, основанных на опыте сопровождения пациентов.
Сопутствующие хронические заболевания. Как их контролировать во время лучевого лечения?
Если у пациента есть хроническое заболевание: гипертония, сахарный диабет, гастрит и т.д., то следует знать, что возможно обострение или изменение его течения. Это может потребовать коррекции дозы принимаемых препаратов. Необходимо быть внимательным к своему самочувствию, аккуратно принимать назначенные лекарства.
Обо всех изменениях своего самочувствия необходимо сообщать лечащему врачу или медицинской сестре.
Что делать курильщикам?
Бесспорно — курение вредно. Необходимо постараться снизить количество выкуриваемых сигарет, а лучше совсем перестать курить.
Полезны ли физические нагрузки во время лечения?
Физические нагрузки должны быть лёгкими и неутомительными. Прогулки полезны и желательны.
Бег, поднятие тяжестей необходимо отложить на потом.
Если у пациента есть хобби: вязание, вышивка, рисование, то желательно взять всё необходимое этих занятий с собой в стационар. Если увлечения нет, то, может быть, стоит попробовать?
Общение, или где найти единомышленников?
Многие согласятся, что очень важно иметь единомышленников, с которыми можно поговорить и обсудить насущные проблемы. В ситуации заболевания единомышленник — это сосед по палате или отделению. Общение, поддержка друг друга, обмен информацией и даже взаимоконтроль помогают лучше и легче перенести лечение. Это доказано опытом.
С другой стороны, соседи по палате могут создавать и проблемы, например, храп! Не стоит пренебрегать берушами для сна. Качественный сон очень важен.

Врачи, медсёстры и другие медицинские работники — это тоже единомышленники пациента. Они рядом и готовы помочь.
Очень важно не замыкаться и не закрываться от окружающего мира.
А если нужна психологическая помощь?
Во многих стационарах есть возможность получить помощь медицинского психолога. Не стоит отказываться, если в этом есть необходимость.
Полезно задать психологу вопросы, которые беспокоят, получить на них ответы и профессиональную психологическую поддержку.
Перед выпиской важно обдумать и записать возникшие вопросы по питанию, обезболиванию, дальнейшему лечению и задать их лечащему врачу. Выписываясь из стационара, пациент должен знать, что ему делать, куда обращаться в той или иной ситуации.
И в завершение пожелание от одного из пациентов НМИЦ онкологии им. Н.Н. Петрова:
2013 год, 58 лет, диагноз рак горла IV стадия. В течение 7 месяцев 6 курсов химиотерапии, 33 сеанса лучевой терапии, не прекращая основной работы, переведя её в дистанционную форму.
2020 год, 65 лет. Работа, хобби.
Авторы:

Медсестринский состав отделения ОГШ
- Ольга Сергеевна Корнеева;
- Наталия Сергеевна Василькова;
- Елена Николаевна Степанова;
- Кабанова Лариса Валерьевна;
- Норочевская Инга Васильевна;
- Полякова Оксана Николаевна;
- Игнашова Надежда Борисовна;
- Верюжская Любовь Николаевна.
![]()

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Реабилитационные мероприятия, их эффективность у онкологических больных зависят, прежде всего, от локализации опухоли, а также от применяемых методов специального лечения и полученных результатов.
Основное место в лечении злокачественных новообразований органов головы и шеи занимают комбинированный и хирургический методы, которые, как правило, вызывают различные косметические и функциональные нарушения (речи, акта глотания и жевания).
Это порождает тяжелые психологические проблемы для больных и особенно остро ставит вопрос об эффективном восстановительном лечении.
Рак гортани
Известно, что применяемые методы лечения рака гортани неизбежно вызывают нарушение или утрату ряда физиологических функций организма, что значительно затрудняет социальную и трудовую реабилитацию.
При раке гортани в подавляющем большинстве случаев лечение начинается с облучения, наиболее эффективного в I-II стадиях заболевания. При этом нередко отмечаются такие осложнения, как эпителиит и эпидермит, по поводу которых проводят местное лечение (полоскание горла антисептиками, смазывание слизистой глотки облепиховым маслом и др., антибиотики).
Почти у всех больных после курса лучевой терапии в течение первых двух лет наблюдается ощущение сухости в горле. Таким больным рекомендуется отказ от курения, приема крепких алкогольных напитков и острой пищи, полоскание горла щелочными растворами, масляные вливания и смазывание слизистой глотки облепиховым маслом. К поздним лучевым осложнениям относится хондроперихондрит гортани, проявляющийся болями в порпе, огрублением голоса, запахом изо рта. сглаженностью контуров гортани и болезненностью при ее пальпации.
Лечение заключается в проведении интенсивной противовоспалительной терапии (антибиотики, анестетики, глюкокортикоиды и нестероидные противовоспалительные препараты — нестероидные противовоспалительные препараты (НПВС), ингаляционная терапия). При нарастании дыхательной недостаточности показана трахеостомия. При отсутствии лечения хондроперихондрит может приводить к стенозу гортани.
Части больных раком гортани выполняется хирургическое вмешательство в объеме резекции или экстирпации органа. Необходимо уже в первые дни после операции привить таким больным навыки по уходу за собой и общению с окружающими. В первую очередь следует обучить их методике извлечения вкладыша трахеостомической трубки, очистки его от слизи, корок и установке в прежнее положение. Позднее больной должен освоить методику полной замены трахеостомической трубки и смены повязки.
У больных, перенесших парингэктомию, часто развиваются хронические бронхолегочные заболевания. Это связано с новыми условиями дыхания, которые способствуют избыточному охлаждению слизистой дыхательных путей, ее высыханию, раздражению пылевыми частицами и различными веществами, поступающими с воздухом через трахеостому.
Поэтому больному следует объяснить меры защиты слизистой оболочки дыхательных путей от внешних воздействий, что уменьшает риск возникновения респираторных заболеваний. Для предупреждения трахеобронхита периодически назначается санирующая ингаляционная терапия с бронхо- и муколитическими препаратами, по показаниям — целенаправленная антибактериальная терапия.
Тяжелым осложнением после частичных резекций или экстирпации гортани является рубцовый стеноз гортани (трахеи, трахеостомы). Лечение рубцовых стенозов хирургическое. При выборе метода следует отдавать предпочтение лазерной эндоскопической хирургии.
После типичных и расширенных ларингэктомий часто возникают глоточные свищи и фарингостомы, что существенным образом удлиняет и затрудняет реабилитацию больных. Небольшие одиночные глоточные свищи, как правило, не препятствуют восстановлению питания через естественные пути, так как во время приема пищи можно закрывать их мягкими обтураторами из поролона.
Если нарушение целости пищепроводного тракта носит стойкий характер, то осуществляют реконструктивно-восстановительные операции (эзофагофарингопластика). Наилучшим пластическим материалом при этих операциях являются кожно-мышечные лоскуты на питающей сосудистой ножке или висцеральные лоскуты на микрососудистых анастомозах (участок тонкой кишки или желудка).
После ларингэктомии важной задачей реабилитации является восстановление звучной речи. Обучение воспроизведению звучной речи обычно осуществляется под руководством логопеда.
Логовосстановительная терапия после экстирпации гортани включает комплекс специальной дыхательной гимнастики, тренировку мышц шеи и глотки для обучения выталкиванию воздуха из полости рта и глотки и формирования псевдоголосовой щели на уровне первого физиологического сужения пищевода, артикуляционную гимнастику для щек, губ, языка с целью активизации артикуляции, необходимой для четкой модуляции воспроизводимых звуков.
Логовосстановительная терапия после ларингэктомии достаточно эффективна и позволяет большинству больных овладеть псевдоголосом и общаться звучной речью в полном объеме.
С целью оптимизации условий для восстановления голосовой функции после ларингэктомии применяют методы реконструктивно-восстановительной хирургии, в том числе с использованием специальных протезов. Наиболее простым методом восстановления речеобразования является использование голосовых аппаратов.
Злокачественные опухоли челюстно-лицевой области
После удаления большинства опухолей челюстно-лицевой области наблюдаются уродующие деформации лица. Дефекты челюстно-лицевой области чрезвычайно разнообразны и зависят главным образом от локализации опухоли, объема оперативного вмешательства, локализации и величины возникшего дефекта <тканевого или костного).
При ликвидации обширных дефектов челюстно-лицевой области (резекция верхней челюсти, ушной раковины, экзентерация глазницы и т.д.) применяется ортопедический способ, при котором восстановление косметических дефектов, нарушенных функций полости рта может быть проведено с помощью временных или постоянных челюстно-лицевых протезов.
В настоящее время ведущим методом реабилитации таких больных является реконструктивно-восстановитепьная и пластическая хирургия. Оптимальным считается выполнение одномоментно с удалением опухоли восстановительных операций.
Раннее замещение обширных дефектов челюстно-лицевой области не только устраняет функциональные и косметические нарушения, но и благотворно влияет на психику больного. Однако надо отметить, что применение восстановительно-реконструктивных операций связано с большими трудностями из-за обширности дефекта и неясности клинического прогноза.
Рак органов полости рта
Оперативные вмешательства по поводу рака языка, дна полости рта, слизистой оболочки щек, мягкого и твердого неба, альвеолярного края нижней и верхней челюсти различны по объему и сопровождаются значительными повреждениями органов речеобразования и последующим нарушением звукопроизношения, ухудшением качества голоса (ринофония).
Логовосстановитепьную терапию у таких больных начинают на 5-7-е сутки после операции с упражнений, активизирующих мимическую мускулатуру и движения губ. Затем, при сохранности или наличии фрагмента нижней челюсти, осваивают упражнения для нее (движения вниз — вперед — назад, влево — вправо) и для нижней губы.
По мере заживления послеоперационной раны приступают к артикуляционной гимнастике для языка. В раннем послеоперационном периоде при нарушениях подвижности мягкого неба и парезе языка наблюдаются дисфагии, которые довольно быстро (в течение 4-5 дней) устраняются соответствующей артикуляционной гимнастикой.
Новообразования мягких тканей шеи
При выполнении хирургических вмешательств по поводу опухолей шеи, легких, щитовидной железы, хемодектомы могут возникнуть парезы и параличи мышц гортани вследствие их травмы, нарушения иннервации гортани при повреждении возвратного нерва, что влечет за собой нарушение дыхательной и голосообразующей функции гортани. Первым симптомом, свидетельствующим о нарушении иннервации гортани, является дисфония (изменение голоса) вплоть до афонии (полной потери голоса).
Дисфонии вследствие парезов и параличей гортани иногда сопровождаются нарушениями подвижности губ, языка, мягкого неба, что приводит к возникновению дислалий (нарушение звукопроизношения) и ринофоний (носовой оттенок голоса).
Дисфонии, возникающие в связи с резекцией возвратного или блуждающего нервов, требуют более длительных логовосстановительных занятий.
Удаление опухолей шеи (особенно парафарингеальной локализации) может также сопровождаться прямым повреждением или контузией вследствие натяжения, сдавления отечными тканями или послеоперационным рубцом подъязычного, языкоглоточного и блуждающего нервов.
Возникающие при этом дисфонии сопровождаются дислалиями и ринофониями. К числу нарушений речи следует отнести нарушения, возникающие вследствие повреждения лицевого нерва во время операции по поводу опухопи околоушной слюнной железы.
Травматизация лицевого нерва приводит к парезу и параличу мимической мускулатуры (несмыкание губ, ограничение их подвижности, нарушение артикулирования губных, в особенности гласных звуков).
Мимико-артикуляционная гимнастика го устранению данных нарушений требует значительного времени. Нормализация эвукопроизношения и акустики речи при парезе ветвей лицевого нерва наблюдается через 7-19 мес от начала лечения.
При стойком параличе мимической мускулатуры выполняют пластические операции (миорезекцию, комбинированную мио- и фасциоппастику, статическое подвешивание парализованных участков частей лица). Кроме того, реабилитация при нейропатиях черепно-мозговых нервов и их отдельных ветвей заключается также в проведении противовоспалительной, дегидратационной, рассасывающей, улучшающей микроциркупяцию терапии, целенаправленной лечебной физкультуры.
После радикального удаления опухолей в систему реабилитационных мероприятий включают электростимупяцию и низкочастотную магнитотерапию.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Голова и шея являются важнейшими областями человеческого тела. Анатомия и физиология органов, расположенных в этой зоне, представляют собой уникальный комплекс. Выполнение основных функций – зрение, речь, жевание, глотание, обоняние – зависят от совместной слаженной работы этих органов. Особенности внешних проявлений личности в наибольшей степени основываются на форме и структуре тканей, образующих лицевые структуры и особенно критично оцениваются как самим человеком, так и окружающими. Исходя из этого, целью специального лечения опухолевой патологии органов головы и шеи является не только избавление пациента от заболевания, но и сохранение или восстановление качества жизни. Этот подход реализуется посредством проведения лечения, сохраняющего форму и функцию пораженного органа.
Кроме того, необходимо минимизировать отрицательные последствия лечения и, по возможности, предупредить появление второй опухоли, что включает в себя тщательное последующее наблюдение за больным и прекращение приема алкоголя и курения. Это особенно важно для больных, у которых болезнь диагностирована на ранней стадии, так как они имеют больший шанс умереть от второй злокачественной опухоли, чем от первой. Лечение злокачественных новообразований головы и шеи требует мультидисциплинарного подхода, сотрудничества врачей различных специальностей: хирурга-онколога, радиолога, химиотерапевта, рентгенолога, эндоскописта, стоматолога, патоморфолога, цитолога, а также врачей некоторых других специальностей, каждый из которых участвует в установлении диагноза, оценке степени распространения опухоли, выработке тактики лечения и его проведении. В общей структуре онкологической заболеваемости злокачественные опухоли головы и шеи составляют около 20%. Это означает, что ежегодно в России регистрируются более 80 тыс. больных с данной патологией.
В настоящее время принято считать, что большинство злокачественных новообразований являются следствием последовательного накопления генетических повреждений, которые приводят к появлению и росту клона трансформированных клеток. Предполагается, что для развития злокачественного фенотипа требуется несколько не связанных между собой генетических событий. Статистический анализ выявил, что для развития злокачественной опухоли в области головы и шеи должны произойти от 6 до 10 таких генетических событий, и на это требуется период около 20–25 лет. В течение этого времени осуществляется воздействие канцерогенов, прежде всего, табачного дыма и алкоголя, которые являются преимущественной причиной генетических повреждений, необходимых для развития рака головы и шеи. Факторы, влияющие на выбор варианта лечения первичной опухоли органов головы и шеи, связаны с характеристиками опухоли, состоянием пациента, уровнем развития медицинской помощи.
Наиболее важные факторы опухоли, влияющие на выбор тактики лечения:
– локализация (для опухолей полости рта имеет значение близость к нижней или верхней челюсти, расположение опухоли в передних или задних отделах);
– распространенность первичной опухоли (стадия опухолевого процесса, наличие и распространенность регионарных метастазов, отдаленное метастазирование);
– предшествующие оперативные вмешательства и лучевая терапия;
– наличие синхронных вторых злокачественных опухолей.
В связи с увеличением периода наблюдения за больными после лечения по поводу рака головы и шеи увеличивается возможность развития вторых опухолей. Частота диагностики вторых опухолей при первичной локализации новообразования в области головы и шеи составляет от 4% до 38% в зависимости от локализации. Наибольшая частота отмечена при раке гортаноглотки. Хорошо известна возможность развития вторых злокачественных опухолей полости рта на фоне диспластических изменений слизистой оболочки в виде эритроплакий и лейкоплакий, особенно на фоне сочетанного злоупотребления табаком и алкоголем, после излечения первой опухоли; – гистологическая форма опухоли.
Морфолог в этом случае является ключевой фигурой в команде специалистов, занимающихся лечением опухолей головы и шеи. Своевременная и точная диагностика новообразований является необходимой предпосылкой успешного лечения. Трудности в распознавании патологических процессов в области головы и шеи определяют высокий процент (50–70%) ошибок при первичной клинической диагностике. Большое разнообразие гистологических форм опухолей, а также сходство их клинических проявлений с неопухолевыми заболеваниями вызывает необходимость морфологического подтверждения характера поражения. Анатомотопографические особенности органов головы и шеи не всегда позволяют выполнить биопсию и взять достаточное количество материала для патоморфологического исследования.
Существует целый ряд опухолей, локализующихся в области головы и шеи, при которых выполнение биопсии сопряжено с целым рядом технических трудностей, и порой является попросту нежелательным. Это относится к опухолям щитовидной и слюнных желез, опухолям челюстей и верхнечелюстной пазухи, опухолям кожи, в частности к меланоме, внеорганным опухолям кожи, метастазам в лимфатические узлы шеи. В этих случаях большую помощь клиницистам оказывает тонкоигольная пункция с последующим цитологическим исследованием. Метод технически прост, безопасен. Результативность метода во многом определяется правильным учетом его возможностей и квалификацией врача-цитолога. В целом процент правильной цитологической диагностики для опухолей головы и шеи колеблется от 40% до 90%.
Для наиболее распространенных форм новообразований.
Базалиомы, плоскоклеточного рака кожи, слизистой оболочки полости рта, гортани, щитовидной, слюнных желез, опухолей полости носа и носоглотки – он составляет от 87,5% до 92,8%, для мягкотканных опухолей – 76,3%, опухолей костей верхней и нижней челюсти – 56,8%; при метастазах в лимфатические узлы шеи из невыявленного первичного очага в 68,6% случаев определить органную принадлежность опухолевых клеток не представляется возможным.
Помимо установления природы опухолевых изменений (определение злокачественности), метод дает возможность оценить распространенность злокачественного процесса, наличие метастазов, констатировать прорастание первичной опухоли в соседние органы и ткани. В современной клинической практике особое значение приобретают прицельные диагностические пункции под контролем ультразвукового исследования и компьютерной томографии, а также цитологическое исследование материала, взятого в процессе лечения (лучевая терапия, лекарственное лечение, фотодинамическая терапия), для оценки его эффективности. Факторы, обусловленные состоянием пациента: – возраст; – общее состояние; – профессия; – желание самого больного. Уровень развития медицинской помощи включает в себя опыт и мастерство врачей данной клиники в области хирургического лечения опухолей головы и шеи, лучевой терапии, химиотерапии, реабилитации и пластической хирургии, челюстнолицевой хирургии, нейрохирургии.
Для успешного окончания лечения необходимы также:
Психосоциальная, эмоциональная поддержка, профессиональная реабилитация и помощь в трудоустройстве. В большинстве случаев при раке головы и шеи выбор варианта лечения первичной опухоли и регионарных метастазов лежит между лучевой терапией, операцией или их комбинацией. Химиотерапия играет в основном вспомогательную роль. Вместе с тем комбинация препаратов платины и 5-фторурацила, показав высокую эффективность сначала при лечении рецидивов рака головы и шеи, а затем – в качестве индукционной терапии, стала основным методом лечения рака головы и шеи. Высокая частота полных и частичных клинических ответов после неоадъювантной химиотерапии позволяет в ряде случаев достичь увеличения безрецидивной и общей выживаемости, а иногда и сохранения пораженного органа. При ограниченном опухолевом поражении, соответствующем символам Т1–Т2, высокий процент излечения может быть получен при проведении какого-либо одного лечебного воздействия.
При раке складочного отдела гортани Т1N0М0.
Проведение хирургического лечения (резекции гортани) и лучевой терапии в режиме гиперфракционирования позволяют добиться безрецидивной выживаемости соответственно в 96,3% и 90,6%. При ограниченных опухолях языка и голосовых складок возможно также проведение лазерной эксцизии, что позволяет сохранить функцию органа и обойтись без лучевой терапии или отсрочить ее проведение до появления рецидива опухоли.
У больных раком складочного отдела гортани.
И ограниченными формами рецидива рака эндоскопическая лазерная деструкция опухоли эффективна у 81,8% и 60% больных соответственно и может быть рекомендована как метод выбора при невозможности проведения хирургического или лучевого лечения. При более распространенных опухолевых процессах первичного и рецидивного рака гортани с вовлечением комиссуральной области и/или вестибулярного отдела и/или подскладочного отдела эндоларингеальная лазерная деструкция может быть применена с условнорадикальной или паллиативной целью, так как в 91% случаев диагностирован продолженный рост опухоли.
При местнораспространенных опухолевых процессах (Т3–Т4) более высокие результаты достигаются при комбинированном лечении. При сочетании операции и послеоперационной лучевой терапии показатели безрецидивной выживаемости выше. Но бывают и исключения. Так, по данным J.T. Parsons и соавт., при местнораспространенном раке ротоглотки и полости носа проведение лучевой терапии и комбинированного лечения дает сходные результаты безрецидивной выживаемости, но при большем числе осложнений в случае проведения оперативного вмешательства. При выявлении двух или даже трех первичных новообразований в зоне, которая может быть подвергнута как хирургическому, так и лучевому лечению (например, ротоглотка или надскладочный отдел гортани), предпочтение следует отдавать лучевому методу, так как лечебному воздействию подвергается достаточно большая область слизистой оболочки и регионарных зон лимфооттока с двух сторон.
Наиболее частая причина для назначения предоперационной лучевой терапии – сомнения в резектабельности первичной опухоли. В случае чувствительности новообразования к лучевому воздействию имеется возможность проведения оперативного вмешательства в пределах здоровых тканей. Большой объем опухоли и ограниченная смещаемость регионарных метастазов также являются показанием для проведения предоперационной лучевой терапии. Применение терморадиотерапии при местнораспространенных регионарных метастазах плоскоклеточного рака головы и шеи по сравнению с лучевой терапией достоверно увеличивает частоту полных регрессий метастатических узлов до 30% и повышает частоту резектабельности опухолевых узлов, что позволяет провести радикальное оперативное вмешательство.
Лучевая терапия на первом этапе комбинированного лечения
Проводится в случае, когда планируется одномоментная реконструктивная операция, например, пластика желудочным стеблем либо свободным тонкокишечным трансплантатом после ларингэктомии с резекцией гортаноглотки, либо использование титановых реконструктивных пластин для возмещения дефекта нижней челюсти при сегментарной резекции. Еще одной причиной назначения предоперационной лучевой терапии является стремление сократить объем оперативного вмешательства за счет уменьшения размеров опухоли в случае достижения противоопухолевого эффекта, что позволяет в ряде случаев избежать отрицательных последствий комбинированных операций в виде косметических и функциональных нарушений. Примерами данной лечебной тактики могут быть местнораспространенные опухоли языка, при которых проведение лучевой терапии в объеме 50–60 Гр приводит к выраженной регрессии опухоли, что позволяет в дальнейшем выполнить резекцию остаточной опухоли.
Тот же подход имеет место при распространенном раке слизистой оболочки полости носа с поражением верхней челюсти: предоперационная лучевая терапия позволяет в дальнейшем выполнить резекцию верхней челюсти. В то же время, по данным А.А. Уварова и P.P. Kumar и соавт., при распространенных опухолях полости рта с язвенно-инфильтративной формой роста, сопровождающихся болевым синдромом и нарушением процесса приема пищи, на первом этапе лечения показано выполнение оперативного вмешательства с последующей лучевой терапией. Проведение последней в условиях опухолевой интоксикации и дисфагии приводит к ранним лучевым реакциям с обострением болевого синдрома, и в итоге не всегда удается завершить первый этап лечения. Двухлетняя безрецидивная выживаемость у данной группы пациентов составляет 65,3%.
При стенозирующей форме рака гортани Т3–4N0М0
Наиболее эффективен хирургический метод при условии выполнения расширенной ларингэктомии с послеоперационной лучевой терапией. В этом случае 5-летняя выживаемость составляет 70,6% при распространенности опухоли Т3N0М0 и 46,1% при Т4N0М0. Доза предоперационной лучевой терапии обычно составляет 45–50 Гр. При сомнении в резектабельности опухоли возможно увеличение дозы облучения на область наибольшего опухолевого поражения до 65–70 Гр в зависимости от ответа на проводимое лечение. Основная проблема при проведении предоперационной лучевой терапии связана с увеличением числа послеоперационных осложнений, таких как нарушение заживления раны, нагноение, формирование свищей, оростом. Риск послеоперационных осложнений может быть снижен за счет уменьшения зоны облучения после дозы 45 Гр.
При выполнении комбинированных операций использование различных вариантов лоскутов с осевым сосудистым рисунком, взятых вне зоны лучевой терапии, также позволяет снизить число послеоперационных осложнений. В случае, когда оперативное вмешательство выполняется на первом этапе комбинированного лечения, предрасполагающими факторами развития локорегионарного рецидива являются наличие клеток опухоли по линии резекции и экстракапсулярное распространение метастаза в лимфатическом узле. Поскольку возможность радикального повторного вмешательства в случае рецидива низка, а при его выполнении объем операции, возможные побочные эффекты и осложнения значительно выше, то при высоком риске рецидива заболевания показано проведение послеоперационной лучевой терапии.
Дополнительным показанием для лучевой терапии на втором этапе лечения:
Являются близость края опухоли к линии резекции (
Читайте также:

