Опухолевые маркеры при герминогенных опухолях яичка
Герминогенные опухоли, что это такое?
Большая часть герминогенных опухолей возникает внутри гонад. Внегонадные опухоли встречаются значительно реже, это опухоли забрюшинного пространства, переднего средостения и центральной нервной системы.
Развитие герминогенных опухолей связано с аномалиями миграции зародышевых клеток в процессе развития эмбриона.
Большая часть этих опухолей диагностируется в пределах относительно узкого возрастного интервала: 25 — 35 лет.
Герминогенные опухоли относятся к достаточно редким заболеваниям и составляют около 1% от всех злокачественных опухолей у мужчин. Более 90% герминогенных опухолей у мужчин представлены новообразованиями яичка, т.е. могут быть отнесены к опухолям наружной локализации, доступным осмотру и пальпации.
На момент постановки диагноза большинство пациентов имеют распространенный процесс (IIC – III ст.): до 60% больных.
Классификация Всемирной Организации Здравоохранения (ВОЗ) подразделяет герминогенные опухоли на 3 категории:
- новообразования новорождённых и раннего детского возраста. К ним относят тератомы и опухоли желточного мешка. Они могут располагаться в яичках, яичниках, забрюшинном пространстве, средостении, головном мозге.
- новообразования яичка, которые возникают между 15 и 40 годами, и подразделяются на семиномы и несеминомы.
- сперматоцитные семиномы (пациенты старше 50 лет). В отличие от опухолей 1 и 2 типов, источником новообразования являются не эмбриональные зародышевые клетки, а более зрелые – сперматогонии и сперматоциты.
Вероятность возникновения герминогенных опухолей яичек увеличивается при крипторхизме (неопущении яичка в мошонку), травмах, инфекционных заболеваниях.
В группе риска находятся пациенты с различными генетическими заболеваниями.
Виды герминогенных опухолей
В зависимости от морфологической картины, клинического течения герминогенные опухоли делятся на семиномные и несеминомные опухоли. Семиномные опухоли составляют около 40%, несеминомные – 60%. Тактика лечения и прогноз различны в двух этих группах.
Семиномы характеризуются довольно вялым течением, долгое время человек не ощущает никаких симптомов болезни. Эти опухоли хорошо поддаются лечению: они чувствительны к лучевой терапии и особенно к химиотерапии.
При запущенном процессе наблюдается, как правило, лимфогенное метастазирование в забрюшинные лимфоузлы, реже в средостенные и надключичные лимфоузлы.
К данным опухолям относят следующие морфологические подтипы:
- внутрипротоковая герминогенная неоплазия неклассифицированного типа (carcinoma in situ); семинома с клетками синцитиотрофобласта;
- сперматоцитарная семинома;
- сперматоцитарная семинома с саркомой;
- эмбриональный рак;
- опухоль желточного мешка;
- трофобластические опухоли:
- хориокарцинома;
- монофазная хориокарцинома;
- трофобластическая опухоль места крепления плаценты;
- тератома:
- дермоидная киста;
- монодермальная тератома;
- тератома с соматической малигнизацией;
- смешанные опухоли.
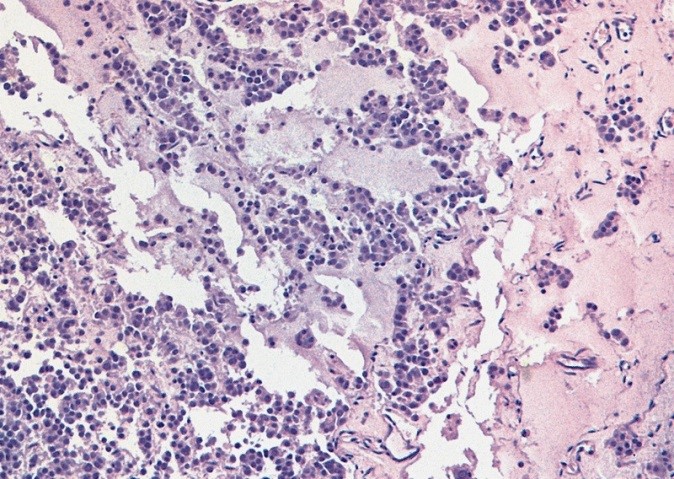
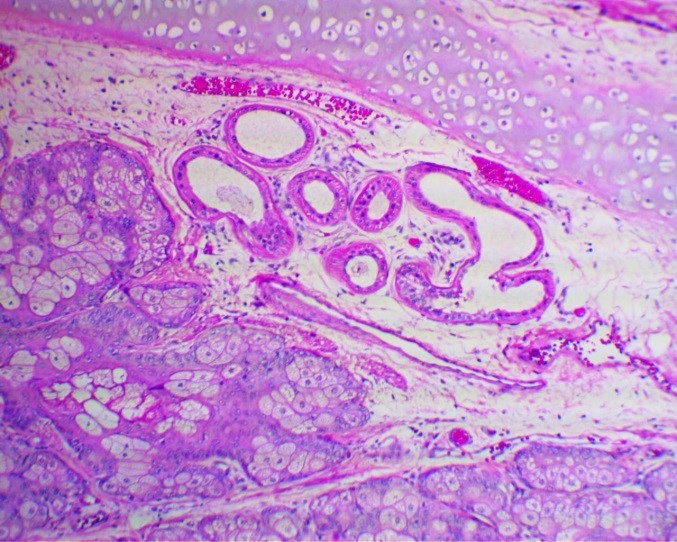
Микропрепарат, тератома яичника
Симптомы и первые признаки герминогенных опухолей
Опухоли яичка в ранних стадиях не сопровождаются болями или другими неприятными симптомами, в связи с чем долгое время не возникает стимулов для обращения к врачу.
Чаще всего пациенты приходят с жалобами на увеличение яичка, боль в мошонке, увеличение лимфоузлов. При распространенности процесса появляются симптомы интоксикации, например, слабость, снижение веса, отсутствие аппетита.
Когда опухоль располагается в средостении, особенности при ее больших размерах, пациента будут беспокоить жалобы на кашель, одышку, боли в груди, невозможность выполнять без усилия привычную физическую активность, возможна отечность шеи, синюшность кожных покровов.
Могут возникать шум в голове/ушах, ухудшение зрения, головная боль, сонливость. Это объясняется тем, что растущая опухоль давит на верхнюю полую вену.
Опухоли забрюшинного пространства обычно также не дают о себе знать длительное время. На них могут указывать такие симптомы, как нарушение стула и мочеиспускания, боли в животе, варикозное расширение вен, а также отеки.
Герминогенные опухоли центральной нервной системы (головного мозга) имеют следующие клинические проявления: головная боль, расстройство движений глазных яблок, тошнота, рвота и развитие судорог.
Диагностика герминогенных опухолей
Стандартом диагностики герминогенных опухолей является физикальный осмотр пациента, сбор анамнеза и анализ крови на биологические опухолевые маркеры. К ним относятся АФП (альфа-фетопротеин), β -ХГЧ (β единица хорионического гонадотропина человека) и ЛДГ (лактатдегидрогеназа).
В качестве уточняющих исследований проводится КТ органов брюшной полости и грудной клетки, либо УЗИ органов брюшной полости и рентгенография грудной клетки в двух проекциях.
Также выполняют МРТ головного мозга, чтобы выявить наличие метастазов в нем.
Орхофуникулэктомия — удаление яичка, выполняется с диагностической и лечебной целью.
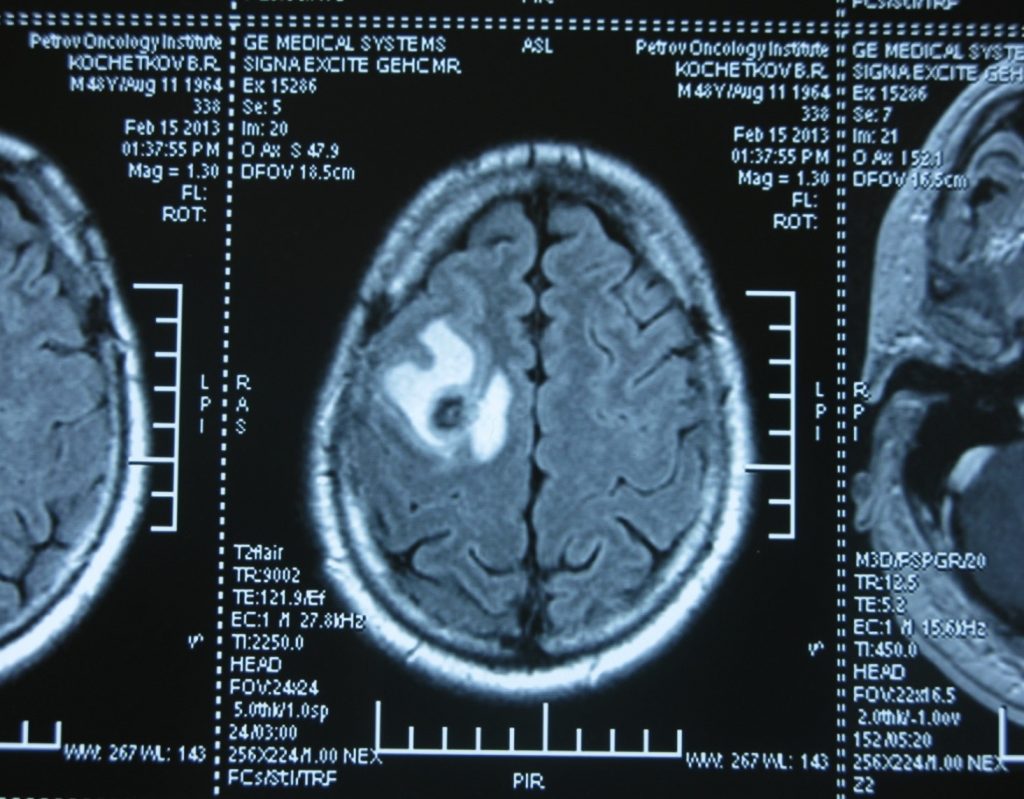
Метастаз в головной мозг при герминогенных опухолях (МРТ головного мозга)
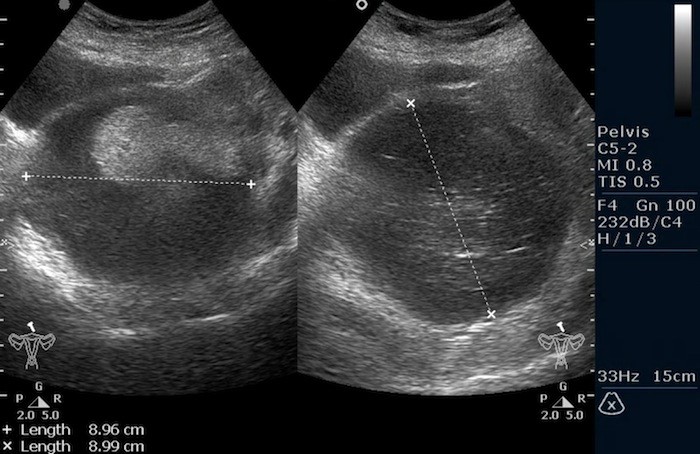
Тератома яичника (УЗИ малого таза)
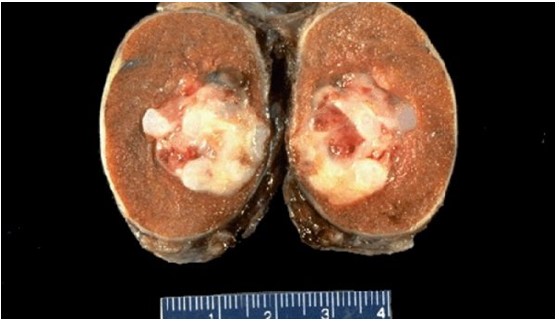
Герминогенная опухоль яичка (макропрепарат)
Стадии герминогенных опухолей
Для выработки индивидуального плана лечения учитываются классификации TNM, а также классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG).
Стадирование герминогенных опухолей в соответствии с классификацией ТNМ
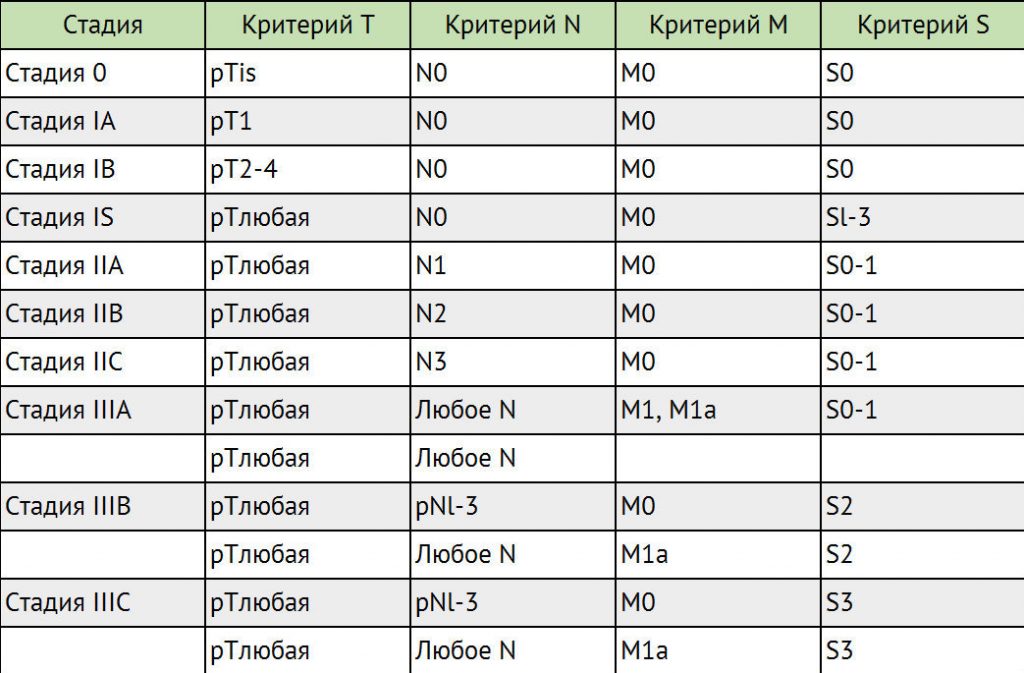
Для герминогенных опухолей IV стадия заболевания не предусмотрена.
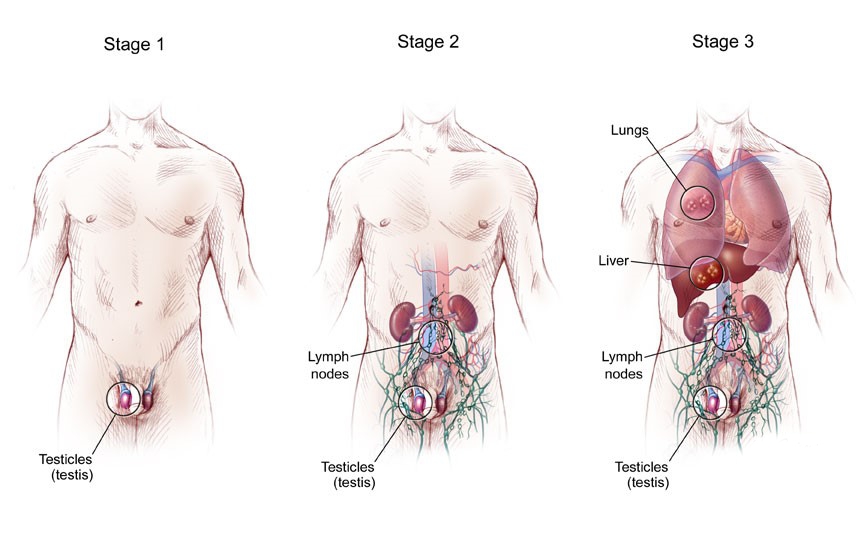
Методы лечения герминогенных опухолей
К настоящему времени в онкологической практике накоплен большой научно-практический материал, разработаны стандарты и международные рекомендации по лечебной тактике больных герминогенными опухолями.
При герминогенных опухолях проводится, как правило, комплексное лечение, которое включает в себя хирургическое лечение, системное противоопухолевое лечение, реже лучевую терапию.
Метод лечения основывается на морфологическом типе опухоли, группе прогноза и стадии заболевания.
Большинство больных герминогеными опухолями добиваются излечения даже при распространенной форме заболевания, когда процесс не ограничен только первичной опухолью. Наиболее эффективная схема лечения – это химиотерапия с последующим удалением остаточных опухолевых очагов.
Хирургические методы:
- орхфуникулэктомия
- забрюшинная лимфаденэктомия,
- удаление легочных метастазов и пр.
Лучевая терапия назначается чаще при поражении головного мозга. Ее применение обусловлено возможностью точного локального воздействия на опухолевые массы.
Химиотерапия
Следует отметить, что при проведении системного лекарственного лечения необходимо строгое соблюдение временных рамок (начало очередного цикла проводится на 22 день).
Для оценки эффективности химиотерапии каждые 2 цикла и после ее окончания проводится компьютерная томография исходных зон поражения, перед каждым циклом мониторинг уровня опухолевых маркеров. Рост маркеров на фоне лечения или после его завершения, а также замедление их снижения свидетельствует об активности опухолевого процесса и необходимости проведения второй линии химиотерапии.
Перед проведением химиотерапии рекомендуется обдумать и решить вопрос о необходимости криоконсервации спермы.
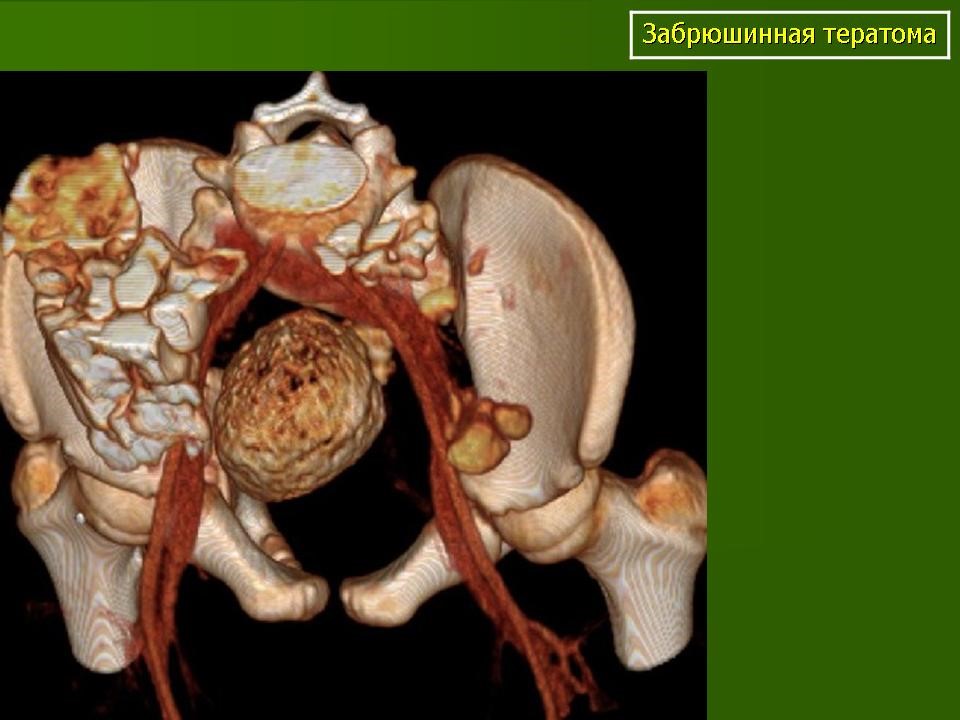
Забрюшинная тератома (3D реконструкция)
Контроль эффективности лечения и динамическое наблюдение.
Перед началом каждого цикла химиотерапии проводится контроль онкомаркеров (АФП, ЛДГ, ХГЧ).
Обязательный принцип динамического наблюдения за больными герминогенными опухолями — строгое соблюдение временных промежутков при выполнении контрольного обследования. Первый год после лечения необходимо проходить обследование каждые два месяца, а на второй год – раз в три месяца.
Следующие два года нужно обследоваться сначала каждые четыре месяца, затем каждые шесть месяцев. И далее планируется ежегодный поход к врачу.
Перечень обследований рекомендованных к выполнению в период динамического наблюдения: физикальный осмотр, кровь на маркеры (АФП, ЛДГ, ХГЧ), УЗИ пахово-подвздошных областей, брюшной полости и забрюшинного пространства, рентгенография органов грудной клетки каждые 6 месяцев.
Прогноз выживаемости
Благодаря успехам в развитии химиотерапии, герминогенные опухоли стали ярким примером курабельных солидных опухолей. Пятилетняя выживаемость больных герминогенными опухолями составляет от 60 до 90%.
Классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG), основанная на прогностических факторах
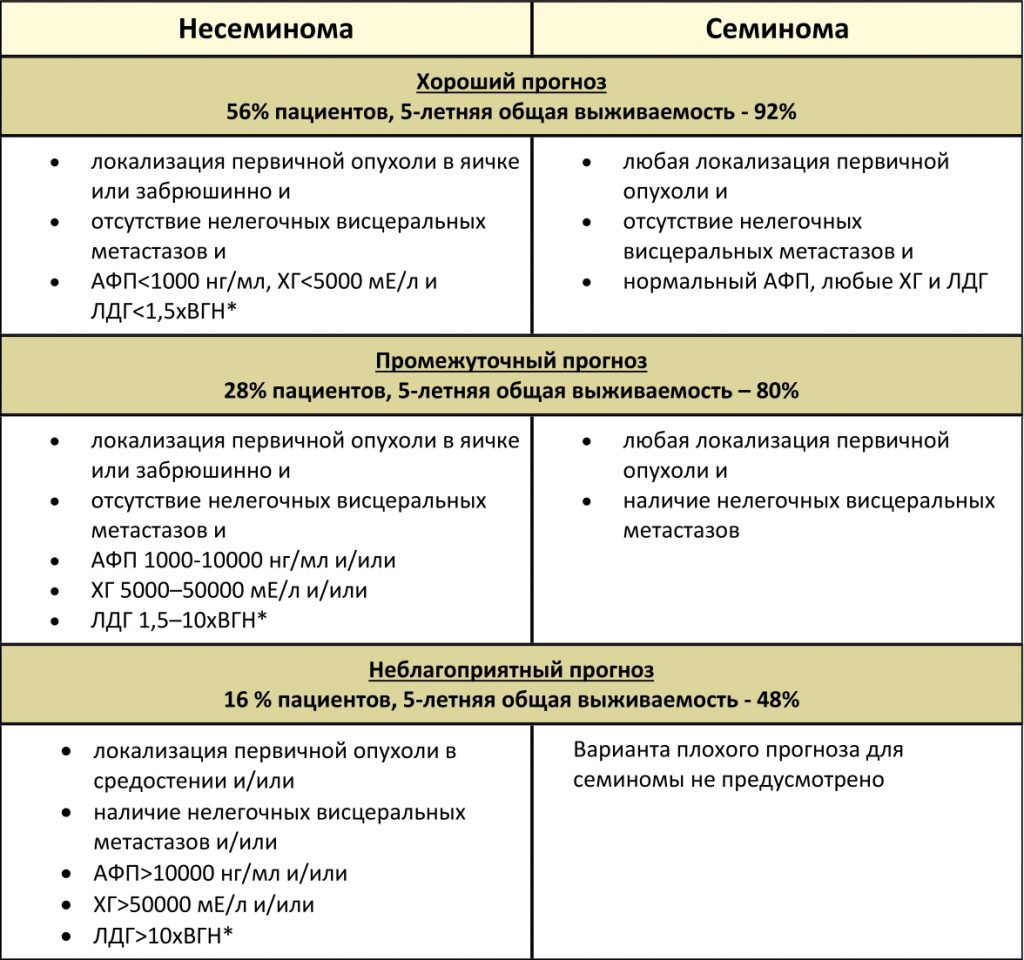
*ВГН – верхняя граница нормы.


- ХГЧ (хорионический гонадотропин, бета-ХГЧ)
- АФП (альфафетопротеин)
- ЛДГ (лактатдегидрогеназа)
Материал подготовлен врачами лабораторий ЦИР
Рак яичка — это злокачественная опухоль, развивающаяся из тканей яичек. При этом в ткани яичка появляются злокачественные клетки, которые интенсивно размножаются.
Яички (гонады) – парные мужские половые железы. В них образуются сперматозоиды. Яичко состоит из множества оболочек, которые образованы различными тканями. Из каждой представленной ткани могут возникать опухоли, этим и объясняется многообразие злокачественных опухолей яичка.
Опухоли яичек разделяют на две большие группы:
- Герминативные - возникающие из эпителиальной ткани яичка: семинома, эмбриональный рак, хорионэпителиома, тератобластома и другие - они составляют 95 % всех опухолей;
- Негерминативные - возникающие из так называемой стромы яичка: лейдигома, сертолиома, саркома.
Причины возникновения опухолей яичка до сих пор точно не определены. Можно выделить три группы основных факторов риска, увеличивающих вероятность формирования рака яичка. Наличие одного или нескольких факторов риска еще не означает, что возникновение рака неизбежно. У некоторых больных раком яичка не наблюдалось никаких факторов риска.
К первой группе относятся эндокринные факторы, которые действуют непосредственно на плод во время внутриутробного развития гонад. Это, в основном, эстрогены и эстрогеноподобные вещества. Например, токсикоз беременных, перенесенный матерью в результате гиперсекреции эстрогенов, или продолжительный прием эстрогенов во время беременности повышают риск возникновения рака яичка у сыновей. Загрязнение пестицидами окружающей среды, повышающее дозу эстрогенов в потребляемых продуктах, воде также ассоциировано с повышением заболеваемости раком яичка.
Ко второй группе факторов следует отнести факторы, приводящие к атрофии яичка, то есть к прекращению его нормального развития вследствие нарушения питания и т.п. Наиболее часто к атрофии яичка приводят химические факторы, травмы, инфекционные заболевания, крипторхизм. Неопустившееся в мошонку яичко увеличивает возможность заболеть раком яичка в 5 раз по сравнению с мужской популяцией. Риск становится значительно выше (более, чем в 10 раз) у мужчин с двухсторонним крипторхизмом. Повышать риск рака яичка могут также врожденные аномалии яичек, полового члена, паховая грыжа Существует также идиопатическая атрофия яичка, причину которой не удается установить. Результатом атрофии яичка является снижение выработки им тестостерона и как следствие повышение уровня ЛГ и ФСГ в крови, приводящее к повышению частоты деления клеток яичка и увеличению в них количества мутаций.
К третьей группе относятся генетические факторы риска. Существуют семейные случаи рака яичка. Родство увеличивает вероятность заболеть раком яичка для отцов и сыновей больных в 2-4 раза, а для братьев - в 8-10 раз по сравнению с мужской популяцией.
Клиническая картина опухоли яичка складывается из симптомов, обусловленных наличием первичной опухоли, и метастазов.
Наиболее частым симптомом рака яичка является появление опухолевого образования в мошонке. Оно может быть безболезненным, но может вызывать дискомфорт. Больной может жаловаться на припухлость яичка. В яичке может ощущаться боль, дискомфорт или ощущение тяжести в мошонке.
У больного раком яичка возможно ощущение тяжести или боли в животе или мошонке. При наличии метастазов появляются симптомы, отражающие сдавление или нарушение функции пораженного метастазами опухоли органа. Так, например увеличение забрюшинных лимфоузлов приводит к сдавлению корешков нервов и проявляется болями в спине. Сдавление нижней полой вены и блокада лимфатических путей влекут за собой появление отеков нижних конечностей. Нарушение оттока мочи по мочеточникам, вызванное их сдавлением, может привести к развитию почечной недостаточности. Следствием значительного увеличения забрюшинных лимфоузлов может являться кишечная непроходимость. Из других симптомов рака яичка следует отметить увеличение грудных желез, их болезненность; рост волос на лице и туловище до периода полового созревания. При наличии любых признаков следует сразу же обратиться к врачу.
Диагностика новообразований яичка осуществляется с помощью пальпации и ультразвукового исследования органов мошонки, компьютерной томографии (КТ) органов брюшной полости, забрюшинного пространства и грудной полости и определения уровня опухолевых маркеров сыворотки крови, биопсии.
Опухолевые маркеры - это высокомолекулярные соединения, определяемые в крови, в моче или на поверхности клеток, идентификация и определение уровня которых используется в диагностике или планировании лечения. Онкомаркер позволяет дифференцировать злокачественную опухоль от доброкачественной на основе количественных отличий в содержании соответствующего антигена - опухолевого маркёра в сыворотке крови вне зависимости от локализации опухолевого очага. Повышенный уровень маркёров обнаруживается уже при малых размерах опухоли.
АФП (альфафетопротеин) - гликопротеин, в норме он секретируемый желточным мешком, печенью и желудочно-кишечным трактом плода. У детей старше года и взрослых верхняя граница нормы концентрации АФП в сыворотке крови составляет 15 мг/мл. В новообразованиях яичка источником АФП являются элементы эндодермального синуса.
Свободная бета-субъединица ХГЧ. ХГЧ - гликопротеин в норме синтезируется в синцитиотрофобласте плаценты. У мужчин и небеременных женщин повышение концентрации ХГ является достоверным признаком злокачественного роста. Повышение уровня ХГЧ может быть обусловлено наличием рака яичка. Концентрация ХГ, равная 1 Ед/л, соответствует 10 000 опухолевых клеток.
ЛДГ (лактатдегидрогеназа) — фермент, вырабатываемый гладкой, поперечнополасатой и сердечной мышцами, а также рядом других тканей. Определение данного маркера информативно только в комплексе с другими показателями. Повышение ЛДГ только более 2000 Ед/л можно считать реальным признаком опухоли.
Определение уровня опухолевых маркеров позволяет диагностировать опухоль яичка на ранней стадии или выявить ее внегонадную локализацию, уточнить гистологическое строение опухоли, помогает определить тактику лечения и оценить его эффективность, способствует раннему выявлению рецидивов опухоли и помогает составить прогноз заболевания. Использование АФП, ХГ и ЛДГ в дополнение к комплексному обследованию повышает диагностическую чувствительность как в отношении герминогенных опухолей. Повышение концентрации АФП и ХГ может свидетельствовать о прогрессировании заболевания за 1-6 месяцев до клинического появления рецидива и служит основанием для начала лечения.
Лечение
Первым этапом лечения всех опухолей яичка является оперативное удаление яичка с семенным канатиком. Дальнейшая тактика лечения определяется гистологическим строением, уровнем опухолевых маркеров до и после операции, стадией заболевания.
Сохранение фертильности больными, получающими лечение по поводу опухолей яичка, является существенным вопросом. Соответствующую информацию о состоянии репродуктивной функции и процессе сперматогенеза позволяет получить такое исследование, как спермограмма, т.е результат исследования физических свойств эякулята, морфологии и подвижности сперматозоидов. Эякулят представляет собой совокупность сперматозоидов, клеток сперматогенеза, лейкоцитов и секрета дополнительных половых желез (спермоплазмы). У больных герминогенными опухолями яичка до начала лечения с высокой частотой выявляется олиго- и азооспермия, то есть уменьшение концентрации сперматозоидов или их отсутствие в эякуляте соответственно. Эти нарушения происходят, главным образом, в связи с повышением уровня ФСГ (фолликулостимулирующего гормона), обуславливающего длительные изменения сперматогенеза. Если азооспермия сочетается с высокой концентрацией ФСГ (фолликулостимулирующего гормона), риск полной потери фертильности очень высок. Кроме того, повышение уровня ХГ при опухолях яичка вызывает увеличение выработки эстрадиола, который сильно подавляет сперматогенез.
Необходимо отметить, что подавляющее число больных опухолями яичка восстанавливают фертильность в ближайшие годы после окончания лечения и способны стать отцом самостоятельно или путем искусственного оплодотворения.
Необходимо ли дальнейшее обследование?
После лечения необходимо регулярное обследование. Как и при любом раковом заболевании возможет рецидив. Мужчина должен регулярно проходить обследование у врача, сдавать анализы крови на онкомаркеры (желательно комплексно – панель онкомаркеров для мужчин), проходить УЗИ, КТ.
Самообследование яичек
Лучшее время для выполнения самообследования - во время или после ванны или душа, когда кожа мошонки расслаблена. Чтобы выполнить осмотр, мужчины должны пропальпировать каждое яичко отдельно мягко между большим пальцем и остальными пальцами. Регулярная пальпация позволит вовремя заметить изменение консистенции, размера, формы.
З.Г.Кадагидзе, В.М.Шелепова, А.В.Соколов
Российский онкологический научный центр им. Н.Н.Блохина РАМН, Москва
Общеизвестно, что за последние 15 лет достигнуты большие успехи в лечении трофобластических неоплазм и герминогенных опухолей. В онкологических центрах, специализирующихся на лечении этих заболеваний, частота излеченности больных превышает 90%. Главными причинами наблюдаемого значительного прогресса являются, наряду с внедрением новых лекарств — цисплатина, VP16-213 и др., — также и рациональное использование опухолевых маркёров.
Наиболее информативными при герминогенных опухолях считаются a-фетопротеин (АФП) и хорионический гонадотропин человека, b-субъединица (b-ХГЧ).
АФП представляет собой гликопротеин с молекулярной массой 70 кД. Он является физиологическим продуктом желточного мешка, печени и желудочно-кишечного тракта плода. Повышенный уровень сывороточного АФП у пациентов с герминогенными опухолями яичка был впервые обнаружен Абелевым в 1997 г. В герминогенных опухолях АФП продуцируется элементами эндодермального синуса (желточного мешка). У детей старше года, как и у взрослых, сывороточный АФП имеет верхнюю границу нормы 15 нг/мл (
10kE/л). Его концентрация может быть повышенной при доброкачественных заболеваниях печени и некоторых злокачественных новообразованиях. Наиболее часто повышенные уровни наблюдаются при герминогенных опухолях и гепатоклеточной карциноме, но иногда также — при раке желудка, кишечника, желчного пузыря, поджелудочной железы и лёгких (приблизительно у 20% пациентов). Полупериод жизни сывороточного АФП после орхэктомии составляет 4-5 дней.
В клинической практике эти маркёры используются для диагностики, мониторинга и прогноза герминогенных опухолей яичка.
Роль АФП и b-ХГЧ в диагностике.
Скрининг на наличие герминогенных опухолей по биохимическим тестам в общей популяции проводить не рекомендуется. При клиническом подозрении герминогенной опухоли (основанном на данных пальпации и УЗИ яичка) определение опухолевых маркёров может быть иногда полезным в дифференциальной диагностике злокачественной опухоли и эпидидимитов у пациентов с безболезненным опуханием одного из яичек. Использование маркёров в дополнение к рентгенологическому и ультразвуковому исследованию брюшной полости повышает диагностическую чувствительность в отношении как гонадных, так и внегонадных (медиастинальных, забрюшинных, центральной нервной системы) герминогенных опухолей.
Связь маркёров с патологией. Проблема диагностики рака яичка состояла, прежде всего, в дифференциации семиномных и несеминомных герминогенных опухолей. В настоящее время эта проблема в большой мере решена благодаря использованию АФП и b-ХГЧ. (таблица 1).
Таблица 1.
Наличие АФП и b-ХГЧ в сыворотке в зависимости от гистологического строения опухоли.
| Гистологическое строение опухоли | АФП | b -ХГЧ |
| Семинома чистого типа | — | — |
| Эмбриональный рак чистого типа | — | — |
| Тератомы незрелые | — | — |
| Тератокарциномы | + | + |
| Опухоли желточного мешка (из эндодермального синуса) | + | — |
| Желточный мешок + другие | + | +/- |
| Хорионкарциномы | — | + |
| Хорионкарциномы + другие | +/- | + |
| Низкодифференцированный рак | +/- | +/- |
Как можно видеть из представленных данных, все больные с герминогенными опухолями яичка в зависимости от наличия маркёров могут быть разделены на две группы. К первой группе (
Таблица 2
Частота герминогенных опухолей яичка с АФП>10kE/л, b-ХГЧ>5E/л.
| Гистологическое строение | АФП+ | ХГЧ+ |
| Несеминомные опухоли | ||
|---|---|---|
| Низко- и средне-дифференцированная злокачественная тератома | 70-72% | 55-60% |
| Зрелая тератома | 0% | 0% |
| Желточный мешок | 64% | 0% |
| Трофобластическая дифференцировка | 0% | 100% |
| Смешанные опухоли | 50-80% | 50-60% |
| Все | 60-80% | 40-60% |
| Семинома | ||
| Семинома | 0% | 15-20% |
Поскольку подходы к лечению семиномных и несеминомных герминогенных опухолей различаются, определение АФП и b-ХГЧ имеет очень важное практическое значение, и часто эти маркёры оказываются более информативными, чем патоморфологическое заключение. Так, по совокупным литературным данным, высокие уровни ХГЧ позволяют распознать трофобластические структуры, нераспознанные в рутинном патогистологическом рапорте, примерно в 10% семином и приблизительно в 30% несеминомных герминогенных опухолей. Практически не вызывает сомнения, что, если у пациентов с семиномой уровень ХГЧ повышен, то в опухоли имеют место быть несеминомные элементы, которые влияют на эффективность лечения и выживаемость.
Использование маркёров для стадирования. При клинической стадии I показано оперативное лечение. Второе определение маркёров проводят через 5-6 дней после операции, чтобы вычислить полупериод жизни соответствующего маркёра. Таким образом, установленная клинически стадия заболевания может быть подтверждена ретроспективно, если концентрация маркёра снижается в соответствии с полупериодом его жизни. До 1997 г. клиническое и патологическое стадирование герминогенных опухолей основывалось только на распространённости заболевания в соответствии с системой ТNM. Следовательно, для стадирования первичной опухоли необходимо было проведение орхэктомии, для классификации N и М — радиографическое исследование грудной клетки, брюшной полости и таза. Определение исходных (до лечения) уровней АФП, ХГЧ и ЛДГ было рекомендовано для клинической практики на основании результатов, полученных в ходе обширного исследования, включавшего 5000 пациентов с герминогенными опухолями и проводившегося под эгидой Международной Группы по изучению герминогенных опухолей — IGCTCG (The International Germ Cell Tumour Collaborative Group). Эти маркёры официально не включены в качестве обязательных в Международную систему по стадированию герминогенных опухолей, но благодаря их определению до и сразу же после орхэктомии, частоту ошибок клинического стадирования удаётся снизить с 50% до менее чем 15%.
Роль маркёров в лечении и наблюдении за больными.
Рациональное использование маркёров находится в соответствии со стадией заболевания.
Стадии 1А и 1В. После проведения паховой орхэктомии более предпочтительным, чем диссекция забрюшинных лимфоузлов, является наблюдение за больным. Наряду с клиническим обследованием и рентгенологическим исследованием органов грудной клетки должно проводиться рутинное определение опухолевых маркёров: ежемесячно в течение первого года после орхэктомии, а затем каждые 6 месяцев во второй и третий годы. Если после орхэктомии уровни АФП и b-ХГЧ остаются повышенными, и полупериод жизни маркёров увеличен, то, несмотря на то, что, по данным компьютерной томографии, остаточная опухоль не обнаруживается, существует высокая вероятность отдалённых метастазов; при этом системная химиотерапия будет предпочтительнее по сравнению с диссекцией забрюшинных лимфоузлов.
Стадия II. После удаления забрюшинных лимфоузлов и либо а) проведения 3-4 циклов химиотерапии, либо б) проведения 2-х циклов адъювантной химиотерапии непосредственно после диссекции — в обоих этих случаях мониторинг больных должен включать, наряду с физикальным и рентгенологическим обследованием, определение опухолевых маркёров: ежемесячно в течение первого года, каждые 3 месяца на протяжении второго года и 1 раз в 6 месяцев на протяжении 3-го года.
Распространённые стадии II и III. Скорость снижения опухолевых маркёров после химиотерапии прогнозирует ответ на лечение. Устойчивое повышение уровня маркёра или удлинение полупериода его жизни в первые 6 недель после специфической химиотерапии указывают на резистентность опухоли и плохой прогноз. Пациенты с остаточной опухолевой массой после проведения химиотерапии могут быть подвергнуты оперативному лечению. Однако, в тех случаях, когда уровни маркёров устойчиво повышаются, пациенты чаще всего оказываются иноперабельными, и вместо операции им показана химиотерапия.
Несеминомные герминогенные опухоли содержат различные типы клеток. Помимо этого, опухоль, которая синтезировала оба маркёра, в ходе лечения может переключиться на продукцию лишь одного из них. Случается, что безмаркёрная до лечения опухоль при рецидиве начинает продуцировать один или оба маркёра в больших количествах. Поэтому необходимо вести мониторинг с использованием обоих маркёров — как АФП, так и b-ХГЧ. Следует также учитывать, что в опухолях со смешанным типом клеток снижение концентрации АФП и b- ХГЧ после резекции отражает соответствующее уменьшение опухолевой массы, в то время как снижение уровней маркёров после химиотерапии отражает лишь поведение маркёр-положительного типа клеток.
После полного удаления опухоли уровни маркёров должны снижаться до нормальных значений в соответствии с их полупериодами жизни: для АФП 1000 кЕ/л, ХГЧ >10000 МЕ/л, опухолевые массы в средостении более 5 см в диаметре и 20 и более метастатических узлов в лёгких. IGCTCG предлагает использовать систему стадирования для метастатических герминогенных опухолей (как семиномных, так и несеминомных), основанную на факторах прогноза. Это позволяет подразделить опухоли на 3 группы — с хорошим, средним и плохим прогнозом — в зависимости от концентрации опухолевых маркёров, как показано в табл.3.
Таблица 3.
Вклад опухолевых маркёров в классификацию прогноза метастатических герминогенных опухолей
| Концентрация опухолевых маркёров | ||
| Группа прогноза1 | АФП (кЕ/л) ХГЧ (Е/л) ЛДГ (х RR)2 | |
| Хороший (S1) | 10 000 >50 000 >10 x (RR) | |
1) — S, сывороточный уровень маркёра
2) — концентрация ЛДГ выражена как произведение соответствующего значения на верхний предел референс-границы (RR- Reference Range).
Предлагаемая система учитывает также расположение опухоли (яичко, забрюшинная область, средостение) и наличие или отсутствие внелёгочных висцеральных метастазов. Для этих трёх прогностических групп частота безрецидивного периода и средней выживаемости составляет, соответственно: для S1 — 89% и 92%, для S2 — 75% и 80%, для S3 — 41% и 48%.
При лечебном мониторинге рекомендуется определять полупериод жизни АФП и ХГЧ; нормализация обоих маркёров (АФП за 5 дней, ХГЧ за 1-2 дня) предполагает благоприятный прогноз. У пациентов с полупериодом жизни АФП более 7 дней и/или ХГЧ более 3 дней частота выживаемости значительно ниже. Система прогноза распространённых герминогенных опухолей была значительно улучшена за счёт использования разработанных в Великобритании United Kingdom Medical Research Council — MRC — комбинированных прогностических критериев, включающих анализ полупериода жизни маркёров (табл. 4). На основании этого пациенты также подразделяются на 3 группы риска.
Таблица 4.
Прогностическая классификация для метастазирующих герминогенных опухолей, основанная на прогностических критериях UK MRC и измерении опухолевых маркёров.
Итак, герминогенные опухоли являются уникальным примером интеграции опухолевых маркёров в диагностику, стадирование и мониторинг терапии. При дифференциальной диагностике чистых семином и опухолей с трофобластическими элементами повышенные уровни ХГЧ более доказательны, чем гистологическое заключение, что имеет значение для выбора терапии. Помимо этого, определение опухолевых маркёров позволяет более аккуратно поставить стадию заболевания. Кинетика маркёров на протяжении первых 6 недель химиотерапии обеспечивает важную прогностическую информацию. У пациентов в ремиссии повышение уровней АФП и ХГЧ может прогнозировать рецидив за несколько месяцев до его клинического диагностирования. Определение маркёров показано при оценке ответа на терапию, а их нормализация является предпосылкой для успешной операции после воздействия химиотерапии.
Читайте также:

