Опухоль ската головного мозга
Причины и особенности заболевания
Достоверные причины возникновения болезни не выявлены учеными. Онкологическое заболевание может появиться в любом возрасте, однако существует небольшая закономерность: хордома заднего ската черепа больше диагностируется у молодых людей, у пожилых она возникает в пояснично-крестцовой области позвоночника. Согласно статистике, хордоме зачастую подвержены мужчины (50-60%) нежели женщины.
Новообразование может располагаться:
- в носоглотке;
- основной кости;
- в головном мозге;
- в пояснично-крестцовом отделе позвоночника;
- у основания или заднего ската черепной коробки.
Хордома носоглотки, основной кости и головного мозга обладают одинаковым строением. Они имеют вид небольшого узла, состоящего из долек. Под микроскопом можно увидеть, что клетки опухоли не одинаковы по размеру и строению. Особенностью является то, что в клетке есть большая вакуоль и маленькое ядро.
Симптомы и диагностика
Симптоматика разнообразна, она зависит от места расположения опухоли. Интенсивность проявлений хордомы увеличивается постепенно по мере роста новообразования и затрагивания им окружающих тканей (нервов, сосудов, мышц и др.). Симптомы будут таковы:
- боль, онемение конечностей;
- головокружение, нарушение координации движений;
- нарушение слуха, зрения, обоняния, речи;
- расстройства функционирования кишечника, мочевого пузыря;
- затрудненное глотание.
Одним из точных методов диагностики является рентгенологическое исследование. Оно выявляет наличие дефекта костной ткани, иногда с перегородками, наличие новообразования его размер и структуру. Подтверждает диагноз биопсия и последующее гистологическое исследование. Врач с помощью иглы должен взять фрагмент опухоли и подтвердить либо опровергнуть онкологический диагноз.
Хордома – лечение в Москве
Преимущественно применяется хирургические лечение данного заболевания. В процессе операции хордома полностью иссекается вместе с капсулой. Если этого не сделать, возможно возникновение рецидива.
терапия используется при наличии резидуальной опухоли (неполное ее иссечение), с паллиативной целью при нерезектабельных случаях, при рецидивах. Хордома не чувствительна к химиопрепаратам, поэтому химиотерапия не применяется.
| Стоимость лечения | |
| Опухолевые поражения костей (от 305 000) |
Точная стоимость лечения определяется только после консультации с врачом
- О центре
- Специалисты
- Новости
- Партнеры
- Отзывы
- Запись на приём
- Стоимость лечения
- Консультация
- Диагностика
- FAQ
- Статьи
- Аппарат Кибернож
- Уникальность системы
- Показания к лечению
- Противопоказания
- Как происходит лечение
- Сравнение методов
- Дистанционная
- Комбинированное лечение
- Лечение
- Опухоли головного мозга
- Рак легкого
- Рак печени
- Рак почки
- Рак предстательной железы
- Рак носоглотки
- Опухоль спинного мозга
- Опухоль ЦНС у детей
- Рак поджелудочной железы
- Опухолевое поражение костей
- Метастазы
- Невралгия тройничного нерва
- Пяточная шпора
Что важно знать о хордоме ската
- 35% составляет хордома основания черепа
- Хордома ската составляет 3-4% от всех первичных опухолей костей
- Возрастной пик: 50-70 лет
- Хордома - локальная опухоль, расположенная по средней линии, характеризуется инфильтративным ростом
- Исходит из остатков спинной струны зародыша
- Миксоидный матрикс вокруг недифференцированных вакуолизированных клеток.
Клинические проявления
Типичная симптомы хордомы:
- Головная боль
- Диплопия
- Симптомы поражения черепных нервов.
Методы диагностики хордомы: КТ и МРТ
- МРТ с гадолинием
- Участки пониженной плотности в кости и окружающих мягких тканях
- Деструкция кости (95%)
- Внутриопухолевые кальцинаты (50%) и костные фрагменты
- Умеренное усиление после введения контрастного вещества.
- Низкая интенсивность сигнала на Т1-взвешенном изображении с выраженным усилением после введения гадолиния
- Высокая интенсивность сигнала на Т2-взвешенном изображении
- Неоднородность в связи с наличием кальцинатов и кровоизлияниями в опухоль.
Накапливающая контраст, расположенная по средней линии опухоль с внекостным компонентом; характеризуется инфильтративным ростом.
Что хотел бы знать лечащий врач
- Распространенность и взаимосвязь с окружающими структурами (например, внутренней сонной артерией и пещеристым синусом).
- Диагноз
С чем можно спутать хордому ската черепа
Хондросаркома
- Расположена в каменисто-затылочной щели
Метастазы
- Сходные данные методов визуализации, но метастазы редко располагаются по средней линии
Плазмоцитома
- Возможна деструкция костей ската черепа
- Низкая интенсивность сигнала на Т2-взвешенном изображении
Лечение
- Удаление опухоли в сочетании со стереотаксической лучевой терапией.
Врачи каких специальностей диагностируют и лечат хордому ската черепа
-Невропатолог (осмотр, оценка неврологического статуса)
- Нейрохирург (удаление опухоли)
Прогноз
- Хордома растет медленно
- Метастазирует редко
- При использовании только хирургического лечения часто рецидивирует
- После лечения протонным пучком рецидивы в течение 5 лет наблюдаются в 30-45% случаев
- После рецидива 5-летняя выживаемость составляет 5%.
Возможные осложнения и последствия
- При неполном удалении – рецидивирование, метастазирование
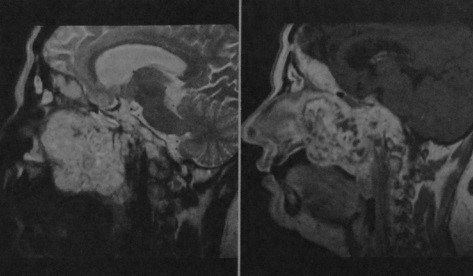
Крупная расположенная по средней линии опухоль с типичными характеристиками сигнала: высокая интенсивность сигнала на Т2-взвешенном изображении и выраженное гомогенное усиление после введения гадолиния (Т1-взвешенное изображение).
Выбор хирургического доступа к опухолям центрального основания черепа. Часть 2
Выбор хирургического доступа к опухолям центрального основания черепа. Часть 2: клиническое иСследование.
Гуляев Д.А., Чеботарев С.Я., Белов И.Ю., Горбань В.В.
Гуляев Дмитрий Александрович, кандидат медицинских наук, старший научный сотрудник ФГУ РНХИ им. проф. А.Л.Поленова
Чеботарев Сергей Яковлевич, кандидат медицинских наук ассистент кафедры челюстно-лицевой хирургии и хирургической стоматологии Санкт-Петербургского государственного университета им. акад. И.П.Павлова.
Белов Игорь Юрьевич, аспирант ФГУ РНХИ им. проф. А.Л.Поленова.
Горбань Виталий Валерьевич, интерн кафедры челюстно-лицевой хирургии и хирургической стоматологии Санкт-Петербургского государственного университета им. акад. И.П.Павлова.
В современной литературе существует достаточно ограниченное количество публикаций, посвященных сравнительному анализу хирургических доступов к центральному основанию черепа. В работе приводится сравнение трансбазального и оригинальных трансфациальных доступов к основанию черепа на основании клинических сопоставлений. Проанализированы результаты лечения 21 больного с распространенными опухолями ската черепа с экстра- интракраниальным ростом. Приведен клинический пример хирургического лечения гигантской опухоли ската черепа с ростом в рото- и носоглотку.
Ключевые слова: основание черепа, трансфациальный доступ, опухоль ската.
The choice of surgical approach to tumors of the central skull base. part 2:clinical trial.
Gulyaev D. A., Chebotarev S.Ya., Belov I.Yu., Gorban V.V.
Russian Polenov’s Neurosurgical Institute, Saint-Petersburg Pavlov State Medical University.
In modern literature there are a fairly limited number of publications devoted to the comparative analysis of surgical approaches to the central skull base. The paper compares transbasal transfcial and original approaches to the skull base based on clinical comparisons. The results of treatment of 21 patients with advanced tumors of the skull base with extra-intracranial growth are discussed. Clinical example of the surgical treatment of giant tumor of the clivus with growth into the oro-and nasopharynx is presented.
Key words: skull base, transfcial approach, tumor of the clivus
Как было отмечено ранее, в современной литературе существует достаточно ограниченное количество публикаций, посвященных сравнительному анализу хирургических доступов к центральному основанию черепа [2,4,7,9,15]. В особенности когда речь идет о трансфациальных подходах.
Очевидно, что рассмотрение геометрических характеристик доступов в отрыве от результатов их клинического применения не позволяет однозначно судить об эффективности их использования [2]. Одним из основных методов оценки результативности противоопухолевой терапии, в настоящее время, является исследование качества жизни. Несмотря на то, что последнее является вторым по значимости критерием оценки проведенного лечения после выживаемости, более важным, чем первичный опухолевый ответ - исследования данного показателя на основе современных шкал единичны [5].
Учитывая это, на основе проведенного анатомо-топографического исследования, в настоящей работе мы ставили цели оценить клиническую эффективность применения различных доступов к центральному основанию черепа, анализируя результаты хирургического лечения больных с опухолями данной локализации.
Материалы и методы.
Работа основана на ретроспективном анализе хирургического лечения пациентов, находившихся в РНХИ им. проф. А.Л. Поленова, СПбГМУ им. акад. И.П.Павлова, Клинической больницы № 122 им. Л.Г.Соколова ФМБА c 2004 по 2010 год. Возраст пациентов варьировал от 15 до 69 лет, из них женщин - 9, мужчин -12 (всего – 21). Гистологически верифицированы: хордома ската - 8, ювенильная ангиофиброма - 3, менингиома передней черепной ямки с распространением в носовую полость и орбиты - 1, рабдомиосаркома - 1, низкодифференцированная саркома - 1, рак - 4, остеобластокластома - 2, эстейзионейробластома – 1.
При ретроспективном анализе клинического материала установлено, что трансбазальный доступ по Derome был использован в 5 наблюдениях. Лишь в одном из них удалось добиться достаточно радикального удаления новообразования с длительным (более 7 лет) периодом ремиссии. В остальных случаях хирургическое вмешательство ограничивалось частичным удалением или расширенной биопсией. Все эти больные реоперированы в связи с быстрым рецидивом новообразования. Использование выше перечисленных трансфациальных доступов позволило в большинстве наблюдений обеспечить радикальное, в случаях с доброкачественными новообразованиями или тотальное – при злокачественных опухолях удаление новообразования с удовлетворительной реэкспансией мозговых структур.
При сравнительном анализе клинической эффективности рассматриваемых доступов, проведенном на основании шкалы качества жизни EORTC QLQ-C30 v. 3.0 выявлено, что основными статистически значимыми факторами (критерий корреляции Спирмена - 0,8, p=0,00001), влияющими на общий уровень качества жизни, являются симптоматические шкалы, в которых отмечено наибольшее снижение значений в дооперационном периоде (Табл.1). Кроме того, большинство пациентов имело некоторые ограничения в трудоспособности. В послеоперационном периоде отмечается улучшение в симптоматических шкалах и отсутствие достоверной динамики в шкалах физического и психологического функционирования. Лучшие показатели общего состояния здоровья (QL2) отмечены в случаях тотального удаления опухоли (53,3±2,08), нежели после санирующих операций (38,4±1,79) (р=0,059). При применении непараметрических методов статистического анализа доказано, что значимым фактором, влияющим на показатели общего состояния здоровья является бульбарный синдром (χ² =2,31,при p=0,005).
В ближайшем и отдаленном послеоперационном периоде мы не наблюдали грубых рубцовых деформаций лица, нарушений функции жевания и глотания за счет рубцовых контрактур жевательной мускулатуры, смещения глазных яблок, выворота век. В раннем послеоперационном периоде погибли 2 больные на 4 и 16 сутки после операции от ишемического инфаркта левого полушария на фоне тромбоза интракавернозной части внутренней сонной артерии. Послеоперационная летальность составила 9,5%. Послеоперационная ликворрея отмечена в 1 наблюдении. Катамнез прослежен от 6 месяцев до 7 лет. Безрецидивная выживаемость составила 6 месяцев. Средняя выживаемость составила 18 месяцев.
Клинический пример демонстрирует возможность тотального удаления гигантской рецидивной хордомы ската с ростом в носо- и ротоглотку из расширенного билатерального транслокационного доступа.
Больной О. 34 лет поступил в отделение хирургии опухолей головного и спинного мозга РНХИ с жалобами на гнусавость голоса, нечеткость произношения слов, нарушение глотания, слепоту на левый глаз, онемение левой половины лица, головную боль с тошнотой и рвотой, общую слабость, снижение памяти.
Из анамнеза известно, что болен с 2005 года, когда появилось снижение зрения на левый глаз. Оперирован по месту жительства, где было выполнено трансназальное частичное удаление хордомы основной пазухи и ската. Проведен курс лучевой терапии в СОД 54 Гр. На контрольных МРТ выявлен продолженный рост опухоли гигантских размеров. Для операции был госпитализирован в РНХИ.
Состояние больного компенсированное, сознание ясное. По шкале Karnofsky 70 баллов. Память умеренно снижена. Правша. В неврологическом статусе: асимметрия лицевой мускулатуры слева, амавроз слева, гипестезия левой половины лица, нарушение функции левых VII, IX, X, XII черепных нервов, легкая двусторонняя пирамидная симптоматика. По данным МРТ головного мозга – продолженный рост хордомы основания черепа с экстра- и интракраниальным ростом (Рис.1). 28.09.2007 операция – удаление опухоли из расширенного билатерального транслокационного доступа. В положении больного на спине, выполнен Т-образный разрез мягких тканей в лобно-теменно-височной области. Сформирован надкостнично-апоневротический лоскут. Выполнена бифронтальная краниотомия. Кость на время удалена из операционного поля. Далее разрез продлен вниз по левому крылу носа и по средней линии верхней губы. Кожно-апоневротический и мышечно-фасциальный лоскут лица отсепарованы и отвернуты влево с диссекцией верхнего и нижнего век. Произведены пропилы по средней линии твердого неба, скуловой дуге, крыловидному отростку клиновидной кости с двух сторон. Произведены пропилы через крышу орбиты и площадку основной кости. Осуществлен доступ к опухоли. Выявлено многоузловое объемное образование серо-синюшного цвета, обильно кровоснабжаемое, имеющее капсулу и распространяющееся интра- и экстракраниально (Рис.2). Опухоль прорастала кавернозный синус слева, обрастала лВСА, распространялась в основную, верхнечелюстную пазухи слева, на заднюю стенку глотки, с разрушением ската, основания СЧЯ слева и пирамиду височной кости слева. Опухоль удалена в пределах неизмененных тканей. Образовалась операционная полость, дном которой является вентральные структуры кранио-вертебрального перехода, правой стенкой является стенка носа, левой - мягкие ткани крылонебной ямки, скула, нижней – твердое небо. Препарат отправлен на гистологическое исследование. С использованием оригинальной методики сформирован и перемещен забральный надкостично-апоневротический лоскут (Патент на изобретение № 2347535), который размещен на основании черепа от нижних отделов ската до лобных пазух и тщательно подшит к кости и мягким тканям. Верхняя челюсть, скуловая кость и назоэтмоидальный комплекс фиксированы титановыми минипластинами (Рис.3). Костный лоскут уложен на место и фиксирован костными швами. Интраоперационно поставлен назо-гастральный зонд. Послойный шов ран с оставлением активного трубчатого дренажа, выведенного через контрапертуру. Кровопотеря составила 1500мл. Заживление раны первичным натяжением. В послеоперационном периоде отмечался регресс бульбарного синдрома (самостоятельно принимает пищу), появление разборчивой речи. Выписан на 18 сутки после операции. На контрольных МРТ отмечается субтотальное удаление опухоли, с сохранением опухолевой инфильтрации в ретрофарингеальном пространстве (Рис.4). Катамнез прослежен в течение 34 месяцев. Причина смерти - диссеминация опухолевого процесса.
Основываясь на проведенном анатомическом и клиническом исследовании, анализе литературных данных, нами было установлено ряд принципиальных моментов.
Так, верхние доступы, применяемые для удаления опухолей ската, сопровождаются экстрадуральным освобождением внутреннего основания черепа и тракцией лобных долей, что в послеоперационном периоде обусловливает развитие интеллектуально-мнестических расстройств в виде снижения интеллекта, нарушения инициативности и самостоятельности в действиях, угнетения речевой и двигательной активности, замедлением межличностных социальных реакций [4,11,14]. В случаях применения таких оперативных подходов существуют известные трудности визуализации новообразования, а также проксимального и дистального контроля магистральных сосудов и черепных нервов, обусловленные крайней степенью сложности топографо-анатомических взаимоотношений в области основания черепа. Измерения параметров операционного доступа, замеры глубины до ключевых анатомических объектов и определение углов операционного действия в двух основных плоскостях так же подтверждают ограниченность доступа. Данное обстоятельство не только обусловливает невозможность радикального удаления опухоли, но и нередко способствует развитию интраоперационных и послеоперационных осложнений.
Применение передних, трансфациальных доступов, позволяет избежать подобных проблем, однако при реплантации свободных костных фрагментов верхней челюсти и скуловой кости, резецированных в ходе доступа, имеется высокая вероятность их резорбции в позднем послеоперационном периоде с развитием деформаций лица различной степени или их полной утратой при нагноении послеоперационной раны [3,6,7,10]. Также неблагоприятное воздействие на их приживление может оказать до- или послеоперационный курс лучевой терапии. Удаление опухолей ската и клиновидной пазухи из, так называемых, транслокационных трансфациальных доступов не только предотвращает послеоперационные изменения вещества мозга, но и обеспечивает профилактику осложнений, связанных с некрозом костного лоскута за счет сохранения надкостницы и сосудов, питающих кость [13,15].
В современной хирургии основания черепа краниофациальная ее составляющая имеет существенное значение. Это обусловлено тем, что она обладает рядом важных преимуществ перед краниобазальными доступами, основным из которых является возможность осуществления широкого подхода к окружающим тканям опухоли и резекции последней в их пределах. По нашему мнению в вопросе выбора доступа к опухолям центрального основания черепа наиболее адекватным решением являются трансфациальные подходы. Так, при определенном понимании и соблюдении основных их принципов, возможно произвести адекватную онкологическую резекцию, добиться низкого уровня послеоперационных осложнений, хорошего функционального и эстетического результата, а также улучшение прогноза и качества жизни.
Чеботарев С.Я., Гуляев Д.А., Белов И.Ю., Горбань В.В.
Средние показатели качества жизни больных с опухолями центрального основания черепа до и после операции.

Хордома – это редко встречающееся новообразование, предположительно происходящее из остатков хорды. В настоящее время чаще рассматривается как злокачественное. Возникает вблизи позвоночника, может располагаться на любом уровне, от копчика до основания черепа. Обычно развивается в крестцово-копчиковом отделе или затылочно-базилярной части черепа. Симптомы хордомы определяются локализацией опухоли и степенью поражения различных нервов. Возможны боли, парезы, нарушения чувствительности и расстройства функций тазовых органов. Диагноз выставляют с учетом данных неврологического осмотра, рентгенографии, КТ, МРТ и биопсии. Лечение – операция, лучевая терапия.
МКБ-10

- Причины хордомы
- Патанатомия
- Симптомы хордомы
- Осложнения
- Диагностика
- Лечение хордомы
- Прогноз
- Цены на лечение
Общие сведения
Хордома – опухоль различной степени злокачественности, предположительно возникающая из эмбрионального предшественника позвоночника. Всегда располагается рядом с позвоночным столбом. Обычно локализуется в области крестца или основания черепа, но может поражать и другие отделы. Может встречаться в любом возрасте. Хордомы в области основания черепа чаще диагностируются в возрасте 20-40 лет, опухоли крестцового отдела – в возрасте 40-60 лет. Мужчины страдают вдвое чаще женщин. Распространенность заболевания – 1-3 новых случая хордомы в год на 1 млн. населения. Лечение проводят специалисты в области онкологии, неврологии и вертебрологии.

Причины хордомы
Причины и предрасполагающие факторы, влияющие на вероятность развития онкологического процесса, пока остаются невыясненными. Предполагается, что факторами риска являются клеточный иммунодефицит, контакты с радиоактивными и химическими канцерогенами в анамнезе.
Патанатомия
Вопрос злокачественности новообразования остается дискутабельным. Одни исследователи выделяют доброкачественные и злокачественные формы хордом, другие расценивают такие опухоли как относительно доброкачественные из-за их медленного роста и редкого метастазирования. Вместе с тем, из-за высокой склонности к рецидивированию и большого количества неблагоприятных исходов современные специалисты склонны рассматривать хордому как злокачественный процесс.
Хордома представляет собой мягкий одиночный узел, покрытый хорошо выраженной капсулой. При злокачественном течении инкапсуляция просматривается слабо. Новообразование имеет дольчатое строение, на разрезе хордома полупрозрачная, светло-серая, в ткани видны участки некроза. При микроскопии выявляется полиморфизм клеток. Клеточные ядра мелкие, гиперхромные. В клетках видны крупные вакуоли. В злокачественных хордомах выявляются клеточная анаплазия и атипичные фигуры митоза.
Симптомы хордомы
Симптомы зависят от локализации, размеров и направления роста опухоли. На первый план в клинической картине обычно выходят признаки поражения тех или иных нервов. Хордомы, расположенные в зоне основания черепа, могут распространяться в область турецкого седла, расти вглубь черепа, в направлении носоглотки или орбиты. При сдавлении гипофиза могут возникать гормональные нарушения. Характерны бульбарные расстройства, возникающие в результате поражения блуждающего, подъязычного и языкоглоточного нерва.
У пациентов, страдающих хордомой основания черепа, могут выявляться дизартрия, нарушения глотания и изменения голоса (слабость, гнусавость) вплоть до афонии. При распространенных хордомах наблюдаются нарушения ритма дыхания и сердечной деятельности, обусловленные вовлечением дыхательного и сердечно-сосудистого центров, расположенных в продолговатом мозге. Возможны нарушения зрения вследствие сдавления зрительного нерва. При распространении процесса может наблюдаться прорастание орбиты или носоглотки.
Хордомы крестца могут распространяться как поверхностно, так и в направлении брюшной полости или малого таза. При сдавлении спинного мозга и нервных корешков возникают боли, слабость нижних конечностей, расстройства чувствительности и движений, парезы и нарушения деятельности тазовых органов. При расположении хордомы в нетипичном месте (в области шейного, грудного или поясничного отдела позвоночника) наблюдаются боли и неврологические расстройства, соответствующие уровню поражения.
Осложнения
При злокачественном течении отмечается быстрый рост новообразования. Хордома прорастает позвонки или кости черепа, дает метастазы в регионарные лимфоузлы, печень и легкие. На поздних стадиях выявляется картина раковой интоксикации. Больные хордомой теряют вес и аппетит, чувствуют постоянную слабость. Наблюдаются колебания настроения, депрессивные расстройства, анемия и гипертермия. При метастазах в легкие возникают одышка и кашель с кровью, при метастазах в печень – гепатомегалия, желтуха и асцит.
Диагностика
Диагноз выставляют с учетом анамнеза, жалоб больного, данных общего и неврологического осмотра и результатов обследования. Необходимые исследования:
- Рентгенография. Пациентам с подозрением на хордому назначают рентгенографию черепа или рентгенографию крестцово-копчикового отдела позвоночника (в зависимости от локализации новообразования). На рентгенограммах обнаруживаются крупные участки разрушения костной ткани. Иногда в области костного дефекта просматриваются тонкие перегородки, разделяющие полость на несколько камер. При расположении хордомы в крестцовом отделе выявляется увеличение переднезаднего размера крестца. При локализации опухоли в области черепа отмечается рассасывание клиновидной кости. Для определения вовлеченности сосудов проводят ангиографию.
- Томографическая диагностика. Для более точного определения размера, структуры и распространенности хордомы назначают КТ головного мозга, МРТ головного мозга, КТ позвоночника и МРТ позвоночника.
- Биопсия опухоли. Окончательный диагноз хордомы устанавливают на основании биопсии и последующего гистологического исследования образца тканей. Забор материала производят под рентген-контролем. Состояние регионарных лимфоузлов оценивают с учетом данных УЗИ пораженной области.
Для выявления метастазов в легких проводят рентгенографию грудной клетки и КТ легких, для обнаружения вторичных очагов в печени – КТ органов брюшной полости и МРТ печени. Для оценки общего состояния организма пациентам, страдающим хордомой, назначают общий анализ крови, общий анализ мочи и биохимический анализ крови. В ходе предоперационной подготовки определяют группу крови и резус-фактор. При наличии соматической патологии больного направляют на консультацию к врачам соответствующего профиля (кардиологу, гастроэнтерологу, эндокринологу и т. д.).
Дифференциальную диагностику хордомы осуществляют с новообразованиями спинного и головного мозга, хондросаркомой крестца, а также опухолями женских половых органов и раком толстого кишечника, распространяющимися на область позвоночника.
Лечение хордомы
Основным методом лечения хордомы является хирургическое вмешательство. Из-за особенностей расположения и роста опухоли радикальное удаление возможно только у незначительной части пациентов. При возможности радикального оперативного вмешательства осуществляют полную резекцию хордомы вместе с капсулой. В остальных случаях проводят паллиативные операции. Частичное иссечение хордомы позволяет уменьшить сдавление нервных структур и существенно улучшить качество жизни пациентов.
Лучевая терапия при хордомах малоэффективна, однако из-за больших технических затруднений при проведении оперативного вмешательства этот метод нередко приобретает существенное значение в процессе паллиативной терапии. Радиотерапия обеспечивает снижение интенсивности болевого синдрома и некоторое уменьшение размеров хордомы. Облучение проводят, используя рентгеновский аппарат или гамма-установку.
Наряду с традиционными методами лучевой терапии применяют стереотаксическую хирургию, в ходе которой осуществляется прицельное воздействие тонкими пучками гамма-лучей на область хордомы. Химиотерапия в лечении данной патологии не применяется из-за устойчивости опухоли к действию химиопрепаратов. Из-за частого рецидивирования многим больным требуются повторные операции и курсы лучевой терапии.
Прогноз
Прогноз при хордомах определяется уровнем злокачественности новообразования, распространенностью онкологического процесса и успешностью первого хирургического вмешательства. Средняя пятилетняя выживаемость при злокачественных формах хордомы составляет около 30% Средняя продолжительность жизни пациентов, страдающих данной патологией, колеблется от 5 до 10 лет. Рецидив хордомы рассматривается как прогностически неблагоприятный признак.
Менингиомы – наиболее распространенные доброкачественные внутричерепные внемозговые опухоли. Данный вид новообразований развивается из клеток паутинной оболочки, окружающей головной и спинной мозг. Чаще всего менингиомы растут медленно, оставаясь невыявленными до достижения больших размеров и клинической манифестации. Однако в некоторых случаях даже небольшие по размерам опухоли представляют опасность для жизни пациента.
Большинство менингиом фиксируются к твердой мозговой оболочке, венозным синусам мозга, основанию черепа. Обычно обнаруживаются в области больших полушарий, сагиттального синуса, серповидного отростка, пирамид височной кости, крыльев клиновидной кости, намета мозжечка, большого затылочного отверстия, в мостомозжечковом углу и кавернозном синусе, на скате черепа, в полостях желудочков мозга.
Сложность лечения менингиом обусловлена их высокой кровоточивостью вследствие обильного кровоснабжения, плотной консистенцией, склонностью к инвазии в кости черепа, мозг и кожные покровы, тенденцией к обрастанию магистральных артериальных и венозных сосудов, черепно-мозговых нервов.
Стратегия лечения пациентов с данным заболеванием определяется в первую очередь качеством жизни пациента после хирургического вмешательства.
При планировании лечения пациента с менингиомой следует учитывать общее состояние больного, его возраст, наличие и выраженность неврологических расстройств, а также расположение, распространение опухоли, ее размер, консистенцию, адгезию с окружающими анатомическими образованиями.
Пожалуй, самыми сложными для хирургического лечения являются менингиомы ската черепа, что обусловлено их глубинным расположением и близостью жизненно важных анатомических структур.
Для удаления опухолей применялись следующие хирургические подходы: в 15 случаях использовался ретросигмовидный доступ; в 8 – передний чрескамянистый доступ; в 7 – чрезмыщелковый доступ; в 3 – комбинированный чрескамянистый доступ. В 26 случаях (82%) менингиома была расположена в верхней и средней части ската черепа, в 7 (18%) – в передней части большого затылочного отверстия. У 4 пациентов наблюдалась опухоль среднего размера (1,0–2,4 см), у 24 – большая (2,5–4,4 см), у 5 – очень большая (>4,5 см). Схема выбора хирургического подхода представлена на рис. 1.

Для лечения менингиом большого затылочного отверстия применялся чрезмыщелковый доступ. При использовании этой методики рекомендуется спиливание мыщелка для адекватного подхода к опухоли, исключающего тракцию спинного и продолговатого мозга. Рассечение зубных связок для обеспечения мобильности спинного мозга, сохранение функции XI, XII, VIII и IX нервов, позвоночной и задней нижней мозжечковой артерии являются критическими для обеспечения хорошего функционального послеоперационного результата.

На рис. 2 показаны данные нейровизуализации у пациентки (женщина, 61 год) с менингимой большого затылочного отверстия с сопутствующим тетрапарезом до и после хирургического вмешательства. В результате операции было отмечено улучшение неврологического состояния, новых неврологических нарушений не наблюдалось. Пациентка была выписана на 7-й день после операции.
В случае расположения менингиомы в верхней и средней части ската черепа и распространении ее ниже уровня внутреннего слухового канала применялся субтенториальный/ретросигмоидный подход. Данный подход является простым, безопасным и позволяет использовать две траектории: субтенториальную надмозжечковую и ретросигмовидную.
В случае значительных размеров менингиом использовался комбинированный чрескамянистый подход, сочетающий передний чрескамянистый и пресигмовидный доступы. Данный подход является наиболее сложным и трудоемким.
Менингиомы верхней части ската, не распостраняющиеся ниже уровня внутреннего слухового канала, могут быть удалены из подвисочного экстрадурального переднего чрескамянистого доступа. На рис. 3 представлены данные МРТ у пациента 39 лет с диагностированной пертокливальной менингиомой. При хурургическом вмешательстве использовался левосторонний передний чрескамянистый доступ. В результате операции опухоль была удалена полностью. Рис. 4 демонстрирует томограммы пациента (мужчина, 49 лет) с петрокливальной менингиомой, которому с помощью переднего транспетрозального доступа опухоль была удалена субтотально. Появления новых неврологических нарушений не отмечалось. Через год больному было проведено радиохирургическое лечение, в связи с прогрессированием остаточной опухоли в кавернозном синусе.


Результаты
Все менингиомы, расположенные в нижней части ската черепа, были удалены полностью. 7 (37%) из 19 петрокливальных менингиом также были удалены полностью, 9 (47%) были удалены субтотально, 3 (16%) – частично. Из 7 сфенопетрокливальных менингиом 3 (43%) были удалены субтотально и 4 (57%) – частично. В 4 случаях после хирургического вмешательства было отмечено появление новых неврологических нарушений в виде нарушения функции блокового (2 случая), тройничного (3 случая), отводящего (1 случай) нервов. В 2 случаях наблюдалось истечение спинномозговой жидкости из операционной раны, потребовавшее хирургической пластики. Не было ни одного летального исхода. В 2 случаях в связи с прогрессированием опухоли после операции было проведено радиохирургическое лечение.
В ходе операции для выполнения адекватного хирургического подхода необходимо обеспечивать правильное положение пациента на операционном столе; в большинстве случаев требуется поясничный дренаж спинномозговой жидкости. При проведении операции всегда следует выбирать наиболее простой и безопасный способ доступа к опухоли; проводить спиливание костных структур до открытия твердой мозговой оболочки; обязательны интраоперационный нейромониторинг черепно-мозговых нервов и допплеровское исследование мозговых сосудов. В ходе операции необходимо стремиться сохранять черепные нервы и даже мельчайшие сосуды, не пытаться отделять опухоль от мозговых струртур в случае их плотного сращения; обеспечивать герметичное закрытие раны.
Мы применяли радиохирургию для лечения остаточной опухоли только в случаях ее доказанного прогрессирования.
Заключение
Ведущим фактором, определяющим выбор стратегии хирургического лечения пациентов с менингиомами ската, является качество их жизни после операции. Мы пришли к целесообразности использования простых, малотравматичных модифицированных хирургических подходов, позволяющих безопасно удалять опухоли ската и достигать хороших функциональных результатов операции. Для удаления большинства менингиом ската черепа наиболее адекватными являются субтенториальный/ ретросигмовидный, передний чрескамянистый и чрезмыщелковый подходы. Комбинированный чрескамянистый подход применялся только для удаления менингиом огромного размера, оккупировавших всю протяженность ската черепа.
Читайте также:

