Опухоль периваскулярных эпителиоидных клеток
Мы сообщаем о случае периваскулярной опухоли эпителиоидной клетки, возникающей в прямой кишке 55-летней женщины. Опухоль обрабатывалась транссанальной эндоскопической микрохирургией. После 1 года наблюдения пациент жив без рентгенологических или эндоскопических доказательств рецидива. Периваскулярная опухоль эпителиоидных клеток представляет собой редкую мезенхимальную опухоль, характеризующуюся совместным выражением меланоцитарных и гладкомышечных маркеров. Эта редкая опухоль может возникать в различных органах, включая соломенную связку, матку, шейку матки, печень, почки, легкие, грудь, сердечную перегородку, поджелудочную железу, простату, бедро и желудочно-кишечный тракт. Периваскулярная опухоль эпителиоидной клетки желудочно-кишечного тракта встречается очень редко, только с 23 ранее зарегистрированными случаями. Мы рассматриваем литературу о периваскулярных опухолях эпителиоидных клеток, возникающих в желудочно-кишечном тракте.
Желудочно-кишечные PEComa-NOS очень редки. Насколько нам известно, в литературе было зарегистрировано 23 случая 8; следовательно, клинические и биологические характеристики PEComa-NOS плохо изучены. Мы сообщаем о случае возникновения PEComa в прямой кишке и анализируем клинико-патологические характеристики желудочно-кишечного тракта PEComa-NOS.
55-летняя женщина была направлена в нашу больницу из-за ректальной подслизистой опухоли, обнаруженной при колоноскопическом обследовании. 2 года назад в нашей больнице она перенесла сигмоидэктомию для сигмовидной карциномы толстой кишки. После операции конечная стадия заболевания составляла T1N0M0 (стадия I) в соответствии с классификацией TNM. Гистологический подтип рака сигмовидной кишки был умеренно дифференцированной аденокарциномой. Не было доказательств рецидивов или метастазов в течение 2 лет наблюдения. У пациента не было признаков комплекса клубневого склероза.
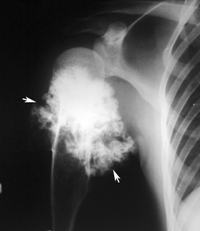
При цифровом ректальном исследовании на задней стенке прямой кишки пальпировали твердую массу. Результаты других физических осмотров живота и других органов были нормальными. Лабораторные данные не показали никаких выраженных аномалий, включая маркеры опухолей, такие как карциноэмбриональный антиген и углеводный антиген 19-9. Колоноскопическое обследование в нашей больнице выявило наличие подслизистой опухоли диаметром 3 см, возникающей в задней ректальной стенке, в 10 см от анального края (рис. 1а). Подслизистая опухоль сопровождалась язвой и поверхностным слизистым кровотечением в центре. Проведена биопсия, но гистопатологический диагноз не может быть установлен. Эндоанальное ультразвуковое сканирование показало гетерогенную, низкоэховую, узловатую опухоль, возникающую в мышечной ткани задней ректальной стенки (рис. 1b). Предполагалось, что опухоль вторглась в мышечную ткань и подсерию. Контрастная усиленная компьютерная томография грудной клетки, брюшной полости и таза не выявила повреждений лимфатических узлов вокруг прямой кишки или метастазов в другие органы.
Выводы по колоноскопии и эндоскопическому ультразвуковому сканированию. (a) Колоноскопическое обследование показало наличие подслизистой опухоли диаметром 3 см, возникающей в задней ректальной стенке. (б) Эндоанальное ультразвуковое сканирование показало гетерогенную, малоэховую опухоль с узловым появлением, возникающим в мышце (длинной стрелке) задней стенки прямой кишки.
Пациенту была выполнена транссанальная эндоскопическая микрохирургия для предполагаемого диагноза ректальной стромальной опухоли. Мы вырезали полную толщину вырезания прямой кишки с 1 см запасом прочности нормальной слизистой оболочки вокруг опухоли. Рану в ректальной стенке закрывали бегущим швом. Макроскопически резецированный образец показал коричневую массу 2,5 см в максимальном диаметре, с центральной язвой, с нечеткой границей и без образования капсул. Поверхностные изъязвления были заметны в связи с отсутствием слизистой оболочки прямой кишки, что было приписано предшествующей эндоскопической биопсии.
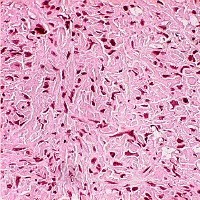
При микроскопическом обследовании опухоль находилась в основном в мускларидной пропририи и вторглась в слизистую оболочку и была обнажена на ее поверхности. Гистопатологически опухоль состояла из круглых и многоугольных клеток с прозрачной-эозинофильной зернистой цитоплазмой. Опухолевые клетки разрастались в виде сотовой структуры (рис. 2). В ядрах опухолевых клеток наблюдались гиперхромность, расширение ядра и известные ядрышки. Опухолевые клетки были отрицательными для окрашивания Фонтана-Массон. Отмечались периодические кислотно-шиффовые пятноположительные интрацитоплазматические гранулы, которые были расщеплены диастажем. Опухолевая клетка показала легкую или умеренную ядерную атипию без митоза или некроза опухолей. Не было лимфатического или сосудистого вторжения.
Появление опухоли, окрашенной гематоксилином и эозином. Опухоль состояла из круглых и многоугольных клеток с прозрачной-эозинофильной зернистой цитоплазмой. Опухолевые клетки размножались в виде сотов.
Иммуногистохимически опухолевые клетки были положительными для антигена, ассоциированного с меланомой (HMB-45), нейроспецифической энолазы, CD68 и фактора транскрипции E3 (TFE-3), но отрицательного для AE1 / AE3, CAM5.2, эпителиального мембранного антигена, гладкомышечный актин, Desmin, MyoD1, Caldesmon, Calponin, Synaptophysin, Chromogranin A, NCAM, Vimetin, CD34, S-100, Melan-A, CD99, CD10, D2-40, CD138, P-ALP и множественные онкогенные миеломы, 1 (рисунок 3аб). Маркер пролиферации Ki-67 показал положительную активность ядра примерно в 15% клеток. На основании этих результатов был поставлен диагноз кишечной PEComa. Этот пациент получил только хирургическую резекцию. Она проходит регулярный надзор и остается без болезней через 15 месяцев после операции.
Иммуногистохимические данные о опухоли. (а) HMB-45 является положительным в цитоплазме опухолевых клеток. (б) Ядерная экспрессия TFE3 наблюдается в опухолевых клетках. HMB-45, меланома-ассоциированный антиген; TFE3, фактор транскрипции E3.
PEComas являются частью группы очень редких мезенхимальных новообразований. Bonetti и его коллеги [23] впервые предложили концепцию периваскулярной эпителиоидной клетки в 1992 году. Термин PEComa был придуман Замбони и его коллегами [24] в 1996 году для описания этого редкого семейства поражений. В 2002 году Всемирная организация здравоохранения приняла обозначение PEComa как отдельного мезенхимального новообразования, состоящего из гистологических и иммуногистохимически уникальных периваскулярных эпителиоидных клеток [1]. Эта редкая опухоль была зарегистрирована в различных органах, таких как соломенная связка, матка, шейка матки, печень, почка, легкие, грудь, перегородка сердца, поджелудочная железа, простата, бедро и желудочно-кишечный тракт. PEComas обычно проявляют иммунореактивность как для меланоцитарных (HMB-45, так и для мелан-A) и маркеров с гладкой мышцей (актин и / или desmin). Недавно в нескольких докладах описана экспрессия TFE3 в PEComas [14,22,25]. В одном обзоре TFE3 был положительным для 3 из 24 случаев желудочно-кишечной PEComa. В нашем случае положительность для TFE3 способствовала диагнозу PEComa.
В этом исследовании мы сосредоточились на желудочно-кишечном PEComa-NOS и не включили в наш обзор классические AML и LAM желудочно-кишечного тракта. Клиникопатологические особенности PEComa-NOS, включенные в это исследование, суммированы в таблице 1. Отношение мужчин к женщинам составляло от 8 до 16, что указывает на то, что первичная желудочно-кишечная PEComa-NOS чаще встречается у женщин, аналогичная PEComa-NOS, возникающая в других органы. Средний возраст при диагностике первичного желудочно-кишечного тракта PEComa-NOS составил 31,5 года (от 7 до 63 лет). Средний диаметр первичного желудочно-кишечного тракта PEComa-NOS составлял 45,5 мм (от 12 до 100 мм). Опухоль находилась в толстой кишке у 14 пациентов (58,3%), прямой кишки у 5 (20,8%), тонкой кишки у 2 (8,3%), двенадцатиперстной кишки у 2 (8,3%) и желудка в 1 (4,3% ). Хирургическая резекция проводилась почти у всех пациентов, и только две получали адъювантную химиотерапию. Одному пациенту была назначена адъювантная терапия интерфероном-α2b, а в другом случае была проведена адъювантная химиотерапия с доксорубицином, ифосфамидом и месной в соответствии с протоколом саркомы мягкой ткани детской онкологической группы (non-rhabdomyosarcoma). Ни у одного из этих пациентов не было доказательств рецидива. Последующие данные были доступны для 19 пациентов, а медианное наблюдение — через 15 месяцев (от 3 до 41 месяцев) после операции. Три случая имели рецидив [5,12], два из которых подверглись повторной резекции их опухолей. 3-летняя выживаемость безрецидивной выживаемости 19 пациентов составила 75%. У них умерли два пациента. Один пациент умер через 3 месяца после операции, а другой умер через 38 месяцев после первой операции.
Характеристики пациента и морфологические и гистопатологические особенности опухоли и результаты
/ 50 высокомощных полей HPF 50, адъювантная химиотерапия AC, DOD умерла от болезни, F-женщина, лимфоваскулярная инвазия LVI, M-мужчина, n.a нет данных, NER нет доказательств рецидива.
Хотя лечение выбора для желудочно-кишечной PEComa является хирургической резекцией, общая стратегия управления желудочно-кишечной PEComa еще не установлена. Кроме того, потенциальные преимущества адъювантной химиотерапии не были исследованы. В недавнем исследовании PEComa о мягких тканях и гинекологическом происхождении Folpe и коллеги [25] предложили критерии для классификации PEComas для доброкачественного, неопределенного злокачественного потенциала и злокачественных категорий. Они предположили, что злокачественность была предсказана наличием двух из следующих результатов: размер опухоли более 5 см, граница инфильтративной опухоли, высокий ядерный сорт и клеточность, более 1 митоза / 50 высокомощных полей, некроз опухолей и сосудистая инвазия , У нашего пациента опухоль классифицировалась как низкий класс в соответствии с этими диагностическими критериями, потому что была граница инфильтративной опухоли, но ни одна из других находок.
Учитывая сложившуюся ситуацию, тщательное наблюдение, в том числе исследования изображений и колоноскопия, является обязательным после хирургической резекции желудочно-кишечной PEComa, особенно у пациентов с полноценной злокачественностью. Поскольку результаты желудочно-кишечной PEComa остаются неясными, необходимы дальнейшие долгосрочные исследования для большего числа пациентов.
Мы сообщили о редком случае ректальной PEComa и рассмотрели клинико-патологические характеристики желудочно-кишечного тракта PEComa-NOS. В настоящее время наиболее эффективным методом лечения желудочно-кишечного тракта является хирургическая резекция. Но послеоперационное лечение, включая адъювантную химиотерапию, еще не установлено. Таким образом, пациенты с послеоперационной PEComa-NOS должны тщательно отслеживаться.
Письменное информированное согласие было получено от пациента для публикации этого отчета о случаях и сопутствующих изображений. Копия письменного согласия доступна для рассмотрения Главным редактором этого журнала.
Авторы заявляют, что у них нет конкурирующих интересов.
AK, SF, TG, AI, TO и TF провели хирургическое лечение. AK и SF составили рукопись. TI и AN провели патологические исследования. NY, YR, TI и MM пересмотрели эту рукопись. CK критически рассмотрел рукопись и дал окончательное разрешение на публикацию. Все авторы прочитали и утвердили окончательную рукопись.
б) Визуализация:
1. Общие характеристики:
• Лучший диагностический критерий:
о ПЭКомы могут возникать в разных тканях:
- Почки: неотличимы от опухолей почки и лимфомы
- Забрюшинное пространство: обычно неотличимы от саркомы:
Однако ПЭКомы не содержат жировой ткани
• Локализация:
о Большинство образуется в мочеполовом тракте, забрюшинном пространстве или желудочно-кишечном тракте
• Размер:
о Большой (средний размер - 11 см)
• Четкие контуры, круглая или овальная форма
2. КТ при периваскулярной эпителиодноклеточной опухоли (ПЭКоме):
• Бесконтрастная КТ:
о Сигнал-от гипо- и изоденсного до плотности скелетных мышц
о Возможна кальцификация (редко)
• КТ с контрастированием:
о Различное контрастирование-от гиповакулярного типа до выраженного захвата контраста
о Возможна инвазия в сосуды и смежные структуры (редко)
о В крупных опухолях наблюдают некроз
3. МРТ при периваскулярной эпителиодноклеточной опухоли (ПЭКоме):
• Т1-ВИ:
о Сигнал - от гипо- и изоденсного до плотности скелетных мышц
• Т2-ВИ:
о Гетерогенный гиперинтенсивный сигнал
4. УЗИ:
• Гетерогенная эхоструктура; признаки некроза в крупных опухолях
5. Советы по визуализации:
• Лучший метод визуализации:
о КТ или МРТ с контрастным усилением
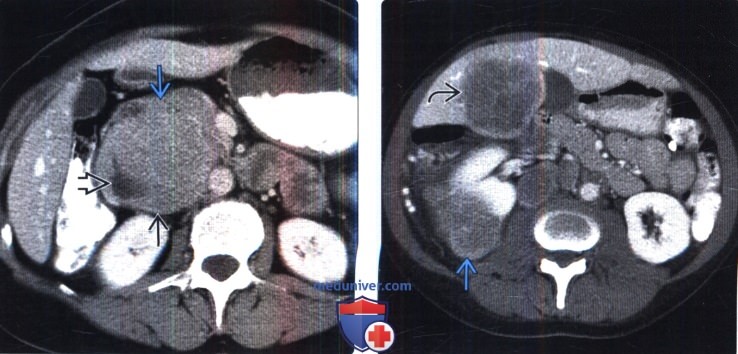
(Слева) КТ с контрастированием, аксиальная проекция: в забрюшинном пространстве справа выявлена крупная опухоль с гетерогенным контрастированием. Опухоль сдавливает и смещает кзади НПВ. Показана небольшая область некроза вдоль боковой границы опухоли.
(Справа) КТ с контрастированием, аксиальная проекция: визуализировано контрастное образование, исходящее из латеральной части коркового слоя паренхимы правой почки. В пятом сегменте печени выявлены схожие по виду метастазы. Лишь небольшое количество ПЭКом являются злокачественными и имеют склонность к метастазированию.
в) Дифференциальная диагностика:
1. Почечноклеточный рак:
• Чаще всего сопровождается сосудистой инвазией и лимфаденопатией
2. Переходноклеточный рак:
• Более характерны нечеткие инфильтрированные границы
3. Лимфома:
• Более характерна регионарная или генерализованная лимфаденопатия
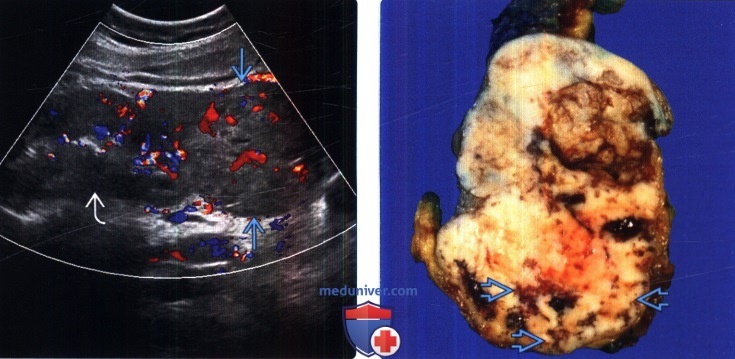
(Слева) УЗИ, цветовое допплеровское картирование, продольная плоскость: выявлена солидная опухоль, распространяющаяся от нижнего полюса левой почки. Определен обширный кровоток в экзофитной опухоли. Признаков инвазии в сосуды почки или лимфаденопатии не установ -лено (не показано на этом изображении).
(Справа) Макропрепарат: множество небольших сосудов, пронизывающих опухоль, что демонстрирует сосудистую природу ПЭКом. При гистологическом исследовании установлена ПЭКома.
г) Патология:
1. Общие характеристики:
• Сопутствующие аномалии:
о Характерные мутации в туберозном склеротическом комплексе:
- Делеция короткого плеча хромосомы 16p (ген TSC2)
2. Стадирование, степень дифференцировки и классификация:
• Характеризуется периваскулярной локализацией
3. Микроскопия:
• Экспрессия меланоцитарных или гладкомышечных маркеров
д) Клинические особенности:
1. Клиническая картина:
• Наиболее распространенные признаки/симптомы:
о Опухоль обычно служит случайной находкой
2. Демография:
• Возраст:
о Наиболее часто встречают в шестой декаде жизни
• Пол:
о Соотношение женщин и мужчин - 2-3:1
3. Течение и прогноз:
• Большинство ПЭКом-доброкачественные:
о Меньшая часть ПЭКом-злокачественные, склонны к метастазированию:
- Из них большая часть (75%) метастазирует в течение одного года
- Метастазы: печень, реже-легкие, сальник, кости
4. Лечение:
• Хирургическая резекция
е) Диагностическая памятка. Советы по интерпретации изображений:
• Не существует; специфичные методы визуализации для дифференцирования от других новообразований отсутствуют
ж) Список использованной литературы:
1. Shi Н et al: Malignant perivascular epithelioid cell tumor of the kidney with rare pulmonary and ileum metastases. IntJ Clin Exp Pathol. 7(9):6357-63, 2014
2. Tirumani SH etal: Imaging features of primary and metastatic malignant perivascular epithelioid cell tumors. AJR Am J Roentgenol. 202(2):252—8, 2014
3. Tan Y et al: Perivascular epithelioid cell tumor: dynamic CT, MRI and dinicopath-ological characteristics-analysis of 32 cases and review of the literature. Clin Radiol. 68(6):555-61,2013
4. Chang H et al: Pigmented perivascular epithelioid cell tumor (PEComa) of the kidneys case report and review of the literature. Korean J Pathol. 46(5):499—502, 2012
5. Tan Y et al: Hepatic perivascular epithelioid cell tumor (PEComa): dynamic CT, MRI, ultrasonography, and pathologic features-analysis of 7 cases and review of the literature. Abdom Imaging. 37(5):781 —7, 2012
6. Rajiah P et al: Imaging of uncommon retroperitoneal masses. Radiographics. 31 (4):949-76, 2011
7. Folpe AL et al: Perivascular epithelioid cell neoplasms: pathology and pathogenesis. Hum Pathol. 41 (1): 1-15, 2010
Редактор: Искандер Милевски. Дата публикации: 23.9.2019
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Саркомы – это группа различных по клиническим и морфологическим признакам злокачественных новообразований, которые происходят из любых неэпителиальных тканей. В этом заключено основное отличие саркомы от рака, ростком которого являются эпителиальные клетки.
Риск возникновения данного заболевания повышается при некоторых генетических патологиях:
- синдром базальноклеточных невусов;
- синдром Вернера;
- синдром Гарднера;
- туберозный склероз;
- кишечный полипоз т.д.
А болезнь Реклингхаузена, или нейрофиброматоз 1 типа, является наиболее распространенным наследственным заболеванием, которое осложняется опухолевыми процессами. При этой патологии нейрофибросаркомы возникают примерно в 15% случаев. Описаны также случаи возникновения саркомы в зоне воздействия ионизированного излучения, как патологического, так и с лечебными целями.
Гистоморфологическая классификация сарком
Зачастую точно определить, из какой именно ткани возникла конкретная опухоль, довольно сложно. Кроме того, выделяется большая группа опухолей, которые имеют неясный гистогенез.
Наиболее часто диагностируются фибросаркомы, липосаркомы и рабдомиосаркомы. Вторыми по частоте встречаемости следует злокачественная гистиоцитарная саркома мягких тканей и саркомы неясного генеза. Ангиосаркомы, синовиальные саркомы, злокачественные шванномы, лейомиосаркомы и прочие типы наблюдаются редко.
Опухоли жировых тканей
Промежуточные (местно-агрессивные) формы:
- атипичный липоматоз;
- высокодифференцированные липосаркомы.
Злокачественные формы:
- недифференцированные липосаркомы;
- миксоидные липосаркомы;
- круглоклеточные липосаркомы;
- полиморфная липосаркома;
- липосаркомы смешанного типа;
- липосаркомы без признаков дифференцировки.
Миофибропластические и фибробластические опухоли
Промежуточные, или местно-агрессивные, формы:
- поверхностные подошвенные или ладонные фиброматозы;
- фиброматозы десмоидного типа;
- липофиброматозы.
Редко метастазирующие формы:
- солитарные фиброзные опухоли;
- гемангиоперицитомы, включая липоматозные гемангиоперицитомы;
- воспалительные миофибропластические опухоли;
- миофибропластические саркомы низкой степени дифференцировки;
- миксоидные фибропластические саркомы;
- инфантильные фибросаркомы.
Злокачественные формы:
- зрелые фибросаркомы;
- миксофибросаркомы;
- медленнорастущие фибромиксоидные саркомы;
- гиалинизирующие веретеноклеточные саркомы;
- склерозирующие эпителиоидные фибросаркомы.
Фиброгистиоцитарные опухоли
Промежуточные, или местно-агрессивные формы:
- плеоморфные фиброгистиоцитарные опухоли;
- гигантоклеточные саркомы мягких тканей.
Злокачественные формы:
- недифференцированные плеоморфные саркомы;
- недифференцированные плеоморфные саркомы с гигантскими клетками;
- недифференцированные плеоморфные саркомы с преобладанием воспаления.
Саркома мышечной ткани
Опухоли скелетных мышц:
- эмбриональные веретеноклеточные и анапластические рабдомиосаркомы;
- альвеолярные солидные и анапластические рабдомиосаркомы;
- плеоморфные рабдомиосаркомы.
Саркома гладких мышц: лейомиосаркома, включая и кожные формы.
Периваскулярные опухоли
- Злокачественные гломусные опухоли;
- миоперицитомы.
Сосудистые опухоли
Промежуточные, или местно-агрессивные формы: гемангиоэндотелиомы типа Капоши.
Редко метастазирующие формы:
- ретиформные гемангиоэндотелиомы;
- папиллярные внутрилимфатические ангиоэндотелиомы;
- смешанные гемангиоэндотелиомы;
- саркомы Капоши.
Злокачественные формы:
- эпителиоидные гемангиоэндотелиомы;
- гемангиосаркома мягких тканей.
Костно-хрящевые опухоли
Опухоль костной ткани, или остеогенная саркома:
- обыкновенные: хондробластические, фибробластические, остеобластические;
- телеангиоэктатические;
- мелкоклеточные;
- центральные, имеющие низкую злокачественность;
- вторичные;
- параоссальные;
- периоссальные;
- поверхностные, имеющие высокую злокачественность.
Опухоли хрящевой ткани (хондросаркомы):
- центральные, первичные и вторичные;
- периферические;
- дедифференцированные;
- мезенхимальные;
- светлоклеточные.
Опухоли неясного происхождения
Редко метастазирующие формы:
- ангиоматоидные фиброзные гистиоцитомы;
- оссифицирующие фибромиксоидные опухоли;
- миоэпителиомы;
- парахондромы.
Злокачественные формы:
- синовиальная саркома;
- эпителиоидные саркомы;
- альвеолярная мягкотканная саркома;
- светлоклеточная саркома мягких тканей;
- внескелетные миксоидные хондросаркомы хордоидного типа;
- примитивные нейроэктодермальные опухоли (PNET);
- внескелетные саркомы Юинга;
- десмопластические мелко- и круглоклеточные опухоли;
- внепочечные рабдоидные опухоли;
- злокачественные мезенхимомы;
- миелоидная саркома;
- новообразования, имеющие периваскулярную эпителиоидно-клеточную дифференцировку (PEComa);
- светлоклеточные миомеланоцитарные опухоли;
- интимальные саркомы.
Каждый из названных гистологических типов отличается не только своими морфологическими признаками и гистогенезом, но также имеет определенное клиническое течение. Конечно, подобное многообразие морфологических форм сарком вызывает значительную трудность в их диагностике.
Еще больше гистологическое типирование сарком осложняется в детском возрасте. Обусловлено это тем, что у детей большая часть опухолей происходит из примитивных эмбриональных клеток (эмбриональная саркома) или клеток, которые еще не завершили свое гистогенетическое становление. Такие опухоли, имея большое разнообразие морфологических форм, зачастую не имеют четких признаков гистотиповой дифференцировки, характеризуются резкой анаплазией и вариабельностью клеточного состава. Вместе с тем часто наблюдается и обратная картина: новообразования различного происхождения часто имеют сходные признаки строения. Все это делает типирование опухолей значимой проблемой.
Распределение основных типов сарком по преобладанию в их составе
клеток определенной формы
Рутинная оценка сарком начинается с оценки общего строения опухоли, которая базируется, прежде всего, на ее "узнаваемости" при микроскопии. Описывается общая картина преобладания клеток определенной формы.
Опухоли, состоящие из округлых клеток:
- нейробластома;
- саркома Юинга/PNET;
- мезенхимальная хондросаркома;
- эмбриональная и альвеолярная рабдомиосаркома;
- десмопластичная круглоклеточная саркома;
- круглоклеточная липосаркома;
- малигнизированная рабдоидная опухоль.
Опухоли, состоящие из веретенообразных клеток:
- фибросаркома;
- веретеноклеточная рабдомиосаркома;
- лейомиосаркома;
- злокачественные опухоли периферических нервных стволов;
- веретеноклеточная ангиосаркома;
- монофазная веретеноклеточная синовиальная саркома.
Опухоли, состоящие из эпителиоидных клеток:
- эпителиоидноклеточная синовиальная саркома;
- эпителиоидноклеточная ангиосаркома;
- эпителиоидноклеточные злокачественные опухоли нервного ствола;
- склерозирующая эпителиоидноклеточная фибросаркома;
- злокачественная фиброзная гистиоцитома;
- эпителиоидноклеточная лейомиосаркома.
Остальные гистоморфологические типы сарком, входящие в классификацию, имеют преимущественно смешанную форму клеток. Кроме того, иногда форма злокачественно перерожденных клеток не поддается описанию и определению. В таких случаях опухоль классифицируется как плеоморфная саркома.
Типирование сарком по степени дифференцировки клеток
После определения гистологического типа саркомы оценивается степень ее дифференцировки (G). При этом учитываются такие критерии, как клеточный полиморфизм, митотическая активность и др.
Степени дифференцировки сарком:
- GX – степень дифференцировки клеток определить невозможно;
- G1 – саркома высокодифференцирована;
- G2 – саркома дифференцирована умеренно;
- G3 – саркома низкодифференцирована;
- G4 – недифференцированая саркома.
Дифференциация клеток определяется возможностью установить, к какому именно виду ткани относится конкретная клетка. Чем ниже степень дифференциации клеток, составляющих опухоль, тем более выраженную злокачественность имеет данная саркома. Это напрямую связано с шансами раннего метастазирования в другие органы и ткани. Кроме этого, чем выше злокачественность саркомы, тем быстрее она увеличивается в размерах, тем большую инфильтративность имеет ее рост и тем стремительнее прогрессирует заболевание.
Иммуногистохимическое (ИГХ) типирование сарком
Иммуногистохимическое исследование позволяет:
- провести гистогенетическое типирование опухоли и определить нозологический вариант новообразования;
- определить органопринадлежность первичной опухоли при метастазах неизвестного происхождения;
- определить степень злокачественной трансформации клеток опухоли;
- прогнозировать течение опухолевого заболевания;
- прогнозировать чувствительность и резистентность опухолевых клеток к химиотерапевтическим препаратам и лучевой терапии;
- определить возможность проведения узконаправленной терапии.
Сегодня при верификации сарком используется несколько десятков основных ИГХ-маркеров. Поскольку практически нет ИГХ-маркеров, которые были бы специфичными только для какого-то конкретного типа опухоли, для типирования новообразования должен использоваться набор из нескольких антител.
1. В группу опухолей, состоящих из мелких округлых клеток, относятся новообразования, наиболее часто встречающихся в детском возрасте. Они обычно имеют низкую дифференцировку и высокую степень злокачественности.
- Бластная нейрогенная саркома. Все ее разновидности экспрессируют нейрональные маркеры, такие как нейронспецифическая энолаза (NSE), синаптофизин, хромогранины (CgA), СD56, СD57.
- Рабдомиосаркома. Все ее виды экспрессируют виментин, десмин и мышечный специфический актин (MA), а также СD99. Основными же ее специфическими маркерами является миогенные ядерные регуляторные протеины – миогенин и МуоD1.
- Основными диагностическими маркерами для саркомы Юинга и примитивной нейроэктодермальной опухоли являются СD99 (продукт гена MIC2) и Fli-1. Также клетки этих опухолей экспрессируют виментин, сравнительно часто - синаптофизин, в редких случаях - цитокератины (CK), CD57.
- Клетки мезенхимальной хондросаркомы экспрессируют виментин, S-100 протеин и, реже, СD57.
- Мелкоклеточная остеосаркома характеризуется экспрессией виментина, остеокальцина, может наблюдаться экспрессия СD57 и СD99.
- Мелкоклеточная низкодиференцированная синовиальная саркома мягких тканей, как и другие типы синовиальных сарком (монофазная веретеноклеточная синовиальная саркома, эпителиоидная синовиальная саркома, дедиференцированная полиморфноклеточная саркома), экспрессируют CK, эпителиальный мембранный антиген (EMA), виментин, коллаген IV типа.
- Десмопластическая мелкокруглоклеточная опухоль - очень редкий вид чрезвычайно агрессивного новообразования. Обычно клетки этой опухоли экспрессируют эпителиальные (СК и ЕМА), мезенхимальные (виментин), миогенные (десмин) и нейральные (СD56, NSE) маркеры.
2. К опухолям, состоящим из веретенообразных клеток, прежде всего относятся новообразования, развивающиеся из производных мезенхимы.
- Фибросаркома и инфантильная фибросаркома не имеют специфического иммунопрофиля, но всегда положительны к виментину, а иногда – и к SMA.
- Клетки лейомиосаркомы, как правило, экспрессируют виментин, десмин, МА, SMA, кальдесмон.
- Злокачественная опухоль оболочки периферического нервного ствола экспрессирует виментин, коллаген IV типа и СD57.
- Сосудистая эпителиоидно- и веретеноклеточная саркома, а также саркома Капоши экспрессируют Fli-1, CD31, CD34 и фактор фон Виллебранта (фактор VIII связывающий протеин).
- Гемангиоперицитома и солитарная фиброзная мягкотканая саркома относятся к новообразованиям, пограничным по своему потенциалу злокачественности. Их клетки обычно экспрессируют CD34, CD99, а также bcl-2.
3. Опухоли, состоящие из эпителиоидных клеток, характеризуются признаками, присущими специализированным клеточным элементам соединительной ткани (миофибробластам, эпителиоидным клеткам сосудов, миоэпителиальным клеткам).
- Злокачественная воспалительная миофибробластическая опухоль (воспалительная фибросаркома) демонстрирует иммунореактивность с кальпонином, SMA и десмином.
- Злокачественная фиброзная гистиоцитарная саркома характеризуется коэкспрессией виментина, EMA и CD68, в некоторых случаях наблюдается экспрессия MA, однако не экспрессируются миогенин и МиоD1.
- Периваскулярные эпителиоидноклеточные опухоли (PEC-омы) – это группа опухолей, к которым относятся: ангиомиолипома почек (и других локализаций), светлоклеточная саркома легких ("сахарная" опухоль), лимфангиолейомиоматоз и др. Клетки этих опухолей демонстрируют меланоцитарный иммунофенотип (положительны к: Мелан-А, НМВ45, тирозиназе) с коэкспрессией SMA.
- Эпителиоидная саркома коэкспрессирует виментин и СК.
Помимо гистогенетического типирования опухолей, принципиально важной задачей ИГХ является определение степени злокачественности опухоли и выявление прогностических маркеров. Это позволяет намного более обоснованно и достоверно прогнозировать течение болезни, а также чувствительность опухоли к лечебным средствам.
Читайте также:

