Опухоль pd l1 позитивная что значит
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
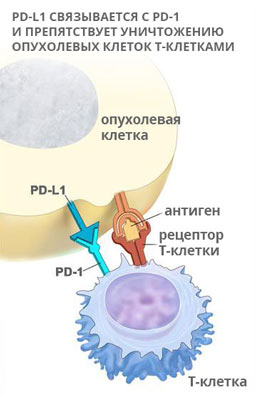
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.

Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
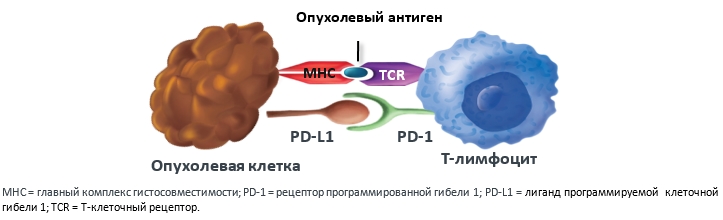
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
- Отличается пороговый уровень PD-L1 экспрессии. Для одного препарата порог назначения – это 1% экспрессии PD-L1 и более, для другого – это уровень не менее 5%.
- Отличается тип клеток, на которых оценивается PD-L1. Некоторые опухоли требуют исследования уровня PD-L1 на опухолевых клетках, другие – на иммунных.
- Отличаются тест-системы для PD-L1. Так, для определения PD-L1 при тройном негативном раке молочной железы перед назначением анти-PD-L1 терапии проводится исследование PD-L1 c применением тест-системы Ventana SP142. Важно учитывать, что в случае изменения терапии может потребоваться другая тест-система – тест SP263 или 22С3.
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
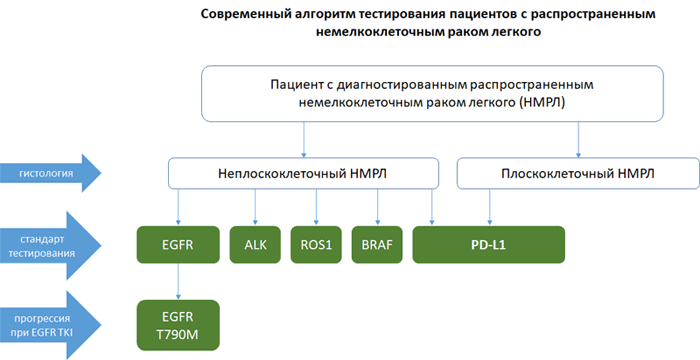
- метастатическим НМРЛ (плоскоклеточным и неплоскоклеточным);
- распространенным уротелиальным раком;
- метастатическим тройным негативным раком молочной железы.
НМРЛ: методы определения экспрессии PD-L1
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
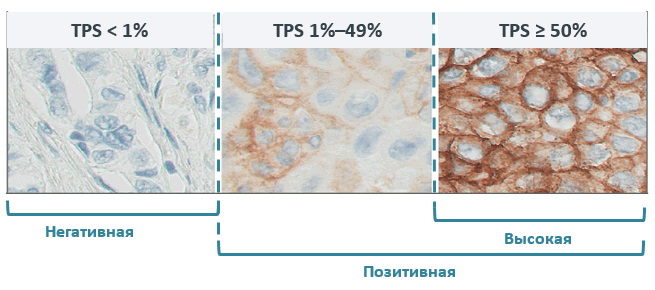
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
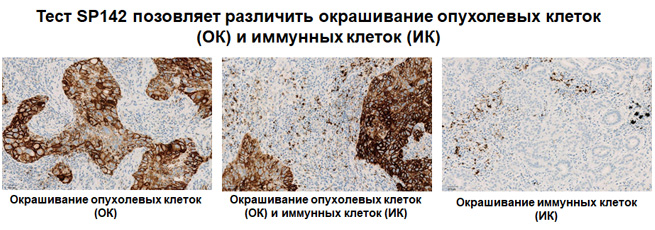
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
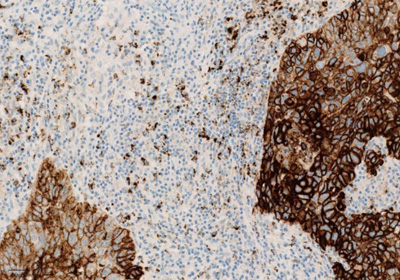
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
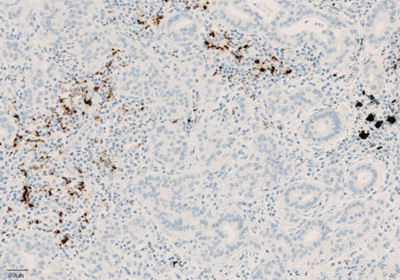
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
- Тестирование в рамках программы проводится на всей территории страны.
- Отправка материала и тестирование проводятся бесплатно для врачей, лечебных учреждений и пациентов.
- Zitvogel L, et al. Tumor Immunol. 2006; 6(10): 715-727. 2. Vesely MD, Schreiber RD. Ann NY Acad Sci. 2013; 1284(1): 1-5.
- May KF Jr, et al. In: Prendergast GC et al. Cancer Immunotherapy. 2nd ed. Elsevier; 2013: 101-113.
- Pardoll DM. Nat Rev Cancer. 2012; 12(4): 252-264. 2. McDermott DF, Atkins MB. Cancer Medicine. 2013; 2(5): 662-673.
- Garon EB, et al. N Engl J Med. 2015; 372(21): 2018-2028.
- Mino-Kenudson M. Programmed cell death ligand-1 (PD-L1) expression by immunohistochemistry: could it be predictive and/or prognostic in non-small cell lung cancer? Cancer Biol Med. 2016; 13: 157-170. doi: 10.20892/j.issn.2095-3941.2016.0009.
- Dako Denmark A/S. PD-L1 IHC 22C3 pharmDx™ Interpretation Manual. 2. Dako Denmark A/S. Immunohistochemical Staining Methods. Sixth Edition, 2013.
- Saleh K, Khalifeh-Saleh N, Kourie HR. Is it possible to rechallenge with PD-1/PD-L1 inhibitors after progression? Immunotherapy. Vol. 10(5), P.345-347.
- Ghiotto M, Gauthier L, Serriari N, et al. PD-L1 and PD-L2 differ in their molecular mechanisms of interaction with PD-1. Int Immunol. Vol. 22(8), P.651-660.
- Sharpe AH, Pauken KE. The diverse functions of the PD1 inhibitory pathway. Nat Rev Immunol. Vol. 18(3), P.153-167.
- Ratcliffe MJ, et al. Clin Cancer Res. 2017; 23(14): 3585-3581.
- von der Maase H, Sengelov L, Roberts JT, et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol. Vol. 23(21), P.4602-4608.
- Hirsch FR, Bunn PA. Lancet Oncol. 2009; 10(5): 432-433.
- Kwak EL, et al. N Engl J Med. 2010; 363(18): 1693-1703.
- Sonpavde G, Galsky MD, Latini D. Cisplatin-ineligible and chemotherapy-ineligible patients should be the focus of new drug development in patients with advanced bladder cancer. Clin Genitourin Cancer. Vol. 12(2), P.71.
- Reck M, et al. N Engl J Med. 2016; 375(19): 1823-1833.
- Garon EB, et al. N Engl J Med. 2015; 372(21): 2018-2028.
- De Santis M, Bellmunt J, Mead G, et al. Randomized phase II/III trial assessing gemcitabine/carboplatin and methotrexate/carboplatin/vinblastine in patients with advanced urothelial cancer who are unfit for cisplatin-based chemotherapy: EORTC study 30986. J Clin Oncol. Vol. 30(2), P.191-199.
- Hirsch FR, et al. J Thoracic Oncol. 2017; 12(2): 208-222.
- Medical Systems Inc. VENTANA PD-L1 (SP142) Assay Interpretation Guide. pretation Guide. Реагент Ventana PD-L1 (SP142) IHC Assay для иммуногистохимической оценки лиганда-1 белка программируемой смерти в in vitro диагностике к иммуностейнерам автоматическим серии Ventana BenchMark №РЗН 2020 /9554 от 21.01.2020.
- Melosky B, Blais N, Cheema P, at al. Standardizing biomarker testing for Canadian patients with advanced lung cancer. Curr Oncol. 2018 Feb; 25(1): 73-82.
- Ratcliffe MJ, et al. Clin Cancer Res. 2017; 23(14): 3585–3581.
- Ilie M, et al. PLoSONE. 2017; 12(8): 1.
- Balar A.V., Dreicer R., Loriot Y. et al. Atezolizumab (atezo) in first-line cisplatin-ineligible or platinum-treated locally advanced or metastatic urothelial cancer (mUC): Long-term efficacy from phase 2 study IMvigor210. J Clin Oncol 36, 2018 (suppl; abstr 4523).
- Herbst RS et al. Lancet. 2016;387(10027):1540–1550.
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
PD-L1− это химическое вещество, лиганд, экспрессируемый опухолевыми клетками. На поверхности иммунокомпетентных клеток (Т-лимфоцитов) присутствует белок PD-1 (сокр. от Programmed cell Death-1). Когда Т-лимфоцит пытается прикрепиться к раковой клетке, чтобы разрушить ее, протеин PD-1 связывается с имеющимся на ее поверхности лигандом PD-L1. В результате функционирование иммунных клеток ингибируется: тормозится пролиферация, не происходит выделение цитокинов, губительных для злокачественных клеток. Таким образом, раковая опухоль отражает иммунную атаку и продолжает свой дальнейший рост. Оценка уровня экспрессии молекулы PD-L1 рассматривается как потенциальный биомаркер прогноза эффективности и продолжительности лечения злокачественных новообразований.
Лиганд PD-L1, лиганд рецептора программируемой клеточной смерти 1.
Какой биоматериал можно использовать для исследования?
Образец ткани (в парафиновом блоке).
Общая информация об исследовании
Иммуногистохимическое исследование - метод идентификации специфичных антигенных свойств ткани, основанный на обработке срезов маркированными специфическими антителами к выявляемому веществу, которое в данной ситуации служит антигеном. Современные системы визуализации комплекса антиген-антитело относятся к новому поколению фермент-опосредованных методов окраски и позволяют проводить иммунологические исследования с высокой специфичностью и чувствительностью.
В онкологии иммуногистохимическое исследование помогает выявить молекулярные структуры опухолевых клеток, ассоциированные со степенью дифференцировки, способностью их к инвазии и метастазированию, чувствительностью к химиотерапии, иммунотерапии, с особенностями течения и прогнозом заболевания у конкретного пациента; определить источник метастазирования при невыясненном первичном очаге, прогноз опухолевого процесса на дооперационном этапе и коррекцию схемы лечения; выбрать адекватную патогенетическую и таргетную терапию, определить наличие в опухолевых клетках различные точки приложения.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных рецепторов, точек приложения препаратов, направленных для их лечения. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету "увидеть" опухоль и уничтожить её. Ответственные за "видимость" опухоли белки PD-1 - PDL-1 и PDL-2 - в достаточном количестве присутствуют не во всех опухолях, именно поэтому одним пациентам иммунотерапия помогает, а другим нет. Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2. Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки. При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2 показано применение иммунотерапии препаратами Пембролизумабом (Кейтруда), Ниволумабом (Опдиво), Атезолизумабом (Тецентрик).
Доказано, что антитела к белкам PD-1 и PD-L1 борются с раком путем высвобождения Т-клеток организма, особого типа иммунных клеток. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
PD-1 - это клеточный рецептор, который играет важную роль в защите организма от сверхактивной иммунной системы. Т-клетки, которые являются иммунными клетками, учатся выявлять и уничтожать поврежденные или больные клетки и иногда могут ошибочно нападать на здоровые клетки, что провоцирует аутоиммунные заболевания, такие как волчанка или рассеянный склероз. PD-1 - это то, что называется иммунным чекпойнтом, рецептор белка, который подавляет очень активные Т-клетки, так что они имеют меньше шансов атаковать здоровые ткани.
Не так давно исследователи обнаружили, что раковые клетки научились использовать эту иммунную защиту для своих собственных целей. Опухолевые клетки разворачивают производство PD-L1-белков, которые распознаются PD-1-рецепторами, ингибируя атаку Т-клеток на опухоли. Больные раком лечатся антителами, блокирующими PD-1-рецепторы или фиксирующимися на обязательном партнере PD-L1, чтобы выключить "противоуничтожающий" сигнал и позволить Т-клеткам атаковать.
Также было обнаружено, что активация PD-1 ингибирует антираковую активность других иммунных клеток, макрофагов, и, когда PD-1 или PD-L1 рецепторы блокируются антителами, это заставляет эти макрофагиальные клетки атаковать рак.
В современной онкологии иммуногистохимическое исследование, в частности определение рецептора PD-L1 в ткани опухоли, играет важнейшую роль, так как при помощи этого онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Для чего используется исследование?
- Иммуногистохимия позволяет выявить гистологическую и нозологическую принадлежность опухоли. С помощью этого исследования определяется класс новообразования для проведения иммунотерапии.
- Иммуногистохимия позволяет определиться с тактикой лечения. В частности, этот метод исследования позволяет выявить чувствительность опухолевых клеток к воздействию препаратов иммунотерапии.
- С помощью иммуногистохимии врачи определяют резистентность опухоли к некоторым группам химиотерапевтических препаратов.
Когда назначается исследование?
- Анализ материала, взятого во время биопсии, для подбора иммунотерапии.
- Анализ материала, взятого во время операции, для подбора иммунотерапии.
Что означают результаты?
Заключение о позитивности/негативности опухоли по рецептору PD-L1.
Избыточная экспрессия PD-L1 выявляется в клетках более чем 50% опухолей человека, причем наиболее характерна для следующих новообразований:
- глиобластома и смешанная глиома (в 100% случаев),
- назофарингеальная карцинома (68-100%),
- множественная миелома (93%),
- опухоли мочевого пузыря (28-100%),
- немелкоклеточный рак легкого (35-95%),
- аденокарцинома кишечника (53%),
- гепатоцеллюлярная карцинома (45-93%),
- рак яичника (33-80%),
- рак поджелудочной железы (39%),
- злокачественные опухоли желудка и пищевода (42%).
Повышенная экспрессия PD-L1 в опухоли ассоциирована с неблагоприятным прогнозом при различных типах рака, включая рак почки, рак мочевого пузыря, рак пищевода, рак желудка, рак поджелудочной железы, рак печени, рак яичников.
Кто назначает исследование?
Малый клеточный рак легких (SCLC) является агрессивной злокачественностью с отчетливой естественной историей и мрачным прогнозом. SCLC характеризуется как нерегулярное новообразование с ограниченными терапевтическими возможностями, а химиотерапия на основе платины — это выбор. Запрограммированный клеточный гибель-лиганд 1 (PD-L1) -медицированный иммунный побег может быть подходящей мишенью для конкретной терапии, но его роль в SCLC неясна.
Всего было исследовано 186 случаев SCLC. Зараженные парафином участки опухолей окрашивали антителом PD-L1. Сверхэкспрессию PD-L1 обозначали окрашиванием мембраны PD-L1 от умеренной до сильной в ≥ 5% опухолевых клеток. Опухолевые клетки и инфильтрирующие лимфоциты оценивались отдельно.
Общая частота избыточной экспрессии PD-L1 в опухолевых клетках и инфильтрирующих опухолях лимфоцитах (TIL) составляла 78,0% и 54,3% соответственно. Высокая экспрессия PD-L1 опухоли достоверно коррелировала с высокой экспрессией TIL PD-L1 (P = 0,001) и стадией IV заболевания (P = 0,048). Многофакторный анализ показал, что высокая экспрессия PD-L1 опухоли и болезнь IV стадии были двумя независимыми факторами риска для плохой общей выживаемости.
Высокая экспрессия PD-L1 наблюдалась в SCLC по сравнению с их экспрессией в обычных NSCLC. Агрессивное поведение SCLC может быть частично связано с опосредованным PD-L1 иммунным побегом. Высокая экспрессия PD-L1 коррелирует с плохим прогнозом и может служить обоснованием для иммунотерапии для полноценного SCLC.
Малый клеточный рак легкого (SCLC) представляет собой агрессивный нейроэндокринный рак, который выделяет и реагирует на широкий спектр митогенных факторов роста пептидов, SCLC составляет 10-20% всех раковых заболеваний легких [1]. Он показывает отчетливую естественную историю с высоким пролиферативным индексом и необычайно сильной склонностью к раннему метастазированию [2]. Эти опухоли очень чувствительны к химиотерапии и лучевой терапии, но характеризуются относительно быстрым появлением хемо / радиорезистентности, а рецидивы распространены. Пятилетняя выживаемость составляет примерно 20-25% для стадии I-III заболевания, при котором опухоль ограничена одним гемитораксом и 5% для стадии IV заболевания, при котором опухоль метастазируется за пределы одного полуторакса [3]. Развитие системной терапии за последние 10 лет было разочаровывающим. Поэтому существует явная потребность в поиске новых терапевтических стратегий для лечения SCLC.
Целью этого исследования было проведение всестороннего исследования экспрессии PD-L1 у большой серии пациентов с SCLC и корреляция экспрессии с клинико-патологическими параметрами и клиническими исходами.
Сто шестьдесят семь (89,8%) пациентов были мужчинами, а 19 (10,2%) были женщинами (табл. 1). Сто шестьдесят (86%) пациентов были курильщиками. Средний возраст при постановке диагноза составил 67,1 года (дальность, 36-89 лет). Распределение SCLC-стадии среди пациентов было следующим: стадия I-III болезни, 74 пациента (39,8%) и IV стадии заболевания, 112 пациентов (60,2%) (таблица 1). Сто сорок шесть пациентов прошли химиотерапию, лучевую терапию или комбинированную химиолучевую терапию. Большинство пациентов умерло от болезни. Сто один пациент (54,3%) испытывал паранеопластический синдром (ПНС), который представлял собой гипонатриемию (50,5%), гипокалиемию (4,3%), гиперкалиемию (3,7%), гиперлипидемию (0,5%) или гипомагниевую (0,5%). Уровень ЛДГ в сыворотке был выше, чем верхний нормальный предел нормы у 98 пациентов (52,7%), тогда как высокий уровень СЕА в сыворотке был отмечен у 56 пациентов (30,1%).
* Нет информации у некоторых пациентов
Сокращения: PNS, паранеопластический синдром; PD-L1, запрограммированный лиганд смерти клеток 1; TIL, инфильтрационные опухоли лимфоциты.
Интересно, что расположение опухоли у пациентов с SCLC имело более высокую склонность к левому верхнему лепестку (36,0%), а затем правую верхнюю долю (23,7%). Распределение опухолей в левой нижней доле, правой средней доле и правой нижней доле было одинаковым: по 13,4%.
Учитывая очень ограниченную роль хирургии в SCLC, большинство материалов было собрано с помощью биопсий, в том числе: бронхоскопическая биопсия (125/186, 67,2%), биопсия с сонографией (30/186, 16,1%) или биопсия с КТ (22 / 186, 11,8%). Лишь несколько пациентов прошли операцию: лобэктомия (6/186, 3,2%) или резекция клина (3/186, 1,6%).
В гистологическом анализе опухоли характеризовались небольшими клетками с скудной цитоплазмой, слабо определенными границами клеток, мелкодисперсным гранулярным ядерным хроматином и отсутствующими или неприметными ядрами. Клетки были круглыми, овальными или веретенообразными (рис. 1А). В 103 опухолях 186 пациентов (55,4%) отмечалась некроз / оживленная апоптотическая активность (рисунок 1B).
A. Малая клеточная карцинома легких, состоящая из плотно упакованных небольших опухолевых клеток с скудной цитоплазмой, мелкозернистым ядерным хроматином и незаметными ядрышками. B. Некроз и оживленная апоптотическая активность являются общими.
Иммуноокрашивание PD-L1 наблюдалось в мембране опухолевых клеток и стромальных лимфоцитов. Мембранная реакционная способность опухоли PD-L1 (рис. 2А) была обнаружена у 145 из 186 пациентов (78,0%). Были также PD-L1-положительные моноцитарные клетки (рис. 2B) в соседней строме. Эти клетки были иммунореактивными на общий лейкоцитарный маркер IHC CD45 (фиг. 2C) и маркер Т-клеток CD3 (рисунок 2D), в то время как отрицательный для маркера макрофагов CD68 (фиг. 2E) и были рассмотрены ассоциированные с опухолью лимфоциты (TIL). Были отмечены различные количества TIL, и 101/186 случаев (54,3%) показали PD-L1-положительные TIL. Интенсивность окрашивания обычно была умеренной или сильной, аналогичной той, которая наблюдалась в опухолевых клетках. TIL часто находились на границе между клетками карциномы и стромой, с случайной инфильтрацией внутри клеток карциномы.
A. Положительное иммуногистохимическое окрашивание PD-L1 с мембранным рисунком в мелкоклеточной карциноме легкого. B. Кроме того, PD-L1 экспрессируется в опухолесодержащих лимфоцитах, которые окрашивают положительно для C. CD45 и D. маркер Т-клеток CD3, а для E. — маркер макрофагов CD68.

Благодаря развитию молекулярной биологии и генетики, в онкологии за последние десятилетия появилось много новых методов лечения. Созданы таргетные препараты, которые с точностью снайпера находят и блокируют молекулы, жизненно необходимые для раковых клеток. Иммунопрепараты активируют иммунитет и заставляют его эффективнее уничтожать опухолевую ткань.
Что такое PD1 и PD-L1, и какое значение имеют эти вещества при лечении рака?
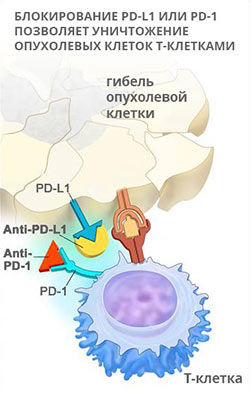
Подавляющие активность иммунитета рецепторы и их лиганды (молекулы, которые вступают в связь с рецептором и вызывают определенные эффекты) называются контрольными точками. К этому классу веществ относится мембранный белок — рецептор запрограммированной клеточной смерти PD1 и его лиганд PD-L1.
Белок PD1 встроен в мембрану иммунных клеток — T-лимфоцитов. PD-L1 экспрессируется на поверхности других иммунных клеток, которые взаимодействуют с T-лимфоцитами, а также клеток других тканей — слизистых оболочек, внутренней оболочки кровеносных сосудов. При взаимодействии PD1 и PD-L1 замедляется размножение T-лимфоцитов, снижается их активность.
В 2014 году в США были одобрены два ингибитора PD-1: пембролизумаб (Кейтруда) и ниволумаб (Опдиво) для борьбы с метастатической меланомой. В 2015 году их одобрили для лечения пациентов, страдающих немелкоклеточным раком легкого (НМРЛ). Среди ингибиторов PD-L1 применяют атезолизумаб (Тецентрик), авелумаб (Бавенсио), дурвалумаб (Имфинзи). Блокаторы PD1 и PD-L1 уже лицензированы для лечения различных типов рака и на данный момент продолжают исследоваться более чем в 1000 клинических испытаниях.
Зачем проводить анализ экспрессии PD-L1?
С появлением ингибиторов контрольных точек в развитии онкологии наступила новая эпоха. У врачей появился эффективный инструмент для борьбы со злокачественными опухолями на поздних стадиях. Ремиссия при метастатическом раке по-прежнему, как правило, невозможна, но иммунопрепараты помогают повысить выживаемость таких пациентов, затормозить прогрессирование болезни, когда не помогают другие виды лечения.
Однако, есть и некоторые проблемы. Ингибиторы контрольных точек помогают не всем. Они эффективны лишь в случаях, когда имеется повышенная экспрессия соответствующих молекул-мишеней, в частности, PD1 и PD-L1. Необоснованное назначение иммунопрепаратов недопустимо, потому что, при всех своих преимуществах, они могут вызывать весьма серьезные побочные эффекты. Лекарства стоят очень дорого, потому что производитель должен окупить огромные средства, вложенные в их разработку и клинические исследования.
Для врача-онколога важно четко определиться, кому из пациентов ингибиторы контрольных точек принесут реальную ощутимую пользу, есть ли веские основания, чтобы назначить их в конкретном случае. В этом помогает анализ экспрессии PD-L1.
Насколько такой анализ помогает повысить эффективность лечения?
В мае 2017 года был опубликован анализ 14 исследований, включивших 2019 пациентов с запущенным немелкоклеточным раком легкого, которые получали иммунотерапию. Авторы публикации пришли к выводу о том, что сверхэкспрессия PD-L1 является прогностическим фактором более высокой выживаемости на фоне терапии ингибиторами контрольных точек.
Кому стоит выполнить анализ экспрессии PD-L1?
Исследование в первую очередь рекомендовано пациентам, которые страдают немелкоклеточным раком легкого на поздних стадиях. При этой злокачественной опухоли позитивный результат анализа экспрессии PD-L1 встречается в 60–65% случаев, высокопозитивный — в 23–25% случаев.
Как проводят исследование?
Для того чтобы проверить экспрессию PD-L1, нужен образец ткани, в котором содержится не менее 100 опухолевых клеток. Его можно получить во время операции или биопсии. Материал исследуют иммуногистохимическим методом с помощью специальных моноклональных антител. В зависимости от уровня экспрессии PD-L1, может быть получен один из трех результатов:
- Отрицательный — PD-L1 1%.
- Высокоположительный — PD-L1>50%.
В современной онкологии крайне важен персонализированный подход к выбору противоопухолевой терапии. Это дает уверенность в том, что пациенту было назначено оптимальное лечение. Врачи Европейской клиники следуют данному принципу и применяют наиболее современные технологии. В этом нам помогает сотрудничество с ведущими зарубежными онкологическими центрами, специализированными лабораториями. Свяжитесь с нами, мы знаем, как помочь:
Читайте также:

