Опухоль на подвздошных сосудах
К опухолям подвздошного типа относятся все новообразования доброкачественного и злокачественного характера, располагающихся в забрюшинной области. Для патологического синдрома свойственно длительное отсутствие клинических признаков. При крупногабаритных новообразованиях отмечаются расстройства диспепсического типа, отекают нижние конечности. Диагноз устанавливается врачом на основе ряда процедур: ультразвуковое исследование, магнитно-резонансная терапия и другие. Код по МКБ — C 17.2.
Причины возникновения заболевания
Были выявлены провоцирующие факторы, значительно повышающие риск прогрессирования доброкачественной или злокачественной опухоли.
- Нарушения в генетике, которые ассоциируются с новообразованиями подвздошного типа, условно разделяются на специфические и неспецифические. К первой категории относят мутации KIT, ко второй относятся мутации p53.
- Излучение ионизирующего характера также повышает риск образования рака в подвздошном пространстве. У многих пациентов после прохождения лучевой терапии диагностировалось новообразование. Молекулярные изменения в ходе ионизирующего облучения врачами изучены не были. Важным моментом является то, что опухоли прогрессируют в тканях, находящихся на границе облучения.
- Медицинские исследования подтверждают, что риск возникновения сарком, в том числе и в подвздошной области, увеличивается под влиянием пестицидов, которые используются в области сельского хозяйства. Некоторые объясняют это имунносупрессией, развивающейся под влиянием вышеописанных химических препаратов.
Существует несколько предположений, которые не имеют под собой исследовательской базы, например, повышение вероятности прогрессирования опухоли после ушиба. Точные причины возникновения новообразований в подвздошной области пока неизвестны.
Клинические признаки забрюшинных опухолей
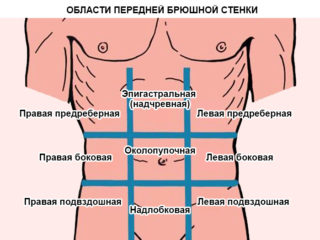
Проявления заболевания не зависят от стороны расположения опухоли, слева или справа в подвздошной области. Патологический синдром характеризуется длительным отсутствием симптомов. К признакам прогрессирования новообразования в подвздошной области следует отнести поражения органов и сосудистых каналов, которые участвуют в патологическом процессе во второстепенной роли. Широкое разнообразие симптомов заболевания объясняется возможностью расположения злокачественного или доброкачественного новообразования. Патология может развиваться в области малого таза или диафрагмы. От расположения опухоли зависят клинические признаки, а также ее объемные показатели. В некоторых случаях симптоматика напоминает аппендицит.
Клинические признаки отсутствуют на первых стадиях развития заболевания по причине рыхлости забрюшинной области. Симптомы развиваются либо из-за опухоли, либо из-за повышенного давления на органы, располагающихся вблизи.
У 4 из 5 пациентов с диагностированной забрюшинной опухолью в правой подвздошной области отмечается пальпируемый характер. У 2 из 5 больных в процессе прощупывания параколярной и других разновидностей новообразования имеются болезненные ощущения в области левого подреберья и других участков ЖКТ, локализация определяется месторасположением опухоли. Гематома подвздошной области характеризуется малой степенью подвижности. Консистенция зависит от множества факторов. Многие пациенты жалуются на болезненные и дискомфортные ощущения в области живота, возникает чувство тяжести. Больной быстро наедается, процесс дефекации затрудняется. Это объясняется сдавливанием отделов желудочно-кишечного тракта.
Если новообразование располагается в нижней части живота, возникают проблемы с мочеиспускательным процессом. Компрессия венозных каналов провоцирует отечность нижних конечностей. При высоком расположении опухоли создается давление на диафрагму, что провоцирует развитие одышки.
На заключительных этапах прогрессирования патологического синдрома отмечается повышенная температура тела, больной худеет, развивается хроническая усталость. Это результат интоксикации организма в результате распада новообразования, начавшегося процесса метастазирования.
Клинические признаки неврологического характера объясняются сдавливанием нервных стволов, отмечаются у 3 из 10 пациентов. Отличием патологического синдрома в подвздошной области считается высокая вероятность рецидива. После радикальной методики лечения заболевание развивается снова более чем в половине всех случаев. Кистозное объемное образование справа в подвздошной области характеризуется метастазированием лишь в 15%. Клинические признаки одинаковы у детей, женщин и мужчин.
Чаще процесс распространения метастазов затрагивает систему печени или легких, редко поражаются лимфоузлы.
Диагностирование патологического синдрома
Диагноз устанавливается на основе сбора анамнеза, жалоб пациента, а также дополнительных процедур. При наличии подозрений на прогрессирование новообразования подвздошного характера пациента направляют на ультразвуковое исследование, компьютерную томографию забрюшинной области. Также используется магнитно-резонансная томография.
Диагностические процедуры дают возможность определить расположение опухоли, её структуру, влияние на близкорасполагающиеся органы, наличие или отсутствие метастазирования. В зависимости от плотности, гомогенности, формы новообразования удается определить характер заболевания.
Для определения функционирования работы системы желудочно-кишечного и мочеиспускательного тракта используются рентгеноконтрастные методики исследования. Для обнаружения герминогенной разновидности патологического синдрома используются тесты на альфа-фетопротеин. Биопсия используется в редких случаях, что объясняется высокой вероятностью обсеменения. К исключениям относятся ситуации, когда материал требуется для определения характера заболевания или для дальнейшего планирования хирургической методики лечения.
Лечение и прогноз опухоли подвздошного типа
Единственным эффективным способом терапии считается резекция новообразования. Согласно статистическим данным это повышает пятилетнюю выживаемость до 50%. В качестве оперативного вмешательства чаще других используется лапаратомия. Доступ сбоку считается менее приемлемым вариантом, что объясняется затруднениями в процессе удаления новообразования. Становится сложнее контролировать сосуды, снабжающие опухоль кровеносными тельцами.
При верхней локализации патологического синдрома, используется торакоабдоминальный доступ. Изначально проводится лапаратомия, позволяющая определить возможность удаления новообразования, наличие метастазов. Нередко после разреза проводится биопсия клиновидного характера, если имеются подозрения на прогрессирование лимфатических кист в подвздошной области.
Одним из положительных факторов для дальнейшего прогноза считается отсутствие признаков объемного образования в правой подвздошной области по краям удаления. Однако процесс резекции анэхогенного новообразования довольно затруднителен, что объясняется солидными габаритами патологии, а также сложностью строения подвздошной области.
Степень резектабельности, по статистическим данным, имеет широкий диапазон, от 25 до 95%. Причиной низкой операбельности является распространение отсевов в сосудистые каналы магистрального типа, отдаленное метастазирование. После хирургического вмешательства не исключается возможность рецидивов в течение первых 5 лет жизни после операции. Повторное уплотнение диагностируется у каждого 2 больного.
Нерадикальные методики хирургического вмешательства считаются оптимальным вариантом при клинических признаках непроходимости желудочно-кишечного тракта. Подобные мероприятия позволяют увеличить выживаемость только при липосаркоме на начальных этапах её развития.
Злокачественные и доброкачественные опухоли, расположенные в подвздошной области, отличаются неутешающим прогнозом. Пятилетняя выживаемость пациентов при обнаружении патологического синдрома на поздней стадии развития составляет около 25%. Рецидивный характер является главной причиной высокой смертности. С каждым повторным возникновением опухоли вероятность проведения радикальной хирургической терапии уменьшается. После оперативной методики лечения назначают лучевую или химиотерапию.
Чтобы улучшить прогноз, больному требуется обратиться в медицинское учреждение при первых признаках кисты подвздошных сосудов.
Реферат. Лечение забрюшинных опухолей является трудной, многокомпонентной задачей для онкологов. Удаление опухоли с соблюдением онкологических принципов футлярности и зональности части приводит к образованию обширных дефектов на магистральных сосудах. Широкое внедрение новейших методов пластической сосудистой хирургии позволило значительно повысить процент сохранных операций и улучшить качество жизни многих пациентов. Проведен анализ результатов комбинированного лечения у 58 пациентов с местно-распространенными саркомами мягких тканей с инвазией в магистральные сосуды. Использованы реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей, а также первый опыт в протезирования брюшной части аорты. Представленный анализ результатов, показывает что соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить число органосохранных операций при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
Ключевые слова: забрюшинные опухоли, магистральные сосуды, реконструктивная хирургия.
Вовлечение в опухолевый инфильтрат магистральных сосудов, в том числе брюшного отдела аорты, традиционно считается одним из противопоказаний к радикальному хирургическому лечению при злокачественных опухолях брюшной полости и забрюшинного пространства. Такие поражения считаются неоперабельными из-за технических сложностей вмешательства и сомнений в его радикализме. Тем не менее в довольно редких публикациях, посвященных этой проблеме, продолжительность и качество жизни пациентов после комбинированных операций с протезированием аорты при некоторых заболеваниях оказываются вполне удовлетворительными [1].
Удаление забрюшинной опухоли больших размеров, нередко на фоне затрудненного кровотока по нижней полой вене и наличия множественных венозных коллатералей, сопровождается массивной кровопотерей и требует высокой квалификации хирургической, анестезиологической и реанимационной бригады, достаточной технической оснащенности. При выполнении комбинированных вмешательств возможно вскрытие просвета тонкой или толстой кишки и инфицирование брюшной полости в зоне протеза и т.д.
Первые попытки моноблочного удаления опухоли и участка сосудистой магистрали с последующим восстановлением целостности сосуда были предприняты Г.Л. Ратнером (1961) и E.S. Crawford et al. (1956). Однако с тех пор за полувековой период опубликованы лишь немногочисленные работы, касающиеся реконструкции МСЖ при хирургическом лечении опухолей органов живота. Между тем широкое применение сосудистой хирургии в абдоминальной онкологии предполагает увеличение группы резек-табельных наблюдений, повышение радикальности операции, выполнение операций, определяющих качество жизни пациентов. Таким образом, назрела необходимость в реализации давно предложенной ангиоонкологической стратегии, разработке комбинированных ангиоонкологических операций на основе известных приемов и методов сосудистой техники и определение четких показаний к этим операциям.
До сих пор довольно большое число онкологических больных (70—80%) поступает в стационар с распространенным опухолевым процессом. При этом имеет место высокая частота сосудистой инвазии. Несмотря на вышеизложенное, на сей день нет единой точки зрения в хирургическом лечении местно-распространенного опухолевого процесса. Бытует мнение, что разумным решением при данном поражении является отказ от попытки удаления опухоли либо выполнение циторедуктивных и паллиативных вмешательств. В то же время именно местно-распространенный опухолевый процесс с вовлечением магистральных сосудов наглядно отражает острую необходимость в объединении усилий онкологов и ангиохирургов.
Литературные данные последних лет свидетельствуют не только о росте онкологических заболеваний, но и о заметном увеличении числа неоперабельных больных с данной патологией (Илюхин Ю.А., 1998; Тарасов В.А. и др., 2000; Heda К. et al., 2001). Ключевым признаком неоперабельности опухоли считается вовлечение в опухолевой инфильтрат магистрального кровеносного сосуда. Несмотря на достижения современной сосудистой хирургии и позитивного опыта протезирования кровеносных сосудов у онкологических больных, отношение большинства хирургических клиник к возможностям радикального оперативного лечения больных этой категории в настоящее время представляется более чем сдержанным. Все еще высок процент отказа от радикальных операций в связи с опасностью повреждения сосудов или необходимостью вмешательств на них (Васютков В.Я., 1988; Дудицкая Т.К., 1994; Гробель О.В., 1999). При современном развитии ангиохирургии следует признать необоснованным частичное удаление новообразований с неизбежным сохранением опухолевых клеток в непосредственной близости от магистральных сосудов, поскольку это с высокой вероятностью сопровождается рецидивированием процесса и метастазами.
Впервые отдельные сообщения о произведенных реконструктивных вмешательствах на аорте и магистральных артериях при удалении новообразований различной локализации стали появляться с начала 50-х годов (Moore, 1952; Conley, 1953; Lord, Sehetlin, 1954; Lawrence, 1957). В отечественной литературе впервые такая операция была предпринята Г.Л. Ратне-ром в 1961 г., успешно выполнившим реконструкцию сосуда при удалении злокачественной опухоли мягких тканей бедра.
В последние годы сообщения о сосудистых реконструкциях в онкологической практике стали встречаться все чаще (Васютков В.Я., 1995; Зотов С.П., 1996, 1999; Соболевский В.А., 1999; Bianchi С. et al., 1999; Matsushita М. et al., 2001). Вместе с тем следует отметить, что в большинстве публикаций представлены лишь единичные наблюдения об успешно выполненных операциях, что свидетельствует только о принципиальной возможности сосудистой пластики у онкологических больных.
Такие важнейшие аспекты проблемы, как доопера-ционное определение степени вовлеченности сосуда в опухолевый процесс, выбор объема операции на сосудах и пластического материала в зависимости от локализации и морфологии опухоли, а также оценка результатов комбинированного лечения данного контингента пациентов и качества их жизни в разные периоды после операции представляют актуальную задачу не только для онкологии и сосудистой хирургии, но и для широкого круга специалистов разного профиля.
Указанные обстоятельства требуют широкопланового исследования на стыке двух специальностей: онкологии и сосудистой хирургии, и имеют не только медицинское, но и социальное значение.
Удобство использования готового пластического материала с необходимыми качествами и заложенной геометрией различных сосудов привело к широкому использованию синтетических имплантатов. Синтетические протезы изготавливаются из инертных полимеров. Они хорошо зарекомендовали себя при работе в крупных магистральных артериях.
Таким образом, когда возникает необходимость пластики дефектов аорты, это в подавляющем большинстве случаев выполняется с помощью синтетических протезов, поскольку они производятся серийно нескольких типов и размеров, функционировать могут десятилетия, однако общим основным недостатком для них является нестойкость к инфекции.
Таким образом, одной из нерешенных проблем сосудистой хирургии остается недостаточная эффективность современных методов профилактики осложнений протезирования сосудов в условиях инфицированной раны. Существование данной проблемы обусловлено тем, что использовать комбинированные протезы не всегда возможно из-за их отсутствия в экстренных ситуациях, аутовена может быть ранее удалена при флебэктомии или потребоваться в дальнейшем для АКШ или БПШ, или просто ее может быть недостаточно по площади для пластики большого дефекта. Все это побуждает к поиску новых материалов и способов их пластики, которые отвечали бы следующим требованиям: а) стойкость к инфекции; б) достаточные размеры для пластики больших дефектов; в) вызывающие минимальные иммунные реакции в организме (что наиболее легко достигается, если пластический материал является аутотканью).
При соблюдении этих требований трансплантат также должен быть мобильным, обладать достаточной эластичностью и прочностью, не подвергаться склерозированию, деформации и дилатации под действием давления крови в аорте.
Цель работы — улучшение показателей радикальных операций при удалении опухолей различной локализации путем усовершенствования хирургической тактики на магистральных сосудах.
Приводим наш опыт лечения больных с опухолями различных локализаций с инвазией магистральных сосудов. С 1995 по 2012 г. реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей выполнено у 58 больных. Возраст больных — от 22 до 63 лет, мужчин 43, женщин 15. В дооперационном периоде больные обследованы на УЗИ, КТ, МРТ, УЗ-допплерографии, при необходимости проводилась ангиография. По данным этих исследований, у 41 больного до операции была инвазия сосудов. Изолированная пластика дефекта сегмента артерии выполнена у 38 больных, пластика дефекта вен — у 12, сочетанная пластика артерии и вены — у 8 больных. Показанием к выполнению реконструктивных вмешательств явилось прорастание опухоли или метастазов в стенку магистрального сосуда: в бедренную артерию (10), бедренную вену (3), наружную подвздошную артерию (8), наружную подвздошную вену (8), общую сонную артерию (8), бифуркацию сонной артерии (7), внутреннюю сонную артерию (3), плечевую артерию (10), подключичную вену (4), яремную вену (3). В 14 случаях было прорастание сонных артерий метастазами опухолей головы и шеи.

Клинический случай. В 2012 г. в абдоминальное отделение РКОД МЗ РТ поступила пациентка Ш., 56 лет, с диагнозом: опухоль забрюшинного пространства. При обследовании, по данным КТ, МРТ органов брюшной полости, выявлена опухоль забрюшинного пространства ниже почечных сосудов на уровне L3—L4 размерами 82x78 мм, охватывающая брюшную часть аорты.
При планировании хирургического вмешательства у пациентки с забрюшинной опухолью, расположенной вблизи аорты и, возможно, прорастающей в стенку, перед ведущими специалистами РКОД МЗ РТ стоял ряд вопросов: показано ли хирургическое лечение, существует ли техническая возможность удаления опухоли, насколько высок риск вмешательства, насколько соответствует степень риска ожидаемым ближайшим и отдаленным результатам, какова готовность хирургической, анестезиологической и реанимационной бригады к выполнению комбинированного, чреватого массивной кровопотерей вмешательства?
Учитывая современную оснащенность РКОД МЗ РТ и богатый опыт специалистов в лечении забрюшин-ных опухолей, решено было выполнить радикальное оперативное лечение.
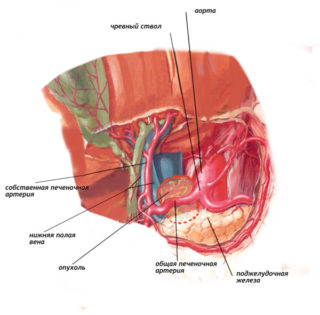
Первым этапом во время операции выполнена ревизия органов брюшной полости, где была выявлена забрюшинная опухоль 8x7 см, располагающаяся на передней поверхности аорты и нижней полой вены (рис. 1). Верхний полюс располагался дистальнее впадения почечных вен, нижний полюс — проксимальнее устья нижней брыжеечной артерии.

Опухоль охватывала данные сосуды по передней и боковым поверхностям полуциркулярно, неподвижно. Для верификации диагноза интро-операционно была выполнена срочная гистология, результат — лейомиосаркома. Нижняя брыжеечная артерия перевязана и пересечена у устья. Аорта отделена от позвоночной фасции (рис. 2). Выполнено удаление опухоли с резекцией брюшной части аорты (рис. 3).



Соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить
число органосохранных операций на магистральных сосудах при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
1. Babaian, R.J. Complications of transabdominal retroperito-neal lymphadenectomy / R.J. Babaian, R.B. Bracken, D.E. Johnson // Urology. — 1981. — Vol. 17. — P. 126—131.
2. Beck, S.D.W. Aortic replacement during post-chemotherapy retroperitoneal lymph node dissection / S.D.W. Beck, R.S. Foster, R. Bihle [et al.] // J. Urol. — 2001. — Vol. 165. — P. 1517—1520.
3. Bohner, H. Primary malignant tumors of the aorta: Clinical presentation, treatment, and course of different entities / H. Bohner, B. Luther, S. Braunstein [et al.] // J. Vasc. Surg. — 2003. — Vol. 38. — P. 1430—1433.
Реферат. Лечение забрюшинных опухолей является трудной, многокомпонентной задачей для онкологов. Удаление опухоли с соблюдением онкологических принципов футлярности и зональности части приводит к образованию обширных дефектов на магистральных сосудах. Широкое внедрение новейших методов пластической сосудистой хирургии позволило значительно повысить процент сохранных операций и улучшить качество жизни многих пациентов. Проведен анализ результатов комбинированного лечения у 58 пациентов с местно-распространенными саркомами мягких тканей с инвазией в магистральные сосуды. Использованы реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей, а также первый опыт в протезирования брюшной части аорты. Представленный анализ результатов, показывает что соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить число органосохранных операций при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
Ключевые слова: забрюшинные опухоли, магистральные сосуды, реконструктивная хирургия.
Вовлечение в опухолевый инфильтрат магистральных сосудов, в том числе брюшного отдела аорты, традиционно считается одним из противопоказаний к радикальному хирургическому лечению при злокачественных опухолях брюшной полости и забрюшинного пространства. Такие поражения считаются неоперабельными из-за технических сложностей вмешательства и сомнений в его радикализме. Тем не менее в довольно редких публикациях, посвященных этой проблеме, продолжительность и качество жизни пациентов после комбинированных операций с протезированием аорты при некоторых заболеваниях оказываются вполне удовлетворительными [1].
Удаление забрюшинной опухоли больших размеров, нередко на фоне затрудненного кровотока по нижней полой вене и наличия множественных венозных коллатералей, сопровождается массивной кровопотерей и требует высокой квалификации хирургической, анестезиологической и реанимационной бригады, достаточной технической оснащенности. При выполнении комбинированных вмешательств возможно вскрытие просвета тонкой или толстой кишки и инфицирование брюшной полости в зоне протеза и т.д.
Первые попытки моноблочного удаления опухоли и участка сосудистой магистрали с последующим восстановлением целостности сосуда были предприняты Г.Л. Ратнером (1961) и E.S. Crawford et al. (1956). Однако с тех пор за полувековой период опубликованы лишь немногочисленные работы, касающиеся реконструкции МСЖ при хирургическом лечении опухолей органов живота. Между тем широкое применение сосудистой хирургии в абдоминальной онкологии предполагает увеличение группы резек-табельных наблюдений, повышение радикальности операции, выполнение операций, определяющих качество жизни пациентов. Таким образом, назрела необходимость в реализации давно предложенной ангиоонкологической стратегии, разработке комбинированных ангиоонкологических операций на основе известных приемов и методов сосудистой техники и определение четких показаний к этим операциям.
До сих пор довольно большое число онкологических больных (70—80%) поступает в стационар с распространенным опухолевым процессом. При этом имеет место высокая частота сосудистой инвазии. Несмотря на вышеизложенное, на сей день нет единой точки зрения в хирургическом лечении местно-распространенного опухолевого процесса. Бытует мнение, что разумным решением при данном поражении является отказ от попытки удаления опухоли либо выполнение циторедуктивных и паллиативных вмешательств. В то же время именно местно-распространенный опухолевый процесс с вовлечением магистральных сосудов наглядно отражает острую необходимость в объединении усилий онкологов и ангиохирургов.
Литературные данные последних лет свидетельствуют не только о росте онкологических заболеваний, но и о заметном увеличении числа неоперабельных больных с данной патологией (Илюхин Ю.А., 1998; Тарасов В.А. и др., 2000; Heda К. et al., 2001). Ключевым признаком неоперабельности опухоли считается вовлечение в опухолевой инфильтрат магистрального кровеносного сосуда. Несмотря на достижения современной сосудистой хирургии и позитивного опыта протезирования кровеносных сосудов у онкологических больных, отношение большинства хирургических клиник к возможностям радикального оперативного лечения больных этой категории в настоящее время представляется более чем сдержанным. Все еще высок процент отказа от радикальных операций в связи с опасностью повреждения сосудов или необходимостью вмешательств на них (Васютков В.Я., 1988; Дудицкая Т.К., 1994; Гробель О.В., 1999). При современном развитии ангиохирургии следует признать необоснованным частичное удаление новообразований с неизбежным сохранением опухолевых клеток в непосредственной близости от магистральных сосудов, поскольку это с высокой вероятностью сопровождается рецидивированием процесса и метастазами.
Впервые отдельные сообщения о произведенных реконструктивных вмешательствах на аорте и магистральных артериях при удалении новообразований различной локализации стали появляться с начала 50-х годов (Moore, 1952; Conley, 1953; Lord, Sehetlin, 1954; Lawrence, 1957). В отечественной литературе впервые такая операция была предпринята Г.Л. Ратне-ром в 1961 г., успешно выполнившим реконструкцию сосуда при удалении злокачественной опухоли мягких тканей бедра.
В последние годы сообщения о сосудистых реконструкциях в онкологической практике стали встречаться все чаще (Васютков В.Я., 1995; Зотов С.П., 1996, 1999; Соболевский В.А., 1999; Bianchi С. et al., 1999; Matsushita М. et al., 2001). Вместе с тем следует отметить, что в большинстве публикаций представлены лишь единичные наблюдения об успешно выполненных операциях, что свидетельствует только о принципиальной возможности сосудистой пластики у онкологических больных.
Такие важнейшие аспекты проблемы, как доопера-ционное определение степени вовлеченности сосуда в опухолевый процесс, выбор объема операции на сосудах и пластического материала в зависимости от локализации и морфологии опухоли, а также оценка результатов комбинированного лечения данного контингента пациентов и качества их жизни в разные периоды после операции представляют актуальную задачу не только для онкологии и сосудистой хирургии, но и для широкого круга специалистов разного профиля.
Указанные обстоятельства требуют широкопланового исследования на стыке двух специальностей: онкологии и сосудистой хирургии, и имеют не только медицинское, но и социальное значение.
Удобство использования готового пластического материала с необходимыми качествами и заложенной геометрией различных сосудов привело к широкому использованию синтетических имплантатов. Синтетические протезы изготавливаются из инертных полимеров. Они хорошо зарекомендовали себя при работе в крупных магистральных артериях.
Таким образом, когда возникает необходимость пластики дефектов аорты, это в подавляющем большинстве случаев выполняется с помощью синтетических протезов, поскольку они производятся серийно нескольких типов и размеров, функционировать могут десятилетия, однако общим основным недостатком для них является нестойкость к инфекции.
Таким образом, одной из нерешенных проблем сосудистой хирургии остается недостаточная эффективность современных методов профилактики осложнений протезирования сосудов в условиях инфицированной раны. Существование данной проблемы обусловлено тем, что использовать комбинированные протезы не всегда возможно из-за их отсутствия в экстренных ситуациях, аутовена может быть ранее удалена при флебэктомии или потребоваться в дальнейшем для АКШ или БПШ, или просто ее может быть недостаточно по площади для пластики большого дефекта. Все это побуждает к поиску новых материалов и способов их пластики, которые отвечали бы следующим требованиям: а) стойкость к инфекции; б) достаточные размеры для пластики больших дефектов; в) вызывающие минимальные иммунные реакции в организме (что наиболее легко достигается, если пластический материал является аутотканью).
При соблюдении этих требований трансплантат также должен быть мобильным, обладать достаточной эластичностью и прочностью, не подвергаться склерозированию, деформации и дилатации под действием давления крови в аорте.
Цель работы — улучшение показателей радикальных операций при удалении опухолей различной локализации путем усовершенствования хирургической тактики на магистральных сосудах.
Приводим наш опыт лечения больных с опухолями различных локализаций с инвазией магистральных сосудов. С 1995 по 2012 г. реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей выполнено у 58 больных. Возраст больных — от 22 до 63 лет, мужчин 43, женщин 15. В дооперационном периоде больные обследованы на УЗИ, КТ, МРТ, УЗ-допплерографии, при необходимости проводилась ангиография. По данным этих исследований, у 41 больного до операции была инвазия сосудов. Изолированная пластика дефекта сегмента артерии выполнена у 38 больных, пластика дефекта вен — у 12, сочетанная пластика артерии и вены — у 8 больных. Показанием к выполнению реконструктивных вмешательств явилось прорастание опухоли или метастазов в стенку магистрального сосуда: в бедренную артерию (10), бедренную вену (3), наружную подвздошную артерию (8), наружную подвздошную вену (8), общую сонную артерию (8), бифуркацию сонной артерии (7), внутреннюю сонную артерию (3), плечевую артерию (10), подключичную вену (4), яремную вену (3). В 14 случаях было прорастание сонных артерий метастазами опухолей головы и шеи.

Клинический случай. В 2012 г. в абдоминальное отделение РКОД МЗ РТ поступила пациентка Ш., 56 лет, с диагнозом: опухоль забрюшинного пространства. При обследовании, по данным КТ, МРТ органов брюшной полости, выявлена опухоль забрюшинного пространства ниже почечных сосудов на уровне L3—L4 размерами 82x78 мм, охватывающая брюшную часть аорты.
При планировании хирургического вмешательства у пациентки с забрюшинной опухолью, расположенной вблизи аорты и, возможно, прорастающей в стенку, перед ведущими специалистами РКОД МЗ РТ стоял ряд вопросов: показано ли хирургическое лечение, существует ли техническая возможность удаления опухоли, насколько высок риск вмешательства, насколько соответствует степень риска ожидаемым ближайшим и отдаленным результатам, какова готовность хирургической, анестезиологической и реанимационной бригады к выполнению комбинированного, чреватого массивной кровопотерей вмешательства?
Учитывая современную оснащенность РКОД МЗ РТ и богатый опыт специалистов в лечении забрюшин-ных опухолей, решено было выполнить радикальное оперативное лечение.
Первым этапом во время операции выполнена ревизия органов брюшной полости, где была выявлена забрюшинная опухоль 8x7 см, располагающаяся на передней поверхности аорты и нижней полой вены (рис. 1). Верхний полюс располагался дистальнее впадения почечных вен, нижний полюс — проксимальнее устья нижней брыжеечной артерии.

Опухоль охватывала данные сосуды по передней и боковым поверхностям полуциркулярно, неподвижно. Для верификации диагноза интро-операционно была выполнена срочная гистология, результат — лейомиосаркома. Нижняя брыжеечная артерия перевязана и пересечена у устья. Аорта отделена от позвоночной фасции (рис. 2). Выполнено удаление опухоли с резекцией брюшной части аорты (рис. 3).



Соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить
число органосохранных операций на магистральных сосудах при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
1. Babaian, R.J. Complications of transabdominal retroperito-neal lymphadenectomy / R.J. Babaian, R.B. Bracken, D.E. Johnson // Urology. — 1981. — Vol. 17. — P. 126—131.
2. Beck, S.D.W. Aortic replacement during post-chemotherapy retroperitoneal lymph node dissection / S.D.W. Beck, R.S. Foster, R. Bihle [et al.] // J. Urol. — 2001. — Vol. 165. — P. 1517—1520.
3. Bohner, H. Primary malignant tumors of the aorta: Clinical presentation, treatment, and course of different entities / H. Bohner, B. Luther, S. Braunstein [et al.] // J. Vasc. Surg. — 2003. — Vol. 38. — P. 1430—1433.
Читайте также:

