Опухоль на легком с прорастанием в аорту
Рак лёгкого с прорастанием в лёгочную артерию
Здравствуйте, уважаемые специалисты!
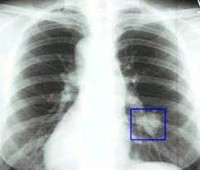
В марте 2005 г. у моей мамы (58 лет) при флюорографии была обнаружена опухоль правого лёгкого (предыдущая флюорография проводилась 2 года назад). Клинических симптомов на тот момент никаких не было. Очень подвижна, работоспособна. Кашля не было, болей в груди не было. Простудными, инфекционными заболеваниями болела очень редко.
В онкологический диспансер она не пошла. Все назначаемые исследования проводились в обычной городской больнице. На рентгенографии - опухоль в 3 сегменте верхней доли правого лёгкого. На бронхоскопии - никаких изменений нет, в том числе взятый при бронхоскопии кусочек на биопсию. Кровь в норме. Лимфоузлы в норме. Компьютерная рентгенотомография не проводилась. Была назначена операция по удалению опухоли и верхней доли правого лёгкого.
На операции (диагноз из выписки): опухоль правого главного бронха с прорастанием в лёгочную артерию верхней полой вены 2,5-3 см, в 3 сегмент верхней доли правого лёгкого. Гистология: анапластический рак. T4N1M1
Хирург, проводивший операцию, сказал мужу больной, что опухоль неоперабельная из-за прорастания в лёгочную артерию, и никто не возьмется её делать. И направил в онкодиспансер.
В онкодиспансере хирург-онколог усомнился в правильности диагноза и назначил повторную бронхоскопию. Эта бронхоскопия - так же: трахея, бронхи чистые, полностью проходимые, нет никаких изменений. После неё хирург-онколог сказал больной, что снимает часть диагноза, касающуюся главного бронха, и ставит 2 стадию. Но операция невозможна из-за спаек после первой операции. И направил к терапевтам-химикам. В данный момент мама проходит первый курс химиотерапии.
С этими хирургами я сама поговорить не могу, так как проживаю в другом городе. Поэтому, пожалуйста, ответьте:
1. что такое анапластический рак?
2. T4N1M1 - это 4 стадия? И как поставили М1 (отдалённые метастазы), если никаких исследований других органов не проводилось?
3. Возможно ли прооперировать эту опухоль, ведь, наверное, необходимо протезирование лёгочной артерии?
4. И если возможно, то в какие клиники России можно обратиться, желательно поближе к Казахстану (Омск, Новосибирк, Барнаул), где делают подобные операции?
Спасибо за ответ.
Анапластический рак - разновидность, с одной стороны, довольно злокачественная и агрессивная, а с другой - нередко малочувствительная к химиотерапии, поэтому в отношении такой формы рака легкого прежде всего всегда приходится изучать возможности хирургического лечения.
Повидимому, дело обстоит следующим образом: в городской больнице во время операции первичная периферическая опухоль, находящаяся в 3-м сегменте правого легкого, была ошибочно принята за отдаленный метастаз в том же легком, а регионарные метастазы в бронхопульмональных лимфатических узлах были опять-таки ошибочно приняты за первичную опухоль. Отсюда и М1 в стадии - обозначение отдаленных метастазов.
Таким образом, проблем со стороны метастазов пока не предвидится. Другое дело - распространенность первичной опухоли. Если всё обстоит так, как Вы написали, и опухоль прорастает только ПРАВУЮ легочную артерию и верхнюю полую вену, - тогда она в принципе вполне удалима. Легочную артерию при этом протезировать, скорее всего, не придется - целесообразнее, как представляется, удалить всё легкое вместе с его легочной артерией. Протезировать придется верхнюю полую вену: это делается в немногих российских клиниках, но возможно.
Если же опухолью поражен общий ЛЕГОЧНЫЙ СТВОЛ - дело серьезнее, но и здесь возможны варианты.
Сейчас, поскольку уже начата химиотерапия (кстати, какими препаратами, по какой схеме?), я бы рекомендовал провести два цикла, недели через три после второго сделать или магнитно-резонансную томографию грудной клетки, или спиральную компьютерную томографию с болюсным контрастированием сосудов, на этом основании определиться с динамикой - увеличилась ли опухоль и ее метастазы в лимфатических узлах, уменьшились ли они, или остались без изменения - и на этом основании решить вопрос о продолжении химиотерапии или об операции.
Такое препятствие к операции, как спайки после перенесенной диагностической лапаротомии, не представляется мне состоятельным.
Что касается вопроса о том, куда обращаться для операции, с учетом поражения сосудов. Пожалуй, ближе всего к Вам Челябинский областной онкологический центр - там есть такой профессор Фокин, к нему и можно обратиться. Можно было бы, разумеется, и к нам, но наш адрес для Вас - самый далекий в СНГ.
Уважаемый Евгений Серафимович!
Большое спасибо за быстрый ответ. Обязательно сделаем рекомендованную Вами диагностику. Уточним распространение опухоли (поражён ли общий лёгочный ствол). Порадовала принципиальная возможность проведения операции, хотя и такой радикальной.
Химиотерапия проводится препаратами Гемзар и Цисплатин. К сожалению, не могу сказать по какой схеме.
Аннотация научной статьи по клинической медицине, автор научной работы — Паршин В. Д., Белов Ю. В., Тарабрин Е. А., Комаров Р. Н., Паршин В. В.
In spite of the progress in thoracic surgery and oncology, great lethality in lung cancer patient still persists, and so the questions of not only the early diagnostics but also the development of new techniques of surgical treatment remain actual which allow radical ablation of extended tumors. In the Russian Scientific Center of Surgery named after academician B.V.Petrovsky of the Russian Academy of Medical Sciences three patients were subjected to extended combined operations of pneumonectomy with a simultaneous resection and replacement of the thoracic part of the aorta for local dissemination of lung cancer. Extracorporeal circulation was used in one patient and in two patients resection and replacement of the aorta were fulfilled on the cross-clapmed aorta under conditions of ischemia of organs and tissues below the left subclavian artery. There were no ischemic injuries of organs after operation. All the patients were directed to chemio-radiation therapy.
Похожие темы научных работ по клинической медицине , автор научной работы — Паршин В. Д., Белов Ю. В., Тарабрин Е. А., Комаров Р. Н., Паршин В. В.
RESECTION AND AORTA REPLACEMENT IN EXTENDED AND COMBINED OPERATIONS FOR LUNG CANCER
In spite of the progress in thoracic surgery and oncology, great lethality in lung cancer patient still persists, and so the questions of not only the early diagnostics but also the development of new techniques of surgical treatment remain actual which allow radical ablation of extended tumors. In the Russian Scientific Center of Surgery named after academician B.V.Petrovsky of the Russian Academy of Medical Sciences three patients were subjected to extended combined operations of pneumonectomy with a simultaneous resection and replacement of the thoracic part of the aorta for local dissemination of lung cancer. Extracorporeal circulation was used in one patient and in two patients resection and replacement of the aorta were fulfilled on the cross-clapmed aorta under conditions of ischemia of organs and tissues below the left subclavian artery. There were no ischemic injuries of organs after operation. All the patients were directed to chemio-radiation therapy.
В.Д. Паршин, Ю.В. Белов, Е.А. Тарабрин, Р.Н. Комаров, В.В. Паршин, В.В. Ховрин
РЕЗЕКЦИЯ И ПРОТЕЗИРОВАНИЕ АОРТЫ ПРИ РАСШИРЕННЫХ И КОМБИНИРОВАННЫХ ОПЕРАЦИЯХ ПО ПОВОДУ РАКА ЛЕГКОГО
Ключевые слова: рак легкого, резекция аорты.
Введение. Ситуация, сложившаяся к настоящему времени в лечении рака легкого в мире и особенно в нашей стране, достаточно драматична. В структуре онкологической заболеваемости рак легкого занимает лидирующие позиции, сохраняются высокие показатели летальности в этой группе больных. Уже при первом обращении к врачу пациенты часто имеют запущенную стадию, когда хирургическое лечение невозможно [1, 12]. Главным образом, это обусловлено поздней диагностикой заболевания и распространенностью опухолевого процесса. В этой связи остаются актуальными вопросы не только ранней диагностики, но и разработки новых методов хирургического лечения, позволяющие радикально удалять распространенные опухоли. Развитие современной кардиохирургии, внедрение в клиническую практику операций на крупных сосудах и сердце позволяют выполнять комбинированные операции по поводу рака легкого, прорастающего жизненно важные органы и структуры [7, 11]. Кардиохирургические и торакальные операции в настоящее время стали достаточно безопасными. Это позволяет их сочетать при одновременном поражении злокачественной опухолью легких, сердца и крупных сосудов.
Материал и методы. В Российском научном центре хирургии им. акад. Б.В.Петровского РАМН (РНЦХ) в 2009-2010 гг. были оперированы 3 пациента с распространенным раком легкого с прорастанием грудного отдела аорты (табл. 1).
Пациент (№) Пол Возраст (лет) Гистология TNM-статус
1 М 50 Аденокарцинома T4N0M0
2 Ж 31 Аденокарцинома T4N2M1
3 М 54 Плоскоклеточный рак T4N2M0
У всех пациентов рак локализовался слева. У одной пациентки имел место рецидив опухоли после перенесенной за год до настоящей госпитализации нижней лобэктомии слева по поводу аденокарциномы I стадии. Два пациента ранее перенесли пробные торакотомии в различных онкологических учреждениях по месту жительства, в которых не было технических возможностей производить хирургические операции на аорте. У последнего пациента имел мест паралич левой половины гортани вследствие прорастания опухолью левого нижнего гортанного (возвратного) нерва.
Летальных исходов не было. Послеоперационное осложнение отмечено в одном случае — у пациентки диагностировали хилоторакс, который устранили путем временного перевода на парентеральное питание и назначения октреоти-да. Все пациенты выписаны и направлены на химиолучевое лечение.
Результаты и обсуждение. Классические резекционные операции при раке легкого в настоящее время достаточно хорошо разработаны и вошли в широкую медицинскую практику. Это не относится к ситуациям, когда необходимо вмешательство на крупных сосудах или сердце. Такие операции производят крайне редко, что объясняется объективными и субъективными причинами. Из объективных главное место занимает тот факт, что при подобном распространении редки случаи, когда нет отдаленных метастазов, и операция теряет свой смысл. Немаловажное значение имеет тот субъективный факт, что онкологические учреждения не имеют технических возможностей и опыта операций на сердце и крупных сосудах, особенно в условиях ИК. Развитие этого направления
Особенности операции и послеоперационного периода
Пациент, № ИК/время (мин) Пережатие аорты/ время (мин) Протез аорты Послеоперационные осложнения
длина (мм) диаметр (мм)
2 - +/26 70 16 Хилоторакс
в других клиниках сдерживают ряд административных установок, ограничивающих возможности выполнения сложных хирургических операций у онкологических больных в неонкологических многопрофильных клиниках. Назрела настоятельная необходимость провести коррекцию данного положения на законодательном уровне. По понятным причинам низкую летальность и частоту послеоперационных осложнений следует ожидать в стационарах, где операции на сердце и легких выполняют повседневно и накоплен большой соответствующий опыт. В качестве примера подобной операции приводим следующее клиническое наблюдение.
У больного А., 50 лет, в декабре 2008 г. при плановой флюорографии выявили опухолевидное образование нижней доли левого легкого. На протяжении последующих месяцев больной отказывался от какого-либо лечения. В апреле 2009 г. по месту жительства произведена попытка выполнения радикальной операции, при которой обнаружили аденокарциному нижней доли левого легкого с прорастанием нисходящего отдела аорты. Больной был признан неоперабельным, и операцию закончили эксплоративной торакотомией. Больного повторно обследовали в РНЦХ в июне 2009 г., через 2 мес после операции. Общее состояние пациента было удовлетворительным. Периферические лимфатические узлы не увеличены. Отдаленных метастазов не выявили. Рентгенологически в проекции нижней доли левого легкого и заднего средостения определялось овальной формы образование высокой интенсивности, неоднородное, с неровным наружным контуром, размером 16x10 см. Образование тесно прилежало к грудной аорте. При компьютерной томографии грудной клетки обнаружили, что в нижней доле левого легкого в VI сегменте имелось округлое образование 7,0x10,0x12,0 см с неровными нечеткими контурами, имеющее неоднородную структуру за счет плотных включений. Данное образование интимно прилежало к аорте и левой нижней легочной вене, костальной плевре (рис. 1). Отмечались косвенные признаки прорастания аорты опухолью — диаметр аорты выше и ниже опухоли больше, чем на уровне новообразования. Эндоскопически просветы бронхов, кроме BvI слева, были проходимы на всем протяжении. Устье BvI слева было полностью обтурировано округлым белесоватым образованием плотноэластической консистенции. Видимой инфильтрации стенок и окружающей слизистой оболочки не выявлено.
Отсутствие отдаленных метастазов, неэффективность других методов лечения, а также техническая возможность удалить злокачественную опухоль легкого, позволило предпринять повторную операцию. Выполнили боковую рето-ракотомию по шестому межреберью. Плевральная полость была тотально заращена. Пневмолиз осуществили острым путем и с использованием электрокоагуляции. При ревизии
Рис. 1. Компьютерная томограмма органов грудной
клетки больного А., 50 лет. В нижней доле правого легкого определяется образование, которое распространяется на аорту.
Провели профилактику материальной и воздушной эмболии, сняли зажимы с аорты и протеза, пустили кровоток по аорте. Послеоперационный период протекал без осложнений, неврологических расстройств не было. При плановом морфологическом исследовании опухоли выявили картину низкодифференцированной аденокарциномы, прорастание адвентиции аорты опухолью и парааортальных лимфатических узлов. В лимфатических узлах корня легкого метастазов не было, по линии резекции бронха и аорты
злокачественных клеток не выявили. Пациента выписали в удовлетворительном состоянии. В дальнейшем в специализированном медицинском учреждении ему провели два курса лучевой терапии на область средостения.
Наш опыт к настоящему времени крайне мал, чтобы делать какие-либо долгосрочные выводы. Он только показывает возможность подобных комбинированных и расширенных операций. Сегодня подобная хирургическая тактика находится в начале своего пути, и необходимо решить несколько вопросов, относящихся к лечению таких пациентов.
Во-первых, вопросы диагностики у данных больных. Кроме обследования по поводу рака легкого, необходимо иметь информацию о прорастании в аорту. Компьютерная томография с усилением и аортография могут рассматриваться как методы выбора [2]. Дополнительную информацию также можно получить при выполнении транспищеводной эхокардиографии [9]. Точный диагноз позволяет правильно спланировать хирургическое лечение и избежать пробных тора-котомий.
Рис. 2. Сосуды легкого и левый главный бронх пересечены. Во-вторых, во время операции бывает доста-
от аорты всегда есть угроза перфорации с возникновением тяжелого профузного кровотечения. Следует также учитывать, что даже прорастание
Рис. 3. Операция (а) и схема (б) протезирования нисходящего грудного отдела аорты. Легкое удалено с участком аорты. Последняя — протезирована синтетическим протезом.
только адвентиции аорты и выделение новообразования в этом слое с онкологической точки зрения сомнительно. Это позволяет рекомендовать расширение объема операции — выполнение резекции и протезирования аорты [8].
В-четвертых, оправданы ли подобные операции с онкологической точки зрения? В настоящее время имеющиеся данные противоречивы [5, 8]. Ответить на этот вопрос могут только соответствующие исследования, когда будет выполнено достаточное количество подобных операций и станет известен отдаленный результат после них в комбинации с другими способами противоопухолевого лечения. Не следует ожидать, что эти результаты будут лучше, чем при лечении онкологических процессов I или II стадии. Однако подобные операции уже сегодня можно рассматривать как единственную возможность добиться выздоровления или продления жизни обреченного онкологического пациента. Без операции неблагоприятный исход следует ожидать в течение ближайших месяцев.
Выводы. 1. Одномоментные расширенные и комбинированные операции при раке легкого, когда необходимо резецировать и протезировать аорту, возможны, так как больные их неплохо переносят.
2. Операции нужно производить в клиниках, имеющих опыт операций на легких и аорте, что не всегда имеет место в онкологических учреждениях нашей страны.
1. Мерабишвили В.М., Дятченко О.Т. Статистика рака легкого (заболеваемость, смертность, выживаемость) // Практич. онкол.—2000.—№ 3.—C. 3-7.
2. Bonomo L., Ciccotosto C., Guidotti A., Storto M.L. Lung cancer staging: the role of computed tomography and magnetic resonance imaging // Eur. J. Radiol. — 1996.—Vol. 23, № 1. — P. 35-45.
3. Klein J., Kral V., Nemec P., Bohanes T. Temporary aorto-aortal bypass used during extended pneumonectomy for lung cancer // Acta Chir. Belg.—2007.—Vol. 107, № 1. — P. 81-83.
4. Klepetko W., Wisser W., Bîrsan T. et al. T4 lung tumors with infiltration of the thoracic aorta: is an operation reasonable? // Ann. Thorac. Surg. — 1999. — Vol. 67, № 2. — P. 340-344.
5. Klepetko W. Surgical intervention for T4 lung cancer with infiltration of the thoracic aorta: are we back to the archetype of surgical thinking? // J. Thorac. Cardiovasc. Surg.—2005.—Vol. 129, № 4. — P. 727-729.
6. Marulli G., Lepidi S., Frigatti P. et al. Thoracic aorta endograft as an adjunct to resection of a locally invasive tumor: a new indication to endograft // J. Vasc. Surg.—2008.—Vol. 47, № 4. — P. 868-870.
7. Meko J., Rusch V.W. Neoadjuvant therapy and surgical resection for locally advanced non-small cell lung cancer // Semin. Radiat. 0ncol.—2000. — Vol. 10, № 4. — P. 324-332.
8. Ohta M., Hirabayasi H., Shiono H. et al. Surgical resection for lung cancer with infiltration of the thoracic aorta // J. Thorac. Cardiovasc. Surg.—2005.—Vol. 129, № 4. — P. 804-808.
9. Schroder C., Schonhofer B., Vogel B. Transesophageal echographic determination of aortic invasion by lung cancer // Chest.— 2005.—Vol. 127, № 2. — P. 438-442.
10. Shimokawa S., Watanabe S., Sakasegawa K. Combined resection of T4 lung cancer with invasion of the descending thoracic aorta // Ann. Thorac. Surg.—2000.—Vol. 69, № 3.—P. 971-972.
11. Shirakusa T., Kawahara K., Iwasaki A. et al. Extended operation for T4 lung carcinoma // Ann. Thorac. Cardiovasc. Surg.—1998.— Vol. 4, № 3. — P. 110-118.
12. World Cancer Report 2008 // IARC.—2008.—512 p.
Поступила в редакцию 14.05.2010 г.
V.D.Parshin, Yu.V.Belov, E.A.Tarabrin, R.N.Komarov, V.V.Parshin, V.V.Khovrin
RESECTION AND AORTA REPLACEMENT IN EXTENDED AND COMBINED OPERATIONS FOR LUNG CANCER
Злокачественные опухоли легких – общее понятие, объединяющее группу новообразований трахеи, легких и бронхов, характеризующихся бесконтрольным делением и разрастанием клеток, инвазией в окружающие ткани, их разрушением и метастазированием в лимфоузлы и отдаленно расположенные органы. Злокачественные опухоли легких развиваются из средне-, низко- или недифференцированных клеток, значительно отличающихся по структуре и функциям от нормальных. К злокачественным опухолям легких относятся лимфома, плоскоклеточный и овсяноклеточный рак, саркома, мезотелиома плевры, малигнизированный карциноид. Диагностика злокачественных опухолей легких включает рентгенографию, КТ или МРТ легких, бронхографию и бронхоскопию, цитологическое исследование мокроты и плеврального выпота, биопсию, ПЭТ.
МКБ-10
- Причины злокачественных опухолей легкого
- Виды злокачественных опухолей легких
- Классификация рака легкого
- Симптомы злокачественных опухолей легких
- Диагностика злокачественных опухолей легких
- Лечение злокачественных опухолей легких
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Злокачественные опухоли легких – общее понятие, объединяющее группу новообразований трахеи, легких и бронхов, характеризующихся бесконтрольным делением и разрастанием клеток, инвазией в окружающие ткани, их разрушением и метастазированием в лимфоузлы и отдаленно расположенные органы. Злокачественные опухоли легких развиваются из средне-, низко- или недифференцированных клеток, значительно отличающихся по структуре и функциям от нормальных.
Самой частой злокачественной опухолью легких является рак легкого. У мужчин рак легкого встречается в 5-8 раз чаще, чем у женщин. Рак легкого обычно поражает пациентов старше 40-50 лет. Рак легкого занимает 1-е место в ряду причин смерти от рака, как среди мужчин (35%), так и среди женщин (30%). Другие формы злокачественных опухолей легких регистрируются значительно реже.

Причины злокачественных опухолей легкого
Появление злокачественных опухолей вне зависимости от локализации связывают с нарушениями дифференцировки клеток и пролиферации (разрастания) тканей, происходящими на генном уровне.
Факторами, вызывающими подобные нарушения в тканях легкого и бронхов, являются:
- активное курение и пассивное вдыхание сигаретного дыма. Курение является основным фактором риска возникновения злокачественных опухолей легких (в 90% у мужчин и в 70% у женщин). Никотин и смолы, содержащиеся в сигаретном дыме, обладают канцерогенным действием. У пассивных курильщиков вероятность развития злокачественных опухолей легких (особенно рака легкого) возрастает в несколько раз.
- вредные профессиональные факторы (контакт с асбестом, хромом, мышьяком, никелем, радиоактивной пылью). Люди, связанные в силу профессии с воздействием этих веществ, подвержены риску возникновения злокачественных опухолей легких, особенно, если они – курильщики.
- проживание в зонах с повышенным радоновым излучением;
- наличие рубцовых изменений легочной ткани, доброкачественных опухолей легкого, склонных к малигнизации, воспалительных и нагноительных процессов в легких и бронхах.
Данные факторы, влияющие на развитие злокачественных опухолей легких, могут вызывать повреждения ДНК и активизировать клеточные онкогены.
Виды злокачественных опухолей легких
Злокачественные опухоли легких могут изначально развиваться в легочной ткани или бронхах (первичная опухоль), а также метастазировать из других органов.
Рак легкого – эпителиальная злокачественная опухоль легких, исходящая из слизистой бронхов, бронхиальных желез или альвеол. Рак легкого обладает свойством метастазирования в другие ткани и органы. Метастазирование может происходить по 3 путям: лимфогенному, гематогенному и имплантационному. Гематогенный путь наблюдается при прорастании опухоли в кровеносные сосуды, лимфогенный – в лимфатические. В первом случает опухолевые клетки с кровотоком переносятся в другое легкое, почки, печень, надпочечники, кости; во втором – в лимфоузлы надключичиной области и средостения. Имплантационное метастазирование отмечается при прорастании злокачественной опухоли легких в плевру и распространении ее по плевре.
По локализации опухоли по отношению к бронхам различают периферический рак легкого (развивается из мелких бронхов) и центральный рак легкого (развивается из главного, долевых или сегментарных бронхов). Рост опухоли может быть эндобронхиальным (в просвет бронха) и перибронхиальным (в сторону легочной ткани).
По морфологическому строению различают следующие виды рака легкого:
- низко- и высокодифференцированный плоскоклеточный (эпидермоидный рак легкого);
- низко- и высокодифференцированный железистый рак легкого (аденокарцинома);
- недифференцированный (овсяноклеточный или мелкоклеточный) рак легкого.
В основе механизма развития плоскоклеточного рака легкого лежат изменения эпителия бронхов: замещение железистой ткани бронхов фиброзной, цилиндрического эпителия плоским, возникновение очагов дисплазии, переходящих в рак. В возникновении карциномы играют роль гормональные факторы и генетическая предрасположенность, способные активизировать канцерогены, попавшие в организм.
Овсяноклеточный рак относится к злокачественным опухолям легкого диффузной нейроэндокринной системы (АПУД-системы), продуцирующим биологически активные вещества. Этот вид рака легкого дает гематогенные метастазы уже на ранней стадии.
Лимфома – злокачественная опухоль легких, исходящая из лимфатический системы. Лимфома может первично локализоваться в легких или метастазировать в них из других органов (молочных желез, толстого кишечника, прямой кишки, почек, щитовидной железы, предстательной железы, желудка, яичка, шейки матки, кожи и костей).
Саркома – злокачественная опухоль легкого, развивающаяся из интраальвеолярной или перибронхиальной соединительной ткани. Саркома чаще развивается в левом, а не в правом легком, как рак. Мужчины заболевают саркомой чаще женщин в 1,5-2 раза.
Рак плевры (мезотелиомы плевры) - злокачественная опухоль, исходящая из мезотелия – эпителиальной ткани, выстилающей полость плевры. Чаще поражает плевру диффузно, реже - локально (в виде полипозных образований и узлов). В результате плевра утолщается до нескольких сантиметров, приобретает хрящевую плотность, становится шероховатой.
Малигнизированный карциноид приобретает все признаки злокачественной опухоли легкого: неограниченный инфильтративный рост, способность метастазирования в отдаленные органы (другое легкое, печень, головной мозг, кости, кожу, надпочечники, почки, поджелудочную железу). В отличие от рака легкого карциноид растет медленнее и позднее дает метастазы, поэтому радикальная операция дает хорошие результаты, местные рецидивы возникают редко.
Классификация рака легкого
В онкопульмонологии используется классификация рака легкого по международной системе TNM, где:
- ТХ – рентгенологические и бронхологические данные за наличие злокачественной опухоли легких отсутствуют, однако определяются атипичные клетки в смывах из бронхов или в мокроте
- ТО — первичная опухоль не определяется
- Tis — преинвазивный (внутриэпителиальный) рак
- Tl — в окружении легочной ткани или висцеральной плевры определяется опухоль диаметром до 3 см, при бронхоскопии признаков поражения главного бронха не обнаруживается
- Т2 — определяется опухоль диаметром более 3 см, переходящая на главный бронх ниже зоны бифуркации не менее чем на 2 см, либо с прорастанием висцеральной плевры, либо с наличием ателектаза части легкого
- ТЗ — опухоль с прорастанием в грудную стенку, париетальную плевру, перикард, диафрагму, или с распространением на главный бронх, не доходя менее 2 см до бифуркации, или сопровождающаяся ателектазом целого легкого; размер опухоли любой
- Т4 — опухоль распространяется на средостение, миокард, крупные сосуды (аорту, ствол лёгочной артерии, верхнюю полую вену), пищевод, трахею, зону бифуркации, позвоночник, а также опухоль, сопровождающаяся выпотным плевритом.
- NX — недостаточно данных для оценки регионарных лимфоузлов
- NO — отсутствие метастатического поражения внутригрудных лимфоузлов
- N1 — метастазирование или распространение злокачественной опухоли легких на перибронхиальные или (и) лимфоузлы корня легкого
- N2 — метастазирование злокачественной опухоли легких в бифуркационные или лимфоузлы средостения со стороны поражения
- N3 — метастазирование злокачественной опухоли легких в лимфоузлы корня и средостения на противоположной стороне, надключичные или прескаленные лимфоузлы с любой стороны
- MX — недостаточно данных для оценки отдаленных метастазов
- МО — отсутствие отдаленных метастазов
- Ml — наличие отдаленных метастазов
- GX — невозможно оценить степень клеточной дифференцировки
- GI — высокодифференцированная
- G2 — умереннодифференцированная
- G3 — низкодифференцированная
- G4 — недифференцированная
- I – опухоль легкого размером до 3 см с локализацией в пределах одного сегмента или сегментарного бронха, метастазы отсутствуют.
- II – опухоль легкого размером до 6 см с локализацией в пределах одного сегмента или сегментарного бронха, наличие единичных метастазов в бронхопульмональных лимфоузлах
- III – опухоль легкого размером более 6 см, переходящая на соседнюю долю, соседний или главный бронх, метастазы в трахеобронхиальные, бифуркационные, паратрахеальные лимфоузлы.
- IV— опухоль легкого распространяется на другое легкое, соседние органы, имеются обширные местные и отдаленные метастазы, раковый плеврит.
Знание классификации злокачественных опухолей легких позволяет прогнозировать течение и исход болезни, план и результаты лечения.
Симптомы злокачественных опухолей легких
Проявления злокачественных опухолей легких определяются локализацией, размерами опухоли, ее отношением к просвету бронха, осложнениями (ателектазом, пневмонией), распространенностью метастазов. Ранние симптомы злокачественных опухолей легких малоспецифичны. Пациентов беспокоят нарастающая слабость, повышенная утомляемость, периодическое повышение температуры тела, недомогание. Начало развития опухоли часто маскируется под клинику бронхита, пневмонии, частых ОРВИ. Нарастание и рецидивы этих проявлений заставляют пациента обратиться к врачу.
Дальнейшее развитие злокачественных опухолей легких эндобронхиальной локализации характеризуется упорным кашлем со слизисто-гнойной мокротой и нередко кровохарканьем. Легочное кровотечение говорит о прорастании опухоли в крупные сосуды. С увеличением размеров злокачественной опухоли легких нарастают явления нарушения бронхиальной проходимости - появляется одышка.
Периферические опухоли легких протекают бессимптомно до момента прорастания в грудную стенку или плевру, когда возникают сильные боли в груди. Поздние проявления злокачественных опухолей легких – слабость, похудание, кахексия. В поздних стадиях рак легкого сопровождается массивным, рецидивирующим геморрагическим плевритом.
Диагностика злокачественных опухолей легких
Выраженные физикальные проявления на ранних этапах онкопроцесса в легких нехарактерны. Основным источником выявления злокачественных опухолей легких на стадии отсутствия клиники является рентгенография. Злокачественные опухоли легких могут быть случайно выявлены при проведении профилактической флюорографии. При рентгенографии легких определяются опухоли диаметром более 5-6 мм, участки сужения и неровностей контуров бронхов, ателектаза и инфильтрации. В сложных диагностических случаях дополнительно проводят МРТ или КТ легких.
При периферической локализации опухоли легкого определяется плевральный выпот. Подтверждается диагноз такой злокачественной опухоли легких цитологическим исследованием выпота, полученного путем плевральной пункции, или биопсией плевры. Наличие первичной опухоли или метастазов в легких может устанавливаться при цитологическом исследовании мокроты. Бронхоскопия позволяет осмотреть бронхи вплоть до субсегментарных, обнаружить опухоль, провести забор бронхиальных смывов и трансбронхиальную биопсию.
Глубоко расположенные опухоли диагностируются при помощи пункционной биопсии легкого и гистологического исследования. С помощью диагностической торакоскопии или торакотомии определяется операбельность злокачественной опухоли легких. При метастазировании злокачественной опухоли легких в прескаленные лимфоузлы проводят их биопсию с последующим определением гистологической структуры опухоли. Отдаленные метастазы первичной опухоли легких выявляются при УЗИ-эхолокации, КТ или радиоизотопном сканировании (ПЭТ).
Лечение злокачественных опухолей легких
Радикальным методом лечения злокачественных опухолей легких является их оперативное удаление, которое проводят торакальные хирурги. Учитывая стадию и обширность поражения, производят удаление одной или двух долей легкого (лобэктомия или билобэктомия); при распространенности процесса – удаление легкого и регионарных лимфоузлов (пневмонэктомия). Методом проведения оперативного вмешательства может быть торакотомия или видеоторакоскопия. Одиночные или множественные метастазы в легком оперируют, если произведено удаление первичного очага.
Оперативное лечение при злокачественных опухолях легких не проводится в случаях:
- невозможности радикального удаления опухоли
- наличия отдаленных метастазов
- тяжелых нарушений функций легких, сердца, почек, печени
Относительным противопоказанием к оперативному лечению является возраст пациента старше 75 лет.
В послеоперационном периоде или при наличии противопоказаний к операции проводится лучевая и/или химиотерапия. Часто различные виды лечения злокачественных опухолей легких комбинируют: химиотерапия - операция – лучевая терапия.
Прогноз и профилактика
Без лечения продолжительность жизни пациентов с диагностированными злокачественными опухолями легких составляет около 1 года.
Прогноз при радикально проведенной операции определяется стадией заболевания и гистологическим видом опухоли. Самые неблагоприятные результаты дает мелкоклеточный низкодифференцированный рак. После операций по поводу дифференцированных форм рака I стадии пятилетняя выживаемость пациентов составляет 85-90%, при II стадии - 60%, после удаления метастатических очагов - от 10 до 30 %. Летальность в послеоперационном периоде составляет: при лобэктомии - 3-5 %, при пневмонэктомии - до 10 %.
Профилактика злокачественных опухолей легких диктует необходимость активной борьбы с курением (как активным, так и пассивным). Важнейшими мерами являются снижение уровня воздействия канцерогенов на производстве и в окружающей среде. В предупреждении злокачественных опухолей легких играет роль профилактическое рентгенологическое обследование лиц группы риска (курящих, пациентов с хроническими пневмониями, работников вредных производств и др.).
Читайте также:

