Опухоль это пролиферативная форма воспаления
Продуктивное (или пролиферативное) воспаление представляет собой реакцию организма. При появлении которой преобладает конкретная фаза. То есть в данном случае преобладает пролиферация клеток гистиогенного и гематогенного происхождения. Основной клеткой в области продуктивного воспаления считается моноцит, поступающий в ткань непосредственно из кровеносного русла, в тканях моноцит трансформируется в макрофаг.
Макрофаг
Главная функция макрофага – фагоцитоз. На его поверхности находится множество разных рецепторов, которые необходимы для захвата вирусов, грибов, бактерий, иммуноглобулинов. Фагоцитоз во время пролиферативного воспаления не всегда может быть завершенным, то есть не заканчивается абсолютным перевариванием чужеродного агента. Вирусы и микробные клетки внутри макрофагов выживают, размножаются, по причине чего процесс приобретает хроническую форму. Помимо макрофагов во время пролиферативного воспаления часто встречаются другие клетки. К ним следует отнести лимфоциты, эозинофилы, плазматические клетки, тучные клетки, единичные нейтрофилы.
При пролиферации клеток формируются клеточные диффузные либо очаговые инфильтраты.
Разновидности
Проблема может развиваться в любом органе организма и на любой ткани. Выделяют следующие виды пролиферативного воспаления:
- интерстициальное (межуточное);
- продуктивное с формированием полипов, остроконечных кондилом;
- гранулематозное.
Рассмотрим их по отдельности.
Интерстициальное
Интерстициальное (или межуточное) – вид пролиферативного воспаления, при котором в строме сердца, печени, почек, легких формируется диффузный или очаговый клеточный воспалительный инфильтрат. Инфильтрат представляется лимфоцитами, плазматическими клетками, макрофагами, эозинофилами, тучными единичными клетками, элементами разрушенной паренхимы, редкими нейтрофилами.
В паренхиматозных элементах определяются выраженные дистрофические, в некоторых случаях некробиотические изменения. Итогом межуточного воспаления будет интерстициальный фиброз, представляющий собой разрастание соединительных тканей.
С полипами и остроконечными кондиломами
Пролиферативная фаза воспаления с образованием полипов, а также остроконечных кондилом отличается хроническим течением. Она локализуется на слизистой оболочке. На слизистых разных органов формируются отдельные участки гиперплазии, а также разрастания эпителия в форме полипов, у которых соединительнотканная основа инфильтрирована макрофагами, лимфоцитами, плазматическими клетками и другими.

Локализуется чаще всего на слизистой оболочке носа, желудка, матки, кишечника, бронхов. В случае локализации воспалений на стыке однослойного цилиндрического и многослойного плоского эпителия формируются так называемые кондиломы. Эти образования частенько появляются в заднем проходе, а также на половых органах. При хроническом пролиферативном воспалении частая кондилома - это остроконечная, которая вызывается папилломавирусом. Она считается фактором риска для развития плоскоклеточной формы рака.
Грануломатозное
Грануломатозное – еще один вариант продуктивного (пролиферативного) воспаления. Во время которого главным морфологическим субстратом считается гранулема, где преобладают клетки: макрофаги, а также их производные (гигантские клетки, эпителиоидные).
Морфогенез гранулем имеет из четыре последовательные фазы. К таковым относятся следующие:
- накопление молодых моноцитов в очаге повреждения;
- созревание данных клеток в макрофаге с формированием макрофагальной гранулемы;
- дальнейшее созревание и преобразование моноцитов и макрофагов в эпителиоидную клетку и формирование эпителиоидоклеточной гранулемы;
- трансформация эпителиоидной клетки в гигантскую клетку Пирогова-Лангханса (клетка инородных тел) и образование гигантоклеточных гранулем.
Следует отметить, что фагоцитарная активность клетки гранулемы по мере ее созревания постепенно снижается.
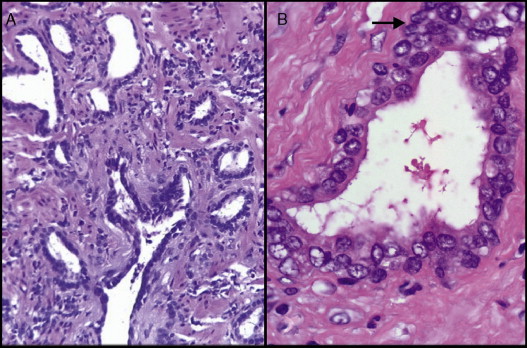
Диаметр гранулем составляет около 1-2 мм, чаще всего они видны лишь микроскопом. В центральной области гранулемы можно разглядеть тканевой детрит, который образуется в результате некроза тканей и в котором способен выявляться возбудитель основного заболевания, если в данном случае имеет место быть инфекционный процесс. Располагаются макрофаги по периферии некроза. Также там имеются гигантские, эпителиоидные клетки, среди них могут находиться еще плазматические клетки, нейтрофилы, лимфоциты, эозинофилы.
Грануломатозные болезни
Среди таких заболеваний при форме пролиферативного воспаления выделяют 4 группы. К ним относятся:
- инфекционной этиологии, куда следует отнести ревматизм, сыпной и брюшной тиф, бешенство, бруцеллез, туляремию, вирусный энцефалит, иерсинеоз, актиномикоз, сифилис, лепру, шистосомоз, туберкулез, склерому, сап и другие;
- неинфекционной этиологии, куда следует отнести подагру, силикоз, антракоз, талькоз, асбестоз, бериллиоз, алюминоз;
- медикаментозные недуги, например, лекарственный гепатит, олеогранулематозная болезнь;
- болезни не установленной этиологии: болезнь Крона, саркоидоз, болезнь Хортона, гранулематоз Вегенера, ревматоидный артрит, ксантогранулематозный пиелонефрит.
Абсолютно все гранулемы имеют инфекционную этиологию, не смотря на имеющиеся различия, по морфологии они сходны между собой. Также стоит отметить, что во всех ситуациях инфекционные гранулемы представляются в виде скоплений клеток, имеющих моноцитарно-макрофагальной природу. В некоторых гранулемах формируются лимфоциты, нейтрофилы, плазматические клетки, при гельминтозах появляется много эозинофилов.

Исключением будут лишь гранулемы в случае туберкулеза, сифилиса, склеромы, сапы, лепры. При названных болезнях при пролиферативном воспалении эти гранулемы обладают специфическими чертами, свойственными только определенному возбудителю. А это позволяет относить данную группу заболеваний к группе специфических гранулематозов. Или специфическое воспаление.
В морфологическом понятии для специфического воспаления будет характерно образование нескольких специфических гранулем. Которые имеют характерное строение. Оно может отличаться в зависимости от главного возбудителя - причины пролиферативного воспаления. Таким образом, клеточный состав, а также расположение клеток непосредственно в гранулеме довольно специфично для каждого возбудителя.
При туберкулезе
Воспалительный процесс при туберкулезе, то есть микобактерия туберкулеза способна вызывать три разновидности тканевой реакции: экссудативную, альтеративную, и пролиферативную.

Что касается альтеративного воспаления, то оно чаще развивается в результате гипоергии, в случае снижения защитных сил человеческого организма. Проявляется данное воспаление морфологически казеозным некрозом.
Экссудативный тип воспаления развивается в результате имеющейся гиперергии (в случае повышенной чувствительности к токсинам микобактерии, антигенам). Морфологически накопление проявляется в очаге поражения фибринозного, серозного либо смешанного экссудата, в дальнейшем который подвергается тоже казеозному некрозу.
Пролиферативное воспаление, патанатомия говорит, развивается в условии специфической туберкулезной иммунной системы. Морфологическим проявлением в данном случае будет выступать образование так называемых туберкулезных гранулем, представленных в виде просяного зерна.
Туберкулезная гранулема
Итак, мы разобрали, чем характеризуется пролиферативное воспаление. Теперь стоит по отдельности рассмотреть некоторые случае, при которых оно проявляет себя.

Туберкулезная гранулема обладает характерным строением: в центральной ее области находится очаг так называемого казеозного некроза, за которым располагается вал радиарно локализующихся (то есть вытянутых по-длиннику к периферии от центра) эпителиоидных клеток. За этими клетками видны гигантские единичные клетки Пирогова-Лангханса.
Следует также заметить, что на периферии такой гранулемы находится вал лимфоцитов. В большом количестве данных типичных клеток обнаружены могут быть еще в незначительном количестве плазматические клетки, а также макрофаги. Кроем того, здесь же выявляется тоненькая сеть, состоящая из аргирофильных волокон. Что касается кровеносных сосудов, то они тут не встречаются. В случае окраски по Цилю-Нильсену в данных гигантских клетках могут быть определены микобактерии туберкулеза.
Воспалительный процесс при сифилисе
Воспалительный процесс при сифилисе в разные периоды будет отражать на бледную трепонему различную тканевую реакцию: выделяют, как правило, первичный, вторичный, а также третичный периоды при заболевании сифилисом.
В случае первичного сифилиса развивается так называемая продуктивно-инфильтративная реакция в области внедрения трепонемы.

Во время вторичного наблюдается сильно выраженная экссудативная реакция, способствующая генерализации возбудителя,
В случае третичного периода сифилиса продуктивно-некротическая реакция будет представлена в виде сифилитической гранулемы, а также гуммозными инфильтратами.
Подробнее о сифилитической гранулеме
От некроза по периферии располагается большое количество лимфоцитов, фибробластов, а также плазматических клеток. В небольшом количестве здесь могут присутствовать и макрофаги, и гигантские клетки, и эпителиоидные клетки. Характерным считается в данном случае разрастание соединительных тканей (это связано с быстротой пролиферации фибробластов), которые формируют подобие капсул, а также большое количество кровеносных сосудов.
Довольно редко среди этих клеток удается специалистам выявить так называемую бледную трепонему методом серебрения по Левадити. Характерна гумма для третичного периода сифилиса, который начинает развиваться через несколько лет (5 и больше) со времени его заражения.
В различных органах: коже, печени, костях, головном мозге образуются в течение одного десятка лет узлы размером 0,3-1,0 см в диаметре. В разрезе из данных узлов выделяется некая желеобразная масса желтоватого оттенка, которая по своему внешнему виду напоминает клей гуммиарабик, откуда и произошло такое название "гумма".
Гуммозная инфильтрация
Кроме этих гумм, в третичном периоде заболевания сифилисом может развиваться также гуммозная инфильтрация. Представлен инфильтрат теми же клетками, то есть склерозом, сосудистой пролиферацией. Инфильтрат локализуется чаще всего в восходящем отделе сердца, а также дуге аорты, а носит название "сифилитический мезоаортит".
Он, расположенный в центральной и наружной оболочке сердечной аорты разрушает постепенно эластический ее каркас, а на месте эластических волокон начинает разрастаться соединительная ткань. По причине всего этого внутренняя оболочка на аорте становится неровной и морщинистой с большим количеством рубцовых втяжений, выбуханий, внешне напоминая шагреневый кожный покров.
Заключение
Как мы уже ранее отмечали, пролиферативное (или продуктивное) воспаление отличается пролиферацией клеток. Экссудативные и альтеративные изменения отступают лишь на второй план. Все течение данного воспалительного процесса может быть острым, однако, чаще всего — хроническим.
Клетки любой опухоли представляют собой патологические мутировавшие клеточные структуры организма, которые в ходе своего развития приобрели признаки тканевой атипии. Соответственно, опухолевая пролиферация является патологическим процессом, который сопровождается размножением этих клеток. При этом клетки злокачественной опухоли получают не только атипичную морфологию, но и возможность неконтролируемого беспрерывного деления. Пролиферация опухолевых клеток приводит к быстрому увеличению размеров опухоли. Кроме того, элементы опухолевого процесса могут давать метастазы в другие органы и ткани, которые могут находиться даже в отдаленных от опухоли частях организма.
Особенности канцерогенеза
Канцерогенез представляет собой патологический процесс развития опухоли. Одной из основных его составляющих является опухолевая пролиферация. На последней стадии канцерогенеза наблюдается малигнизация, которая представляет собой озлокачествление клеток. Основные признаки малигнизации патологического процесса:
- Быстрое неконтролируемое размножение и деление клеток.
- Нарушение дифференцировки, в результате чего существенно увеличивается количество незрелых молодых форм опухолевых клеток. Такая опухолевая пролиферация носит название анаплазия.
- Автономия – независимость процесса пролиферации опухолевых клеток от других процессов, происходящих в организме. Как правило, наибольшую автономию имеют самые дифференцированные клетки.
- Склонность к метастазированию. Метастазы представляют собой пул опухолевых клеток, которые распространяются по всему организму с током крови и лимфы. Опухолевая пролиферация с метастазированием характерна только для злокачественных опухолей.
- Синдром общей опухолевой интоксикации оказывает отрицательное влияние на организм в целом. Пролиферация опухолевых клеток злокачественного характера всегда приводит интоксикации продуктами опухолевого метаболизма. Кроме того, за счет своего интенсивного роста опухоль расходует большое количество питательных веществ и энергетических метаболитов. Все эти факторы приводят к опухолевой кахексии.
Клеточный атипизм при опухолевой пролиферации
Для любого злокачественного процесса характерна патологическая пролиферация опухолевых клеток с признаками атипизма и нарушением дифференциации. Атипизм представляет собой процесс обратного развития, при котором опухоль переходит на другие пути метаболизма. Сегодня известно несколько видов атипизма:
- Морфологический атипизм – это патологическое изменение клеточных мембран. При этом в клетках опухоли отмечается снижение количества контактных нексусов, которыми обеспечиваются адгезивные свойства мембран клетки. Кроме того, опухолевая пролиферация характеризуется изменениями строения гликопротеидов мембран с укорочением углеводных цепей. На фоне этих морфологических изменений в клетке начинается продукция нехарактерных для зрелых клеток веществ. В результате этого нарушается функция контактного торможения, за счет которого в норме клетки перестают делиться после контакта друг с другом. Опухолевые клетки, напротив, при контакте начинают интенсивно и бесконтрольно делиться.
- Биохимическая атипия. Все биохимические процессы в клетке, в частности, энергетический обмен, характеризуются преобладанием более старого пути получения энергии – гликолиза. За счет преобладания гликолиза происходит существенное увеличение концентрации молочной кислоты в опухолевых клетках. В результате этого нарушаются процессы жизнедеятельности клетки.
- Атипизм, связанный с нарушением дифференциации и опухолевой пролиферации. В физиологических условиях дифференциация деления контролируется центральной регуляцией эндокринной системы. Этот процесс осуществляется за счет выработки соматотропного гормона, инсулина и гормонов щитовидной железы. Кроме того, в каждой ткани присутствуют определенные факторы дифференциации и роста. В частности, пролиферация опухолевых клеток активируется за счет формирования белковых молекул, фосфорилированных при помощи тирозина. Кроме того, опухолевая пролиферация и дифференцировка стимулируется кальций-зависимой протеинкиназой. В физиологических условиях этот фермент играет роль специального модулятора, который стабилизирует процессы дифференциации и роста. В то же время, пролиферация опухолевых клеток всегда сопровождается существенным повышением активности кальций-зависимой протеинкиназы. Фермент выступает в качестве индуктора пролиферативных процессов, активируя выработку фосфотирозина и стимулируя неконтролируемое размножение клеток.
Занятие 8.
Продуктивное (пролиферативное) воспаление –это воспаление при котором преобладает пролиферативная фаза воспаления, т.е. выражена пролиферация клеток гематогенного и гистиогенного происхождения. Главной клеткой в зоне продуктивного воспаления является моноцит, который поступает в ткань из кровеносного русла, в ткани моноцит превращается(трансформируется) в макрофаг. Основная функция макрофага –это фагоцитоз. На поверхности макрофага находится множество рецепторов для захвата бактерий, вирусов, грибов, иммуноглобулинов. Фагоцитоз при продуктивном воспалении не всегда бывает завершенным, т.е. не всегда заканчивается полным перевариванием чужеродного агента. Микробные клетки, вирусы выживают внутри макрофагов, размножаются и поэтому процесс приобретает хроническое течение. Помимо макрофагов при продуктивном воспалении часто встречаются и другие клетки. Это- лимфоциты, плазматические клетки, эозинофилы, тучные клетки, м.б. единичные нейтрофилы.
В результате пролиферации клеток образуются диффузные или очаговые клеточные инфильтраты.
Продуктивное воспаление может встречаться в любом органе и любой ткани.
Выделяют следующие виды продуктивного воспаления:
1) интерстициальное (или межуточное воспаление),
2) продуктивное воспаление с образование полипов и остроконечных кондилом.
3) гранулематозное воспаление.
Интерстициальное (межуточное) воспаление –это продуктивное воспаление, при котором в строме паренхиматозных органов(сердце, печени, почках, легких) формируется очаговый или диффузный воспалительный клеточный инфильтрат. Инфильтрат представлен лимфоцитами, макрофагами, плазматическими клетками, эозинофилами, единичными тучными клетками, редкими нейтрофилами и элементами разрушенной паренхимы. В паренхиматозных элементах органов выявляются выраженные дистрофические, а иногда и некробиотические изменения. Исходом межуточного воспаления является интерстициальный фиброз (разрастание соединительной ткани).
Продуктивное воспаление с образованием полипов и остроконечных кондилом характеризуется хроническим течением и локализуется на слизистых оболочках. На слизистых органов формируются участки гиперплазии и разрастания эпителия в виде полипов, соединительнотканная основа которых инфильтрирована лимфоцитами, макрофагами, плазматическими и др. клетками. Локализуется часто на слизистой носа, желедка, кишечника, матки, бронхов. При локализации воспаления на стыке многослойного плоского и однослойного цилиндрического эпителия формируются кондиломы. Такие образования часто возникают в заднем проходе, половых органах. Самая частая кандилома- остроконечная вызывается папилломавирусом является фактором риска развития плоскоклеточного рака.
Грануломатозное воспаление – вариант продуктивного воспаления при котором основным морфологическим субстратом является гранулема, в которой преобладающие клетки –это макрофаги и их производные(эпителиоидные, гигантские клетки).
Морфогенез гранулем складывается из 4-х последовательных фаз: 1) накопление в очаге повреждения юных моноцитов, 2) созревание этих клеток в макрофаги с образованием макрофагальной гранулемы, 3) созревание и трансформация моноцитов и макрофагов в эпителиоидные клетки и образование эпителиоидоклеточной гранулемы, 4) трансформация эпителиоидных клеток в гигантские клетки Пирогова-Лангханса(или клетки инородных тел) и формирование гигантоклеточных гранулем.
Фагоцитарная активность клеток гранулемы по мере их созревания снижается.
Диаметр гранулемы 1-2 мм, они чаще видны только под микроскопом. В центре гранулемы находится тканевой детрит, образующийся в результате некроза ткани и в котором может выявляться возбудитель заболевания, если имеет место инфекционный процесс. По периферии некроза располагаются макрофаги, эпителиоидные и гигантские клетки, среди которых могут находиться нейтрофилы, плазматические клетки, лимфоциты, эозинофилы.
Выделяют 4 группы грануломатозных болезней:
1) инфекционной этиологии (ревматизм, брюшной и сыпной тиф, бешенство, вирусный энцефалит, бруцеллез, туляремия, иерсинеоз, актиномикоз, шистосомоз, туберкулез, сифилис, лепра, склерома, сап, и др.)
2) неинфекционной этиологии (подагра, силикоз, антракоз, бериллиоз, алюминоз, талькоз, асбестоз)
3) медикаментозные(олеогранулематозная болезнь, лекарственный гепатит);
4)не установленной этиологии (саркоидоз, болезнь Крона, болезнь Хортона, ревматоидный артрит, гранулематоз Вегенера, ксантогранулематозный пиелонефрит).
Все гранулемы инфекционной этиологии, не смотря на различия в этиологии, по морфологии сходны между собой. Во всех случаях инфекционные гранулемы представлены скоплением клеток моноцитарно-макрофагальной природы, в некоторых гранулемах появляется плазматические клетки, лимфоциты, нейтрофилы, при гельминтозах –много эозинофилов. Исключение составляют гранулемы при туберкулезе, сифилисе, склероме, сапе, лепре. При названных заболеваниях гранулемы имеют специфические черты, свойственные только конкретному возбудителю. Что позволяет относить эту группу заболеваний в группу специфиченских гранулематозов (специфическое воспаление). Специфическим называют воспаление, которое обусловлено специфическими возбудителями(микобактерией туберкулеза, бледной трепонемой, (вызывающей сифилис), микобактерией лепры, палочкой риносклеромы.
В морфологическом плане для специфического воспаления характерно образование специфических гранулем, которые имеют характерное строение в зависимости от возбудителя, т.е. клеточный состав и расположение клеток в гранулеме довольно специфичны для каждого вобудителя.
Воспаление при туберкулезе: микобактерия туберкулеза может вызывать три вида тканевой реакции: альтеративную, экссудативную и пролиферативную.
Альтеративное воспаление развивается чаще в результате гипоергии (при снижении защитных сил организма). Проявляется морфологически казеозным некрозом.
Экссудативное воспаление развивается в результате гиперергии (при повышенной чувствительности к антигенам, токсинам микобактерии). Морфологически проявляется накопление в очаге поражения серозного, фибринозного или смешанного экссудата, который в дальнейшем подвергается казеозному некрозу.
Пролиферативное воспаление при туберкулезе развивается в условиях специфического туберкулезного иммунитета. Морфологическим проявлением будет образование туберкулезных гранулем (в виде просяного зерна).
Туберкулезная гранулема имеет характерное строение: в центре очаг казеозного некроза, за которым находится вал радиарно расположенных (вытянутых по-длиннику от центра к периферии) эпителиоидных клеток, за ними видны единичные гигантские клетки Пирогова-Лангханса. На периферии гранулемы располагается вал лимфоцитов. Среди этих типичных клеток могут быть в небольшом количестве плазматические клетки и макрофаги, также выявляется тонкая сеть аргирофильных волокон. Кровеносные сосуды не встречаются. При окраске по Цилю-Нильсену в гигантских клетках выявляются микобактерии туберкулеза.
Воспаление при сифилисев различные периоды отражает разную тканевую реакцию на бледную трепонему: выделяют первичный, вторичный и третичный периоды сифилиса. При первичном сифилисе развивается продуктивно-инфильтративная реакция на месте внедрения трепонемы, при вторичном — экссудативная реакция выражена, способствует генерализации возбудителя, при третичном — продуктивно-некротическая реакция, которая представлена сифилитической гранулемой и гуммозными инфильтратами.
Воспаление при лепре представлено лепрозными гранулемами (лепромами) или лепроматозными инфильтратами.
Лепрозная гранулема имеет полиморфный клеточный состав: в большом количестве макрофаги, эпителиоидные клетки, гигантские, плазматические клетки и фибробласты. В макрофагах в огромном количестве содержатся микобактерии Гансена-Нейссера. Макрофаги переполняются возбудителем. Микобактерии лежат в них строго упорядоченными рядами, напоминая сигареты в пачке (хорошо видно при окраске поЦилю-Нильсену). В последующем микобактерии склеиваясь образуют лепрозные шары. Макрофаги со временем разрушаются а лепрозные шары фагоцитируются гигантскими клетками.
Тканевая реакция при проказе зависит от резистентности организма. Выделяют 2 формы проказы: 1)туберкулоидная(возникает у больных с высокой резистентностью) и 2) лепроматозная(возникает у больных с низкой резистентностью).
Туберкулоидная форма протекает доброкачественно, поражается кожа в виде пятен, бляшек и папул. Морфологически в кожи обнаруживаются эпителиоидоклеточные гранулемы и по ходу нервов выявляются инфильтраты из эпителиоидных клеток. Микобактерий мало в гранулемах. Внутренние органы не поражаются.
Лепроматозная форма характеризуется диффузным поражением кожи с обезображиванием лица(львиная морда). Наблюдается тяжелый лепрозный неврит с постепенным замещением нервного волокна соединительной тканью. Лепромы содержат макрофаги, гигантские клетки со множеством микобактерий. Такие гранулемы обнаруживаются в печени, селезенке, костном мозге, лимфатических узлах, эндокринных органах.
Воспаление при склероме характеризуется образованием склеромных гранулем. Склеромные гранулемы содержат макрофаги, лимфоциты, большое число плазматических клеток. Специфичным для склеромной гранулемы являются крупные одноядерные клетки с вакуолизированной цитоплазмой- клетки Микулича, которые образуются от макрофагов и содержат возбудитель- палочку Волковича- Фриша. Для склеромы типичны также склероз и гиалиноз грануляций. Склеромные гранулемы располагаются в слизистой оболочке верхних дыхательных путей(носа, гортани, трахеи, реже- бронхах). Процесс заканчивается образованием рубцовой ткани на месте гранулем, возиожна асфиксия.
Воспаление при сапе отличается образованием эпителиоидноклеточных гранулем, напоминающих туберкулезные. При остром течении болезни сапные гранулемы подвергаются некрозу и гнойному расплавлению.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Как стало известно, хроническое воспаление и злокачественные опухоли — это два взаимосвязанных процесса:
1) хроническое воспаление вызывает предрасположенность индивидуума к заболеванию опухолями;
2) развивающаяся опухоль индуцирует микро- или макроокружение в виде хронического воспаления, ассоциированного с усилением роста опухоли и появлением метастазов.
Механизмы хронического воспаления при опухолях
Ещё в ХIХ в. была впервые осознана взаимосвязь между раком и воспалением. Наличие проявлений хронических воспалительных реакций при различных опухолях наблюдал Р. Вирхов, а также в более позднее время и Ю. Конгейм. В последние годы интерес к этой проблеме значительно возрос.
Эпидемиологическими исследованиями было показано, что хроническое воспаление предваряет развитие многих форм рака. Хроническое воспаление повышает риск возникновения злокачественных опухолей, индуцируя синтез медиаторов воспаления: свободных радикалов, альдегидов, цитокинов, факторов роста, таких ключевых ферментов воспаления, как циклооксигеназа-2 и индуцибельная NO-синтаза, различных транскрипционных факторов (например, ядерный фактор кв), эйкозаноидов и многих других медиаторов.
Чем продолжительнее воспалительный процесс, тем больше риск возникновения опухоли. Было показано, что блокада NFkP сигнального пути в клетках глиобластомы, дифференцирующихся in vitro и in vivo, приводит к остановке репликации и старению этих клеток. Факторы вторичной альтерации влияют на контроль экспрессии онкогенов и генов-супрессоров при воспалительном процессе, способствуя образованию различных опухолей.
Клетки воспалительного процесса, такие как макрофаги и нейтрофилы, высвобождают против инфекционных агентов высокореактивные элементы оксигены и нитрогены, повреждающие молекулы дезоксирибонуклеиновой кислоты (ДНК). Долгое время полиамины считали маркерами опухолевого роста, однако путресцин, спермидин и спермин являются, в первую очередь, сигнальными молекулами разрушения структур ДНК, а уже во вторую очередь активизируют фермент орнитиндекарбоксилазу, что приводит к повышению пролиферативного потенциала клеток. Вероятно, этот механизм также осуществляется через воспалительный процесс.
При хроническом воспалении повышенный уровень повреждений ДНК, наряду с ускоренным синтезом и увеличением повреждений ферментов репарации, торможением апоптоза, стимуляцией ангиогенеза и клеточной пролиферации, относят к предраковым состояниям. Асептические воспалительные процессы также способствуют появлению злокачественных опухолей.
Мало кто обращал внимание на тот факт, что индукцию злокачественных опухолей с помощью разнообразных канцерогенов в основном проводили и продолжают проводить на животных, а не в клеточной культуре. Оказывается, индуцировать канцерогеном опухоль в условиях in vitro удаётся очень редко. Введение же канцерогена в организм сопровождается развитием хронического асептического воспаления, на фоне которого часто появляются опухолевые зачатки.
Особенности хронического воспаления при опухолях головного мозга
Головной мозг, как известно, является забарьерным органом. Одно время предполагали, что гемато-энцефалический барьер (ГЭБ) защищает ткани мозга от воспалительных процессов. Однако связь между черепно-мозговыми травмами (ЧМТ) и опухолями головного мозга известна давно.
Описаны случаи возникновения глиом после огнестрельных ранений и механических непроникающих травм черепа. У 24% больных с глиомами головного мозга в анамнезе отмечено наличие черепно-мозговых травм. В среднем опухоли головного мозга возникали через 3 месяца — 12 лет после ЧМТ, а в некоторых случаях опухоли возникали и через 15-20 лет после травмы. Каких-либо серьёзных концепций, объясняющих эти наблюдения, не существует.
В головном мозге, который является иммунологически привилегированным органом, воспалительные процессы имеют свои характерные особенности. Клетки микроглии, активные участники внутримозгового воспалительного процесса, в отличие от других клеток мозга, образуются в костном мозге и мигрируют в головной мозг в позднем эмбриональном периоде.
Среди многих молекул, клетки микроглии вырабатывают хемоаттрактанты, их рецепторы, и несут адгезивные молекулы, которые активно участвуют в процессе воспаления. Характерно, что воспалительные процессы в головном мозге, ассоциированные с ростом глиом, как правило, не обнаруживаются общепринятыми системными гематологическими показателями, такими как скорость оседания эритроцитов (СОЭ), С-реактивный белок и др.
Однако, в эксперименте на животных было показано, что внутримозговую глиому С6 после перевивки инфильтрируют, кроме клеток микроглии, также и клетки периферической крови: лимфоциты, макрофаги, фибробласты, цитотоксические Т-клетки и др.. Как обнаружилось, в процессе роста внутримозговых опухолей происходит разрушение гемато-энцефалического барьера и погибающие опухолевые клетки выделяют в прилежащие кровеносные сосуды массу биологически активных факторов, которые способствуют миграции клеток крови из кровеносных сосудов в опухолевый очаг.
Кроме того, из костного мозга происходит миграция стволовых клеток гематогенного происхождения, которые могут дифференцироваться в нейроны и глию, замещая дефекты в тканях опухолевого и неопухолевого генеза. Вероятно, все эти клетки посредством факторов роста, которые они синтезируют, способствуют восстановлению опухолевой массы, стимулируя её разрастание, васкуляризацию, инвазию в прилежащие соседние ткани и т.д., выполняя защитно-компенсаторную функцию в ответ на частичную гибель опухолевой массы.
Известно, что тромбоцитарный фактор роста, кислый и основной факторы роста фибробластов, а также некоторые другие ростовые факторы стимулируют пролиферацию глиом. Макрофаги, инфильтрирующие опухоль, вырабатывают эпидермальный фактор роста, который стимулирует рост многих злокачественных опухолей, в том числе и глиом. Следует предположить, что одним из стимулов для последующего роста и прогрессии глиом может стать хронический асептический воспалительный процесс.
Механизмы опухоль-ассоциированного воспаления
К сожалению, большинство работ ограничивается установлением связи между хроническими воспалительными заболеваниями и злокачественными опухолями, не раскрывая патогенетических механизмов этих процессов. Кроме того, ранее онкологами не разделялись механизмы, принадлежащие сугубо опухолевому росту, и сопровождающим этот рост защитно-компенсаторным реакциям.
Помимо воспалительного процесса, вызванного различными этиологическими факторами, способствующего новообразованию опухолей, существует также воспалительный процесс, вызываемый исключительно некрозом клеток уже существующих опухолей. А.Н. Лучником впервые в 2000 г. был сформулирован общий принцип поддержания злокачественного роста во всех типах опухолей.
Его сущность заключается в том, что опухоль жертвует небольшим количеством погибающих клеток ради стимуляции пролиферации остальных клеток опухоли за счёт развития воспалительного процесса, и получившего название "синдром незаживающей раны". В этом обзоре впервые было обращено внимание на воспаление, как на механизм "самоподдержания" опухолевого микроокружения.
Следует подчеркнуть, что, вероятно, механизмы развития опухолей и поддержания опухолевого микроокружения могут быть различными. Мы предполагаем, что в первом случае воспалительный процесс стимулирует образование опухолей через механизм потери гетерозиготности в ядерных хромосомах, а во втором случае — путём непосредственного воздействия на клетки опухоли медиаторов воспаления.
Идею А.Н. Лучника поддержала П.М. Шварцбурд, которая развила представления предыдущего автора анализом механизмов дисрегуляции, способствующих индукции предракового микроокружения (ПРМ). В работе были обобщены современные данные о сравнительном влиянии острого и хронического воспаления на индукцию ПРМ и конкретные механизмы, поддерживающие состояние ПРМ в перманентном режиме. Т.обр., воспалительный процесс, вызванный гибелью клеток опухоли, носит характер эндогенного хронического асептического микровоспаления и отличается от других видов воспаления влиянием на микроокружение опухоли (МкО).
Влияние опухоль-ассоциированного воспаления на микроокружение опухолей
Впервые учение о микроокружении опухоли было сформулировано S.Paget и I.Filder. Существует мнение, что в перифокальной зоне любой опухоли процессы носят воспалительный характер, которое в последнее время получило экспериментальное подтверждение. Так, в обзоре подробно описана роль клеток иммунной системы в формировании микроокружения опухоли и влияния на её свойства.
Автор приводит сведения об усилении роста опухоли клетками микроокружения и их влияния на активацию иммуносупрессирующих воздействий. Среди факторов, важных для формирования МкО различных солидных опухолей, центральное место занимает гипоксия или оксидативный стресс. При гипоксии в опухолях индуцируется фактор транскрипции генов (HIF), обеспечивающих адаптацию клеток к гипоксии и стимуляцию ангиогенеза. HIF регулирует частоту апоптоза, влияет на скорость клеточного цикла, контролирует гликолиз, внутриклеточный рН, клеточную инвазию и миграцию, а также некоторые другие важные процессы в МкО. HIF является сильным промотором опухолевого роста.
На экспрессию HIF существенно влияет система ядерного фактора транскрипции NF-kappa В. Мишенями указанных факторов являются гены VEGF-A, ангиопоэтина-2, цитокинов, флогогенных белков, ферментов ЦОГ-2 и синтазы оксида азота. Микроокружение солидных опухолей характеризуется также реактивной стромой с избытком медиаторов воспаления и лейкоцитов, дисрегуляцией сосудов и протеолитических энзимов. Опухоль-ассоциированные макрофаги играют существенную роль во взаимосвязи между воспалением и опухолью, суммируя общее количество функций (ускорение пролиферации клеток опухоли и ангиогенез, непрерывный матричный кругооборот, подавление адаптивного иммунитета), и существенно стимулируя опухолевую прогрессию.
Современные исследования направлены на выяснение молекулярных путей, связывающих опухоль и воспаление. В опухолевом микроокружении хроническое воспаление вносит свой вклад в пролиферацию и выживание злокачественных клеток, развитие ангиогенеза, метастазов, снижение адаптивного иммунитета, понижение чувствительности к гормонам и химиотерапевтическим препаратам. Современные исследования подтверждают тот факт, что опухоль-ассоциированное воспаление индуцирует генетическую нестабильность за счёт медиаторов воспаления, что приводит к накоплению генетических альтераций в опухолевых клетках.
Два сигнальных пути связывают воспаление и рак: внутренний сигнальный путь, при котором активация различных классов онкогенов способствует экспрессии взаимосвязанных с воспалением программ, приводящий к реконструкции воспалительного микроокружения; и внешний сигнальный путь, создающий условия для стимуляции развития опухолей. Ключевым регулятором в точке пересечения этих двух путей являются транскрипционные факторы (NFkB и др.), цитокины (TNF и др.), и хемокины. Т.о., воспаление является главным компонентом МкО, и клетки опухолей генерируют те же медиаторы воспаления, поддерживая персистирование МкО.
Кроме этого, следует отметить, что воспалительный процесс, сопровождающий рост опухолей, во многом обусловлен взаимодействием гормональных перестроек в метаболизме эстрогенов, андрогенов, инсулина и изменений в энергетическом обмене. При хроническом панкреатите в клетках поджелудочной железы обнаруживаются мутации гена CFTR, кодирующего белки в анионных каналах, что особенно важно при функционировании протоков клеток поджелудочной железы.
Указанный ген контролирует поток хлоридов и бикарбонатов через эти каналы, регулируя выделение секреции клетками железы. Поэтому нарушение функции этого гена приводит к избыточному накоплению ферментов поджелудочной железы, особенно после активации трипсинов, что может повышать риск возникновения панкреатитов и рака pancreas. По сравнению с воспалительными процессами, вызывающими рост опухолей, которые могут иметь инфекционную природу, микровоспаление, асоциированное с ростом практически всех видов опухолей, включая и опухоли головного мозга, является асептическим.
Естественно, что асептическое микровоспаление при опухолевом росте отличается от такового при раневом происхождении. При опухолях стволовые клетки и другие эмбриональные клетки вступают в антагонистические отношения с микровоспалением. блокируя завершающую стадию процесса (синдром "незаживающей раны").
Нестабильность генома опухолевых клеток приводит к распаду молекул ДНК и рибонуклеиновой кислоты (РНК), к нарушению синтеза белка в клетках и других жизненно важных клеточных функций, а также к нарастанию выраженности процессов микровоспаления. Всё это, в итоге, способствует усугублению процессов опухолевой прогрессии. Механизмы этих процессов в настоящее время мало изучены, и со временем, возможно, будут использованы в качестве новых мишеней для целенаправленной противоопухолевой терапии в практической медицине.
Противовоспалительная терапия при злокачественных опухолях
Несмотря на достижения современной онкологии, полное излечение опухолей достигнуто только при некоторых локализациях рака (молочной железы, кожи, желудка и др.). Успехов в лечении опухолей других локализаций и, в частности, злокачественных глиом головного мозга, пока не достигнуто. Известны литературные данные о том, что комбинированное воздействие цитостатиков и ангиостатическая терапия оказывают более выраженное влияние на опухоли при условии применения противовоспалительных препаратов.
Так, авторы одного из обзоров, посвященного этой проблеме, подчеркивают существенную значимость применения методов стойкого подавления воспалительных процессов при опухолевом росте, приводя примеры о снижении частоты опухолевого роста на фоне длительного приёма аспирина и других нестероидных противовоспалительных средств. Известно, что длительное применение аспирина снижает риск возникновения колоректального рака.
Опубликованы также данные о большом количестве нозологии, которые можно лечить с помощью длительного приёма аспирина. Селективные ингибиторы циклооксигеназы-2 также можно отнести в группу многообещающих противоопухолевых соединений. Сочетанное применение СОХ- и LOX-ингибиторов, которые применяются при лечении воспалительных процессов, в настоящее время исследуются в качестве потенциальных противоопухолевых лекарств.
Их применение теоретически обосновано, так как недавними исследованиями было показано, что изменения метаболизма арахидоновой кислоты тесно связаны с механизмами канцерогенеза. Использование аспирина при различных формах рака показало его эффективность в группах больных, не злоупотребляющих курением.
Препараты, снижающие уровень холестерина в организме, особенно в комбинации с противовоспалительными препаратами, могут тормозить рост некоторых форм злокачественных опухолей, что предполагает использование статинов в качестве противоопухолевых фармпрепаратов. Вероятно, сочетанное применение препаратов, ингибирующих ферменты СОХ -2, LOX и NOS, сможет оказывать более выраженное противоопухолевое действие.
Читайте также:

