Опухоль эксперименте на животных
Одним из ценных методов в изучении проблемы опухолевого роста являются экспериментальные исследования.
Трансплантация опухолей. Первые систематические исследования по трансплантации (пересадке) опухолей были произведены М. А. Новинским в 1875 г. Ему удалось перевить щенкам саркому от собак и лошадям - рак от лошади. Особенно благоприятным объектом для экспериментального изучения опухолевого роста (по преимуществу злокачественного) являются крысы и мыши (рис. 64).
Спонтанные опухоли у крыс и мышей могут быть перевиты от одного животного другому. Для перевивки существуют специально выделенные и хорошо проверенные штаммы опухолей, например мышиный рак Эрлиха, крысиная саркома Иенсена, кроличий рак Броуна-Пирс, куриная саркома Роуса и др.
По своим свойствам перевитые опухоли не могут считаться вполне идентичными опухолями человека. Поэтому результаты экспериментальных исследований над перевитыми опухолями нельзя безоговорочно переносить на людей. Однако экспериментальные данные при сопоставлении с результатами клинических наблюдений облегчают понимание генеза опухолей.
Для удачной перевивки необходимо перенести от одного животного другому живую ткань опухоли.
Фактически трансплантация опухоли представляет собой экспериментальный метастаз в организме нового животного. Большая часть клеточных элементов трансплантированных тканей гибнет, но остающиеся в живых, размножаясь, вызывают возникновение опухоли, которая обладает (особенно при первых перевивках) свойствами той опухоли, которая была трансплантирована.
В некоторых случаях не требуется наличия в трансплантате живых клеток для того, чтобы возникла соответствующая опухоль у реципиента. Так бывает, например, при перевивке куриной саркомы Роуса. Перевивка этой опухоли удается также при помощи бесклеточного фильтрата. По-видимому, фактор злокачественности иногда отделим от опухолевых клеток и может привести к малигнизации, т. е. к приобретению нормальными клетками злокачественных свойств. Именно об этом говорят факты возникновения опухолей от воздействия бесклеточных фильтратов из опухолевой ткани.
Данные опытов с перевивкой опухолей привели к некоторым общим выводам о закономерностях возникновения и развития опухолевого роста.
Значение видовой специфичности. Трансплантация удается лишь в случаях перевивок опухоли от одного животного другому того же вида - от крыс крысам, от мышей мышам (видовая специфичность опухоли).
Лишь в некоторых случаях удавалась перевивка от животного одного вида животному другого вида, например перевивка куриной саркомы утятам либо мышиной карциномы - крысам, лишенным селезенки, либо перевивка опухоли одного вида эмбрионам другого.
Однако все эти данные, противоречащие ранее установленным фактам видовой специфичности опухоли, требуют дальнейших, более углубленных исследований, которые могли бы окончательно подтвердить тождественность перевиваемой опухоли с вновь растущей и определить наличие в организме реципиента всех характерных для трансплантата особенностей роста.
На успешную трансплантацию опухолей влияют факторы как внутренней, так и внешней среды.
Влияние внутренних факторов. Ученые неоднократно обращали внимание на значение психической травмы в заболевании опухолями. Депрессия создает неблагоприятный фон для развития и течения опухоли.
Экспериментальные наблюдения над собаками показали, что длительная травматизация нервной системы путем вызывания хронического экспериментального невроза способствует опухолевому росту (развитию папиллом, фибром и сарком). У мышей травматизация нервной системы электрическим током усиливала рост опухолей и ускоряла их возникновение под влиянием канцерогенных веществ, например дибензантрацена (М. К. Петрова).
Различные воздействия на подкорковую область и периферическую нервную систему также оказывали некоторое влияние на развитие трансплантированных опухолей и локализацию метастазов. Об этом свидетельствуют результаты экспериментов с трансплантацией опухолей и последующими добавочными раздражениями нервной системы то в виде перерезки нервов, то в виде воздействия на них формалином или кротоновым маслом, то путем введения в субарахноидальное пространство канцерогенных веществ. Во всех этих случаях эффект заключался в ослаблении или усилении опухолевого роста или в изменениях распределения метастазов опухолей (А. Д. Сперанский и сотрудники).
Состояние глубокого торможения в высших отделах центральной нервной системы ускоряло развитие и метастазирование опухолей, тогда как возбуждение повышало устойчивость к их возникновению (Р. Е. Кавецкий).
Экспериментальные исследования подтверждают наблюдения о влиянии эндокринных желез на возникновение, развитие и исход опухолевого роста.
Наиболее достоверные данные имеются относительно влияния на опухолевый рост половых желез и гипофиза. Кастрация в раннем возрасте самок-мышей, принадлежащих к высокораковой породе, предупреждает развитие рака молочных желез. Инъекция больших доз гормона яичников эстрона усиливает рост и даже вызывает развитие опухолей у самцов. Введение же андрогена (гормон яичек) тормозит развитие опухоли.
Расстройства эндокринной функции половых желез и их влияние на опухолевый рост могут возникать от изменений гонадотропной функции передней доли гипофиза. Оказалось, что мыши низкораковой породы имеют относительно низкий уровень гонадотропной функции гипофиза, а высокораковые животные характеризуются более высокой гонадотропной активностью гипофиза. После удаления гипофиза развитие опухоли заметно тормозится. Введение самототропного гормона гипофиза стимулирует опухолевый рост.
В возникновении и росте экспериментальных опухолей особенно важное значение имеют факторы внешней среды.
Значение питания. Применение различных диет у животных, которым делалась пересадка, показывает, что характер питания имеет значение для развития опухоли. Рост перевитых опухолей у крыс тормозится при кормлении их растительными белками, лишенными лизина, аргинина и гистидина, или желатиной, не содержащей циклических аминокислот. Усиливает опухолевый рост пища, обогащенная углеводами, холестерином и калием. Длительное кормление животных пищей, лишенной тиамина, рибофлавина или холина, может способствовать возникновению рака.
Химические канцерогены. Опухоли удается вызвать в эксперименте воздействием некоторых химических раздражителей.
Посредством длительного (в течение 6 месяцев) смазывания дегтем ушей кроликов удалось получить разрастание раковой опухоли на коже (Ямагива и Ишикава, 1915). Позднее с помощью каменноугольного дегтя рак был получен и у мышей. Эти опыты были вскоре воспроизведены и подтверждены многими исследователями. Некоторые сорта дегтя, как оказалось, обладают высокой активностью и в течение 3 месяцев (после 50 смазываний кожи мышей) вызывают рак почти у всех животных.
Из каменноугольного дегтя при высокой температуре его перегонки (400 - 600°) выделены чистые канцерогенные вещества - полициклические углеводороды, которые впоследствии были получены также синтетическим путем. Они обладают способностью в зависимости от дозы и длительности действия вызывать у животных злокачественные опухоли. Такими канцерогенными свойствами отличаются производные антрацена и фенантрена: 3,4-бензпирен, диметил-1,2-бензантрацен, метилхолантрен и др. (табл. 2).
Примечание. Плюсами обозначена степень канцерогенности.
Кроме полициклических углеводородов, канцерогенным свойством обладают некоторые другие вещества.
В развитии уже давно известных данных об анилиновом раке ныне обнаружено в экспериментах канцерогенное действие таких веществ, как азосоединения (например, ортоаминоазотолуол, диметиламиноазотолуол), нафтиламин и вещества более простого строения (например, четыреххлористый углерод и хлороформ). К неорганическим канцерогенным веществам относятся соли мышьяка, цинка, хрома, кобальта, бериллий и др. До настоящего времени получено около 500 химических канцерогенных веществ.
При смазывании кожи животных канцерогенными веществами после скрытого периода в несколько месяцев обычно развивается злокачественная опухоль (рис. 65). Резорбция канцерогенных веществ при введении под кожу, внутримышечно, внутрибрюшинно или перорально вызывает рак или саркому в зависимости от того, какая ткань подверглась их воздействию. Чем выше доза вещества, тем быстрее проявляется его канцерогенное действие. Некоторые из этих веществ обладают высокой канцерогенной активностью. В редких случаях даже однократное смазывание 0,6% раствором метилхолантрена в бензоле вызывало у мышей рак.

Рис. 65. Рак у кролика, вызванный канцерогенным веществом (9:10 диметил, 1, 2-бензатрацен). Ухо смазывали этим веществом 2 раза в неделю в течение 29 недель
Однако строгая специфичность канцерогенности этих веществ окончательно не подтверждена.
Злокачественный рост может быть получен трансплантацией не только опухолей, но также нормальной ткани, культивированной в среде с добавлением к ней канцерогенных веществ.
Макрофаги селезенки куриного эмбриона, культивируемые в плазме с прибавлением канцерогенных веществ, превращались в саркоматозные клетки и, будучи введены подкожно курам, вызывали опухолевый рост. Но превращение нормальных клеток в бластоматозные при культивировании их на питательной среде с добавлением канцерогенного углеводорода возможно лишь при наличии также фактора молока (А. Д. Тимофеевский). Например, превращение нормальных клеток подкожной клетчатки мышей в бластоматозные происходит только в том случае, если ткань взята от мышеи раковой линии, т. е. в условиях, когда невозможно исключить наличие в ней фактора молока.
Большинство канцерогенных веществ - производных фенантрена - по своему химическому строению имеют некоторое сходство с эстрогенными гормонами, в частности с фолликулярным гормоном (общее ядро фенантрена). Подобно фолликулину, они оказывают эстрогенное действие (вызывают течку у животных). В особых условиях и фолликулярный гормон может способствовать опухолевому росту, а примененный в больших дозах (в хронических опытах) обладает даже канцерогенными свойствами.
Химическая общность установлена также между канцерогенными углеводородами, с одной стороны, и стеринами, гормонами коры надпочечников, желчными кислотами и витамином D - с другой. Из желчных кислот удалось синтезировать канцерогенный углеводород метилхолантрен. Дезоксихолевая кислота, содержащаяся в нормальной желчи, в условиях эксперимента обладает слабо выраженными канцерогенными свойствами.
При повторном введении мышам вытяжки из печени и легких людей, умерших от рака, а также из печени и легких трупов людей, не болевших раком, было установлено, что у мышей в известном проценте случаев развиваются злокачественные опухоли. При этом опухоли возникали чаще при введении вытяжек из органов людей, болевших раком (Л. М. Шабад).
Значение всех этих наблюдений заключается в том, что они позволяют поставить вопрос о зависимости патогенеза злокачественных опухолей от образования канцерогенных веществ в самом организме в связи с расстройством обмена веществ, особенно обмена стеринов (эндогенные канцерогенные вещества). Однако их роль в возникновении опухолей окончательно не выяснена.
Физические канцерогены. При длительном воздействии механических раздражителей на ткань могут возникать опухоли. Например, у морских свинок рак желчного пузыря возникает через большой промежуток времени после зашивания в него камешков.
Рак у крыс и мышей могут вызывать малые дозы ионизирующего излучения, например γ-лучей. Эти лучи в зависимости от дозы вызывают появление новообразований, ускоряют или тормозят их рост.
В этом отношении особое внимание обращено на заболеваемость опухолями в связи с попаданием в организм различных радиоактивных веществ, например стронция, накоплением их в тканях и длительным действием на организм. Канцерогенное действие радиоактивных веществ зависит от характера излучения (например, от степени жесткости . -лучей), химической природы изотопов, периода их полураспада, а также скорости выведения из организма.
Существуют отдельные наблюдения, указывающие на возникновение злокачественных опухолей от длительного действия ультрафиолетовых лучей и даже при известных условиях от массивного и длительного облучения солнцем не покрытой шерстью кожи у крыс (Н. Н. Петров). Ультрафиолетовые лучи с длиной волн в пределах 280 - 335 mμ могут вызывать опухолевый рост.
Биологические факторы. Установлена связь между возникновением опухолей и хроническими раздражениями, исходящими от воздействия на организм некоторых биологических агентов.
Так, экспериментальный рак желудка у крыс возникал при кормлении их тараканами, в мускулатуре которых содержались глисты Spiroptera neoplastica. Однако в метастазах опухоли эти паразиты не были обнаружены.
Саркомы печени у крыс вызывались глистами Taenia crassicolis, паразитирующими в кишечнике кошки.
Все эти опыты свидетельствуют о том, что наряду с другими раздражителями макропаразиты также могут вызывать опухоли. Однако их роль сводится лишь к неспецифическим физическим или химическим раздражениям ткани, которые в конце концов и ведут к возникновению бластоматозного роста.
Опухоли у кур удавалось вызывать инъекцией бесклеточного фильтрата куриной саркомы Роуса, т. е. с помощью какого-то агента, отделимого от клеток опухоли (рис. 66). Этот агент обладает признаками, свойственными фильтрующимся вирусам. Например, он способен количественно увеличиваться по мере роста опухоли, переходить в дочерние клетки и даже распространяться в организме животного, т. е. обладает способностью размножения. Химический анализ показал, что вирус представляет собой рибонуклеопротеин с липоидным и углеводным компонентом.
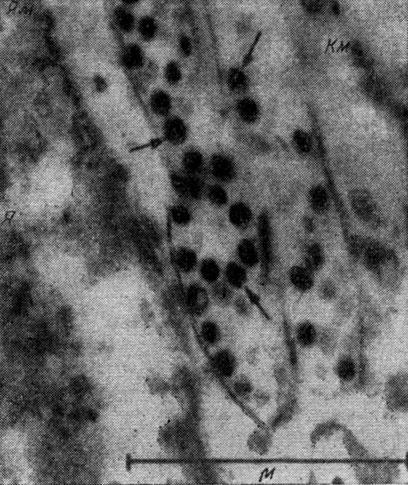
Рис. 66. Вирусные частицы в цитоплазме саркомы Роуса (обозначены стрелками). Я - ядро клетки; Ям - мембрана ядра; Км - клеточная мембрана. Электронная микроскопия; х 45 000 (по В. Бернгарду)
К опухолевым вирусам относят также упомянутый выше фактор молока (Биттнер). В пользу вирусной природы фактора молока приводят его способность размножаться в культурах ткани, физические и химические свойства, отношение к различным внешним агентам (например, термическому воздействию, высушиванию), его ультраструктуру и цикл развития в пораженной клетке, сходные с тем, что свойственно уже известным вирусам. Все же до сих пор нельзя считать окончательно установленным, является этот фактор действительно вирусом или близким вирусам своеобразным продуктом жизнедеятельности опухолевых клеток, обладающим аутокаталитическим действием, или способностью вызывать в новом организме образование себе подобных веществ.
В последнее время у некоторых диких пород кроликов обнаружена опухоль - папиллома, которая перевивается домашним кроликам также при помощи бесклеточного ее фильтрата (папиллома Шопа). Но и здесь возникают сомнения, так как не вполне установлено, является ли эта опухоль истинной опухолью или реактивным разрастанием ткани. Такие разрастания у кроликов могут действительно превращаться в раковые опухоли. Но тогда бесклеточный экстракт образовавшейся таким образом злокачественной опухоли опухолевого роста не вызывает.
Вообще необходимо отметить, что количество достоверно известных вирусов, вызывающих опухоли, пока незначительно. Кроме упомянутых, к вирусным опухолям относят аденокарциному и лейкоз мышей, мышиную опухоль околоушной железы, вызываемую вирусом полиомы, и некоторые другие.
Результаты изучения свойств вируса полиомы поколебали существующее положение о видовой и тканевой специфичности опухолевых вирусов, так как оказалось, что вирус полиомы может вызывать опухоль не только у мышей, но и у некоторых других животных (хомяки, крысы) и притом в разных органах.
Хроническая регенерация и хроническая воспалительная пролиферация. Вызванная воздействием на ткань различных раздражителей хроническая пролиферация или регенерация может дать начало развитию опухолевого роста. Эти предшествующие опухолевому росту изменения рассматриваются многими исследователями как благоприятная почва для появления опухоли.
В связи с этим важно также отметить, что хроническое отравление мышей и крыс дегтем может вызвать усиленное предрасположение таких животных к возникновению опухоли на месте действия какого-либо дополнительного раздражителя (ко-канцероген), например при воздействии подпороговых доз канцерогенных веществ в сочетании с воспалительным агентом (кротоновое масло).
Подверженность отдельных тканей опухолевому росту проявляется также в опытах с растущими вне организма моноцитами и макрофагами селезенки куриного эмбриона, которые чаще других клеток переходят в саркоматозные клетки под воздействием химически чистых канцерогенных веществ в сочетании с бесклеточными фильтратами некоторых опухолей.
Очевидно в возникновении экспериментальных опухолей имеют значение не только внешние факторы раздражения, но также реактивные свойства тканей, в частности размножающиеся пролиферирующие молодые тканевые элементы.
Иммунитет к опухолям. В эксперименте неоднократно пытались доказать существование иммунитета к опухолям на основании возможности возникновения естественно приобретенной устойчивости к ним после самопроизвольного рассасывания спонтанных опухолей. Искусственно приобретенная устойчивость наблюдается после рассасывания ранее привитого кусочка. Иммунитет к опухолям объясняется различно. Одни исследователи в выработке иммунитета решающее значение придают (без достаточных оснований) только местной реакции ткани, окружающей трансплантированную частицу опухоли (так называемая тканевая резистентность). Другие исследователи отвергают это утверждение и главное значение в иммунитете к опухолям приписывают (с большим основанием) иммунобиологическим свойствам организма, в частности по отношению к некоторым нуклеопротеидам, выделенным из опухолей.
Однако строгая специфичность такого иммунитета еще не может считаться доказанной. До сих пор не удалось в связи с перевивкой опухоли обнаружить строго специфические антитела в крови, а также получить пассивный иммунитет к опухолям инъекциями сыворотки крови животного, уже перенесшего заболевание.
"Модель – это ложь, которая помогает увидеть правду"
Говард Скиппер, американский онколог
О том, что животных можно использовать в качестве моделей для изучения различных воздействий, ученые догадались достаточно давно. Еще в Древней Греции Аристотель проводил эксперименты на живых животных. Позднее Авицена тестировал новые хирургические процедуры на животных, прежде чем выполнить их у пациентов. 
В наше время в онкологии животные модели используются с различной целью:
- изучение эффективности и безопасности лекарственных препаратов, которые предполагается внедрить в клиническую практику - доклинические исследования;
- дальнейшая интерпретация результатов клинических исследований - пост-клинические исследования;
- скрининг в поисках новых лекарств;
- изучение биологии опухоли;
- изучение механизмов противоопухолевого лечения: взаимодействие препарата с мишенью.
Чтобы получить представление о роли экспериментальных исследований на животных в развитии онкологии, обратимся к двум историческим примерам.
Пример 1
В 1954 году в США был принят законопроект, поручавший Национальному институт онкологии разработать программу по целенаправленному и эффективному поиску лекарств для химиотерапии. За десять лет на миллионе мышей было протестировано около 83 тысяч синтетических веществ, 115 тысяч продуктов ферментации и свыше 17тысяч веществ растительного происхождения. В итоге, в распоряжении врачей для лечения детей с острым лимфобластным лейкозом было 4 препарата - метотрексат, преднизон, 6-меркаптопурин и винкристин. Все они использовались, но по отдельности. Лечение лейкемии у детей продолжало оставаться паллиативным.
На этой модели Скиппер впервые описал два важных наблюдения:
- Химиотерапия в каждый момент убивает определенный процент от общего числа клеток, вне зависимости от того, сколько их в организме.
Так, если взять мышь, у которой сто тысяч лейкозных клеток, и применить вещество, убивающее за один раз девяносто девять процентов этих клеток, то каждый новый прием будет убивать ровно эту долю, а в результате после каждого раза таких клеток будет оставаться все меньше и меньше: сто тысяч, тысяча, десять – и, наконец, после четвертого цикла упадет до нуля. - При комбинированном применении противоопухолевые лекарства работают синергически, усиливая действие друг друга.
При использовании нескольких препаратов и нескольких повторных циклов химиотерапии с малыми промежутками между ними Скипперу удавалось на своей мышиной модели добиться полного исцеления от лейкемии.
Было решено испробовать схему, сочетающую в себе четыре лекарства: винкристин, аметоптерин, меркаптопурин и преднизон. Эта схема получила сокращенное название по первым буквам каждого лекарства: ВАМП.
В первом же небольшом исследовании у 14 из 16 пациентов была достигнута полная ремиссия, а отдаленная безрецидивная выживаемость отмечена у трех из них.
Позже концепцию сочетания противоопухолевых препаратов и их курсового введения, выработанную на экспериментальной модели, применили для поздних стадий лимфомы Ходжкина. Было решено взять четыре препарата – метотрексат (позже замененный на более сильнодействующее средство – прокарбазин), винкристин, азотистый иприт (или мустарген) и преднизон. Получился не менее токсичный, чем ВАМП, коктейль с аббревиатурой МОМП (МОПП – с прокарбазином), а курс лечения был увеличен с 2,5 мес. до 6. 
Более половины испытуемых выздоровели окончательно и бесповоротно. Для поздних стадий лимфомы Ходжкина подобный ответ на лечение и количество ремиссий был беспрецедентен. Успехи комбинированной химиотерапии разительным образом изменили прогнозы пациентов с ранее неизлечимыми III и даже IV стадиями лимфомы Ходжкина. И изначально это стало возможным благодаря модели лейкемии Л1210 у мышей.
Пример 2
Еще один яркий пример использования животных моделей в онкологии – это создание анти Her2-препаратов. В 1982 в лаборатории Роберта Вайнберга выделили очередной онкоген из крысиной опухоли под названием нейробластома. Ген окрестили neu в честь типа рака, из которого этот ген был получен. От многих других открытых в то же время онкогенов его отличало то, что он не прятался в глубине клетки, а проходил через мембрану, причем так, что большой фрагмент его торчал наружу, доступный любому лекарству, т.е. это была идеальная мишень. Но эксперимент по связыванию этой мишени имеющимися в лаборатории антителами не был проведен.
Теперь от истории вернемся к предмету разговора – моделям опухолей. Классическими объектами экспериментальной онкологии являются млекопитающие, прежде всего мыши и крысы, которые хорошо адаптируются к условиям жизни в неволе и дают многочисленное потомство. Нет ни одной проблемы онкологии, которую не исследовали бы с использованием этих грызунов.
- У животных встречаются спонтанные опухоли (особенно это относится к опухолям молочной железы); подобные модели довольно близки по своей картине к клинической ситуации.
Ограничение - невозможно набрать в конкретный срок требуемое количество животных с опухолями схожих размеров и этапов развития, чтобы провести эксперимент.
- Химически индуцированные опухоли.
Например, бензпиреновые опухоли индуцируются введением мышам однократно подкожно бензпирена в масляном растворе. Это приводит к равномерному развитию подкожных фибросарком у всех животных в месте инъекции в течение 4-5 недель после введения.
Ограничения: эффекты канцерогена на поведение самой опухоли, риск для других животных и персонала.
- Генетически созданные мышиные модели (genetically engineered mouse models – GEMM).
Такие модели позволяют достаточно точно моделировать спорадические человеческие опухоли за счет контролируемого изменения генома мышей, что обеспечивает развитие конкретной опухоли с определенными свойствами в заданной локализации. Так, создаются линии животных, которые целенаправленно лишены определенного гена, или, напротив, имеют встроенный дополнительный ген.
Ярким примером трансгенных мышей является линия мышей с повышенной экспрессией онкогена HER2. У этих животных в возрасте от 2 месяцев появляются опухоли молочных желез (HER2/neu-положительных).
Ограничения: несмотря на гистологическое и генетическое сходство со злокачественными новообразованиями у человека, для большинства GEMM характерно асинхронное развитие опухолей в организме-хозяине. Такие модели, как правило, гетерогенны с точки зрения частоты развития опухолей, времени задержки в развитии опухолей и характеристик роста.
- Перевиваемые опухоли – это самая многочисленная подгруппа.
Здесь можно выделить два принципиально разных способа перевивки.
Первый, когда фрагмент мышиной/крысиной опухоли в последующем перевивается животному той же линии.
Во втором случае животным (обязательно иммунодефицитным) вводится культура опухолевых клеток человека. Такие модели получили название ксенографтных.

Усовершенствованным и наиболее перспективным вариантом стандартной ксенографтной модели является модель, для создания которой используются фрагменты опухолей, полученные непосредственно от пациентов, т.е. осуществляется прямой перенос опухолевого материала, взятого у пациента, в организм животного с иммунодефицитом без предварительного культивирования опухолевых клеток (patient-derived xenografts – PDX). Подобные PDX-модели продемонстрировали способность точно предсказывать положительный клинический ответ на лечение у 90% пациентов, и резистентность к проводимой терапии у 97% больных. Цифры, близкие к этим были получены в целом ряде исследований.
Ограничения использования данной модели обусловлены техническими особенностями ее создания, для которого необходим доступ к опухолевой ткани определенного качества непосредственно после ее получения от пациента, а также определенной материально-технической базы лаборатории, позволяющей проводить соответствующую обработку полученного материала и поддерживать опухоль через серию пассажей в организме-хозяине.
GEMM и PDX-модели, несмотря на свои недостатки, сегодня рассматриваются как наиболее ценные и перспективные с точки зрения тестирования вновь создаваемых противоопухолевых препаратов.
Г.С. Киреева, кандидат биологических наук,
научный сотрудник научной лаборатории канцерогенеза и старения
Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова.
Было решено испробовать схему, сочетающую в себе четыре лекарства: винкристин, аметоптерин, меркаптопурин и преднизон. Эта схема получила сокращенное название по первым буквам каждого лекарства: ВАМП.
Основными, ставшими классическими, методами изучения опухолевого роста в эксперименте являются: 1) трансплантация, 2) индукция, 3) эксплантация, 4) выведение раковых линий животных и животных с наследственной предрасположенностью к опухолям.
Трансплантация (пересадка, перевивка) опухоли впервые успешно была осуществлена от взрослых собак щенкам отечественным учёным М.А. Новинским в 1876 году в Санкт-Петербурге. Наряду с аутотрансплантацией (перевивкой опухоли из одного места тела животного в другое), изотрансплантацией (перевивкой опухоли от одного животного к другому той же линии) и аллотрансплантацией или гомотрансплантацией (перевивкой опухоли от одного животного другому того же вида), в последние годы чаще используют гетеротрансплантацию (перевивку опухоли от одного вида организма другому виду, например, от человека животному). Для повышения эффективности гетеротрансплантации используют животных-реципиентов с подавленным иммунитетом. Для этого применяется общее рентгеновское облучение, введение кортикостероидов, цитостатиков, антилимфоцитарной сыворотки, удаление тимуса.
Трансплантация опухоли является удобным методом для оценки опухолевой прогрессии, изучения влияния опухоли на организм и, особенно, оценке методов и средств лечения конкретных видов опухоли.
Индукция опухолей обычно осуществляется при помощи введения здоровым животным либо вирусов, либо химических канцерогенов.
Модель вирусного канцерогена была впервые, в 1908 году, воспоизведена Эллерманом и Бангом в опытах на курах путём перевивки лейкоза с помощью бесклеточного фильтрата (содержащего вирусы). Затем, в 1911 году, перевивку саркомы также с помощью бесклеточного фильтрата в опытах на курах произвёл Роус. В дальнейшем была доказана способность многих и ДНК-, и РНК-содержащих вирусов вызывать различные опухоли у разных видов животных.
Модель локального химического канцерогенеза была впервые, в 1915 году, воспроизведена Ямагива и Ишикава в опытах на кроликах путём длительного (шестимесячного) втирания в кожу уха кролика каменноугольной смолы. В дальнейшем разными учёными разработаны методики индукции опухолей не только многократным, но даже однократным парентеральным введением химических канцерогенов.
Индукция опухолей широко используется во всём мире для оценки характера и степени канцерогенного действия различных химических, в том числе и лекарственных, веществ и соединений.
Эксплантация опухоли осуществляется путём помещения опухолевых клеток (срезов опухолей или клеточных культур) в искусственную питательную среду (то есть in vitro) на различный период времени.
Данный метод позволяет не только изучать свойства опухолевых клеток в условиях in vitro (как до, так во время и после действия различных факторов на организм), а также исследовать механизмы опухолевой индукции с помощью различных канцерогенов.
Например, учеными многих стран в различных исследованиях используется линия раковых клеток эпителияшейки матки,названную HeLa,по имени американской темнокожей женщины Henrietta Lacks, умершей в 1951 году от данной опухоли.
Выведение раковых линий животных и линий животных, предрасположенных к развитию опухолевых заболеваний, осуществляется разными путями и методами.
Во-первых, этого можно достичь путём тщательного отбора особей со спонтанно возникающими опухолями, скрещиванием их между собой, а также скрещиванием особей их потомства. Существуют линии животных являющихся опухолевыми вследствие зараженности онкогенными вирусами (вирусом рака молочной железы, вирусом лейкоза мышей и т.д.). Хорошо известен так называемый фактор молока Биттнера (онковирус), названный так в честь автора блестящей работы (Bittner, 1936), доказавшего возможность передачи рака молочной железы от мышей высокораковой линии новорожденным мышатам низкораковой линии через материнское молоко.
Во-вторых, можно искусственно создать линии животных с генетическим дефектом, приводящим к возникновению опухолей. Это достигается с помощью введения в оплодотворенную яйцеклетку ДНК с заданными свойствами, предназначенную для интеграции с геномом этой клетки (например, с дефектом антионкогена). Вырастающая особь имеет в своем геноме уже созданные экспериментатором поломки, которые приводят к развитию опухолей. Другим способом такого воссоздания животных с опухолевой предрасположенностью является трансфекция раннего эмбриона (например, мыши) ретровирусом, несущим необходимый код, после чего во всех клетках хозяина (эмбриона) появляется новая генетическая информация, в последующем стимулирующая опухолевое перерождение клетки.
Во всех случаях животные со спонтанным развитием опухолей являются важнейшей моделью для изучения патогенеза и лечения онкологических заболеваний.
ПАТОГЕНЕЗ ОПУХОЛЕЙ
Канцерогенез – это сложный, длительный, многоэтапный и многостадийный процесс, основу которого составляет стойкая и необратимая патология генома клетки, приводящая к изменению программы жизнедеятельности, и, как правило, выбраковкой ее из популяции.
В настоящее время принято рассматривать опухолевый рост как двуэтапный и трехстадийный процесс.
Первый этап, именуемый как бластомоцитогенез претерпевает две стадии: 1) инициации (трансформации)и 2) промоции (активации пролиферации).
Второй этап, именуемый как бластомогенез, включает стадию прогресии.
Стадия инициации - повреждение генома клетки без изменения ее фенотипических свойств. Инициация вызывается генотоксическими химическими канцерогенами, вирусами и физическими факторами. Клетка может находиться в этом состоянии любое время: от нескольких дней до десятков и более лет.
Стадия промоции - изменение фенотипических свойств клетки. Эта стадия чаще всего вызывается химическими веществами - промоторами. В качестве промоторов могут быть любые вещества, в том числе эндогенные канцерогены, химические вещества, относящиеся к возможным канцерогенам, а также вещества, стимулирующие деление клеток. Время влияния промотора после действия инициатора не имеет большого значения. Описан случай развития рака мочевого пузыря через 48 лет после прекращения контакта с анилиновыми красителями. Химические вещества, обладающие промоторным действием на развитие опухолей у человека изучены недостаточно.
В эту стадию происходит более быстрое увеличение количества дочерних опухолевых клеток, образующих первичный опухолевый узел. Как только достигается критическое число (около 10 млрд) опухолевых клеток, их пролиферация становится прогрессирующей, неуправляемой, необратимой.
Стадия опухолевой прогрессии - рост одной или нескольких малигнизированных клеток до морфологически и клинически определяемой опухоли. Рост опухоли происходит медленно. Так, для роста от одной клетки до опухоли массой 1 грамм требуется деление 30-ти поколений клеток (минимальный срок такого роста - 90 дней). Для роста от 1 грамма до 1 килограмма - всего лишь 10 поколений и соответственно требуется как минимум 30 дней. Поскольку в опухоли пролиферирует лишь небольшой процент клеток, реальные сроки роста опухоли значительно дольше. Таким образом, наиболее медленный рост опухоли (до нескольких лет) может происходить на самых ранних стадиях, еще до клинических проявлений. В процессе роста происходит постепенное нарастание генетических повреждений клеток, что приводит к дальнейшему озлокачествлению опухоли. Это связано с тем, что по мере роста опухоли ее клетки оказываются в неравных условиях: на некоторые клетки продолжают действовать канцерогенные вещества, часть клеток подвергается воздействию со стороны иммунной системы, возникают разные условия для поступления к клеткам кислорода и питательных веществ. Это приводит к тому, что в опухоли появляются несколько клонов клеток, что повышает степень злокачественности опухоли. Постепенно наименее дифференцированный клон становится доминирующим.
Роль генов в канцерогенезе
В основе опухолевого роста всегда лежит повреждение генома клетки, вызываемое вирусами, физическими, химическими факторами или спонтанно. В настоящее время не подвергается сомнению генетическая теория канцерогенеза, согласно которой в основе малигнизации клетки лежит повреждение генома (клеточная мутация). Существуют и эпигеномные изменения клетки, способствующие развитию опухоли, что послужило основанием создания эпигеномной теории канцерогенеза.
Повреждение генома клетки происходит по трем классам регулирующих генов: 1) стимулирующих рост опухолевых клеток - протоонкогенов; 2) ингибирующих рост - антионкогенов; 3) отвечающих за апоптоз.
Клеточные протоонкогены. При изучении вирусного канцерогенеза было обнаружено, что онковирусы при попадании в клетки вносят в ее геном гены, стимулирующие и качественно нарушающие клеточную пролиферацию, а следовательно, способствующие малигнизации клеток. Эти гены были названы вирусными онкогенами. Цитогенетические исследования показали, что аналоги вирусных онкогенов имеются и в клетках человека и животных, где они выполняют различные функции регуляции синтетических процессов и деления. Более того, предполагается, что вирусы, несущие эти онкогены когда то “похитили” их из клеток хозяина. Поэтому, для более точного разделения, клеточные регулирующие гены - аналоги вирусных онкогенов были названы протоонкогенами, а в случае их чрезмерной экспрессии - клеточными онкогенами. Клеточные онкогены появляются при таких повреждениях генома клетки, когда происходит нарушение регуляции функции протоонкогенов, их нерегулируемая экспрессия и, соответственно синтез различных факторов (онкобелков), стимулирующих клеточную пролиферацию. Причины такой суперэкспрессии генов или чрезмерной активации их белков-продуктов могут быть различными.
Амплификация. Увеличение (обычно многократное) числа копий протоонкогенов, приводящее с активизации опухолевой трансформации клеток.
Транслокация. В результате перемещения протоонкогена, находящегося на одной хромосоме в область сильного промотора, расположенного на другой хромосоме, в результате чего неактивный протоонкоген может превращаться в онкоген.
Мутация. точечная мутация протоонкогена может приводить к изменению метаболизма и накоплению его белка-продукта.
Инсерция. Молчащий в обычных условиях протоонкоген клетки может активизироваться под влиянием внесённого в клеточный геном той или иной вирусной ДНК.
Трансдукция. Захват вирусами клеточных онкогенов и их разблокировка в геноме вирусов под влиянием разных промоторов, в итоге приводящие к расстройству генетической регуляции процессов деления клеток.
Деметилирование ДНК. Возникающий под влиянием, главным образом, химических канцерогенов и активных радикалов деметилированный участок ДНК становится активным и приводит к стимуляции деления клеток.
По механизму действия онкогены делятся на 4 основные группы:
1. Онкогены, кодирующие факторы роста.
2. Онкогены, кодирующие рецепторы к факторам роста - мембранным белкам с протеинкиназной активностью. Теория онкогенов предполагает выработку рецепторов с постоянной высокой активностью, т.е. не зависящей от стимуляции факторами роста.
3. Онкогены, кодирующие передачу сигнала в клеточной цитоплазме, например, связанные с системой G-протеина.
4. Онкогены, кодирующие ядерные белки, участвующие в транскрипции и репликации ДНК.
Антионкогены или гены супрессии опухолей. Их роль в канцерогенезе хорошо прослеживается при изучении наследственных опухолей. Известно, что многие наследственные опухоли связаны с мутациями некоторых генов, что приводит к потере их функции и возникновению опухолей. Такие гены были названы антионкогенами. Эта группа генов имеет различные функции в клетке. К антионкогенам, например, относятся следующие:
- Rb-1 - ген, кодирующий белок, обладающий ДНК- связывающими свойствами, регулирует транскрипцию ДНК; потеря этого антионкогена отмечается при наследственной ретинобластоме;
- NF-1 - ген, кодирующий ГТФ-азный активирующий протеин. Потеря функции этого гена приводит к снижению активности ГТФ-азы и увеличению содержания в клетке G-протеина; такой дефект встречается при некоторых опухолях нервной системы (нейрофиброматоз);
- APC - (adenopolyposis coli) ген, кодирующий белок, участвующий в поддержании межклеточных контактов, потеря этого гена наблюдается при опухолях толстой кишки, желудка, щитовидной железы;
- гены, регулирующие транскрипцию ДНК, контролирующие и отвечающие за репарацию ДНК, а также за многие другие функции в клетке.
При активации онкогенов и инактивации генов- супрессоров отмечается трансформация нормальной клетки и превращение ее в опухолевую.
Гены регулирующие апоптоз (програмированную смерть клеток). Поскольку одним из основных свойств опухоли является ее иммортализация, то изменение активности генов, влияющих на апоптоз имеет большое значение в этом процессе. Основными в этом семействе являются гены Р-53 (о котором говорилось выше), Вcl-2 и Вcl-x и некоторые другие гены. В зависимости от функции белков, кодируемых этими генами для развития опухоли необходимы различные нарушения. Если белки, например р53, запускают апоптоз, то для развития опухоли требуется выключение генов, которые эти белки кодируют. Если напротив, белки-продукты этих генов предотвращают апоптоз клеток, как например, Вcl-2 и Вcl-x, то при чрезмерной экспрессии таких генов в клетках происходит заметное удлинение их срока жизни, что способствует развитию опухоли.
Необходимо отметить, что в опухолевой клетке имеется не единичное, а множественное нарушение генома и, как правило, происходит активация нескольких онкогенов и выключение функции нескольких антионкогенов. Поэтапное повреждение генома клетки приводит к ее озлокачествлению, что называется опухолевой прогрессией. Таким образом, опухолевая прогрессия происходит при нарушении функции многих генов с различной локализацией в геноме. Последовательное повреждение различных генов генома может быть связано с длительным воздействием химических или других канцерогенных воздействий. При достижении опухолью определенных размеров и степени злокачественности она становится способной к метастазированию.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Читайте также:

