Обследование на онкологию радиоактивным
Сканирование с использованием радиоактивных изотопов является простой и наиболее широко распространенной техникой обнаружения опухолевых метастазов. В ряде случаев эта методика бывает весьма неточна, т. е. выдает большой процент некорректных результатов. Это может быть связано, с одной стороны, с недостаточной чувствительностью детектирующих методов (влияет на процент позитивных результатов в опухолевой ткани), а с другой стороны — с низкой специфичностью (влияет на процент негативных результатов в здоровой ткани).
Однако доза получаемой пациентами радиации крайне низка, методика признана безопасной и обладает хорошей воспроизводимостью результатов. Кроме того, она относительно дешева в применении.
Изотопное сканирование наиболее ярко проявляет себя в диагностике скелетных метастазов. Сканирование костной ткани в настоящее время является процедурой, которую наиболее часто проводят в большинстве сервисных клинико-диагностических лабораторий. В сканировании обычно используют фосфоросодержащие соединения, помеченные технецием.
Изотопы быстро накапливаются в костной ткани, причем уровень поглощения зависит от регионального кровоснабжения и скорости образования новых костных тканей. Так как метастазы обычно характеризуются усиленным кровоснабжением и повышенной активностью остеобластов, эти области накапливают изотопные метки более интенсивно, чем здоровые ткани. У данного правила есть и исключения. Например, множественная миелома характеризуется крайне низкой активностью остеокластов.
Так как процесс поглощения изотопов является неспецифическим процессом, множество причин могут вызвать его увеличение. Трещины и переломы ребер, артриты и деформации позвоночника при остеопорозе — все это может вызвать повышенное поглощение изотопной метки и быть ошибочно принято за наличие метастазов у больных раком. Таким образом, наличие единичной области повышенного поглощения изотопа следует интерпретировать с большой осторожностью.
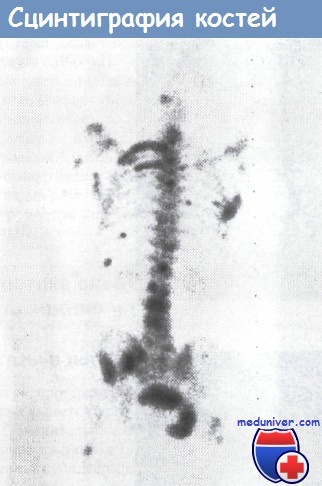
Изотопное сканирование костей скелета обнаруживает многочисленные костные метастазы.
Представлены исследования больного карциномой простаты.
При обнаружении данного факта следует обследовать подозрительную область организма радиографически, а если потребуется, то и с помощью компьютерно-томографических методов. Особенно это касается обнаружения единичных областей повышенного поглощения в позвоночном столбе, так как для него характерна высокая вероятность дегенеративных заболеваний. И все же обнаружение областей повышенного накопления радиоактивной метки у онкологических больных чаще всего бывает связано с возникновением вторичных опухолей, и каждый такой случай нуждается в тщательной проверке.
При обнаружении множества очагов повышенного накопления изотопа почти с уверенностью можно говорить о распространении опухоли. В настоящее время изотопное сканирование костей считается основной диагностической процедурой в определении стадии заболеваемости и проводится у всех больных с первичной карциномой молочной железы.
При диагностике опухолей печени в сканировании используют серный коллоид, меченный 99m Тс. Метастазы детектируются как области пониженного поглощения изотопа. Изотопное сканирование печени является менее точным методом, чем КТ-сканирование, и использование этой методики в последнее время постоянно сокращается.
Для обнаружения отдаленных метастазов при колоректаль-ном раке сейчас используют сцинтиграфию — новую методику с применением следовых количеств меченных монокло-нальных антител. При раке молочной железы и злокачественной меланоме сейчас часто практикуется удаление железы Вирхова как альтернатива стандартной региональной лимфаденоктомии.
При хирургическом удалении железы Вирхова часто отпадает необходимость в чистке подмышечных лимфоузлов — например, у больных раком молочной железы эта операция с вероятностью 95% предотвращает их поражение. Данная методика требует предварительного проведения лимфосцинтиграфии для точной локализации железы и минимализации хирургического вмешательства.
В диагностике опухолей нейроэндокринной системы для точной локализации метастазов можно пометить лекарственные препараты, такие как окситоцин (аналог соматостатина), которые будут специфически связываться с соматостатиновыми рецепторами.

Радиоизотопное лечение и диагностика злокачественных опухолей сегодня активно применяется в онкологии. Современное оборудование позволяет точно рассчитать дозы облучения с минимальным отрицательным воздействием на организм.
Что такое радиоизотопная диагностика?
Радионуклидный способ диагностики можно назвать одним из самых популярных лучевых методов. Он уступает только обычной диагностике с помощью рентгена. Задача этого метода в обнаружении патологий в органах и системах организма. При этом используются радиофармпрепараты, в которых содержатся радионуклиды.
Такой вид диагностических исследований включает в себя применение в малых дозах радиоактивных веществ. Разные методы применения дают возможность обнаружить скопления радиоиндикаторов в различных тканях и органах.
Сегодня последние научные достижения позволили создать целые комплексы оборудования, которые дают возможность получить подробные изображения органов, всего тела. Такие изображения позволяют врачу рассмотреть функции организма, особенности работы отельных органов и тканей.
От других фармпрепаратов, которые применяются при лечении других заболеваний, радиофармпрепараты отличаются не только содержанием радиоактивного вещества. Его количество очень мало, поэтому при попадании в организм человека, они не дают побочных реакций. Как, например, при применении биологического лечения, могут возникать различные аллергии.
Особенность радиоизотопной диагностики на сегодняшний день в том, что применяются только радиоизотопы, которые живут крайне мало. Современные комплексы радиодиагностики позволяют получить очень подробные картины заболевания. Такая точность данных достигается за счет абсолютно новых методов обработки данных. Большой поток информации поступает в систему, обрабатывает очень быстро и без искажений.
Риски и противопоказания при применении радионуклидной диагностики
С одной стороны, радиоизотопная диагностика предполагает использование радиоактивных веществ в крайне малых дозах, поэтому организм получает низкий уровень облучения. Это дает множество преимуществ, по сравнению с рисками, которые имеются в этом случае. Тем более, что такой способ диагностики используют в онкологии вот уже больше полувека. За это время наблюдения показали, что каких-либо побочных реакций с течением времени не выявлено.
С другой стороны, все же имеется ряд противопоказаний для применения этого метода. Перед тем, как назначить метод диагностики, врач проводит анализ всех рисков, которые могут иметь место и плюсов, которые даст исследование. Обо всех этих нюансах он должен сообщить пациенту, чтобы у него не возникало вопросов.
Легкие аллергические реакции возникают крайне редко, но стоит с самого начала рассказать врачу о том, что у вас могут быть реакции на какие-либо препараты или агенты. Особенно важно уделить внимание побочным реакциям организма, которые возможно возникали при предыдущих исследованиях с применением радиоизотопов.
При введении радиофармпрепарата внутривенно, место введения может сильно покраснеть, также эта процедура слегка болезненна, однако, подобные реакции проходят достаточно быстро.
Исключается применение радиоизотопной диагностики, если имеется подозрение на беременность, а также при грудном вскармливании.
Что позволяет выявить радиоизотопная диагностика?
Подобный вид диагностики позволяет выявить злокачественные новообразования на самых ранних стадиях в костях, органах, тканях. Он дает подробную визуализацию онкологических опухолей в головном мозге и щитовидной железе.
Такая четкая картина новообразования дает возможность прогнозировать развитие заболевания и контролировать его течение. Особенно это важно для оценки эффективности других видов лечения, например, химиотерапии.
В каких случаях применяют радиоизотопное лечение?

Метод радиоизотопной терапии предполагает внутривенное или пероральное введение препарата, содержащего радиоактивное вещество. Спустя определенное время оно переносится на участок, который поражен раковыми клетками и облучает его целенаправленно. Эффективность такого лечения в том, что радиоактивное излучение происходит местно.
На раковые клетки воздействует облучение, от которого они погибают. Чтобы этот вид терапии был максимально эффективным, нужно очень тщательное планирование такого лечения, а врач, занимающийся лечением, должен иметь достаточно квалификации. Дело в том, что для каждого пациента дозы и вариант лечения являются индивидуальными.
Сегодня радиоизотопная терапия получает все большую популярность при лечении злокачественных новообразований. Большая часть научных изысканий в сфере фармацевтики посвящена разработке именно радиофармпрепаратов, которые очень эффективны в борьбе с раковыми опухолями.
При любом из видов радионуклидного лечения обязательно проводят компьютерную томографию. Данные, полученные при исследованиях, дают возможность проанализировать то, как накапливаются радиоактивное вещество в различных тканях, помогают дать прогноз развития заболевания, и точно рассчитать дозы применения препарата. Так контролируется и эффективность проводимого лечения. Иногда после получения результатов компьютерной томографии принимается решение о необходимости повторения сеансов лечения.
Применение радиоизотопов при нейроэндокринных опухолях
Нейроэндокринные новообразования иногда лечат с помощью излучения, которое переносится в больные ткани пептидами. Во многих странах Европы именно этот метод лечения рекомендуется при такой разновидности онкологии. Сегодня этот вид лечения апробируется при злокачественных образованиях в поджелудочной железе, печени и предстательной железе.
Радиоизотопное лечение костных метастазов
Фармпрепараты, содержащие радиоактивные вещества, позволяют снизить болевые синдромы в случаях сильного поражения костных тканей метастазами. В таком случае радиофармпрепараты оказывают воздействие на области возле метастазов, а они характеризуются усиленным обменом веществ в этих районах. Также препараты окружают нервные окончания, что помогает подавить боли, при этом на здоровые ткани оказывается минимальное отрицательное воздействие. Таким образом, продляется жизнь пациента и улучшается ее качество.
Лечение при других видах рака
Примерно 15 лет опыту использования радиофармпрепаратов при лечении лимфомы. Такая терапия позволяет уничтожать раковые клетки облучением. Также эффективно применение этого вида лечения при онкологии щитовидной железы, в таком случае используется радиоактивный йод. Во время терапии в метастазах накапливается это вещество, и его излучение уничтожает онкоклетки или уменьшает их количество.
Этот вид терапии можно применять и при некоторых других образований, которые встречаются редко, а также при заболеваниях крови (лейкемия). Однако, на сегодняшний день лечение изучено крайне мало, клинические исследования проведены у небольшого количества пациентов. Обычно, такое лечение предполагает взаимодействие сразу многих врачей из разных сфер медицины. Да и в целом, всего несколько медицинских центров по всему миру могут оказать полноценное лечение таким методом.
Какие побочные эффекты имеет метод?
В основном методы радиоизотопной диагностики и лечения не имеют сильных побочных эффектов и безболезненны. Единственное неудобство может вызвать постановка катетера в вену, но существенного дискомфорта ожидать не стоит.
Обычно при введении фармпрепарата в вену, иглу устанавливают в районе ямки в локте. Естественно, что для этого придется сделать укол. Сама инъекция может вызвать ощущение холода, которое распространяется на всю руку, также случаются покраснения, но других реакций обычно не наблюдается.
Излучение радиоактивного вещества со временем исчезает, потому что радиоизотопы распадаются. После обследований препарат выводится из организма вместе с калом или мочой. Все это занимает несколько дней или часов. Если необходимо скорее вывести из организма радиоактивное вещество, то рекомендуют употреблять много жидкости. Подробные рекомендации составляет лечащий врач.
Радионуклидная диагностика – современный способ тщательного изучения состояния организма человека. Применение радионуклидной диагностики в онкологии позволяет определить степень распространения и уровень активности раковых клеток. С помощью данного метода составляется наиболее действенная схема лечения, а также предотвращаются рецидивы заболевания.
Суть метода
После того как человеку вводится меченое вещество, называемое радиофармпрепаратом, оно начинает перемещаться внутри организма. Распределение препарата напрямую зависит от кровотока, скорости метаболических процессов и степени функциональности органов.
При помощи специального оборудования врач имеет возможность отслеживать перемещение вещества и его излучение, что позволяет выявить любые патологии в организме.
Главный принцип радионуклидной диагностики – накопление и распределение радиоактивного вещества внутри человеческого тела с их дальнейшей регистрацией на оборудовании с высокой чувствительностью.
Минимальная лучевая нагрузка, малая вероятность негативных последствий вкупе с получением достоверной картины функционального состояния органов – ещё один важный принцип радионуклидной диагностики.
Преимущества перед другими видами исследований
В лаборатории радионуклидной диагностики врач получает изображения статического характера исследуемого органа. Они отображают области с аномальным количеством введённого вещества. Это даёт информацию о расположении органа относительно других органов, кровеносных сосудов и нервов. Кроме того, на изображениях видны: форма, размер, наличие очага патологии, степень функционирования.
Радионуклидная диагностика – исследование, дающее менее чёткую картинку, в сравнении с ультразвуковым и рентгенологическим обследованием, она имеет меньшее разрешение. Но методы радионуклидной диагностики направлены на изучение не анатомических и морфологических особенностей органов, а на анализ их функциональности, нарушения которой проявляются намного раньше видимых изменений. За счёт этого преимущества выявляются заболевания на самой ранней стадии, эффективно отслеживается динамика их развития.
Безопасны ли радиофармпрепараты?
В диагностических и терапевтических целях пациенту вводится вещество (нуклид), подобранное таким образом, чтобы при минимальном облучении получить всю возможную информацию. К сравнению, однократное действие радионуклида на пациента практически в 100 раз меньше, чем при стандартном рентгенологическом исследовании.
Кроме того, нуклиды быстро распределяются по организму и выводятся из него за короткий промежуток времени, что также в разы снижает действие облучения.
Радиофармпрепараты, используемые в медицине, не содержат токсических веществ, которые после распада оставляют в организме вредные примеси.
Методы радионуклидной диагностики
Исследование осуществляется двумя способами:
- In vitro. В организм человека не вводятся радиофармпрепараты. С точки зрения безопасности этот метод наиболее оптимальный, т. к. для проведения диагностического исследования у пациента берут кровь или другой биоматериал. Человек не получает даже минимальной дозы облучения, поэтому способ in vitro подходит всем онкобольным.
- In vivo. Радиофармпрепараты вводятся в организм человека.
Способы введения радионуклидов
Существуют следующие пути введения радиоактивных веществ:
- энтеральный – нуклиды попадают в кровь из кишечника; чаще всего применяется при радионуклидной диагностике щитовидной железы;
- внутривенный – используется для обследования большинства органов;
- подкожный – важен при оценке функциональности лимфоузлов и сосудов, также препарат может быть введён непосредственно в лимфатические узлы;
- ингаляционный – нужен для визуализации вентиляции лёгких и кровообращения в головном мозге;
- внутримышечный – незаменим при оценке кровообращения;
- спинно-мозговой – препарат вводится непосредственно в канал для его обследования;
- внутриартериальный.
Способы регистрации распределения радиоактивных веществ
Существуют следующие виды радионуклидной диагностики:
- сцинтиграфия;
- сканирование;
- радиометрия;
- радиография.
Сцинтиграфия - метод, используемый в радионуклидной диагностике чаще всего. Он даёт возможность визуализировать орган и степень накопления препарата в нём, что позволяет оценить его функциональность и своевременно выявить патологический процесс.
Данный способ диагностики осуществляется с помощью гамма-камеры. Основной принцип её работы – регистрация излучения радиофармпрепарата при помощи йодида натрия. Этот компонент в виде кристалла большого размера (примерно 60 см в диаметре) чутко реагирует на излучение вещества. Перемещение препарата проецируется на кристалл в виде вспышек света, которые далее попадают на фотоумножитель, преобразовывающий их в электрические импульсы. С помощью регистрации этих импульсов создаётся изображение, показывающее распределение радионуклида. Гамма-камеры позволяют получать как аналоговые, так и цифровые изображения.
Метод сцинтиграфии предполагает введение меченого вещества внутривенно, за исключением тех случаев, когда необходимо обследование лёгких. Для их сцинтиграфии выбирается ингаляционный путь введения препарата.
Метод сканирования позволяет получить двухмерное изображение распределения радионуклида. Детектор сканера улавливает и регистрирует излучения, они при помощи специального блока преобразуются в штрихи, которые наносятся на обычную бумагу. Они называются сканограммой. О распределении препарата врач судит, исходя из вида штрихов.
Существует также метод цветного сканирования, когда цвет штрихов зависит от излучения, испускаемого радиофармпрепаратом.
Максимальная достоверность данного метода достигается при полной неподвижности пациента. Если это условие не соблюдается, сканер представляет искажённую картину.
Если цель диагностики – обнаружение метастазов, не выявленных клиническими исследованиями, применяется метод профильного сканирования. Его суть заключается в следующем: датчики профильного сканера перемещаются над исследуемой частью тела. В результате на бумаге появляются не штрихи, а кривая линия, показывающая накопление препарата по направлению перемещения датчиков.
На сегодняшний день метод сканирования всё реже находит применение на практике. Это обусловлено тем, что он требует больше времени, чем сцинтиграфия, с помощью которой информация предоставляется за короткий промежуток времени.
Чтобы тщательно изучить степень функционирования органа, применяют радиометрию.
Она подразделяется на виды:
- лабораторная – у пациента осуществляется забор биоматериала (кровь, моча, кал и пр.), после чего его изучают на предмет уровня накопления радионуклида;
- медицинская (клиническая) – с её помощью возможно изучить как все системы человеческого организма сразу, так и отдельный орган.
Для лабораторного исследования применяется радиометр. После того как пробирка с биологическим материалом устанавливается у счётчика, радиометр выдаёт на бумаге результат, обработанный микрокомпьютером. Главное достоинство лабораторного метода – точные расчёты, не требующие доработки врачом.
Медицинская радиометрия подразумевает введение радиоактивного вещества внутрь. Датчик радиометра фиксирует степень излучения над диагностируемой частью тела. Информация выдаётся на приборе в виде числового значения зарегистрированных импульсов. Полученный результат оценивается в процентах.
Если необходимо провести радионуклидную диагностику всего тела, используют несколько детекторов. Перемещаясь вдоль тела, они дают информацию о степени функционирования сразу всех систем и органов.
Недостатком радиометрии является то, что она не даёт информацию о кровотоке в исследуемом органе, вентиляции лёгких и пр., т. е. о быстропротекающих процессах в организме.
Чтобы зарегистрировать скорость перемещения радиофармпрепарата, используют метод радиографии. Динамика изменения излучения фиксируется детекторами и переносится на бумагу в виде кривой линии.
Главное достоинство радиографии – простота диагностики. Но в то же время не представляется возможным расположить детекторы строго на границах исследуемого органа. С помощью радиографа не осуществляется визуализация органа, поэтому интерпретация результатов может быть затруднена.
Томографическая технология в радионуклидной диагностике
Наряду со сцинтиграфией, широкое применение на практике находят томографические направления радионуклидной диагностики:
- ОФЭКТ (однофотонная эмиссионная компьютерная томография);
- ПЭТ (позитронная эмиссионная томография).
Метод ОФЭКТ чаще всего используется в кардиологии и неврологии. Его суть заключается в следующем: вокруг человека вращаются стандартные гамма-камеры, улавливающие излучения с разных позиций. Благодаря этому реконструируется объемное изображение, показывающее распределение радиоактивного вещества.
Метод ПЭТ является уникальным способом диагностики, появившимся недавно. Основное его достоинство – выявление заболевания на ранней стадии, уже тогда, когда это ещё невозможно при обследовании стандартными методами.
В процессе диагностики врач имеет возможность визуализировать не только размер и форму органов, но и их метаболизм и степень функционирования.
Чаще всего ПЭТ применяется в онкологии для своевременного обнаружения злокачественного процесса и наблюдения за его развитием.
Метод позитронной томографии основан на фиксировании реакции, имеющей название аннигиляция. Она представляет собой взаимодействие позитронов и электронов, испускаемых радионуклидами. Вокруг человека размещаются детекторы, улавливающие аннигиляцию. Данный способ настолько чувствителен, что с его помощью могут отслеживаться даже мыслительные процессы!
В ходе обследования происходит точная количественная оценка накопления радиофармпрепарата, что позволяет выявить самое начало опухолевого процесса и составить максимально эффективную противораковую схему лечения. С помощью ПЭТ возможно обследование как отдельного органа, так и всего тела.
Также этот метод эффективен при диагностике состояния головного мозга, когда у пациента отмечается потеря памяти неясного генеза. В сжатые сроки подтверждается или исключается рак мозга, обнаружение которого затруднено на самом раннем этапе обычными способами.
Главный недостаток ПЭТ – необходимость использования дорогостоящих радионуклидов.
Особенности применения в онкологии
Отделение радионуклидной диагностики оснащено передовым оборудованием. С его помощью существенно улучшается качество обследования онкобольных, которое при применении стандартных методов не даёт чёткой картины, например:
- радионуклидная диагностика печени позволяет установить, возможна ли резекция органа на начальной стадии рака;
- исследование лёгких отражает уникальную картину изменения опухоли, своевременно выявляет метастазы;
- при раке толстой кишки данный метод позволяет предотвратить рецидивы и исключить наличие отдалённых метастазов у пациентов, у которых уровень онкомаркеров остаётся повышенным после хирургического вмешательства;
- радионуклидная диагностика почек выявляет точную локализацию метастазов в тех случаях, когда это затруднено при компьютерной и магнитно-резонансной томографии;
- при лимфоме наиболее достоверно определяется стадия заболевания и оценивается степень эффективности лечения;
- обследование больных меланомой позволяет определить уровень развития злокачественного процесса, исключить или подтвердить наличие отдалённых метастазов и рецидивов;
- радионуклидная диагностика щитовидной железы позволяет лучше визуализировать размер ракового узла, его активность по отношению к окружающим тканям;
- эффективно оценивается распространение процесса при злокачественных образованиях органов головы; это позволяет составить наиболее подходящую схему лечения;
- диагностика при раке молочной железы даёт возможность спрогнозировать распространение опухоли, выявить рецидивы и своевременно оценить эффективность назначенного лечения.
Нужна ли подготовка?
Необходимо соблюдать определённые правила подготовки перед диагностикой щитовидной железы и лёгких. Остальные виды обследования не требуют какой-либо подготовки.
Перед радионуклидной диагностикой щитовидной железы:
- за 2 месяца до процедуры исключить все препараты, содержащие йод и пищу, им богатую;
- не принимать L-тироксин и его аналоги как минимум за 3 недели.
Перед радионуклидной диагностикой лёгких:
- минимум за 6 часов исключить приём пищи;
- не курить перед обследованием;
- во избежание получения искажённых результатов не принимать за 30 дней лекарства: антибиотики, адсорбенты, радиофармпрепараты, лекарственные средства на основе висмута, противоязвенные препараты;
- если пациент проходил процедуру эндоскопии, диагностика возможна через 7 дней после неё.
Как проводится, продолжительность обследования
Радионуклидная диагностика проводится исключительно в медицинском учреждении под наблюдением высококлассных специалистов. Перед процедурой нужно отключить мобильный телефон.
Методика радионуклидной диагностики заключается в следующем: пациенту вводится радиофармпрепарат, после чего он размещается на диагностическом оборудовании. Длительность процесса получения информации – минимум 30 минут, продолжительность напрямую зависит от вида патологии и стадии её развития. После завершения процедуры в ближайшие сутки рекомендовано обильное питьё.
Радионуклидная диагностика – уникальный способ обследования, позволяющий выявить на ранней стадии не только онкологические заболевания, но и любые другие патологии. Информативность и безопасность – главные достоинства метода. При минимальном облучении врач получает точную картину функционирования всех органов и систем.
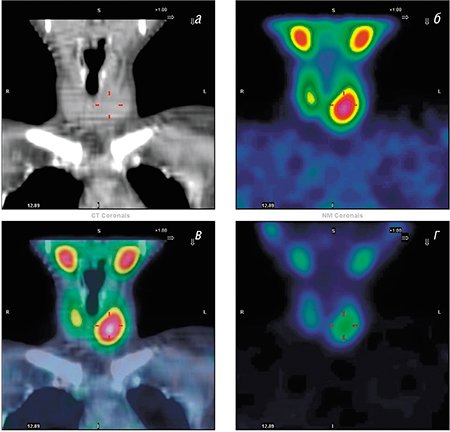
За последние годы и в России построено более десятка ПЭТ-центров, в первую очередь в Москве и Санкт-Петербурге. Федеральная сеть центров ядерной медицины расширяется, охватывая различные регионы страны: уже построены ПЭТ-центры в Уфе, Хабаровске, Челябинске, Красноярске, Ханты-Мансийске, Казани, Екатеринбурге, Белгороде, Тольятти.
В связи с этим возникает ряд вопросов, которые интересны не только специалистам, но и широкой общественности. Например, какую информацию несут изображения, полученные с помощью диагностических методов ядерной медицины? В чем состоит их преимущество при онкологических заболеваниях? Какова лучевая нагрузка на пациента при обследованиях методами ПЭТ и ОЭКТ? Сколько стоит такое обследование, и кто будет за него платить?
От морфологии – к физиологии
К стандартным и широко известным методам диагностики сегодня можно отнести рентгеновскую компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ), каждый из этих методов имеет свою нишу приложения.
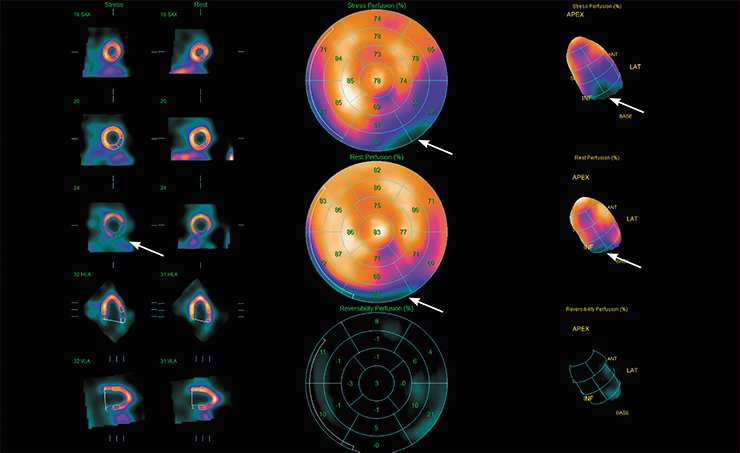
Метод МРТ основан на явлении ядерного магнитного резонанса. С его помощью получают изображение пространственного распределения протонов (ядер атомов водорода, входящих в состав молекулы H2O), которое наиболее контрастно для мягких тканей с различным содержанием воды. МРТ используют для исследования головного и спинного мозга, диагностики опухолей, заболеваний нервной системы.
Усилить чувствительность методов КТ и МРТ можно с помощью контрастных веществ. Большинство опухолей, особенно злокачественных, имеют лучшее кровоснабжение, чем здоровые ткани, и контрастное вещество будет накапливаться в них в большей концентрации. Однако эти отличия не всегда настолько значимы, чтобы на основе визуальных оценок можно было поставить диагноз.
Оба этих метода дают изображения, основанные преимущественно на морфологических различиях тканей. Принципиальное отличие диагностических методов ядерной медицины состоит в том, что они позволяют визуализировать метаболические процессы (химические реакции, необходимые для поддержания жизни), протекающие в организме на клеточном уровне.
Метим опухоль
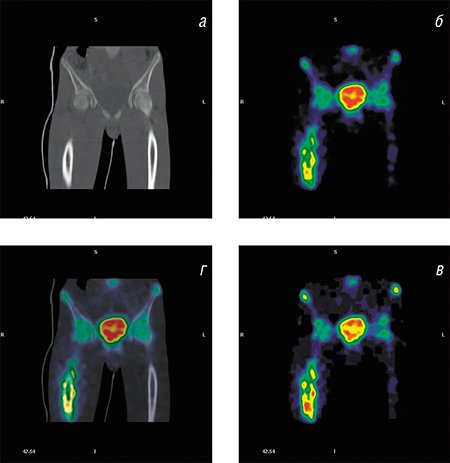
Например, в кардиологии для оценки кровоснабжения миокарда методом ОЭКТ широко применяется препарат Тс99m-МИБИ на основе метокси-изобутил-изонитрила, который захватывается здоровыми клетками миокарда. Метка накапливается в областях с ненарушенным кровоснабжением, и только в неповрежденных клетках, что позволяет диагностировать патологии кровоснабжения миокарда и выявлять области некротического повреждения.
В онкологии метод ОЭКТ в последние годы уступает свои позиции ПЭТ. В этой области медицины практически все ПЭТ-обследования проводят с помощью препарата фтордезоксиглюкоза, по составу близкому к обыкновенной глюкозе и меченному изотопом фтора 18 F. Глюкоза – универсальный источник энергии, поэтому раковые клетки, отличающиеся усиленным метаболизмом, накапливают этот препарат в более высоких концентрациях, чем здоровые. И на ПЭТ-изображениях очаги поражения видны в виде ярких пятен.
В ОЭКТ и ПЭТ используются разные радионуклиды-метки. В первом случае это радиоактивные вещества, которые при распаде испускают гамма-кванты. Радионуклиды, использующиеся при ПЭТ-диагностике, испускают позитроны – античастицы электронов. В биологических тканях присутствует много свободных электронов, поэтому позитрон встречается с электроном, пройдя расстояние менее 1—2 мм. Частицы аннигилируют, выделяя энергию в виде двух гамма-квантов, вылетающих в противоположных направлениях, которые и регистрируются детекторами. Поток гамма-квантов при ПЭТ существенно выше, что и обеспечивает более высокое качество получаемых изображений.
В чем преимущества метода ПЭТ в сравнении с другими видами томографии для диагностики рака? Во-первых, он позволяет не только дифференцировать доброкачественные и злокачественные образования, но и обнаруживать опухоль на самой ранней стадии развития, когда шансов на успех излечивания существенно больше. Во-вторых, это единственный метод, с помощью которого можно просканировать все тело после обнаружения первичной опухоли, чтобы диагностировать наличие или отсутствие метастазов, что чрезвычайно важно для определения тактики лечения. Наконец, только ПЭТ дает самую раннюю оценку эффективности проводимого лечения, а также позволяет отличить рецидив от морфологических повреждений ткани после хирургических и лучевых процедур.
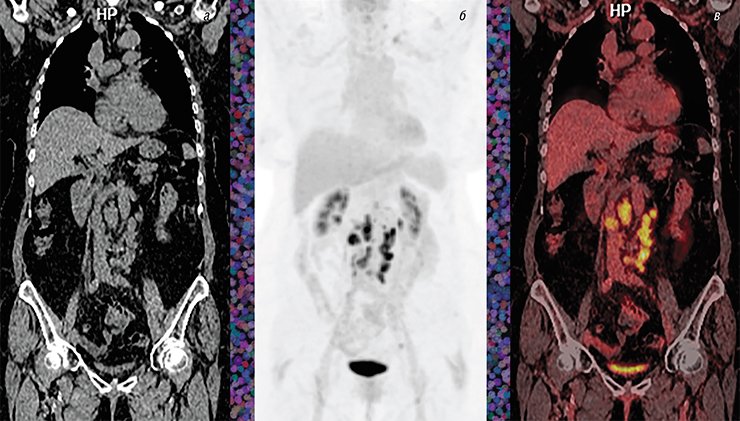
ПЭТ-исследования используют и для контроля опухолевого процесса уже после курса терапии. Например, при изначально гормонопозитивном раке молочной железы опухоль иногда прогрессирует после окончания стандартной 5-летней гормонотерапии. Но в рутинной клинической практике онкологи часто пренебрегают возможностью повторного установления диагноза, особенно при внутригрудной и внутрибрюшинной локализации метастазов. Это непросто сделать даже с помощью ПЭТ-диагностики из-за низкой метаболической активности очагов вследствие небольших размеров. Однако эти ограничения можно преодолеть за счет использования нового препарата – 18 F-фторэтилтирозина, который еще только входит в практику передовых клиник.
Решают кадры
В Европе, США, Японии и Китае быстрое развитие ядерной медицины в последние годы привело к росту числа исследований в этой области, увеличению численности и повышению уровня подготовки специалистов. Текущую ситуацию в России можно оценить как критическую. Чтобы решить проблему подготовки кадров для рутинной и исследовательской работы в области ядерной медицины, нужно вводить соответствующие курсы на действующих кафедрах медицинских вузов, а также готовить немедицинских специалистов: радиохимиков, медицинских физиков, математиков, биологов.
Назрела необходимость быстро решать вопрос образовательной подготовки специалистов для ядерной медицины, так как было бы стратегической ошибкой закупать дорогостоящее высокотехнологичное оборудование и при этом не иметь грамотных специалистов, которые могут на нем работать.
Будущее ядерной медицины определяется, прежде всего, мультидисциплинарными фундаментальными исследованиями, направленными на разработку более эффективных радиофармпрепаратов, обеспечение радиационной безопасности и создание новых аппаратных средств регистрации гамма-излучения, а также на совершенствование математических методов обработки полученной информации. Кстати сказать, в мире фундаментальные исследования в этой области ведутся сегодня настолько интенсивно и широко, что основной Европейский журнал по ядерной медицине и молекулярной визуализации (EJNMMI) даже разделился на несколько дисциплинарных журналов.
Ниже мы коснемся только одного из направлений, близкого автору по роду его научной деятельности, которое связано с применением математического моделирования и компьютерных имитаций в области диагностической ядерной медицины. Необходимость такого подхода диктуется невозможностью из-за лучевой нагрузки проводить исследования на людях, тогда как эксперименты на мелких животных не могут решить проблем, возникающих при диагностике человека.
Матмоделирование в помощь
Томографические исследования в новосибирском Институте теоретической и прикладной механики (ИТПМ) СО РАН были инициированы д. ф.–м. н. Н. Г. Преображенским еще в 1980-е гг. с целью использовать их для диагностики газа и плазмы. В начале 2000-х гг. специалисты института совместно с врачами НМИЦ им. академика Е. Н. Мешалкина (Новосибирск) начали применять математическое моделирование для компьютерной имитации процедуры обследования кардиологических больных методом ОЭКТ. Сейчас эти исследования продолжаются в сотрудничестве с Институтом вычислительной математики и математической геофизики СО РАН, а также Национальным медицинским исследовательским центром кардиологии (Москва), Венским медицинским университетом и отделением ядерной медицины Центральной клинической больницы Вены (Австрия) при поддержке РФФИ и Австрийского научного фонда.
В России подобная работа пока ведется только в ИТПМ СО РАН. Несколько лет тому назад совместно с отделением томографии НМИЦ им. ак. Е. Н. Мешалкина был разработан первый отечественный 3D-математический фантом для исследований в области диагностической ядерной кардиологии. Этот фантом описывает распределение препарата Тс99m-МИБИ в органах грудной клетки среднестатистического пациента мужского пола при исследовании перфузии (кровоснабжения) миокарда методом ОЭКТ. Рассчитанные для него проекционные данные хорошо согласуются с данными реальных клинических обследований. Фантом использовался в различных исследованиях, в том числе по снижению дозы радиофармпрепарата с целью уменьшения лучевой нагрузки на пациента.
Существует два подхода к развитию фантомов: на основе методов компьютерной графики и на основе простых фигур, описываемых уравнениями пространственной геометрии. С самого начала мы хотели построить фантомы, которые можно было бы легко трансформировать, меняя размеры и положение органов, чтобы исследовать влияние анатомического строения пациентов на качество изображений.
У Новосибирска имеется огромный научный потенциал в области диагностической, терапевтической и интервенционной ядерной медицины: перспективные разработки и хорошие заделы по разным направлениям наряду с большим опытом сотрудничества есть и в институтах СО РАН, и в медицинских учреждениях. Достаточно упомянуть лишь о методе бор-нейтронозахватной терапии рака, который успешно развивается в Институте ядерной физики СО РАН совместно с другими научными и медицинскими организациями. Создание в Новосибирске мультидисциплинарного исследовательского центра ядерной медицины даст крепкую основу для развития фундаментальных и прикладных исследований в этой области.
Беляев В. Н., Климанов В. А. Физика ядерной медицины. М.: НИЯУ МИФИ, 2012, Ч. 2, 248 с.
Климанов В. А. Физика ядерной медицины. М.: НИЯУ МИФИ, 2012, Ч. 1, 308 с.
Колядина И. В., Абдуллаев А. Г., Танишина Н. Б. и др. Мультимодальный подход к дифференциальной диагностике метастатического поражения при раке молочной железы: описание клинического случая // Злокачественные опухоли. 2017. Т. 7. № 3. С. 31—36.
Denisova N. V., Terekhov I. N. A study of myocardial perfusion SPECT imaging with reduced radiation dose using maximum likelihood and entropy-based maximum a posteriori approaches // Biomed. Phys. Eng. Express. 2016. V. 2. N. 5. P. 055015 (12).
Denisova N. V., Ansheles A. A. A study of false apical defects in myocardial perfusion imaging with SPECT/CT // Biomed. Phys. Eng. Express. 2018. V. 4. N. 6. P. 065018 (12).
Jones D. S., Podolsky S. H., Greene J. A. et al. The Burden of Disease and the Changing Task of Medicine // N Engl. J. Med. 2012. V. 366. P. 2333—2338.
Читайте также:

