Nk клетки разрушают клетки опухоли путем
Происхождение и вид
Происхождение NK клеток долгое время оставалось тайной, но сегодня о них известно более чем достаточно. Образуются эти натуральные киллеры внутри красного костного мозга, а затем выходят в кровоток и тканевые структуры. Часть ученых даже называет их разновидностью лимфоцитов.
Внешне эти элементы напоминают Т и В-лимфоциты. Главное отличие касается габаритов: NK клетки чуть-чуть крупнее.
Функционал
Как известно, иной тип лимфоцитов – Т-клетки – способны истреблять такие же объекты, что и НК клетки. Возникает вопрос: зачем организму требуются оба типа клеток, которые работают одинаково. А ситуация такова, что натуральные убийцы активизируются лишь тогда, когда иммунитет понимает, что Т-лимфоциты уже не способны устранить угрозу самостоятельно.
Природные убийцы являются гранулированными лимфоцитами: они имеют гранулы, в которых располагаются спродуцированные эндоплазматической сетью ферменты. Одним из таких компонентов является перфорин. Он вырабатывается при контакте природного убийцы с болезнетворной клеткой.
Фермент влияет на клеточную мембрану, уничтожая ее: на мембране появляются дырочки, через которые в клетку попадает вода, а органеллы выводятся в околоклеточную область. Также, через отверстия проникают иные ферменты природных убийц – протеазы.
Эти ферменты разрушают клеточное ядро и другое содержимое. Через определенный временной промежуток клеточный компонент теряет изначальный функционал и погибает.
Пониженная или повышенная концентрация
Понижение либо возрастание концентрации природных клеток вполне вероятна. Завышенная концентрация характерна для ситуаций, при которых иммунной системе есть от чего оберегать организм.
Численность клеток может возрасти из-за воспалений, вирусного поражения, онкологии и прочих ситуаций, при которых требуется серьезная работа цитотоксического иммунитета. Гораздо реже концентрация киллеров понижена. Довольно часто это обусловлено иммунодефицитом (включая врожденный).
Если говорить о врожденных предпосылках патологического повышения или понижения данных клеток, то здесь стоит сказать о таком дефекте, как гемофагоцитарный лимфогистиоцитоз. При наличии такого отклонения резко возрастает активность иммунной системы, включая и природных убийц.
Из-за такой активности проявляется негативная реакция органов, что ведет к летальному исходу (буквально за пару месяцев). Как видно, смена концентрации натуральных киллеров – это серьезный вопрос. Поэтому надо всегда следить, чтобы природная сопротивляемость работала должным образом.
Рассмотреть пагубность дефицита натуральных убийц можно на примере синдрома Чедиак-Хигаси. Из-за дисфункции NK-компонентов и нейтрофилов пациенты обретают склонность к инфекционным поражениям, раку крови.
Весь функционал природных киллеров можно поделить на 2 типа: выработка цитокинов, управляющих работой иных иммунных клеток и истребление пораженных элементов.
Для подбора эффективного метода лечения вы можете обратиться за
- методы инновационной терапии;
- возможности участия в экспериментальной терапии;
- как получить квоту на бесплатное лечение в онкоцентр;
- организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
NK-клетки (МНС‑нерестригированные киллеры, естественные киллеры) составляют до 15% всех лимфоцитов крови. Они не имеют поверхностных детерминант, характерных для T- и B-лимфоцитов, а также не имеют рецептора Т-лимфоцитов. В типичных NK-клетках экспрессируются дифференцировочные Аг CD2, СD7, CD56 и CD16 (рецептор Fc‑фрагмента IgG). В плазматической мембране активированных NK-клеток появляется гликопротеин CD69. NK-клетки распознают и уничтожают опухолевые и вирус-инфицированные клетки. Механизм распознавания неясен. Существует представление о наличии поверхностноклеточных молекул, защищающих клетки организма от цитотоксического действия NK-клеток. Примером служит продукт гена HLA‑C. Распознавание рецептором NK-клетки этой молекулы тормозит цитотоксическую активность NK-клеток и таким образом защищает клетку, экспрессирующую HLA‑C. Модификация продукта гена HLA‑C вирусами или связанными с опухолью молекулами приводит к уничтожению ее NK-клеткой. NK-клетки, располагая рецептором IgG (CD16), способны также взаимодействовать с клетками, окружёнными молекулами IgG, и уничтожать их (феномен АТ‑зависимой цитотоксичности). Активированные NK-клетки выделяют γ-ИФН, ИЛ1, GM‑CSF. При активации (например, под влиянием ИЛ2) NK-клетки приобретают способность к пролиферации. Функция NK-клеток нарушена при синдроме Шедьяка–Хигаси. Дефект NK-клеток — одна из ведущих причин хронических инфекций.
Цитолиз.
В отличие от цитотоксических T‑лимфоцитов, способность NK-клеток к цитолизу не связана с необходимостью распознавания молекул MHC на поверхности мишени. NK-клетки уничтожают клетку–мишень не путём фагоцитоза, а (после установления с ней прямого контакта) при помощи перфорина.
Гуморальная регуляция. Активность NK-клеток регулируется цитокинами. γ-ИФН и ИЛ2 усиливают цитолитическую активность NK-клеток.
NK-клетки, наряду с макрофагами, нейтрофилами и эозинофилами, участвуют также и в АТ-зависимом клеточно-опосредованном цитолизе. Для этого NK-клетки экспрессируют на своей поверхности рецептор Fc‑фрагмента IgG (CD16). Fc‑фрагмент этих АТ взаимодействует с рецептором Fc‑фрагмента, встроенным в плазматическую мембрану NK-клетки.
Антигенпредставляющие клетки (АПК илиА-субсистема) (рис. 17-3) присутствуют преимущественно в коже, лимфатических узлах, селезёнке и тимусе.
К АПК относят макрофаги, дендритные клетки, фолликулярные отростчатые клетки лимфоузлов и селезёнки, клетки Лангерханса, М‑клетки в лимфатических фолликулах пищеварительного тракта, эпителиальные клетки вилочковой железы. Эти клетки захватывают, перерабатывают и представляют Аг (эпитоп) на своей поверхности другим иммунокомпетентным клеткам, вырабатывают ИЛ1 и другие цитокины, секретируют простагландин E2 (PGE2), угнетающий иммунный ответ. Фагоцитарную и цитолитическую активность макрофагов усиливает γ-ИФН.
Дендритные клетки (ДК) образуются в костном мозге и формируют популяцию долгоживущих клеток, которые запускают и модулируют иммунный ответ. В костном мозге их предшественники образуют субпопуляцию CD34 + -клеток, которые способны дифференцироваться в клетки Лангерханса для эпителия и дендритные клетки для внутренней среды. Незрелые и неделящиеся предшественники ДК заселяют многие ткани и органы. Дифференцировку ДК поддерживают колониестимулирующий фактор гранулоцитов и макрофагов GM‑CSF и ИЛ3. ДК имеют звёздчатую форму и в состоянии покоя несут на поверхности относительно небольшое количество молекул МНС. В отличие от клеток Лангерханса, интерстициальные ДК способны стимулировать синтез Ig В‑лимфоцитами. Все ДК могут вначале поступать в тимус-зависимую зону периферических лимфоидных органов, где созревают в так называемые интердигитирующие клетки.
В наших предыдущих исследованиях было показано, что первичное воздействие инфильтрации иммунных клеток на нормальный или прединвазивный тканевой компонент связано с физическим разрушением эпителиальных капсул, что может способствовать прогрессированию опухоли и инвазии. В нашем текущем исследовании была предпринята попытка подтвердить наши предыдущие наблюдения и определить первичный тип (ы) инфильтрирующих иммунных клеток и возможный механизм, связанный с физическими разрушениями эпителиальных капсул.
Всего было проведено исследование 250 первичных опухолей молочной железы и предстательной железы, первичная иммунная клетка цитотоксических Т-лимфоцитов (CTL), естественных киллерных клеток (NK) и тучных клеток была проанализирована с помощью иммуногистохимии, флуоресцентной маркировки и анализа апоптоза. qRT-PCR использовали для анализа экспрессии генов. Наше настоящее исследование оценило физическое нарушение этих иммунных клеток и потенциальное воздействие на эпителиальную капсулу опухолей молочной железы человека и простаты.
Наше исследование дает несколько клинически значимых результатов, которые ранее не изучались. (1) Подавляющее большинство этих инфильтрирующих иммунных клеток распределены в нормальных или предварительно инвазивных тканевых компонентах, а не в инвазивных раковых тканях. (2) Эти клетки часто образуют кольца или полулунные структуры, которые либо окружают фокально разрушенные базальные клеточные слои, либо физически присоединяются к базальным клеткам. (3) Базальные клетки, физически связанные с этими иммунными клетками, обычно проявляли различные признаки дегенерации, включая, по существу, повышенный апоптоз, некроз и уменьшенную экспрессию р63 супрессора опухоли. В противоположность этому, просветные клетки, перекрывающие фокально разрушенные слои базальных клеток, имели существенно повышенную скорость пролиферации и повышенную экспрессию маркеров стволовых клеток по сравнению с их смежными морфологически сходными аналогами, которые перекрывают неразрушаемую капсулу.
Наши данные свидетельствуют о том, что на ранней стадии инвазии опухолей CTL, NK и тучные клетки являются основными типами инфильтрирующих опухоли иммунных клеток, участвующих в фокальных дегенеративных продуктах в опухолевых капсулах. Первичное воздействие этих проникающих иммунных клеток заключается в том, что они связаны с очаговыми нарушениями капсулы опухоли, которые избирательно способствуют пролиферации и инвазии опухолевых стволовых клеток.
Воздействие и клиническое значение опухолепроникающих иммунных клеток остаются актуальной темой после десятилетия дебатов. Большое количество публикаций сообщили, что прямой физический контакт между инфильтрированными иммунными клетками и опухолевыми клетками связан с физическим разрушением связанных опухолевых клеток, уменьшением размера опухоли и значительно улучшенными клиническими прогнозами 2. Однако все большее число публикаций показывает, что увеличение проникновения иммунных клеток может способствовать прогрессированию опухоли и инвазии. Предыдущие сообщения о том, что стадии и гистопатологически подобранные прединвазивные опухоли предстательной железы и пищевода с повышенной инфильтрацией иммунных клеток имеют значительно более высокую частоту последующего прогрессирования инвазивных поражений по сравнению с их аналогами без инфильтрации иммунных клеток 7. Сообщалось также, что: а) макрофаги могут усилить миграцию раковых клеток путем секреции хемотаксических и хемокинетических факторов, которые способствуют фибриллогенезу и ангиогенезу, позволяя опухолевым клеткам отслеживать вдоль коллагеновых волокон и кровеносных сосудов [10,11], (b) глотание макрофагов опухолевые клетки индуцируют смесь генетических материалов и создают гибридный фенотип, который может метастазировать в отдаленные места с образованием новых колоний [12], (в) Т-лимфоциты способствуют инвазии и метастазированию путем регулирования связанных с опухолью макрофагов [13]; (d) инфильтрация иммунных клеток может экспортировать факторы роста и другие молекулы, связанные с пролиферацией, в ассоциированные опухолевые клетки посредством прямого физического контакта и способствовать эпителиально-мезенхимному переходу (ЕМТ) и подвижности клеток [14,15].
Противоречивые наблюдения за воздействием опухолепроникающих иммунных клеток вызвали недоумение в оценке клинических последствий аберрантной инфильтрации иммунных клеток в опухолевых тканях. Кроме того, поскольку иммуностимуляторный лизис или цитотоксические анализы почти исключительно проводятся на клеточных культурах или моделях животных, эти анализы in vitro не могут полностью имитировать внутренние события в канцерогенезе человека 18. Было хорошо документировано, что системы иммунного надзора значительно различаются у людей и животных [19,20].
Мы предположили, что эти противоречивые сообщения и утверждения могут возникать в результате различных стадий опухоли, при которых проникновение иммунных клеток может быть связано с дифференциальными последствиями в зависимости от типа клетки. Чтобы подтвердить наши предположения, наши предыдущие исследования сравнили характер и частоту физической ассоциации опухолепроникающих иммунных клеток с базальными и просветными клетками опухолей молочной железы и предстательной железы, которые содержат как доинвазивные, так и инвазивные компоненты. Наши исследования показали, что: (1) более 90% инфильтрирующих иммунных клеток были распределены в нормальном или прединвазивном тканевом компоненте, тогда как менее 10% были в компоненте инвазивной ткани, (2) в нормальной или прединвазивной ткани компонент, более 90% эпителиальных структур с фокально поврежденной эпителиальной капсулой были связаны с проникновением иммунных клеток, по сравнению с примерно 30% в эпителиальных структурах с неразрушенной капсулой; (3) подавляющее большинство проникающих иммунных клеток были расположены на или рядом с местом очаговых разрушенных эпителиальных капсул, и (4) эпителиальные клетки, расположенные над фокально разрушенными капсулами, часто демонстрируют существенно повышенную скорость пролиферации и часто образуют пальцевидные или язычковые проекции, вторгающиеся в соседнюю строму 24. Основываясь на этих и других выводах, мы предположили, что первичным воздействием проникновения иммунных клеток на нормальный или прединвазивный тканевой компонент является физическое разрушение эпителиальных капсул, что может способствовать прогрессированию опухоли и инвазии [26, 27].
В нашем текущем исследовании была предпринята попытка дополнительно проверить наши предыдущие наблюдения и определить первичный тип (ы) инфильтрирующих иммунных клеток и возможный механизм (механизмы), связанные с физическими разрушениями эпителиальных капсул. Поскольку было хорошо документировано, что: (1) CTL, естественный киллер (NK) и тучные клетки являются первичными типами иммунных клеток для обнаружения и устранения дегенерированных и измененных клеток-хозяев и (2) эти три типа клеток содержат аналогичные цитотоксические гранулы и делят тот же механизм экзоцитоза их гранул 29, мы предположили, что они могут предпочтительно локализоваться на вырожденных слоях базальных клеток и координировать функцию в физическом разрушении вырожденных эпителиальных капсул.
Запечатанная формалином ткань с молочной железой, содержащая парафин, (N = 150) была получена из файлов Департамента патологии и Отделения онкологии, Аффилированной больницы по вопросам материнства и детства в Нанкине, Медицинского университета Нанкина. Блоки опухолевых клеток предстательной железы человека (N = 100) были получены в Отделе патологии, связанной с больными в провинции Цзянсу, медицинском университете Нанкинга с одобрением IRB из Нанкинского медицинского университета.
Серийные 5-7 мкм срезы были сделаны из блоков опухоли опухоли груди и простаты. Первый и последний разделы из каждого блока были окрашены гематоксилином и эозином (H & E) для морфологической классификации с использованием опубликованных критериев. Двойная иммуногистохимия применялась для оценки потенциального воздействия проникающих иммунных клеток на другие типы и структуры клеток с использованием ранее опубликованного протокола [32]. Вторичное антитело, набор для обнаружения ABC и набор хромогена диаминобензидина были получены в Vector Laboratories (Burlingame, CA, USA). Набор красных хромогенов AP был приобретен в лаборатории Zymad Laboratories (Южный Сан-Франциско, Калифорния, США). В каждом отдельном анализе были включены слайды с отрицательным контролем (только IgG).
Аннотация
NK-клетки характеризуются как не В-клетки и не Т-клетки, лишённые характеристик зрелых макрофагов, которые развиваются из клеток костного мозга независимо от влияния тимуса. NK-клетки играют решающую роль в гибели опухоли, иммунологическом надзоре, сопротивляемости инфекциям и иммунном регулировании процессов организма. Разрушение нормальными киллерами раковых клеток включает в себя определенную последовательность событий. Во-первых, клетка NK распознает раковую клетку и привязывается к ней. Этот процесс требует межрецепторного взаимодействия. NK-клетка выделяет гранулы, которые проникают в раковую клетку и в конечном итоге убивают ее. После чего NK-клетка освобождается для привязки к другой раковой клетке и процесс повторяется.
Однако раковые клетки знают, как вести своего рода клеточную войну. Мы впервые в нашей лаборатории открыли, что раковые клетки могут уничтожать лейкоциты посредством фагоцитоза. Мы наблюдали три способа, которыми это делается. Раковая клетка может окружить с двух сторон лейкоциты или может создать чашеобразное отверстие, внутрь которого затягиваются лейкоциты. Третий способ заключается в том, что раковая клетка вытягивает длинное плечо, чтобы захватить лейкоцит и, в конце концов, затянуть его внутрь раковой клетки, где он переварится. Кроме того, другие работы показали, что раковые клетки выделяют иммуносупресивные вещества, которые ослабляют функцию иммунной системы.
За последние 25 лет были сделаны многочисленные попытки укрепления иммунной системы с помощью различных модификаторов биологической реакции (МБР). Эти вещества, создаются из бактерий и грибков, которые обладают иммунорегуляторными свойствами. Кроме того, некоторые виды цитокинов работают подобно МБР, например, интерфероны, интерлейкин-2 и интерлейкин-12. Есть две проблемы, связанные с этими МБР: 1) токсичность, 2) развитие низкой реактивности, при которой однократное введение МБР может значительно повысить активность клеток NK, но повторное введение того же МБР приведет к депрессии активности NK-клеток. Интересно отметить, что BioBran имеет преимущества перед другими МБР. Он нетоксичен и не показал низкой реактивности за четыре года наблюдений. Настоящая работа была проведена с целью изучения влияния нового МБР, известного под названием BioBran, на функцию NK-клетки и пролиферацию Т-и В-клеток у 32 пациентов. У отдельных пациентов были зарегистрированы опухолевые антигены.
Пациенты
Настоящее исследование проводилось на 32 пациентах страдающих от раковых заболеваний. У пациентов были различные типы опухоли: простаты, молочной железы, множественная миелома и лейкемия. Большинство пациентов прошли через циторедукцию при помощи традиционных видов терапии, таких как хирургическое вмешательство, лучевая терапия или химиотерапия.
Материалы
BioBran – это арабиноксилан, полученный из экстракта рисовых отрубей, обработанный под воздействием ферментов из грибов шиитаке. Это полисахарид, который содержит гемицеллюлозу. Торговое название BioBraп – BioBran MGN-3 (компания Daiwa Pharmaceuticals, Co., Ltd., Токио, Япония).
Методы
Протокол лечения. Пациентами давали BioBran (3 г в день) ежедневно перорально.
Опухолевый специфический антиген (ОСА). ОСА для каждого типа опухоли измерялся до начала лечения препаратом BioBran и через месяц после лечения.
Линия опухолевых клеток. К562, клетки эритролейкемической линии человека, использовались в качестве целевой. Опухолевые клетки культивировались в полной среде, состоящей из RPMI-1640 с добавлением 10% эмбриональной телячьей сыворотки и 1% антибиотика (100 единиц пенициллина и 100 г\мл стрептомицина).
Препарат лимфоцитов периферической крови (ЛПК). ЛПК были приготовлены из свежей гепаринизированной венозной крови путем центрифугирования в градиенте плотности Ficoll-Hypaque. Клетки были два раза промыты сбалансированным солевым раствором Хенкса и ресуспендированы до концентрации 10 х 106 кл\мл в общей среде.
51CR – анализ для измерения активности NK-клеток. Активность нормальных киллеров измерялась стандартным 4-х часовым 51CR- анализом. Вкратце, 1х104 опухолевые целевые клетки, меченные Cr в 0.1 мл обшей среды добавлялись в различные лунки 96-луночного титрационного планшета. Затем клетки-эффекторы пипеткой переносились в ячейки в 4 копиях, чтобы получить соотношение клеток-эффекторов к целевым клеткам (E:T) 12:1, 25:1, 50:1 и 100:1. После 4 часового инкубационного периода при температуре37 °C, планшеты были центрифугированы (1 400 об\мин в течение 5 минут) и было собрано 0.1 мл центрифугата из каждой лунки и пересчитано по гамма-счетчику (Beckmann G50, Beckmann Instruments).
Процент освобождённых изотопов рассчитывался по следующей формуле:
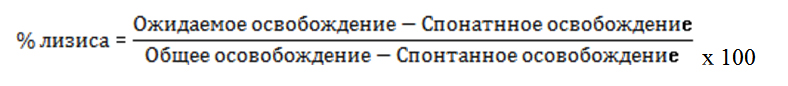
Спонтанное освобождение из целевых клеток составило не боле 8-10% от общего освобождения. Общее освобождение измерялось прибавлением 0.1мл Тритона Х-100 (Sigma Chemical Co.) в назначенные лунки. Единицы лизиса рассчитывались из кривых титрования эффектора с одной определённой единицей лизиса, так как требовалось, чтобы количество клеток-эффекторов достигло 20% лизиса для К562.
Гранулярность естественных киллеров. Выделение лимфоцитов периферической крови в градиенте перколла было настроено на 2.5=10.6\мл и центрифугировано на слайдах при 1 000 об\мин в течение 5 минут при помощи цитоцентрифуги (Shanton Southern Institute, Сеуикли, Пенсильвания). Слайды были высушены в воздушной сушке, фиксированы метанолом, окрашены 5% раствором Гимзе в течение 10 минут. Окрашенные препараты были изучены на предмет гранулярности NK-клеток.
В естественных условиях пролиферация T-лимфоцитов и В-лимфоцитов. Мы исследовали влияние в естественных условиях BioBran на пролиферацию Т-клеток и В-клеток при помощи [3H]тимидина. Мононуклеарные клетки были подготовлены из периферической крови пяти раковых пациентов до лечения BioBran и через месяц после лечения. Клетки были инкубированы при 2х105 кл\мл в общей среде. Клетки были обработаны фитогемагглютинином (10г\мл), конканавалином А или митогеном лаконоса в течение 3 дней. На последние 18 часов к культурам клетки был добавлен меченый тритием тимидин. Были собраны образцы ДНК и определено накопления тимидина при помощи сцинтиллоскопа. Все эксперименты проводились в трех повторениях, данные выражены, как число импульсов в минуту.
Статистический анализ. Т-критерий Стьюдента применялся для изучения значимости отклонений между активностью NK-клеток и реакцией Т- и В-клеток на митогены до и после лечения препаратом BioBran.
Результаты
1. Активность NK-клеток
Рисунок 1 показывает базовые значения цитотоксичных ответов NK-клеток у 32 пациентов, больных раком. У пациентов отмечался общий низкий уровень функции NK-клеток. Депрессия активности NK-клеток наблюдалась у пациентов с разными типами опухолей: простаты, 11.1 единиц лизиса; молочной железы 11.4 единиц лизиса; множественная миелома, 7.3 единиц лизиса; лейкемия 4.3 единиц лизиса. Исследования лимфоцитов периферической крови у 12 участников спустя 1-2 недели после первичного исследования, не выявили статистически значимых различий в активности NK-клеток по сравнению с первоначальными результатами. Лечение MGN-3 показало значительное повышение активности NK-клеток до десяти раз. Усиливающий эффект MGN-3 был выявлен при всех типах опухолей: простаты 41.9 единиц лизиса; молочная железа 33 единиц лизиса; множественная миелома 31.9 единиц лизиса; лейкемия 51.4 единиц лизиса.
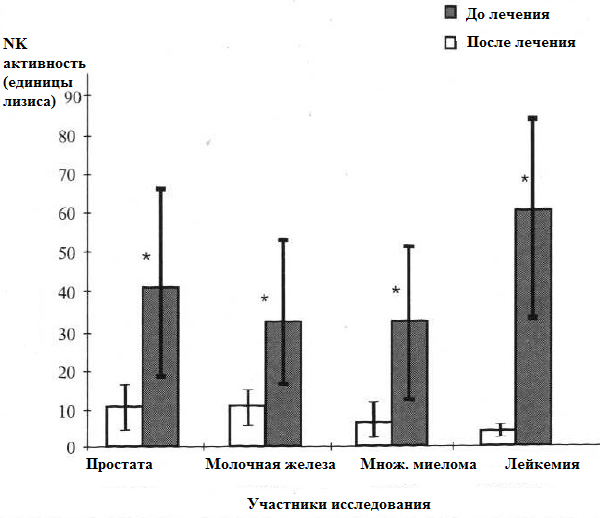
Рисунок 1. Влияние BioBran на активность NK-клеток у 32 пациентов от одной до двух недель после лечения. Типы опухолей: простата (10), молочная железа (12), множественная миелома (5), лейкемия (5). Единицы лизиса при 20% *р
50 таблеток
Арабиноксилана
в одной таблетке 250мг (0,25г)
Исследователи из США изучили взаимодействие клеток рака молочной железы и иммунных NK-клеток и обнаружили, что опухоль способна перепрограммировать NK-клетки, заставляя их помогать опухоли. Ученые описали молекулярный механизм этого процесса и предложили способы блокировать его. Это может послужить основой для новых методов борьбы с метастазами.
Органоид опухоли (показан синим) окружен NK-клетками (красные).
Чтобы выяснить, каким образом клетки рака молочной железы (РМЖ) избегают атаки NK-клеток, ученые из США провели эксперименты на ex vivo культурах и in vitro моделях метастазирования. Они использовали клетки мышиной опухоли молочной железы, экспрессирующие кератин 14 (К14) с флуоресцентной меткой, так как известно, что K14 + -клетки РМЖ особенно инвазивны. В то же время, уровень экспрессии K14 имеет отрицательную корреляцию с уровнем экспрессии молекул MHC-1, что делает эти клетки уязвимыми для NK-клеток.
Активность образования метастазов проверяли в in vitro моделях по формированию колоний в питательной среде. Культивирование в присутствии NK-клеток, выделенных от мышей ликого типа, на 70% снижало эффективность образования колоний, при этом наблюдалась апоптотическая гибель клеток опухоли. Однако после 36–48 часов совместной инкубации атака NK-клетками опухолевой культуры прекращалась. Ученые предположили, что клетки РМЖ перепрограммируют NK-клетки, делая их неопасными.
Чтобы проверить эту гипотезу, они выделили NK-клетки у мышей с РМЖ (авторы называют их tumor exposed NK, teNK) и посмотрели, будут ли teNK подавлять формирование колоний клетками опухоли. Оказалось, что teNK не ограничивали инвазию опухоли, а наоборот, способствовали формированию колоний. Такой же эффект наблюдали при использовании мышиных NK, выделенных из опухолевого инфильтрата. Наконец, эффект был подтвержден в опытах с человеческими NK-клетками и клеточной линией РМЖ MCF-7.
Чтобы определить молекулярный механизм этого феномена, ученые провели РНК-секевенирование NK-клеток мышей дикого типа и teNK. Сигнатура генной экспрессии в teNK была схожа с таковой у покоящихся NK. В частности, в teNK возрастал уровень экспрессии рецептора KLRG1 — ингибитора функций NK и рецептора TIGIT. Блокировка этих рецепторов с помощью антител нейтрализовало действие teNK в совместной культуре с клетками РМЖ и уменьшало интенсивность формирования колоний опухолевыми клетками.
Кроме того, в teNK возрастала экспрессия нескольких ДНК-метилтрансфераз. Обработка teNK ингибиторами ДНК-метилтрансфераз перед добавлением их к культуре РМЖ предотвращало стимулирующее воздействие teNK на опухоль и приводило к снижению уровней KLRG1 и TIGIT.
Isaac S. Chan, et al. // Cancer cells educate natural killer cells to a metastasis-promoting cell state. // Journal of Cell Biology (2020) 219 (9): e202001134; DOI: 10.1083/jcb.202001134

NK-клетки (натуральные, или естественные, нулевые или киллеры, NK-лимфоциты - от англ. Natural Killer cells) составляют основную часть нулевых лимфоцитов. На них приходится 5-10% (по некоторым источникам - до 15 процентов) лимфоцитов в периферической крови и 1-2% лимфоцитов в селезенке. В лимфатических узлах они единичны.
Морфологически это большие лимфоциты с бобовидным смещенным ядром и азурофильными гранулами, которые по виду и составу близки гранулам Т-киллеров. Нулевые лимфоциы также называют большие гранулярные лимфоциты.
Клетками-мишенями для NK - лимфоцитов являются опухолевые клетки, клетки, зараженные вирусами, бактериями или простейшими, а также стареющие и поврежденные клетки.
Механизм уничтожения сходный с Т-киллерами, но более активный, поскольку не требует распознавания молекул МНС. NK-клетки не обладают антигенной специфичностью и не приобретают иммунологическую память.
Нулевые лимфоциты обеспечивают неспецифический противоинфекционный иммунитет, а также являются главным звеном противоопухолевой защиты.
Повышение активности 0 (нулевых) лимфоцитов – перспективное направление онкологии.
Лимфоциты можно смело назвать главным звеном в защитной цепочке нашего организма и нашей иммунной системы. Они зорко следят за то чтобы, в организм не проникали чужеродные клетки, это своего рода клеточная цензура нашего тела.
- Основная обязанность нулевых лимфицитов (NK-клеток), киллерных клеток - выявлять и уничтожать собственные клетки организма, в которых что-то нарушилось: они убивают опухолевые клетки и клетки, зараженные вирусами (а также, возможно, и другими чужеродными агентами).
Нормальные киллеры (НК-клетки) у человека составляют примерно 5% лимфоцитов периферической крови.
Функция нулевых лимфоцитов (NK-клеток) являются:
- защита то раковых клеток
- Реагирование на внедрившуюся инфекцию
- Участие в регуляции гемопоэза
Норма лимфоциты, в 1 мкл (5) 19-37 (1,200-3,000)
0- нулевые лимфоциты - это не "просвещенные" лимфоциты. Можно сказать что нулевые (0)- это молоды лимфоциты, не сформерованые, так сказать "пластилин для лепки".
Интерферон: активация NK клеток
Натуральные киллеры являются важным фактором неспецифической защиты от вирусной инфекции . Они участвуют в так называемой естественной или спонтанной цитотоксичности в отношении клеток-мишеней. НК-лимфоциты не имеют маркеров Т- и В-клеток.
Свое цитотоксическое действие на клетки-мишени они оказывают без участия антител. В отличие от НК другая популяция лимфоцитов, так называемые К-лимфоциты , отвечают за зависимую от антител цитотоксичность и обеспечивают лизис инфицированных вирусом клеток, на поверхности которых экспонированы вирусные антигены, связанные с антителами, специфичными к данным антигенам. НК- и К- лимфоциты обладают более высокоавидными Fc-рецепторами по сравнению с Fc-рецепторами Т- и В-клеток, и относятся к популяции нуль-лимфоцитов.
Активность НК- и К-лимфоцитов может в значительной степени контролироваться (увеличиваться) интерфероном ( Lang et al., 1982 ; Biron, Welsh, 1982 ). Показано, что любой интерферон (альфа, бета и гамма) вызывает активацию НК как in vitro, так и in vivo ( Biron, Welsh, 1982 ).
При этом имеется выраженная корреляция между уровнем интерферона и активностью НК.
Важным моментом регуляции активности интерферона при вирусной инфекции является то, что in vivo активация НК интерфероном происходит вблизи инфицированных вирусом клеток, т.е. интерферон действует локально, так как его продуцируют либо инфицированные вирусом клетки-мишени, либо цитотоксические Т-лимфоциты при их контакте с такими клетками.
При этом НК сами могут быть важными продуцентами интерферона в течение вирусной инфекции. В частности, показано, что при взаимодействии НК с вирусами гриппа или герпеса параллельно с продукцией IFN-б наблюдалось повышение активности НК, предполагая существование позитивной саморегуляции их функции интерфероном.
Увеличение активности натуральных киллеров при действии интерферона может осуществляться двумя путями. Интерферон может либо увеличивать активность существующих НК, либо стимулировать генерацию новой популяции НК путем активации дифференцировки предшественников НК в эффекторные клетки.
Существующие данные позволяют предположить, что в действительности оба механизма могут иметь место (см., например, Bloom, 1980 ; Berman, Franfort, 1982 ). Известно, что цитотоксичность, индуцируемая НК, не является антиген-специфичной и не ограничена по антигенам МНС.
Поэтому повышение активности НК при действии интерферона не связано с повышением экспрессии на их поверхности антигенов гистосовместимости, как это имеет место при стимуляции макрофагов или цитотоксических Т-лимфоцитов.
По всей вероятности молекулярные механизмы регуляции цитотоксической активности Нк и К-лимфоцитов, опосредованные интерфероном, связаны с повышением экспрессии рецепторов к Fc фрагменту иммуноглобулинов G (в случае К-лимфоцитов) и рецепторов к IL2 (в случае НК-клеток).
Во всяком случае для НК мыши и человека показано, что IFN- альфа/бета вызывал увеличение на их поверхности рецепторов к IL2. Эти данные показывают, что кроме интерферона в регуляции активности НК (и, возможно, К-лимфоцитов) могут принимать участие другие лимфокины, например, IL2. При этом процессы активации цитотоксичности могут быть связаны также с изменением внутриклеточного метаболизма этих макрофагов.
Таким образом, в течение вирусной инфекции активность НК и К-лимфоцитов может регулироваться индуцированным вирусом интерфероном.
При этом секретируемый интерферон действует локально, вызывая активацию цитотоксических клеток, которые обеспечивают лизис инфицированных вирусом клеток, ограничивая распространение вируса в организме. НК активируются в ранний период инфекции после того, как начинает синтезироваться интерферон, а активированные К-лимфоциты вызывают избирательный лизис вирус-инфицированных клеток в поздний период после того, как появляются специфичные к вирусу антитела.
NK - лимфоциты, норма и расшифровка
Нормальные показатели NK - лимфоцитов - от 3 до 8%
Клетки, одновременно несущие CD3 и CD16/CD56, рассматриваются как разновидность Т-лимфоцитов с активностью неспецифических киллеров (NKT-клетки).
На их поверхности представлена мембранная молекула CD56 – изоформа адгезивной молекулы из семейства молекул адгезии клеток нервной системы (NCAM - neural cell adhesion molecule) из суперсемейства иммуноглобулинов.
Они способны лизировать определенные клетки-мишени без предварительного контакта и развития реакции типа иммунного ответа.
7-14лет: 13,21±2,71%; 0,34±0,03*109/л
Интервал колебаний: 5-25%
Число клеток в 1 мкл: 380±33
Интервал колебаний: 100±650
Повышение показателя:
- Фаза восстановления после вирусных инфекций (гепатит B, C)
- Ряд аутоиммунных заболеваний
- Онкологические заболевания
- Беременность
- Алкогольный цирроз печени
Снижение показателя:
- Первичных иммунодефицитах: агаммаглобулинемия без В-лимфоцитов (сцепленная с полом), гипер-IgM-синдром.
- Облучении.
- Лечении кортикостероидами.
- Лечении цитостатиками.
- СПИДе.
- Паразитарных заболеваниях.
- Системных заболеваниях.
- Стрессе.
- Дефиците цинка.
Читайте также:

