Наследственная предрасположенность к раку яичников
Наследственный рак яичников – злокачественная эпителиальная опухоль яичников, генетическая предрасположенность к которой передаётся потомкам. Овариальная карцинома сопровождается неспецифическими признаками – снижением аппетита, слабостью, желудочно-кишечным дискомфортом, неопределёнными болевыми ощущениями в животе и пояснице, на поздних стадиях - асцитом. Диагноз устанавливается по данным гинекологического осмотра, лучевых методов, лабораторных анализов крови и биоптатов. Лечение комбинированное или комплексное, основными методами являются оперативное вмешательство и полихимиотерапия, дополнительно может применяться лучевая терапия.
МКБ-10
- Причины наследственного рака яичников
- Патогенез
- Классификация
- Симптомы наследственного рака яичников
- Осложнения
- Диагностика
- Лечение наследственного рака яичников
- Прогноз и профилактика
- Цены на лечение
Общие сведения
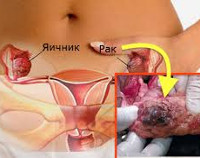
Наследственный (семейный) рак яичников – карцинома женских гонад, ассоциированная с генеративными (герминальными) генными мутациями. Частота таких мутаций среди европейцев составляет в среднем 0,2–0,5% и резко (в 4-10 раз) повышена у евреев ашкенази. На наследственно обусловленные формы приходится 10-19% всех злокачественных эпителиальных новообразований яичников. Средний возраст больных ‒ 48 лет (против 56 лет при спорадическом раке), нередко наследственный рак манифестирует и у более молодых женщин. Риск развития раковой опухоли у женщин-носителей мутации составляет 11-40%, а при отягощённом семейном анамнезе возрастает в 1,1-1,5 раза. Опухолевый процесс в яичниках часто сочетается с карциномами других органов – как репродуктивной системы, так и экстрагенитальными.

Причины наследственного рака яичников
Причиной семейного рака женских гонад является генеративная мутация - повреждение определённых генов в хромосомах половых клеток, передающееся последующим поколениям. К генным нарушениям может приводить воздействие ионизирующего излучения, пестицидов и сельскохозяйственных удобрений, растворителей, алкалоидов, ряда лекарственных препаратов, инфекционных агентов.
Впервые возникшая герминальная мутация проявляется лишь в следующей генерации, то есть повышенному риску рака будут подвержены сибсы (родные сёстры и братья) этого поколения и их дети, но не пробанды (родители, у которых возникла генетическая мутация). В настоящее время известны следующие наследственные состояния, одним из проявлений которых является овариальная карцинома:
- Синдром рака молочной железы и яичника. Обусловлен мутацией в генах BRCA1 и BRCA2 и является основной причиной наследственного овариального рака (доля BRCA-ассоциированных карцином составляет 90-95% всех семейных злокачественных опухолей яичника). Риск развития рака яичника при герминальной мутации BRCA1 достигает 44%, а BRCA2 – 27%. К другим клиническим проявлениям синдрома относятся злокачественные опухоли органов пищеварительной системы, меланома. Одной из разновидностей синдрома является семейный органоспецифичный рак яичника, протекающий изолированно, не сочетаясь с первично-множественными неоплазмами других органов.
- Синдром Линча второго типа (наследственный неполипозный колоректальный рак). Ассоциирован в основном с мутациями в генах MLH1, MSH2. Клинические проявления включают опухоли желудочно-кишечного тракта, женской репродуктивной системы и ряд других.
В группе риска развития наследственного рака яичника находятся женщины, среди близких кровных родственниц которых регистрировались карциномы молочных желёз, яичников, тела матки, толстой кишки и поджелудочной железы, меланома, а по мужской линии – указанные экстрагенитальные опухоли, рак простаты и первичный рак брюшины. Особая роль в плане риска отводится карциноме груди у кровных родственников мужского пола, ранним (до 40-50 лет) эпизодам рака и их первично-множественной (синхронной или метахронной) форме – поражению нескольких разных или парных органов.
Риск развития неоплазии у носителей мутации накапливается с возрастом и имеет прямую зависимость от распространённости наследственных синдромов среди родственников. Значимые для большинства типов спорадического овариального рака факторы риска (нарушения функции яичников, нереализованный репродуктивный потенциал, медикаментозная стимуляция овуляции, гиперэстрогения) практически не влияют на развитие наследственных карцином, поскольку в клетках 80-90% этих опухолей отсутствуют рецепторы эстрогена, прогестерона и эпидермального фактора роста.
Патогенез
Патогенез наследственного рака яичников до конца не изучен, однако результаты последних исследований позволяют полагать, что источником опухоли является не эпителий капсулы яичника, как считалось ранее, а эпителиальная выстилка маточных труб и брюшины (чем можно объяснить морфологическое и клиническое сходство рака яичника с первичной перитонеальной карциномой). Основной и самый ранний путь метастазирования овариального рака – имплантационный, с поражением брюшины, большого сальника, органов малого таза и капсул печени, селезёнки. Другим характерным путём распространения метастазов является лимфогенный – сначала поражаются забрюшинные лимфатические узлы, затем периферические. Гематогенное метастазирование встречается крайне редко, при этом поражается лёгкое, печень, головной мозг.
Классификация
Наиболее полно оценить анатомическую распространённость опухоли с целью правильной постановки диагноза, определения прогноза и выработки рационального лечения позволяет классификация TNM. Наряду с TNM, в онкологии и гинекологии активно используется классификация неоплазий, разработанная Международной федерацией гинекологов и акушеров (FIGO), которая отражает последовательное развитие опухолевого процесса по стадиям. Ниже представлена классификация FIGO пересмотра 2014 года (в скобках указаны соответствующие значения TNM):
- Стадия I (T1N0M0). Опухолевый процесс ограничен яичниками. Выделяют 5 подстадий в зависимости от одно- или двусторонней локализации процесса, наличия раковых клеток в смывах с брюшины, повреждения капсулы яичника в пред- или интраоперационный период.
- Стадия II (T2N0M0). Опухоль распространяется на органы малого таза. Включает две подстадии – поражение только половых органов и вовлечение в процесс других структур.
- Стадия III (T3N0M0 илиT1-3N1M0). Опухоль поражает брюшину за пределами малого таза или (и) регионарные лимфоузлы (необходимо морфологическое подтверждение). В зависимости от размеров метастазов и их локализации внутри стадии выделяют 5 подстадий.
- Стадия IV (T1-3N0-1M1). Имеются метастазы в отдалённых органах (исключая внутрибрюшинные) и периферических лимфоузлах. Включает 2 варианта – наличие злокачественных клеток в плевральном выпоте и вовлечение других дистантных органов.
Симптомы наследственного рака яичников
Первыми субъективными признаками опухоли могут быть проявления паранеопластического синдрома – снижение аппетита, слабость и быстрая утомляемость, общее недомогание, субфебрилитет. По мере роста опухоли симптоматика становится более выраженной, присоединяются тупые распирающие боли в области пупка, нижней части живота, эпигастрия, подреберья. Сдавление кишечника сопровождается тошнотой, рвотой, запорами, вздутием живота, неприятными ощущениями во рту, а сдавление мочевыводящего тракта – частыми позывами на мочеиспускание, затруднением отхождения мочи. При асците увеличивается объём живота, скопление выпота в брюшной полости и в плевре проявляется усиливающейся одышкой, кашлем, сердцебиением, ощущением дурноты в ответ на привычные ранее нагрузки. Распространение процесса на маточные трубы и матку может сопровождаться серозно-кровянистыми выделениями.
Кожные покровы сначала имеют бледный вид, затем приобретают землисто-серый цвет с желтоватым оттенком (ввиду присоединения гемолитической анемии, сдавления или прорастания опухолью билиарной системы). Чаще всего наблюдается снижение веса, однако кахексия не характерна для больных даже с запущенным раком яичника, их вид не всегда может соответствовать тяжести заболевания. Нередко рак яичника сопровождают тромбофлебиты и флеботромбозы таза и нижних конечностей, проявляющиеся болью, уплотнением, гиперемией по ходу поражённой вены. Иногда при овариальной карциноме отмечается характерное выпячивание пупка – появление пупочной грыжи обусловлено выходом за пределы пупочного кольца поражённого опухолью большого сальника.
Осложнения
Осложнения могут быть связаны с местным распространением опухоли, сосудистыми проявлениями паранеопластического синдрома, отдалёнными метастазами. У молодых больных нередко возникает перекрут ножки новообразования, сопровождающийся картиной острого живота. Такое состояние может приводить к некрозу, перитониту, бурному прогрессированию рака. Подобными последствиями грозит и ущемление сальника. Тромбозы могут повлечь тромбоэмболию лёгочной артерии. В результате длительного накопления асцитической жидкости развивается выраженная сердечно-лёгочная недостаточность. Сдавление толстой кишки может закончиться полной кишечной непроходимостью и смертью. Метастазы в печени, лёгких, головном мозге вызывают серьёзные расстройства и значительно ухудшают качество жизни, распространение процесса приводит к летальному исходу.
Диагностика
Диагностика овариального рака осложнена труднодоступностью опухоли и отсутствием специфических гинекологических симптомов. В результате больные длительно и безуспешно лечатся по поводу несуществующих внутренних болезней, а опухоль выявляется слишком поздно. Диагностический поиск направлен на определение BRCA-статуса, морфологическую верификацию неоплазии, оценку распространённости опухолевого процесса и включает следующие исследования:
- Гинекологический и физикальный осмотр. В ходе бимануального ректовагинального исследования можно обнаружить опухоль придатка и по характеру изменений (неровности, подвижности, плотности, фиксации к соседним органам) предположить первичное злокачественное новообразование. При общем осмотре по косвенным признакам (асцит, увеличение периферических лимфоузлов) также можно заподозрить рак яичника.
- Лучевые методы. Абдоминальное УЗИ половых органов с дополнительным применением трансвагинальных, внутриматочных и ректальных датчиков, цветной допплерометрии позволяет обнаружить признаки злокачественного роста (неравномерность структуры, наличие множества беспорядочно расположенных перегородок, нечёткость контура, гиперваскуляризация, асцит). Для более точного исследования первичной опухоли, а также с целью выявления метастазов в матке, печени, лёгких, селезёнке могут назначаться КТ и МРТ малого таза, брюшной полости, грудной клетки. Для обнаружения опухолевого поражения толстой кишки применяется колоноскопия.
- Анализы крови. Производится определение уровня опухолевого маркёра (ИФА-анализ) и дисфункции генов наследственных синдромов (ПЦР-тест). Повышение уровня ассоциированного с раком яичника антигена Ca-125 свидетельствует о высокой вероятности овариальной карциномы, а обнаружение мутаций в BRCA1, 2 – о наследственном характере патологического процесса.
- Морфологические анализы биоптатов. Цитологическое исследование пунктатов дугласова пространства, брюшной и плевральной полости позволяет обнаружить раковые клетки, верифицировать диагноз и уточнить стадию опухолевого процесса.
- Лапароскопию. В некоторых случаях (ожирение, спаечные процессы у больной) точный диагноз возможно установить только хирургическим методом. Диагностическая лапароскопия позволяет наиболее точно диагностировать опухоль яичника и определить стадию.
Дифференциальная диагностика проводится с участием онкогинеколога, врачей лабораторной и ультразвуковой диагностики, медицинского генетика, радиолога, патоморфолога. Рак яичника дифференцируют с овариальными и забрюшинными кистами, доброкачественными и другими злокачественными опухолями яичников, синдромом Мейгса, неоплазиями соседних органов, метастазами рака желудка и толстой кишки, гнойно-воспалительными заболеваниями придатков, пупочной грыжей, гастроэнтеральной, кардиологической, пульмонологической патологией.
Лечение наследственного рака яичников
На ранних стадиях основной целью лечения является радикальное удаление опухоли и достижение стойкой и длительной ремиссии без рецидива. Однако распространённость первично диагностированной неоплазии в большинстве случаев не позволяет уничтожить все раковые клетки в организме, поэтому лечение в таких случаях направлено на стабилизацию процесса и удлинение периода без прогрессирования. Для достижения этих целей применяется комбинация двух методов – хирургического и медикаментозного, которая иногда может дополняться лучевой терапией.
- Циторедуктивная операция. При раке яичника, в отличие от большинства других злокачественных неоплазий, удаление любого технически возможного объёма опухоли позволяет улучшить прогноз, поэтому хирургическая операция выполняется при любой стадии. Если опухоль была удалена не полностью, вмешательства повторяются после нескольких курсов химиотерапии.
- Полихимиотерапия. Наследственные раковые опухоли яичников более чувствительны к химиотерапии, чем спорадические, поэтому медикаментозное лечение тоже можно считать основным методом, применяемым с целью частичной регрессии неоплазии. При наличии асцита или плеврита химиотерапия проводится до операции, в остальных случаях – после. Лечение проводят препаратами платины и таксанами.
- Лучевая терапия. Лечение в основном малоэффективно при эпителиальных опухолях и назначается после операции только в случае резистентности карциномы к лекарственным препаратам.
Прогноз и профилактика
Прогноз безрецидивной и общей выживаемости при семейном раке благоприятнее, чем при спорадическом. В среднем пятилетняя выживаемость составляет 36-40%. При I стадии процесса этот показатель составляет 70-100%, при II – 45%, при III – 35-40%, при IV – 5-10%. Более половины рецидивов регистрируется в течение года после лечения. Частота рецидивов в среднем составляет 20-50%. Пятилетний порог безрецидивной выживаемости перешагивает 27% больных, десятилетний – 7%.
Профилактическая программа включает медико-генетическое консультирование женщин группы риска для расчёта вероятности развития у них рака яичника, ДНК-тестирование для выявления мутаций BRCA. При наличии наследственной предрасположенности молодым (до 35-40 лет) пациенткам с целью раннего выявления вероятных неоплазий рекомендовано ежегодное тщательное обследование (гинекологическое УЗИ, ректовагинальное исследование, определения уровня CА-125). После реализации репродуктивной функции женщинам может быть предложена превентивная тубовариэктомия, снижающая риск развития опухоли яичников на 95%, а опухоли молочной железы – на 50%, или альтернатива – перевязка маточных труб (снижает риск на 60-70% в связи с атрофией эпителия, являющегося источником патологического процесса). Больным, получавшим лечение по поводу рака яичника, необходимо пожизненное динамическое наблюдение онкогинеколога для своевременной диагностики возможного рецидива.
Онкологические заболевания отличаются высокой летальностью для пациентов. Опасность обусловлена длительно бессимптомным течением с возникновением клинической картины на поздней стадии процесса, когда лечение уже не эффективно.
Наследственный рак яичника зачастую выявляется лишь на 3 и 4 стадии, когда уже вступил в фазу поражения всего организма. Методы скрининга на наличие атипичных клеток не позволяют определить данное гинекологическое поражение из-за низкой чувствительности раковых клеток яичников.
Передается ли рак яичников по наследству?
Риск онкологии репродуктивной системы увеличивается при наличии данной патологии в роду. Зачастую это заболевание относится к патологии наследственного характера. Важно учитывать, что рак яичников передается по наследству не только от матери, но и от отца, для определения риска онкологии следует исследовать обе ветви родителей.
Наследственная предрасположенность может спровоцировать развитие онкологии в молодом возрасте еще до наступления менопаузы (до 40 лет), однако носительство опасных генов еще не говорит о вероятности развития патологии, доля носителей опасных генов среди всех заболевших не превышает 10%.
Наследственные причины рака яичников
Наследственные причины злокачественного новообразования яичников кроются в изменении на уровне ДНК. При нарушении в функционировании генов BRCA1 и BRCA2 вследствие их мутации, появляется риск развития онкологии груди и рака яичников.
При мутации гена BRCA1 высок риск заболевания, показатели достигают 54% из женщин-носителей. Учитывая длительное бессимптомное течение и обращение более 80% женщин с диагнозом рака на стадии декомпенсации, наличие данного гена представляет риск летальности у 20% девушек имеющим плохой ген.
Заболевание наследственным (семейным) раком не требует особой тактики в лечении. Ведение больной равнозначно женщинам, не имеющим данный ген, однако патология развивается в более молодом возрасте (при отсутствии предрасположенности онкология репродуктивной системы возникает в период менопаузы).
Какие бывают наследственные формы рака яичника?
Помимо BRCA, повышать риск развития онкологии у женщин могут гены, связанные с неполипозным колоректальным раком.
При данном синдроме патология начинается с нарушения функции щитовидной железы, способной к малигнизации. Причина наследственного рака кроется в нарушении гена PTEN. Развитие опухоли яичников и молочных желез носит вторичный характер (возникает после поражения щитовидки).
Наследственный колоректальный рак
Патология генов MLH1, MLH3, MSH2, MSH6, TGFBR2, PMS1 и PMS2 повышает риск развития злокачественного новообразования толстого кишечника, наряду с которым высока вероятность онкологии яичников и эндометрия матки.
В организме человека высока регуляция внутренней среды, это говорит о том, что наличие мутированного гена не означает 100% развитие злокачественного процесса. Риск развития наследственного рака яичника не превышает 10% от всех носителей.
Вероятность развития рака яичника (эпителиального или гранулезоклеточного) при данном синдроме высока. Синдром Пейтца-Егерса характеризуется множественным формированием полипов толстого и тонкого кишечника. Данная патология встречается крайне редко.
Полипоз при повреждении гена MUTYH
При мутации указанного гена возникает онкологическое поражение толстого и тонкого кишечника, колоректальной области, рак мочевыделительной системы и репродуктивной.
Заболевание возникает на фоне осложнения полипоза толстого кишечника. Для диагностики применяется колоноскопия.
Как часто встречаются наследственные формы рака яичника и кто в группе риска?
Наследственные формы рака яичника встречаются не часто, около 10% из всех онкологических патологий репродуктивной системы.
Кому показано исследование крови на раковый ген:
- диагностирование рака репродуктивной системы (молочной железы или яичников) у одной или нескольких женщин рода;
- развитие рака молочной железы в молодом возрасте (до 45 лет);
- рак яичников;
- диагностика рака репродуктивной системы у одного из родственников до 45 лет, учитывается и отцовская и материнская линии;
- рак груди у любого из мужчин состоящего в родстве.
Для онколога важны все данные о развитии опухоли вызванной атипичными клетками у всех родственников пациентки и динамическое наблюдение за состоянием молочной железы и яичников самой женщины. На развитие болезни оказывает влияние и образ жизни, сопутствующие заболевания, вредные факторы производства или неблагоприятные условия окружающей среды. Учитывая все полученные данные, врач назначает лечение заболевшим женщинам или подбирает тактику наблюдения у здоровых носителей вредного гена.
Как на сегодняшний день определяется наследственный рак яичников?
Предрасположенность к онкологическому заболеванию, связанному с генами BRCA1 и BRCA2 определяется исследованием крови.

Что такое генетический анализ на рак яичников?
Генетический анализ на рак яичников представлен исследованием женщин на наличие мутированных генов. Данный анализ необходим для:
- Оценки риска развития рака репродуктивной системы.
- Определения тактики наблюдения за женщинами, входящими в группу риска для ранней диагностики заболевания, что повышает шанс на благоприятный исход.
- Определение профилактических мероприятий для пациенток группы высокого риска.
Полноценный контроль за состоянием здоровья с раннего возраста девушек, склонных к развитию патологии, позволяет снизить риск не только летальности, но и заболевания раком репродуктивной системы.
Что делать, если анализы подтвердили предрасположенность к наследственному раку?
При определении носительства опасных генов женщина автоматически включается в группу риска раннего развития онкологии яичников и молочной железы. Для своевременного определения симптомов заболевания на стадии подающейся лечению, носители должны наблюдаться с молодого возраста.
В чем заключается тактика наблюдения здоровых носителей наследственных мутаций?
Главная задача наблюдения здоровых носителей мутации, предавшейся по наследству, заключается в комплексе мероприятий, направленных на ранее выявление патологии в случае развития злокачественного процесса.
- Наблюдение у маммолога обычных женщин показано с 45 лет, при носительстве с 20-35.
- Для профилактики патологии врач может назначить прием гормональных контрацептивов или других средств, снижающих вероятность появления опухоли.
- Возможно удаление органов с целью профилактики развития новообразования (груди, яичников), проводится при серьезной опасности рака.
- Определение опухоли на фоне наследственного рака позволяет скорректировать лечение с учетом данного фактора.
- При выявлении гена определяется тактика наблюдения и корректируется образ жизни женщины.
Важно учесть, что носительство мутированных генов требует особой осторожности в подборе препаратов. Самостоятельное назначение таких средств, как противозачаточные, не допустимо ввиду опасности спровоцировать нежелательную для жизни патологию.
Рекомендации женщинам-носителям генов с мутацией
Программа наблюдения носителей подбирается индивидуально с учетом многих особенностей, однако существует общий план контроля состояния, позволяющий своевременно определить развитие опухоли. Тактика ведения заключается в динамическом контроле:
- С 18-летнего возраста женщину следует обучить методике самоконтроля за состоянием молочной железы, которую осуществлять необходимо ежемесячно (осмотр и пальпации груди в положении лежи и стоя).
- С 15 летнего возраста рекомендован осмотр у гинеколога не менее чем каждые 3-4 года.
- С 25 лет назначается ультразвуковое исследование молочной железы с периодичностью в 6 месяцев, МРТ, маммография, УЗИ каждый год.
- Определение уровня СА125 назначают с 25-30 лет каждые 6-12 месяцев.
- С 40-50 лет женщинам необходимо проходить колоноскопию (с интервалом в 3-5 лет), мужчинам – оценку состояния простаты каждый год.
Перечисленные методы могут меняться и дополняться индивидуально. Однако, ежегодное посещение специалиста необходимо каждой женщине, заботящейся о своем здоровье!
Выводы
Наследственный рак яичников зачастую обусловлен изменением на генном уровне, однако мутация ДНК не является единственной причиной онкопроцесса.
Для развития патологии необходимо сочетание нескольких неблагоприятных факторов (излучения, нарушение питания и гигиены половой жизни, частые воспаления яичников, вирусные поражения).
Точное понимание механизма развития атипичных клеток находится в стадии изучения, однако связь наследственной предрасположенности с высоким риском рака яичников уже доказана. Мутация генов может произойти и во время жизни под действием различных факторов. Приобретенные изменения генома также провоцируют патологию. Своевременное обследование и определение отношения к группе риска поможет избежать поздней диагностики рака, а значит и повысит шанс на излечение.
Об этом мы поговорили с онкогинекологом, хирургом Владимиром Носовым, руководителем Клиники гинекологии и онкогинекологии Eвропейского медицинского центра – первой клиники в России, где персонализированная терапия онкогинекологических заболеваний стала стандартной практикой.
В своём нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от опухолевого перерождения. Если возникает мутация в этих генах, здоровые клетки оказываются не защищенными и сами могут становиться злокачественными. Вероятность заболеть раком груди при носительстве мутации гена BRCA 1/2 колоссальная — до 80%(в общей популяции у женщин без мутации — около 10-12%), риск заболеть раком яичников — до 40-45 %( в популяции —около 1,5%) .
В большинстве случаев назначение этих препаратов после первой линии химиотерапии обеспечивает ремиссию около 3 лет – это огромное достижение, еще никогда в онкогинекологии ремиссия при 3-4 стадии заболевания не продлевалась каким-либо лекарством на столь длительный срок.
Дальнейшие исследования позволили выяснить, что мутации могут быть не только герминогенными, то есть присутствующими во всех клетках организма. Дополнительные 15-20% мутаций генов BRCA происходят только в клетках опухоли, но в крови и других клетках организма их нет. Эти мутации называют соматическими. Они не передаются по наследству, не увеличивают риск развития других онкологических заболеваний, но пациенты, у которых обнаружены мутации в клетках опухоли, также являются кандидатами для лечения ингибиторами PARP.
В Институте онкологии EMC мы предлагаем всем пациентам с раком яичников провести полное секвенирование генов BRCA опухоли и крови. Это позволяет подобрать наиболее эффективную персонализированную терапию. Если речь идет о наследственной мутации – мы рекомендуем в обязательном порядке генетическое обследование детям, сестрам, братьям, родителям, а самим пациенткам-носителям мутации – также пройти дополнительный скрининг на рак молочных желез, риски которого колоссально повышены.
Плохое наследство
Наследственная мутация передается детям с вероятностью 50%, причем как по женской, так и по мужской линии. Носителям мы рекомендуем специальную программу наблюдения и профилактические мероприятия для снижения риска онкологических заболеваний, а также обсуждаем с ними вопросы сохранения репродуктивной функции.
Например, на днях я оперировал пациентку 57 лет с раком яичника. На плановой гистологии был подтвержден злокачественный характер опухоли. Мы провели генетическое исследование опухоли, выявили мутацию BRCA1. Затем было выполнено полное генетическое исследование по крови, чтобы понять, является ли мутация соматической (присутствующей только в опухоли) или герминогенной (наследственной). Выяснилось, что мутация наследственная. Мы рекомендовали пройти обследование двум дочерям пациентки, которые, к сожалению, унаследовали эту мутацию. Женщины-близнецы, им сейчас 31 год, обе еще не планировали беременность и роды. Я рекомендовал им обратиться к репродуктологу, провести стимуляцию и заморозить яйцеклетки, а в 35 лет, именно с этого возраста риски рака яичников начинают расти, удалить профилактически яичники и маточные трубы. В этом случае мы сохраняем матку, и в будущем они смогут выносить своих биологических детей.
Более того, во время ЭКО можно провести предимплантационную диагностику и подсадить эмбрионы, не унаследовавшие мутацию. Таким образом, будущее поколение уже будет защищено.
Рак эндометрия (рак тела матки) – самое распространенное онкогинекологическое заболевание у женщин. Сегодня подходы к его лечению также меняются благодаря персонализированной терапии.
До недавних пор считалось, что существует два типа рака эндометрия. Наиболее частый, первого типа, обычно возникает у полных пациентов, часто с сопутствующими диабетом и гипертонией. Второй – серозный, более агрессивный, не связанный с избытком эстрогенов. На основании клинической картины врачи принимали решение о необходимости дополнительного лечения после операции. Сегодня, благодаря лучшему пониманию биологии опухоли, мы знаем, что этих типов не два, а четыре. И для каждого из них предусмотрено определенное лечение. Чтобы определить, с каким типом рака эндометрия мы имеем дело, достаточно для начала провести иммуногистохимическое исследование.
Каждую опухоль эндометрия вне зависимости от стадии, мы тестируем на наличие определенных молекул, указывающих на благоприятный или менее благоприятный прогноз заболевания. Например, наличие мутации гена P53 говорит о менее благоприятном прогнозе. В этом случае мы рекомендуем не только наблюдение, но и дополнительное лечение с помощью химио-или лучевой терапии.
Некоторые раки матки, так же, как и некоторые раки яичников и молочной железы, имеют в своей основе генетический синдром – синдром Линча. Если мы находим проявления синдрома Линча в опухоли, мы направляем пациентов на полноценное генетическое тестирование. Это важно, потому что рак матки – не единственное заболевание, к которому предрасположены носители мутаций, вызывающих синдром Линча. В частности, у них повышен риск рака толстой кишки в молодом возрасте.
Часто первым возникает рак матки, через какое-то время развивается рак толстой кишки.
Поэтому носителям синдрома Линча рекомендуют начинать скрининг на рак кишки не в 45-50, а гораздо раньше — с 30 лет и делать колоноскопию раз в 6 или 12 месяцев, чтобы не пропустить развитие заболевания.
Выявление синдром Линча у пациентки с раком матки может повлиять и на лечение.
При поздних стадиях пациентам с синдромом Линча мы назначаем специфическую иммунотерапию препаратом пемпролизумаб, что позволяет улучшить прогнозы пациентов.
Генетическое профилирование опухоли – это колоссальный прорыв, который позволил нам подойти к полностью персонализированной терапии в онкологии, основанной не только на диагнозе, но и на понимании биологии опухоли. Для пациентов — это возможность получить точное узкоспециализированное лечение, дающее лучшие результаты, а в случае наследственных раков — возможность защитить будущие поколения от опасных заболеваний.
Читайте также:

