Накопление радиофармпрепарата в опухоли
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время для производства РФП используется очень широкий спектр как специальных веществ, так и радионуклидных меток. Во всем мире самым часто используемым у онкологических больных соединением специального вещества и радионуклидной метки является 18 F-фтордезоксиглюкоза ( 18 F-ФДГ). В данном соединении 18 F выполняет функцию радионуклидной метки, ФДГ – специального вещества.
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Физиологическое накопление наблюдается при исследованиях со всеми РФП: 18 F-ФДГ, 11 С-холином, 11 С-метионином, 68 Ga-ПСМА и т.д. В зависимости от типа РФП меняется лишь местоположение физиологической гиперфиксации. Например, при ПЭТ и ПЭТ/КТ с самой часто используемой 18 F-ФДГ физиологическое накопление РФП определяется в коре головного мозга, ротоглотке, носоглотке, мышцах гортаноглотки, миокарде левого желудочка, чашечно-лоханочных системах почек, фрагментарно по ходу петель толстой кишки, мочевом пузыре.
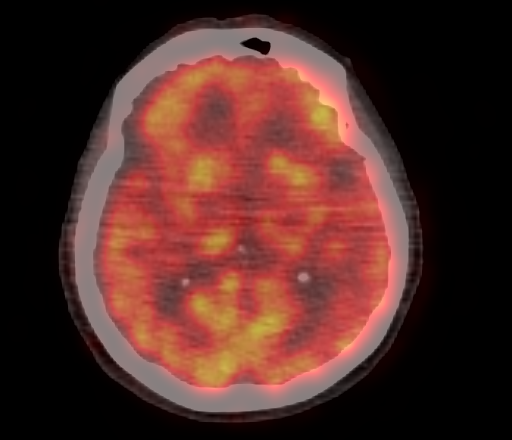 |  |
| Физиологическое накопление 18 F-ФДГ в коре головного мозга. | |
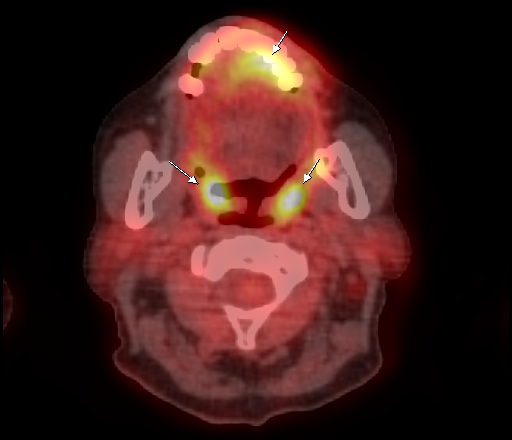 |  |
| Физиологическое накопление 18 F-ФДГ в ротоглотке. | |
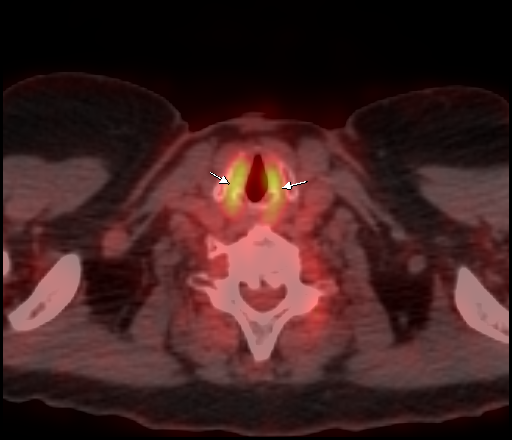 |  |
| Физиологическое накопление 18 F-ФДГ в мышцах гортаноглотки. | |
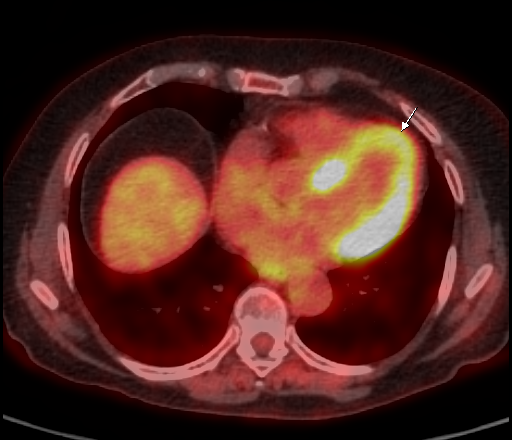 |  |
| Физиологическое накопление 18 F-ФДГ в миокарде левого желудочка. | |
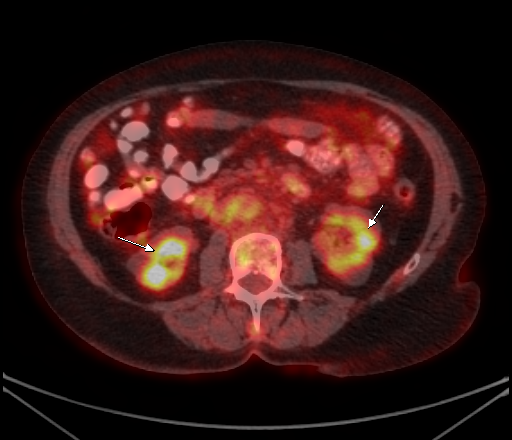 | 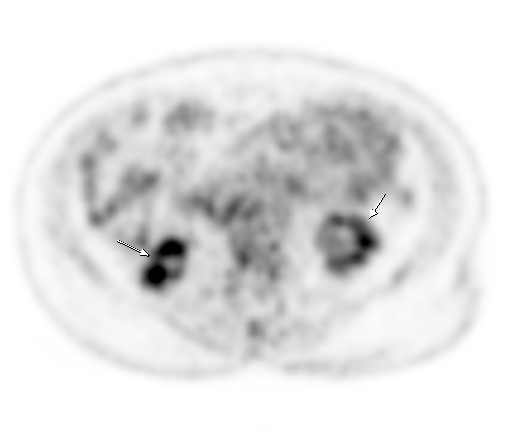 |
| Физиологическое накопление 18 F-ФДГ в чашечно-лоханочных системах почек. | |
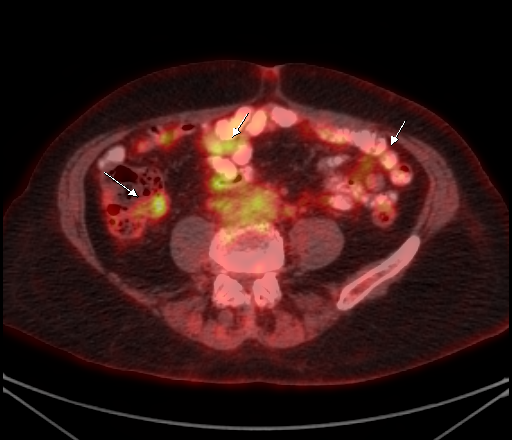 | 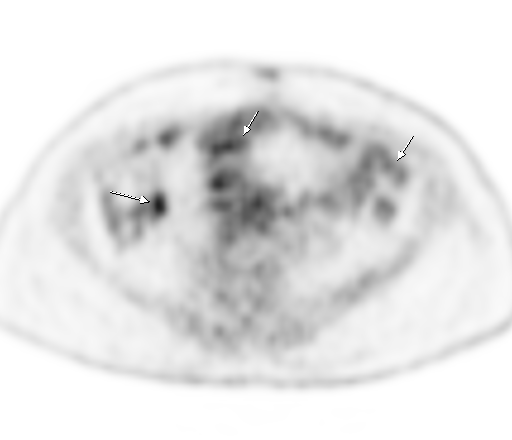 |
| Физиологическое накопление 18 F-ФДГ по ходу петель толстой кишки. | |
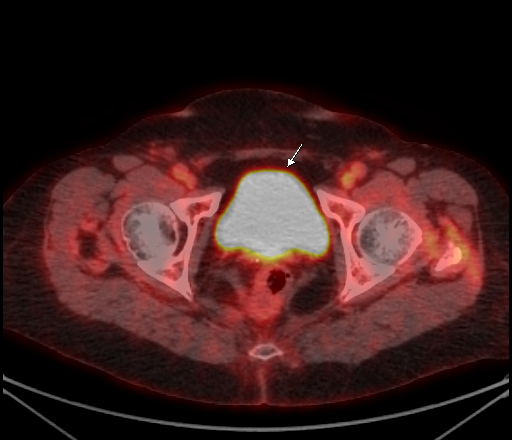 |  |
| Физиологическое накопление 18 F-ФДГ в мочевом пузыре. | |
Вопрос №4. Что такое патологическое накопление РФП?
Патологическое накопление РФП – это повышенное накопление РФП в органах и тканях, регистрирующееся при заболеваниях, чаще всего в злокачественных опухолях.
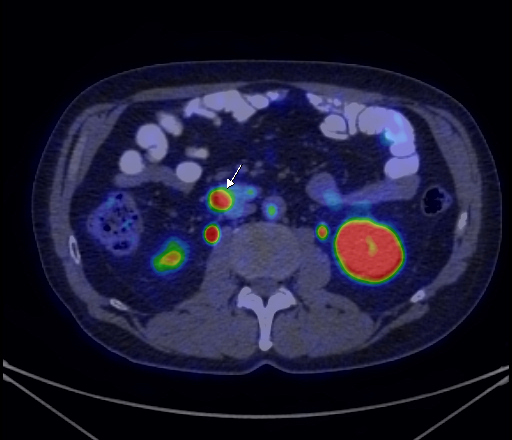 |
| Данные ПЭТ/КТ с 68 Ga-DOTA-TATE у пациента с нейроэндокринной опухолью тощей кишки. В проекции злокачественной опухоли, расположенной в тощей кишке, определяется очаг патологической гиперфиксации РФП. |
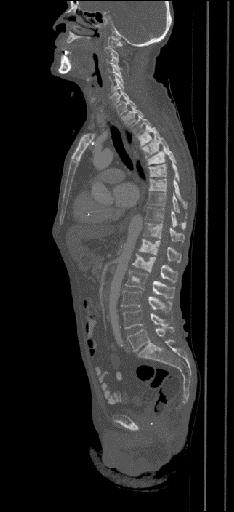 | 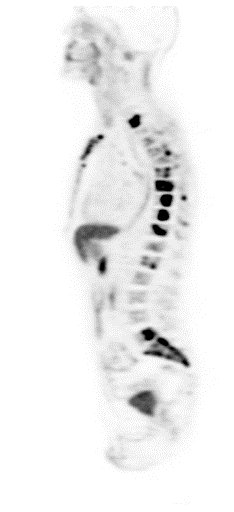 | 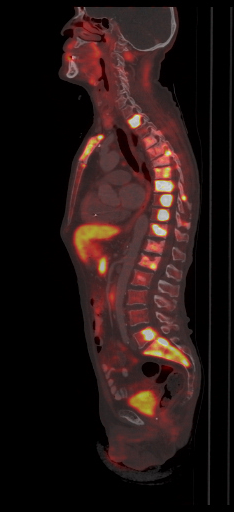 |
| Данные ПЭТ/КТ с 11 С-холином у пациента с раком предстательной железы. Состояние после простатэктомии. В костях скелета визуализируются множественные очаги патологического накопления РФП (метастазы). | ||
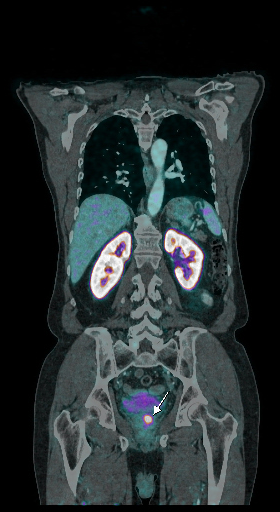 | 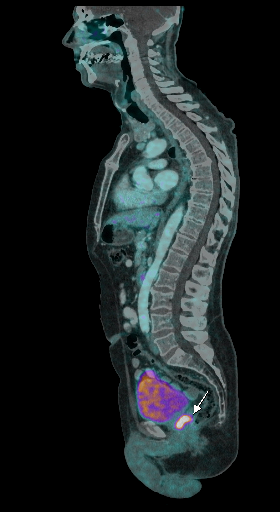 | 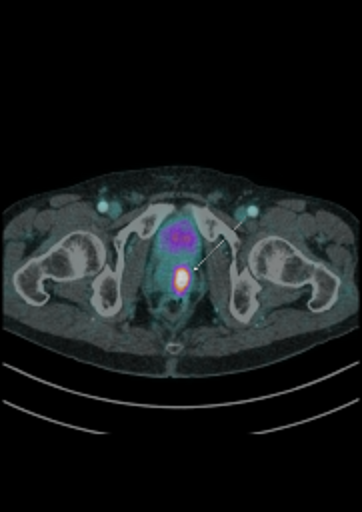 |
| Данные ПЭТ/КТ с 68 Ga-ПСМА у пациента с местным рецидивом рака предстательной железы. Состояние после лучевой терапии. В левых отделах предстательной железы определяется очаг патологического накопления РФП. | ||
Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
Метаболически неактивное образование – это образование, которое не накопило РФП. Чаще всего отсутствие повышенного накопления РФП в опухоли свидетельствует о ее доброкачественной природе.
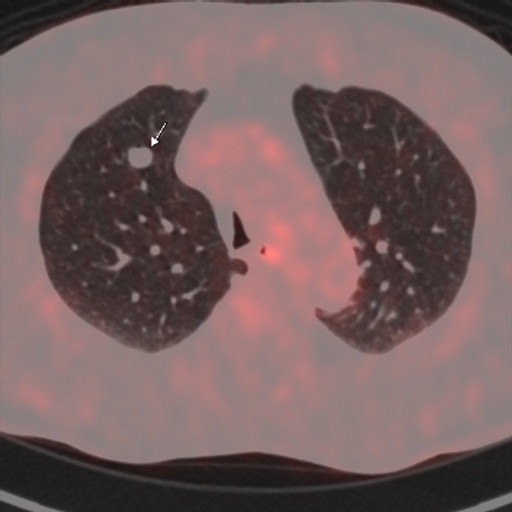 |
| Данные ПЭТ/КТ с 18 F-ФДГ у пациента с метаболически неактивным образованием правого легкого (доброкачественная опухоль - гамартома). |
Метаболически активное образование – это образование, в котором накопился РФП в повышенном количестве. Повышенное накопление РФП в опухоли чаще всего свидетельствует о ее злокачественном характере.
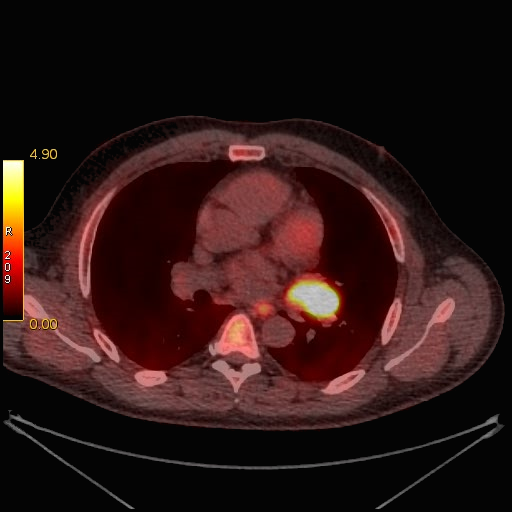 |
| Данные ПЭТ/КТ с 11 С-метионином у больного с метаболически активным образованием корня левого легкого (типичный карциноид). |
Вопрос №6. Что такое SUV?
SUV (Standardized Uptake Value, стандартизированный уровень захвата) – это величина, отражающая интенсивность накопления РФП в зоне интереса, например, в опухоли.
Показатель SUV рассчитывается программным комплексом автоматически и измеряется в различных единицах. В нашем Центре, как и в большинстве отечественных и зарубежных медицинских учреждений, где проводится позитронная эмиссионная томография, в качестве единиц измерения показателя SUV принято использовать г/мл (g/ml).
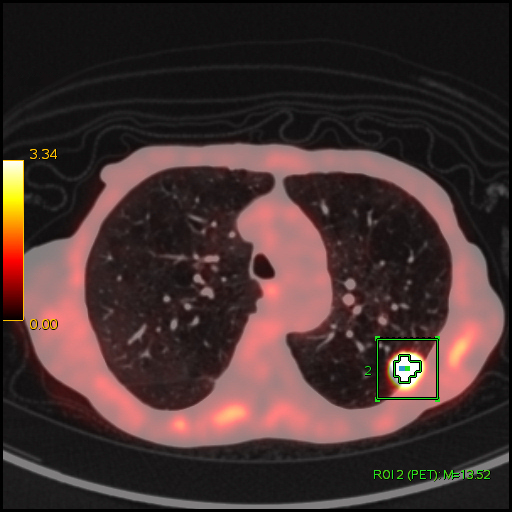 |
| Данные ПЭТ/КТ с 18 F-ФДГ. Оконтуривание метаболически активной злокачественной опухоли левого легкого для измерения показателя SUV. В данном случае величина SUV в опухоли определяется на уровне 13,52 g/ml. |
Вопрос №7. Для чего используется величина SUV?
Величина SUV в основном используется для оценки ответа злокачественной опухоли на проведенное лечение. Важно подчеркнуть, что в ряде клинических ситуаций показатель SUV в опухоли является единственным критерием, позволяющим оперативно получить информацию о чувствительности образования к только что начатой терапии.
Если опухоль чувствительна к лечению, то уровень SUV в ней при повторном ПЭТ-исследовании будет снижаться, если нечувствительна или малочувствительна (резистентна, устойчива) – значение SUV останется без изменений или увеличится. Следует помнить, что своевременная диагностика устойчивости опухоли к лечению позволит скорректировать план лечения, а в некоторых случаях и радикально его изменить.
Как уже было сказано выше, для оценки эффективности терапии врач-радиолог оценивает динамику показателя SUV до и после лечения.
Существует четыре варианта метаболического ответа опухоли на проведенное лечение:
- Частичный метаболический ответ – устанавливается при уменьшении значения SUV в опухоли на 25% и более;
- Полный метаболический ответ – заключается в отсутствии повышенного накопления РФП в опухоли;
- Метаболическое прогрессирование – устанавливается при увеличении SUV на 25% и более и/или при появлении новых очагов патологической гиперфиксации РФП;
- Метаболическая стабилизация – регистрируется при отсутствии достоверных (менее 25%) изменений показателя SUV в опухоли.
 |  |  |
| а | б | в |
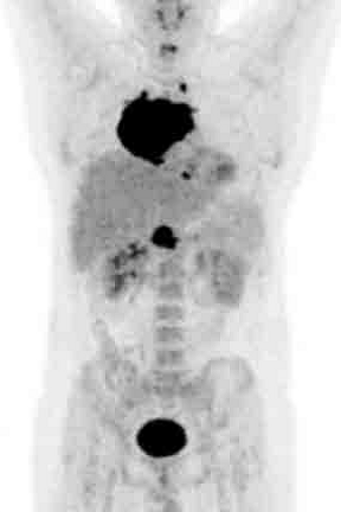
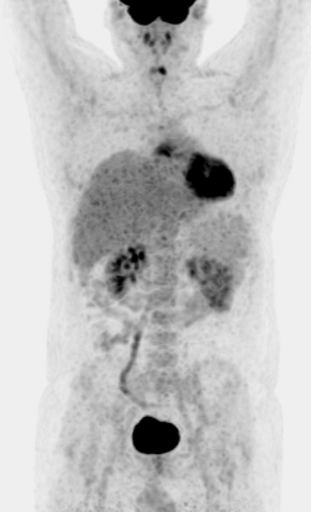
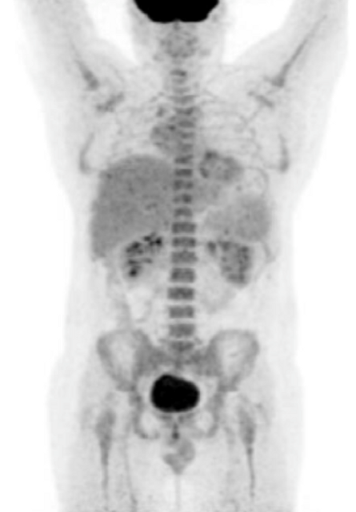
Результаты ПЭТ с 18 F-ФДГ у пациента с диффузной В-клеточной крупноклеточной лимфомой до лечения (а), после 2 курса ПХТ (б) и через 13 месяцев после окончания терапии (в).
а – до лечения в средостении визуализируется массивное метаболически активное образование с уровнем SUV=12,6;
б – после 4 курса ПХТ отмечается значительное уменьшение метаболического объема опухоли и снижение показателя SUV до 3,4 (достигнут частичный метаболический ответ, т.е. опухоль чувствительна к выбранной ПХТ);
в – через 13 месяцев после окончания ПХТ очагов патологической гиперфиксации РФП в проекции органов средостения не обнаружено (достигнут полный метаболический ответ).

Актуальность проблемы. В настоящее время большинство онкобольных нуждаются в комбинированном лечении [4,6]. Наблюдаемые у ряда больных неудачи побудили в последнее время шире прибегать к выбору тактики лечения в зависимости от оценки распространенности процесса [3]. Происходит постоянная оптимизация методов для оценки распространения заболевания у пациентов с опухолями пищевода и желудка. Компьютерная томография (КT) представляет стандарт в определении инвазии опухоли. КТ является неинвазивным и наименее дорогостоящим из доступных методов, но имеет серьезные ограничения в плане точной постановки диагноза [5]. Позитронно-эмиссионная томография (ПЭТ) также является неинвазивным, но предоставляет качественно иную информацию по сравнению с КТ, благодаря своей функции участия в метаболическом процессе опухоли, а не только определяя размер опухоли [1]. Многие исследователи показали, что снижение метаболической активности, измеренной значением стандартизированного накопления (SUV) на ПЭТ/КТ, в результате терапии является прогностически значимым критерием [7,9,10]. Следует отметить, что ПЭТ/КТ изображения были изучены у ограниченного количества больных и, согласно другим исследованиям, прогностическая ценность является сомнительной [8,11]. Тем не менее данные ПЭТ/КТ при злокачественных опухолях верхних отделов желудочно-кишечного тракта не были подтверждены [2] и требуют дальнейшего изучения.
Цель работы: выявить зависимость коэффициента максимального поглощения радиофармпрепарата18F-ФДГ от следующих характеристик опухолевого процесса – глубины инвазии опухолевого процесса, гистологической структуры опухоли и степени дифференцировки злокачественной опухоли.
Результаты и их обсуждение. Нами проведен анализ показателя SUVmax в первичной опухоли и определена зависимость коэффициента SUVmax в зависимости от основных характеристик онкологического процесса, таких как глубина инвазии опухолевого процесса, гистологическая структура и дифференцировка опухоли.
Накопление фармпрепарата в первичной опухоли у больных со злокачественными новообразованиями верхних отделов желудочно-кишечного тракта варьировало от 2,1 до 13, в среднем составило 6,25±2,26.
Зависимость максимального накопления радиоизотопа глюкозы от глубины инвазии опухолевого процесса в стенку органа представлена на рисунке 1.
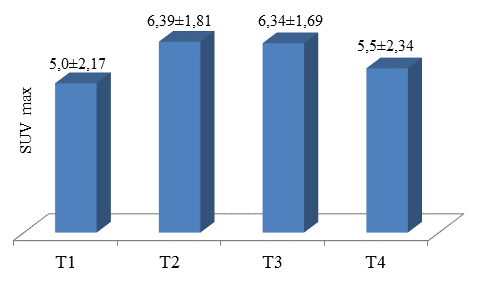
Рисунок 1. Коэффициент SUVmax в зависимости от глубины инвазии опухолевого процесса
Как видно из представленной диаграммы, максимальное накопление радиофармпрепарата не зависело от глубины инвазии стенки органа опухолевым процессом. Наибольшие показатели накопления радиофармпрепарата в первичной опухоли отмечены при прорастании мышечного (Т2, n=27) и серозного (Т3, n=21) слоев. Наиболее низкие показатели отмечены при поражении только слизистого слоя (Т1, n=3) и при прорастании в соседние органы (Т4, n=5). Полученные данные не имели статистически значимых различий (p=0,41).
Проведен анализ содержания радиофармпрепарата ФДГ 18F в зависимости от протяженности поражения органа. Полученные данные представлены в таблице 1.
Таблица 1. Коэффициент SUVmax в зависимости от протяженности поражения органа

У пациентов с неоперабельным гепатоцеллюлярным раком печени появился шанс на хирургическое удаление злокачественной опухоли и, как следствие, на излечение. В Медицинском радиологическом научном центре им. А.Ф. Цыба, филиале НМИЦ радиологии Минздрава РФ прошел первый этап нового для России метода лечения — радиоэмболизации печени. Он признан самым эффективным при этом заболевании и позволяет значительно увеличить продолжительность жизни пациентов по сравнению с теми, кто получил традиционную терапию. В мире радиоэмболизация входит в стандарт лечения, но у нас этот метод до сих пор не внедрен.
Основной метод лечения этого вида рака — радикальная операция. Но проблема в том, что только 20% от общего числа таких пациентов могут быть излечены хирургическим способом. Для всех остальных (у кого опухоль больше 5 см) приходится применять менее эффективные методы лечения, и продолжительность жизни в таком случае составляет 6–18 месяцев.

На сегодня в распоряжении врачей помимо хирургического метода есть еще пять способов лечения, среди которых системная химиотерапия, радиочастотная деструкция и дистанционная лучевая терапия. Все они имеют определенные противопоказания.
Суть радиоэмболизации в том, что в сосуды опухоли вводят радиофармпрепарат Иттрий 90, являющийся источником бета-излучения. Он блокирует кровоснабжение опухоли и разрушает ее изнутри. Такая операция высокоэффективна и малотравматична, а окружающие здоровые ткани практически не страдают.
— С помощью радиоэмболизации при лечении рака печени 2–3-й стадии чаще получается добиться стабилизации процесса и уменьшить объем опухолевой ткани. Это позволяет увеличить продолжительность жизни пациента, понизить стадию заболевания. После возможны традиционная операция и излечение, — сказал Валерий Кучеров. — Метастатические поражения печени тоже достаточно успешно лечатся с помощью радиоэмболизации. А их дают 70–75% всех онкологических заболеваний, ведь печень — это самый уязвимый при раке орган человека.
В России до сих пор радиоэмболизация печени, как стандарт лечения гепатоцеллюлярного рака, не выполнялась по нескольким причинам. Необходимые для нее микроисточники радиоактивного излучения (микросферы) производятся в Канаде и Австралии, а короткий период полураспада препарата осложняет их доставку. К тому же стоимость импортных микросфер очень высока. Кроме того, медучреждениям нужна специальная лицензия на такие операции и высококвалифицированный персонал.
Процедура радиоэмболизации состоит из двух частей. Сначала проводится диагностическая операция. Во время нее пациенту вместо микросфер с радионуклидами Иттрия-90 вводится технеций. При этом оценивается состояние печени и проводится проверка структуры сосудов. Операция позволяет определить, подходит ли пациент для радиоэмболизации, нет ли опасности повредить здоровые ткани или другие органы.
15 марта в МРНЦ им. А.Ф. Цыба провели именно такую подготовительную операцию в форме мастер-класса. На него пригласили ведущих хирургов центра, а также заведующего отделением интервенционной радиологии Anadolu Medical Center In Affilation with Johns Hopkins Medicine (Турция) доктора Ахмета Мурата Докдока. По его словам, процедура радиоэмболизации была одобрена комиссией FDA в 1999 году.
Доктор медицинских наук Мурат Дёкдёк

Второй этап операции — собственно введение микросферы с Иттрием 90 — проведут точно таким же образом, как и первый, через две недели.
Радионуклидная диагностика – современный способ тщательного изучения состояния организма человека. Применение радионуклидной диагностики в онкологии позволяет определить степень распространения и уровень активности раковых клеток. С помощью данного метода составляется наиболее действенная схема лечения, а также предотвращаются рецидивы заболевания.
Суть метода
После того как человеку вводится меченое вещество, называемое радиофармпрепаратом, оно начинает перемещаться внутри организма. Распределение препарата напрямую зависит от кровотока, скорости метаболических процессов и степени функциональности органов.
При помощи специального оборудования врач имеет возможность отслеживать перемещение вещества и его излучение, что позволяет выявить любые патологии в организме.
Главный принцип радионуклидной диагностики – накопление и распределение радиоактивного вещества внутри человеческого тела с их дальнейшей регистрацией на оборудовании с высокой чувствительностью.
Минимальная лучевая нагрузка, малая вероятность негативных последствий вкупе с получением достоверной картины функционального состояния органов – ещё один важный принцип радионуклидной диагностики.
Преимущества перед другими видами исследований
В лаборатории радионуклидной диагностики врач получает изображения статического характера исследуемого органа. Они отображают области с аномальным количеством введённого вещества. Это даёт информацию о расположении органа относительно других органов, кровеносных сосудов и нервов. Кроме того, на изображениях видны: форма, размер, наличие очага патологии, степень функционирования.
Радионуклидная диагностика – исследование, дающее менее чёткую картинку, в сравнении с ультразвуковым и рентгенологическим обследованием, она имеет меньшее разрешение. Но методы радионуклидной диагностики направлены на изучение не анатомических и морфологических особенностей органов, а на анализ их функциональности, нарушения которой проявляются намного раньше видимых изменений. За счёт этого преимущества выявляются заболевания на самой ранней стадии, эффективно отслеживается динамика их развития.
Безопасны ли радиофармпрепараты?
В диагностических и терапевтических целях пациенту вводится вещество (нуклид), подобранное таким образом, чтобы при минимальном облучении получить всю возможную информацию. К сравнению, однократное действие радионуклида на пациента практически в 100 раз меньше, чем при стандартном рентгенологическом исследовании.
Кроме того, нуклиды быстро распределяются по организму и выводятся из него за короткий промежуток времени, что также в разы снижает действие облучения.
Радиофармпрепараты, используемые в медицине, не содержат токсических веществ, которые после распада оставляют в организме вредные примеси.
Методы радионуклидной диагностики
Исследование осуществляется двумя способами:
- In vitro. В организм человека не вводятся радиофармпрепараты. С точки зрения безопасности этот метод наиболее оптимальный, т. к. для проведения диагностического исследования у пациента берут кровь или другой биоматериал. Человек не получает даже минимальной дозы облучения, поэтому способ in vitro подходит всем онкобольным.
- In vivo. Радиофармпрепараты вводятся в организм человека.
Способы введения радионуклидов
Существуют следующие пути введения радиоактивных веществ:
- энтеральный – нуклиды попадают в кровь из кишечника; чаще всего применяется при радионуклидной диагностике щитовидной железы;
- внутривенный – используется для обследования большинства органов;
- подкожный – важен при оценке функциональности лимфоузлов и сосудов, также препарат может быть введён непосредственно в лимфатические узлы;
- ингаляционный – нужен для визуализации вентиляции лёгких и кровообращения в головном мозге;
- внутримышечный – незаменим при оценке кровообращения;
- спинно-мозговой – препарат вводится непосредственно в канал для его обследования;
- внутриартериальный.
Способы регистрации распределения радиоактивных веществ
Существуют следующие виды радионуклидной диагностики:
- сцинтиграфия;
- сканирование;
- радиометрия;
- радиография.
Сцинтиграфия - метод, используемый в радионуклидной диагностике чаще всего. Он даёт возможность визуализировать орган и степень накопления препарата в нём, что позволяет оценить его функциональность и своевременно выявить патологический процесс.
Данный способ диагностики осуществляется с помощью гамма-камеры. Основной принцип её работы – регистрация излучения радиофармпрепарата при помощи йодида натрия. Этот компонент в виде кристалла большого размера (примерно 60 см в диаметре) чутко реагирует на излучение вещества. Перемещение препарата проецируется на кристалл в виде вспышек света, которые далее попадают на фотоумножитель, преобразовывающий их в электрические импульсы. С помощью регистрации этих импульсов создаётся изображение, показывающее распределение радионуклида. Гамма-камеры позволяют получать как аналоговые, так и цифровые изображения.
Метод сцинтиграфии предполагает введение меченого вещества внутривенно, за исключением тех случаев, когда необходимо обследование лёгких. Для их сцинтиграфии выбирается ингаляционный путь введения препарата.
Метод сканирования позволяет получить двухмерное изображение распределения радионуклида. Детектор сканера улавливает и регистрирует излучения, они при помощи специального блока преобразуются в штрихи, которые наносятся на обычную бумагу. Они называются сканограммой. О распределении препарата врач судит, исходя из вида штрихов.
Существует также метод цветного сканирования, когда цвет штрихов зависит от излучения, испускаемого радиофармпрепаратом.
Максимальная достоверность данного метода достигается при полной неподвижности пациента. Если это условие не соблюдается, сканер представляет искажённую картину.
Если цель диагностики – обнаружение метастазов, не выявленных клиническими исследованиями, применяется метод профильного сканирования. Его суть заключается в следующем: датчики профильного сканера перемещаются над исследуемой частью тела. В результате на бумаге появляются не штрихи, а кривая линия, показывающая накопление препарата по направлению перемещения датчиков.
На сегодняшний день метод сканирования всё реже находит применение на практике. Это обусловлено тем, что он требует больше времени, чем сцинтиграфия, с помощью которой информация предоставляется за короткий промежуток времени.
Чтобы тщательно изучить степень функционирования органа, применяют радиометрию.
Она подразделяется на виды:
- лабораторная – у пациента осуществляется забор биоматериала (кровь, моча, кал и пр.), после чего его изучают на предмет уровня накопления радионуклида;
- медицинская (клиническая) – с её помощью возможно изучить как все системы человеческого организма сразу, так и отдельный орган.
Для лабораторного исследования применяется радиометр. После того как пробирка с биологическим материалом устанавливается у счётчика, радиометр выдаёт на бумаге результат, обработанный микрокомпьютером. Главное достоинство лабораторного метода – точные расчёты, не требующие доработки врачом.
Медицинская радиометрия подразумевает введение радиоактивного вещества внутрь. Датчик радиометра фиксирует степень излучения над диагностируемой частью тела. Информация выдаётся на приборе в виде числового значения зарегистрированных импульсов. Полученный результат оценивается в процентах.
Если необходимо провести радионуклидную диагностику всего тела, используют несколько детекторов. Перемещаясь вдоль тела, они дают информацию о степени функционирования сразу всех систем и органов.
Недостатком радиометрии является то, что она не даёт информацию о кровотоке в исследуемом органе, вентиляции лёгких и пр., т. е. о быстропротекающих процессах в организме.
Чтобы зарегистрировать скорость перемещения радиофармпрепарата, используют метод радиографии. Динамика изменения излучения фиксируется детекторами и переносится на бумагу в виде кривой линии.
Главное достоинство радиографии – простота диагностики. Но в то же время не представляется возможным расположить детекторы строго на границах исследуемого органа. С помощью радиографа не осуществляется визуализация органа, поэтому интерпретация результатов может быть затруднена.
Томографическая технология в радионуклидной диагностике
Наряду со сцинтиграфией, широкое применение на практике находят томографические направления радионуклидной диагностики:
- ОФЭКТ (однофотонная эмиссионная компьютерная томография);
- ПЭТ (позитронная эмиссионная томография).
Метод ОФЭКТ чаще всего используется в кардиологии и неврологии. Его суть заключается в следующем: вокруг человека вращаются стандартные гамма-камеры, улавливающие излучения с разных позиций. Благодаря этому реконструируется объемное изображение, показывающее распределение радиоактивного вещества.
Метод ПЭТ является уникальным способом диагностики, появившимся недавно. Основное его достоинство – выявление заболевания на ранней стадии, уже тогда, когда это ещё невозможно при обследовании стандартными методами.
В процессе диагностики врач имеет возможность визуализировать не только размер и форму органов, но и их метаболизм и степень функционирования.
Чаще всего ПЭТ применяется в онкологии для своевременного обнаружения злокачественного процесса и наблюдения за его развитием.
Метод позитронной томографии основан на фиксировании реакции, имеющей название аннигиляция. Она представляет собой взаимодействие позитронов и электронов, испускаемых радионуклидами. Вокруг человека размещаются детекторы, улавливающие аннигиляцию. Данный способ настолько чувствителен, что с его помощью могут отслеживаться даже мыслительные процессы!
В ходе обследования происходит точная количественная оценка накопления радиофармпрепарата, что позволяет выявить самое начало опухолевого процесса и составить максимально эффективную противораковую схему лечения. С помощью ПЭТ возможно обследование как отдельного органа, так и всего тела.
Также этот метод эффективен при диагностике состояния головного мозга, когда у пациента отмечается потеря памяти неясного генеза. В сжатые сроки подтверждается или исключается рак мозга, обнаружение которого затруднено на самом раннем этапе обычными способами.
Главный недостаток ПЭТ – необходимость использования дорогостоящих радионуклидов.
Особенности применения в онкологии
Отделение радионуклидной диагностики оснащено передовым оборудованием. С его помощью существенно улучшается качество обследования онкобольных, которое при применении стандартных методов не даёт чёткой картины, например:
- радионуклидная диагностика печени позволяет установить, возможна ли резекция органа на начальной стадии рака;
- исследование лёгких отражает уникальную картину изменения опухоли, своевременно выявляет метастазы;
- при раке толстой кишки данный метод позволяет предотвратить рецидивы и исключить наличие отдалённых метастазов у пациентов, у которых уровень онкомаркеров остаётся повышенным после хирургического вмешательства;
- радионуклидная диагностика почек выявляет точную локализацию метастазов в тех случаях, когда это затруднено при компьютерной и магнитно-резонансной томографии;
- при лимфоме наиболее достоверно определяется стадия заболевания и оценивается степень эффективности лечения;
- обследование больных меланомой позволяет определить уровень развития злокачественного процесса, исключить или подтвердить наличие отдалённых метастазов и рецидивов;
- радионуклидная диагностика щитовидной железы позволяет лучше визуализировать размер ракового узла, его активность по отношению к окружающим тканям;
- эффективно оценивается распространение процесса при злокачественных образованиях органов головы; это позволяет составить наиболее подходящую схему лечения;
- диагностика при раке молочной железы даёт возможность спрогнозировать распространение опухоли, выявить рецидивы и своевременно оценить эффективность назначенного лечения.
Нужна ли подготовка?
Необходимо соблюдать определённые правила подготовки перед диагностикой щитовидной железы и лёгких. Остальные виды обследования не требуют какой-либо подготовки.
Перед радионуклидной диагностикой щитовидной железы:
- за 2 месяца до процедуры исключить все препараты, содержащие йод и пищу, им богатую;
- не принимать L-тироксин и его аналоги как минимум за 3 недели.
Перед радионуклидной диагностикой лёгких:
- минимум за 6 часов исключить приём пищи;
- не курить перед обследованием;
- во избежание получения искажённых результатов не принимать за 30 дней лекарства: антибиотики, адсорбенты, радиофармпрепараты, лекарственные средства на основе висмута, противоязвенные препараты;
- если пациент проходил процедуру эндоскопии, диагностика возможна через 7 дней после неё.
Как проводится, продолжительность обследования
Радионуклидная диагностика проводится исключительно в медицинском учреждении под наблюдением высококлассных специалистов. Перед процедурой нужно отключить мобильный телефон.
Методика радионуклидной диагностики заключается в следующем: пациенту вводится радиофармпрепарат, после чего он размещается на диагностическом оборудовании. Длительность процесса получения информации – минимум 30 минут, продолжительность напрямую зависит от вида патологии и стадии её развития. После завершения процедуры в ближайшие сутки рекомендовано обильное питьё.
Радионуклидная диагностика – уникальный способ обследования, позволяющий выявить на ранней стадии не только онкологические заболевания, но и любые другие патологии. Информативность и безопасность – главные достоинства метода. При минимальном облучении врач получает точную картину функционирования всех органов и систем.
Читайте также:


