Мутация brca при раке

В норме белки, которые кодируют эти гены, нужны, чтобы восстанавливать поврежденную ДНК. Если в них возникают дефекты, то эта функция нарушается, поврежденная ДНК не восстанавливается должным образом, в клетке накапливаются генетические поломки, и она может превратиться в раковую.
По статистике, мутации в генах BRCA1 и BRCA2 встречаются у одного из 300–800 людей. У носителей повышен риск рака молочной железы, яичников, фаллопиевых труб, брюшины, предстательной железы, поджелудочной железы, желудка, желчного пузыря и желчных протоков, меланомы. Если человек наследует некоторые мутации от обоих родителей, у него развивается анемия Фанкони, повышается риск развития некоторых злокачественных опухолей и острого миелоидного лейкоза.
Какие функции выполняют гены BRCA1 и BRCA2 в норме?
Гены BRCA1 и BRCA2 находятся в разных хромосомах — соответственно в длинном плече (q) хромосомы 17 в положении 21.31 и в длинном плече (q) хромосомы 13 в положении 13.1. Но они выполняют схожие функции.
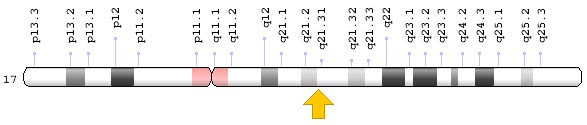
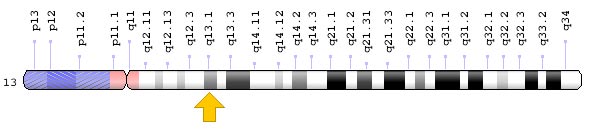
Гены BRCA играют важную роль в этом процессе. Они являются генами-супрессорами опухолей. Если в них происходят мутации, геном становится нестабильным. Из-за накопившихся генетических дефектов нормальная клетка превращается в опухолевую и дает начало злокачественному новообразованию.
Как происходит мутация, и чем это грозит?
Все мутации в генах делят на две большие группы:
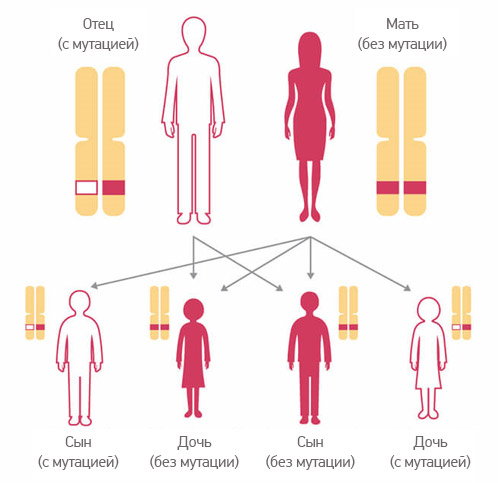
- Наследственные (герминальные) человек получает от родителей. Например, если у матери или у отца есть дефект в гене BRCA1 или BRCA2, ребенок получит его с вероятностью 50%, и он будет присутствовать во всех клетках тела. Мутация BRCA наследуется по аутосомно-доминантному типу, то есть достаточно, чтобы она присутствовала только в одной из парных хромосом. Даже если второй ген будет нормальным, функция белка нарушается, и это грозит повышенным риском рака.
- Соматические мутации возникают в течение жизни, например, из-за воздействия на организм ионизирующих излучений, химических канцерогенов. В этом случае генетический дефект возникнет только в некоторых клетках. И это тоже может привести к раку.
Насколько сильно повышается риск рака?
При мутациях в BRCA1:
- Риск развития рака молочной железы у женщин к 70 годам: 44–78%.
- Риск развития рака молочной железы у мужчин к 70 годам: 0,22–2,8%.
При мутациях в BRCA2:
- Риск развития рака молочной железы у женщин к 70 годам: 31–56%.
- Риск развития рака молочной железы у мужчин к 70 годам: 3,2–12%.
Рак молочной железы, связанный с наследственными мутациями, составляет 5–10% от всех случаев. В 35% случаев за его развитие ответственны дефекты в гене BRCA1, в 25% случаев — в гене BRCA2.
Риск заболеть раком яичников в течение жизни для среднестатистической женщины составляет около 1,3%. При мутациях в гене BRCA1 он повышается до 18–54%, в гене BRCA2 — до 2,4–19%.
Кому нужно провериться на мутации BRCA?
Консультация клинического генетика и анализы на мутации в генах BRCA показаны в следующих случаях:
- Рак молочной железы у женщины выявлен в возрасте младше 50 лет.
- Злокачественные опухоли в обеих молочных железах.
- Трижды негативный рак молочной железы: по данным иммуногистохимического исследования, на поверхности опухолевых клеток отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2.
- Медуллярный рак молочной железы — редкий гистологический тип опухоли, по статистике часто бывает связан с мутациями.
- Первично-множественные злокачественные новообразования (ПМЗН) — когда у пациента диагностируют сразу две или более разных злокачественных опухолей. Чаще всего речь идет о раке молочной железы и яичников.
- Рак яичников, маточных труб, поражение злокачественными клетками брюшины в любом возрасте.
- Рак молочной железы у мужчины.
- Мутации в генах BRCA1 и BRCA2 особенно распространены в этнической группе евреев ашкенази, им рекомендуется провериться, даже когда нет других факторов риска.
Также рекомендуется проверяться людям, у которых отягощен семейный анамнез: если рак молочной железы был диагностирован у близкой родственницы до 50 лет, рак яичников в любом возрасте, двусторонние опухоли в молочной железе, первично-множественные злокачественные опухоли, если рак молочной железы диагностирован в любом возрасте у двух близких родственниц, у родственника-мужчины.
Если есть эти факторы риска, сначала логично проверить на мутации BRCA члена семьи, у которого был диагностирован рак. Затем проводят анализы на обнаруженные мутации у его близких родственников. Детям до 18 лет эти исследования не обязательны, потому что эффективных мер профилактики в детском возрасте не существует.
Зная о наличии мутации BRCA у онкологического больного, врач может назначить более эффективное лечение, правильно оценить прогноз. У здоровых людей эта информация помогает своевременно принять некоторые меры профилактики.
Как выявить мутации BRCA?
Для этого существуют специальные анализы. На исследование можно отправить образец крови (так называемая жидкая биопсия) или фрагмент злокачественной опухоли. В крови можно обнаружить только наследственные мутации. Анализ опухолевой ткани позволяет выявить соматические мутации, которые произошли непосредственно в раковых клетках. Поэтому зачастую рекомендуется отправлять в лабораторию и образец крови, и фрагмент ткани.
Мутации выявляют разными способами, наиболее современный — метод секвенирования следующего поколения (Next-Generation Sequencing, NGS). Он позволяет выявить максимум разных генетических дефектов. Европейская клиника сотрудничает с ведущими зарубежными лабораториями, которые проводят такие исследования.
Если из лаборатории пришел положительный результат, это означает, что в опухолевых клетках есть мутация BRCA.
Если результат отрицательный, это еще не означает, что гены в клетке работают абсолютно нормально. Во-первых, мутации BRCA бывают очень разными. Большинство из них можно выявить, но некоторые редкие не изучены, и анализы их не обнаруживают. Во-вторых, даже если гены BRCA1 и BRCA2 имеют нормальную структуру, мутации, способствующие развитию рака, могут быть в других генах. Многие из них также можно обнаружить с помощью метода NGS.
Иногда результат бывает неопределенным. Это означает, что обнаружена некая мутация, но нет доказательств, что она повышает риск рака.
Если результат анализа на мутации BRCA отрицательный, но есть факторы, явно указывающие на то, что рак может быть наследственным, нужно снова проконсультироваться с клиническим генетиком. Врач решит, что делать дальше.
Что делать, если обнаружен генетический дефект? Можно ли снизить риск рака?
Женщины, у которых обнаружены мутации в генах BRCA1 и BRCA2, нуждаются в более тщательном наблюдении. Девушка должна уметь проводить самообследование молочной железы и с 18 лет делать это раз в месяц. С 25 лет рекомендуется ежегодно являться на осмотры к маммологу.
Кроме того, эксперты рекомендуют с 25 до 30 лет ежегодно проходить МРТ молочных желез, если ее невозможно выполнять — маммографию. С 30 лет показаны ежегодные маммографии и МРТ с контрастом.
Чтобы снизить риски, врач может предложить одну из двух мер:
- Профилактическое лечение тамоксифеном — гормональным препаратом, который блокирует эффекты эстрогенов.
- Профилактическое удаление молочных желез и/или яичников. После двусторонней мастэктомии риск рака молочной железы снижается на 90–95%.
Как лечат рак молочной железы с мутациями BRCA?
Наличие этих мутаций влияет на прогноз и выбор тактики лечения. У таких женщин повышен риск возникновения второй злокачественной опухоли в той же или другой молочной железе, поэтому зачастую хирурги рекомендуют двустороннюю мастэктомию, в то время как у пациентки без мутаций можно было бы обойтись органосохраняющей операцией.
Опухоли молочной железы с дефектами в генах BRCA1 и BRCA2 часто являются тройными негативными, то есть у них отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2. Такой рак сложнее лечить, против него неэффективны гормональные и некоторые таргетные препараты. Прогноз менее благоприятный.
Так как гены BRCA участвуют в репарации ДНК, то раковые клетки, в которых их функция нарушена, более чувствительны к химиопрепаратам, повреждающим ДНК, таким как цисплатин. Если опухолевые клетки имеют рецепторы к половым гормонам, они чувствительны к химиопрепаратам из группы таксанов.
Рост опухоли могут остановить ингибиторы PARP — препараты, которые нарушают восстановление поврежденной ДНК. В результате в раковых клетках накапливается еще больше мутаций, что и приводит к их гибели. К этой группе относятся препараты олапариб (Линпарза), рукапариб (Рубрака).
В Европейской клинике применяются наиболее современные анализы для выявления мутаций в генах BRCA1 и BRCA2, проводится лечение злокачественных опухолей в соответствии с современными международными протоколами. Мы знаем, как бороться с раком в сложных случаях. У нашего онколога вы можете получить консультацию, узнать о ваших рисках и о том, какие виды скрининга рекомендуется регулярно проходить в вашем случае.
Заболеваемость
Частота наследственной предрасположенности к раку молочной железы составляет около 25% всех случаев рака молочной железы. Приблизительно 5-10% случаев рака молочной железы и яичников вызваны мутациями генов BRCA1, BRCA2, CHEK2, TP53 и PTEN. Гены BRCA1 и BRCA2 высоко чувствительны при раке молочной железы, в то время как мутации в CHEK2, ATM, BRIP1 и PALB2 характерны для промежуточного риска возникновения рака молочной железы. Объединенные исследования идентифицировали другие общие варианты, связанные с низким риском возникновения рака молочной железы. Тем не менее, более 70% генетической предрасположенности к раку молочной железы остаются необъяснимыми.
Распространенность носителей мутации гена BRCA, в общем, по популяции составляет от 1/800 до 1/1000. Это обуславливает повышение риска развития рака молочной железы на 15%-20%. Распространенность мутаций генов BRCA1 или BRCA2 значительно различается у этнических групп в географических регионах. Специфические мутации и рецидивы мутаций в зависимости от популяции были описаны в Исландии, Нидерландах, Швеции, Норвегии, Германии, Франции, Испании, Канаде, странах Центральной и Восточной Европы и среди потомков евреев, выходцев из Германии.
Частота мутаций BRCA1 и BRCA2 у больных раком молочной железы и яичников, изначально не дифференцированных по признаку наследственности либо возраста, в общей массе мала: 25 лет, после получения генетической консультации и информированного согласия. Пациентов с выявленными генетическими мутациями следует поддерживать в вопросах получения генетической консультации для близких членов семьи.
Снижение рисков: нехирургические превентивные меры
Наблюдение
Наблюдение с точки зрения возникновения рака груди у носителей BRCA включает ежемесячные самопроверки, клиническое обследование груди раз или два в год, а также раз в год маммографию и магнитно-резонансную томографию (МРТ) молочной железы, начиная с 25-30 лет [IIa, B]. Пока еще нет доступных данных, чтобы определить, что более эффективно в молодом возрасте – поочередно маммография и МРТ каждые 6 месяцев либо оба обследования раз в год, учитывая высокую степень появления рака в промежутках между обследованиями.
Профилактическая химиотерапия
Адъювантный тамоксифен сокращает риск контралатерального рака груди у носителей мутаций гена BRCA [III, B], тогда как преимущества тамоксифена для предотвращения первичного рака молочной железы не были доказаны [Ib, A].
Снижение рисков: профилактические хирургические методы
Профилактическая двусторонняя мастэктомия — наиболее эффективная из известных на сегодня стратегий по сокращению риска развития рака груди у носителей мутации гена [III, B], хотя не отмечены преимущества в выживании, и многие женщины не считают эту стратегию приемлемой по косметическим соображениям. Контралатеральная профилактическая мастэктомия — вариант к рассмотрению для носителей мутации BRCA с раком груди в раннем возрасте и односторонней мастэктомией [IV, C].
Типы профилактической мастэктомии могут быть от тотальной мастэктомии до кожесохраняющей и сосковосохраняющей мастэктомии. Различные варианты реконструкции молочной железы должны быть обсуждены с пациентом и включая преимущество и риски для каждого.
На сегодняшний день недостаточно доказательств для рутинного выполнения биопсии сторожевого лимфатического узла у пациентов, подвергшихся профилактической мастэктомии.
Профилактическая двусторонняя сальпингоовариэктомия
Операция связана со снижением риска рака молочной железы у носителей мутации гена BRCA в пременопаузе, риска снижения рецидива ипсилатерального рака молочной железы после органосохранной операции и лучевой терапии, риска снижения рака яичников и гинекологических опухолей, а также имеются доказательства снижения общей смертности.[III, B]. Двусторонняя сальпингоовариэктомия рекомендована после 35 лет и в тех случаях, когда беременность больше не планируется [IV, C].
Кратковременная гормонозаместительная терапия после двусторонней сальпингоовариэктомии, по-видимому, не снижает общих преимуществ данной стратегии для уменьшения риска заболевания раком молочной железы [III, B].
Модификаторы риска
Риск BRCA-ассоциированного рака молочной железы может быть изменен внешними факторами. Гормональные и репродуктивные факторы, такие как беременность (количество беременностей и возраст в первую беременность), грудное вскармливание и оральные противозачаточные средства связаны с риском модификации у носителей мутации BRCA. Количество родов в анамнезе, кажется, снижает риск развития рака молочной железы у женщин с мутациями BRCA в общей популяции. [III, B].
Органосохранная операция и лучевая терапия у носителей BRCA мутаций, которые подверглись профилактической овариэктомии, ассоциирована с подобной формой развития рецидивного рака молочной железы по сравнению с контролем в течение 10 лет. Риск развития контралатерального рака молочной железы у носителей BRCA выше по сравнению со спорадическим контролем, независимо от гормонального вмешательства.
Решение о хирургическом лечении рака молочной железы у носителей мутации BRCA должно основываться на тех же параметрах, как и при спорадических случаях диагностики рака, при этом принимая во внимание более высокую степень риска двустороннего рака молочной железы, и ипсилатерального рецидива если за органосохранным оперативным лечением следует лучевая терапия без выполнения овариэктомии [III, B].
Системное лечение
Согласно последним данным, общий прогноз рака молочной железы у носителей BRCA мутаций такой же, как и при спорадическом раке молочной железы, а отсутствие мутации BRCA1/2, считается прогнозирующим фактором химиочувствительности опухоли [III, B].
Продолжается II фаза рандомизированного клинического исследования по изучению чувствительности к платино-содержащей химиотерапии при BRCA ассоциированных метастатических опухолях по сравнению с таксан-содержащими режимами.
Ингибиторы PARP используются как единственные терапевтические агенты для пациентов с BRCA ассоциированным раком молочной железы и яичников. Эти препараты ингибируют путь репарации однонитевого разрыва ДНК и приводят к апоптозу в BRCA дефицитных опухолевых клетках, которые уже имеют дефицит в гомологичной рекомбинантной репарации. Некоторые клинические исследования II фазы изучают недостаток специфической репарации ДНК в BRCA ассоциированных опухолях с использованием ингибиторов PARP при метастатическом процессе.
Два клинических исследования II фазы с применением орального ингибитора PARP — олапариба при местно распространенном раке молочной железы и раке яичников с BRCA мутацией недавно показали поддерживающий клинический эффект при применении 400мг препарата непрерывно (процент ответивших: 41% и 33%, и безрецидивная выживаемость составила 5.7 и 5.8 месяцев, соответственно).
До сих пор не имеется окончательных выводов о лучших режимах химиотерапии для пациентов с BRCA ассоциированным раком молочной железы [III, B]. В настоящее время при выборе адъювантного лечения для больных раком молочной железы с наличием BRCA мутации должны использоваться стандартные прогностические факторы.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
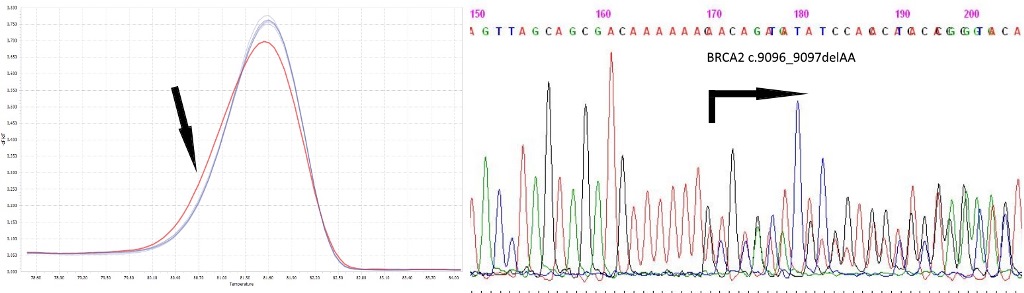
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.



Эпидемиология мутаций в генах BRCA1 и BRCA2
Частота встречаемости BRCA мутаций в популяции – 1:800-1:1000, при этом она зависит от географической локализации и этнической группы. При раке яичников мутации генов BRCA 1/2 выявляются в 10-15% случаев.
Роль мутаций в генах BRCA1 и BRCA2
Гены BRCA1/2 относятся к группе генов-супрессоров, вовлеченных в процесс гомологичной репарации двунитевых разрывов ДНК.
Наличие клинически значимых мутаций в генах BRCA1 или BRCA2 вызывает потерю функции белков, кодируемых этими генами, в результате чего нарушается основной механизм репарации двунитевых разрывов ДНК. Альтернативные пути репарации (BER, NHEJ) не способны полностью исключить накопление большого числа ошибок в первичной структуре ДНК (геномная нестабильность), следствием чего является повышенный риск возникновения некоторых злокачественных новообразований (рака молочной железы, рака яичников, рака простаты, рака поджелудочной железы) (рис. 1).
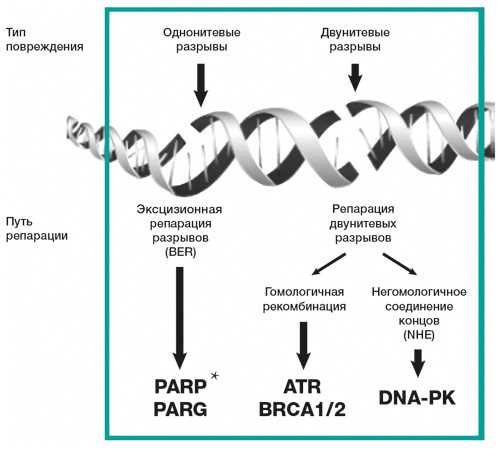
Определение мутации генов BRCA1 и BRCA2
* не входит в Программу
При мутации BRCA1/2 эффективной стратегией лечения является применение PARP-ингибитора олапариба. В случаях, когда блокируется фермент PARP, клетки не могут эффективно восстанавливать однонитевые разрывы. Во время репликации ДНК эти однонитевые разрывы переходят в двунитевые. Накопление двунитевых разрывов при нарушении их восстановления в случае мутации BRCA1/2 ведет к селективной гибели опухолевых клеток.
Прогрессированием рака яичников считается наличие любого из нижеуказанных критериев:
- Рост СА-125, подтвержденный повторным анализом с интервалом не менее 1 недели (маркерный рецидив):
- в два раз выше верхней границы нормы, если ранее он находился в пределах нормы;
- в два раза выше своего наименьшего значения, зарегистрированного во время проводимого лечения, если нормализации СА-125 не зафиксировано.
- Клинически или радиологически подтвержденное прогрессирование.
- Рост клинически или радиологически подтвержденным прогрессированием.
Платиночувствительным считается рецидив при длительности бесплатинового интервала (интервала от последнего введения препарата платины) более 6 месяцев.
- Персонализированной подход к выбору терапии, основанный на результатах молекулярно-генетического тестирования, позволит повысить эффективность лечения рака яичников:
- Наличие клинически значимых мутаций BRCA1/2 позволяет определить пациенток, у которых наиболее эффективна терапия PARP-ингибиторами (олапариб);
- Наличие мутаций BRCA1/2 дает возможность прогнозировать эффективность различных режимов химиотерапии.
- Знание статуса BRCA позволит более точно определить прогноз заболевания.
- Выявление мутаций BRCA1/2 у больных раком яичников определяет необходимость обследования их родственников для выявления здоровых носителей мутации BRCA1/2 и обеспечения диагностики злокачественных новообразований на ранних стадиях, когда лечение наиболее эффективно.
Таблица 1. Наиболее часто встречающиеся мутации у пациенток с раком яичников.
| Мутация | Частота встречаемости | |
|---|---|---|
| BRCA1 | ||
| 1 | 5382insC | 68,8% |
| 2 | 4153delA | 12,5% |
| 3 | 300T>G | 6,3% |
| 4 | 185delAG | 1,6% |
| 5 | 2080delA | 3,1% |
| 6 | 3819delGTAAA | 3,1% |
| 7 | 3875delGTCT | 1,6% |
| BRCA2 | ||
| 8 | 6174delT | 4,8% |
Отрицательный результат теста на частые мутации не гарантирует отсутствие других мутаций в этих генах. При наличии другого злокачественного образования в анамнезе у самой пациентки (рак молочной железы и др.), семейного анамнеза (рак молочной/грудной железы, рак яичников, рак предстательной железы, рак поджелудочной железы и др. у ближайших родственников), рекомендовано проведение консультации клинического генетика.
Для качественного оказания помощи больным раком яичников важно взаимодействие всех специалистов, вовлеченных в процесс выбора режима терапии.
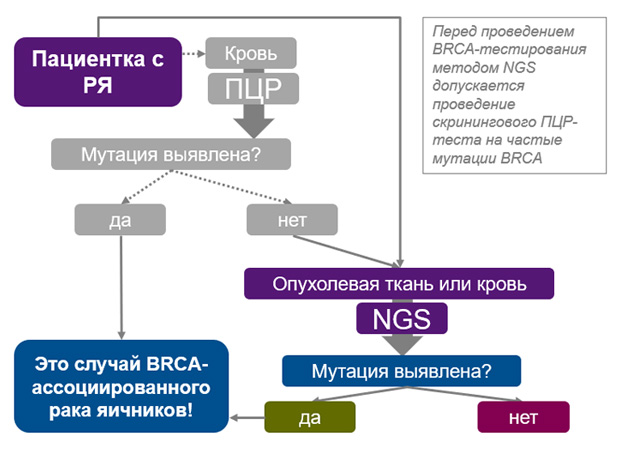
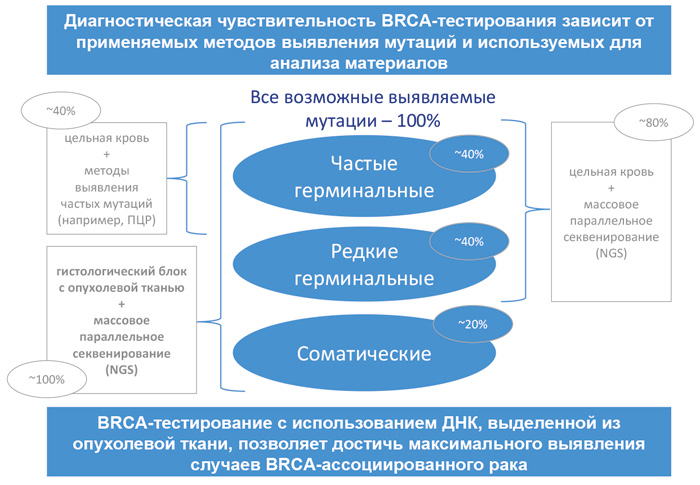
Отправка на BRCA-тестирование только здоровой ткани (например, крови) позволяет выявить только герминальные мутации; отправка опухолевой и здоровой ткани позволяет выявить и герминальные и соматические мутации с определением их характера. Соматические мутации генов BRCA выявляются в 6-8% случаев серозного РЯ высокой степени злокачественности и составляют не менее 20% случаев BRCA-ассоциированного рака яичника. Соматические мутации также определяют характер и тактику лечения.
Рекомендуется направлять на BRCA-тестирование одновременно и опухолевый материал пациентки, и здоровую ткань (кровь). Такой подход позволяет с максимальной чувствительностью выявлять случаи BRCA-ассоциированного рака яичников, а также определять герминальный или соматический характер мутации, что может быть важно для дальнейшей диагностики родственников пациенток.
- Balmana J, Diez O, Rubio IT, Cardoso F. Ann Oncol 2011; 22 (Suppl 6): vi31-vi34.
- Е.Н. Имянитов. Практическая онкология. 2010; Т.11, №4: 258-266.
- Любченко Л.Н., Батенева Е.И., Абрамов И.С., Емельянова М.А., Будик Ю.А., Тюляндина А.С., Крохина О.В., Воротников И.К., Соболевский В.А., Наседкина Т.В., Портной С.М. Наследственный рак молочной железы и яичников. Злокачественные опухоли. 2013; (2): 53-61. DDOOII::1100.18027/2224-5057-2013-2-53-61.
- Jackson SP. Drug Discovery World, 2003; Fall: 41-45.
- Л.Н. Любченко, Е.И. Батенева. Медико-генетическое консультирование и ДНК-диагностика при наследственной предрасположенности к раку молочной железы и раку яичников. Пособие для врачей. М.: ИГ РОНЦ, 2014. 64 с.
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Читайте также:

