Мукоэпидермоидный рак слюнной железы гистологическая картина
Похожие темы научных работ по клинической медицине , автор научной работы — Джумабаев А., Осумбеков Б., Мамаякупуулу Д.
ОПУХОЛИ СЛЮННЫХ ЖЕЛЕЗ TUMORS OF SALIVARY GLANDS
А. Джумабаев', Б. Осумбеков2, Д. Мамаякуп-уулу2
МУКОЭПИДЕРМОИДНЫЕ ОПУХОЛИ СЛЮННЫХ ЖЕЛЕЗ
' Ошский межобластной онкологический центр Министерства здравоохранения Республики Кыргызстан, Ош, Кыргызстан 2 Ошский государственный университет, Ош, Кыргызстан
Обоснование. Опухоли слюнных желез составляют небольшую по численности, но достаточно разнородную группу. Их доля в структуре онкологических заболеваний составляет
1—5%, мукоэпидермоидные опухоли диагностируют в 2—22% случаев.
Цель. Повышение отдаленных результатов лечения больных с мукоэпидермоидными опухолями за счет индивидуализации тактики лечения.
Материалы и методы. В исследование включены 176 больных с гистологически подтвержденными мукоэпидермоидными опухолями слюнных желез.
Результаты. В исследуемую группу входили 72 мужчины и 104 женщины. Возраст большинства больных составил 31—60 лет. Опухоли больших слюнных желез зарегистрированы у 134 (76,1%) больных, малых слюнных желез — у 42 (23,9%). В 62 (35,2%) случаях опухоли имели высокую степень дифференцировки. Умереннодифференцированные опухоли выявлены у 44 (25,0%) больных. В 70 (39,8%) случаях преобладали эпидермоидные клетки. Высокодифференцированные опухоли характеризовались медленным ростом, редким ме-тастазированием, длительным течением заболевания, низкодифференцированные — быстрым ростом, более частым ме-тастазированием, небольшой продолжительностью болезни. Умереннодифференцированные опухоли имеют тенденцию к прогрессирующему течению заболевания. Лечение получил 171 больной. Комбинированное лечение проведено 89 больным и включало предоперационную лучевую терапию (СОД 35— 40 Гр) и хирургическое вмешательство через 3—4 нед после лучевого лечения. Клинический эффект лучевой терапии можно было оценить как хороший лишь в 25% случаев. Хирургическое лечение проведено 72 больным, лучевая терапия —2 больным. В 6 случаях применяли криохирургические методы.
Выводы. Соответствие клинических и морфологических данных указывает на зависимость клинического течения от гистологического строения мукоэпидермоидных опухолей. Оптимальным методом лечения является комбинированный. Объем хирургического вмешательства определяется степенью дифференцировки опухоли.
A. Jumabaev1. B. Osumbekov2, J. Mamajakyp-uulu2
MUCOEPIDERMOID TUMORS OF SALIVARY GLANDS
' Osh Interregional Center of Oncology of the Ministry of Health of the Republic of Kyrgyzstan. Osh. Kyrgyzstan 2 Osh State University. Osh. Kyrgyzstan
Background. Tumors of salivary glands compose a small, but variable group of tumors and are 1 to 5% of all cancers, mucoepidermoid tumors are diagnosed in 2 to 22% of them.
Purpose. To improve long-term results of treatment of patients with mucoepidermoid tumors of salivary glands using individually based treatment measures.
Material and methods. The research is based on 176 histologically verified cases of mucoepidermoid tumors of salivary glands.
Results. The group of patients consisted of 72 men and 104 women. Most of them were at the age 31 to 60 years. Tumors of big salivary glands were found in 134 (76.1%), small salivary glands in 42 cases (23.9%). Well differentiated tumors were found in 62 cases (35.2%). Moderately differentiated type was represented in 44 cases (25.0%). Epidermoid cells were prevalent in 70 cases (39.8%). Well differentiated tumors are characterized by low growth, rare metastasis, long existing tumors; poorly differentiated tumors demonstrate rapid growth, more frequent metastasis, short duration of the disease; moderately differentiated tumors have a tendency to progressive course of the disease. Treatment was given to 171 patients. Combined treatment was used more often (89 cases) and consisted of preoperative radiotherapy at total focal doses 35 to 40 Gy and surgery at 3 to 4 weeks following radiotherapy. Good clinical effect of radiotherapy was noted only in 25% of cases. Surgical treatment was used in 72 patients. Radiotherapy was used in 2 cases. Cryotherapy was used in 6 cases.
Conclusions. Clinical and morphological matching was indicative of dependence of clinical features of mucoepidermoid tumors upon variant of their histological structure. Combined treatment is the optional method. The volume of the surgery should be defined according to the degree of tumor differentiation.
КЛИНИЧЕСКИЕ АСПЕКТЫ РЕЦИДИВНЫХ ОПУХОЛЕЙ СЛЮННЫХ ЖЕЛЕЗ
МГМСУ, Москва, Российская Федерация
Проанализированы результаты лечения 116 больных с рецидивными опухолями околоушной слюнной железы (42 мужчины и 74 женщины), получавших лечение с 1980 по 2008 г. Возраст больных составил 16—83 года. Рецидивы доброкачественных опухолей выявлены у 71 пациента, злокачественных — у 45. Все доброкачественные новообразования имели строение плео-морфной аденомы. У 44 пациентов был 1 рецидив заболевания, у 21 — 2, у остальных — 3—5. В 66% случаев рецидивная опухоль локализовалась позади нижней челюсти или спереди от ушной раковины и появлялась через 6 мес — 10 лет после первичного лечения. Среди больных с рецидивами злокачественных опухолей околоушной слюнной железы у 14 был мукоэпидермоидный рак, у 10 — цистаденокарцинома, у 9 — аденокарцинома, у 5 — ацинозноклеточный рак, у 5 — рак из смешанной опухоли, еще у 2 — саркомы. Диагноз во всех случаях был подтвержден данными цитологического или гистологического исследования. Чаще всего (в 90—96% случаев) рецидив как доброкачественной, так и злокачественной опухоли проявлялся объемным образованием околоушной слюнной железы. У 10% больных доброкачественными опухолями и у 27% больных злокачественными опухолями отмечались боли. У 40% больных с рецидивами злокачественных опухолей околоушной слюнной железы выявлены регионарные и отдаленные метастазы. Проведенный анализ свидетельствует
о сложности клинической картины рецидивных опухолей околоушной слюнной железы и необходимости тщательного обследования больных.
О. Саприна, М. Кропотов, В. Любаев, Т. Кондратьева,
ТАКТИКА ЛЕЧЕНИЯ АЦИНОЗНОКЛЕТОЧНОЙ КАРЦИНОМЫ СЛЮННЫХ ЖЕЛЕЗ
РОНЦ им. Н. Н. Блохина РАМН, Москва, Российская Федерация
Цель. Оценить эффективность хирургического и комбинированного лечения ацинозноклеточной карциномы слюнных желез.
Материалы и методы. С 1969 по 2008 г. в РОНЦ им. Н. Н. Блохина РАМН наблюдали 29 больных ацинознокле-точной карциномой слюнных желез. В течение 5 и 10 лет прослежены 27 пациентов. У 2 больных срок наблюдения составил 2 года. По стадиям больные распределены следующим образом: I стадия — 13 (44,8%) больных, II —7 (24,1%), III — 8 (27,6%), IV —
1 (3,5%). Хирургическое лечение проведено 19 (65,5%) больным (1-я группа), комбинированное лечение, включающее хирургическое вмешательство с пред- или послеоперационной дистанционной лучевой терапией (СОД 40—50 Гр), — 10 (34,5%) (2-я группа). Распространенность опухолевого процесса в обеих группах была сопоставима.
Результаты. В течение 5 лет были живы все больные. В сроки от 4 до 20 лет у 4 (21%) больных 1-й группы и 2 (20%) больных
CLINICAL ASPECTS OF RECURRENT SALIVARY GLAND TUMORS
MSUMD, Moscow, Russian Federation
We have analyzed treatment outcomes in 116 patients with recurrent tumors of parotid salivary gland (42 men and 74 women) managed during 1980 through 2008. Patient age was 16 to 83 years. Recurrent benign tumors were reported in 71 and recurrence of malignant tumors was detected in 45 patients. All the benign tumors had pleomorphic adenoma structure. One disease recurrence was detected in 44, 2 recurrences in 21 and 3 to 5 recurrences in the remaining cases. In 66% of cases the recurrent tumor was located behind the mandible or in front of the auricle and appeared at 6 months to 10 years after primary treatment. The recurrent malignant tumors of parotid salivary gland included 14 mucoepidermoid carcinomas, 10 cystadenocarcinomas, 9 adenocarcinomas, 5 acinic-cell carcinomas, 5 mixed type cancers and 2 sarcomas. The diagnosis was confirmed by cytology or histology in all cases. Recurrences of both benign and malignant tumors most frequently (90 to 96%) looked as mass lesions of parotid salivary gland. Ten percent of patients with benign tumors and 27% of patients with malignant tumors complained of pain. Forty percent of patients with malignant tumors of parotid salivary gland developed regional and distant metastas-es. This analysis confirms that recurrent tumors of parotid salivary glands have complex clinical pattern and the patients should be examined most carefully.
O. Saprina. M. Kropotov. V. Lyubayev. T. Kondratyeva. Y. Sedova
TREATMENT OF ACINIC-CELL CARCINOMA OF SALIVARY GLANDS
N. N. Blokhin RCRC RAMS. Moscow. Russian Federation
Aim. To assess efficacy of surgical and multimodality treatment for acinic-cell carcinoma of salivary glands.
Materials and methods. A total of 29 patients with acinic-cell carcinoma of salivary glands were managed at the N. N. Blokhin RCRC RAMS during 1969 through 2008. Twenty seven patients were followed up for 5 and 10 years. Two patients were followed up for
2 years. Case distribution with respect to disease stage was, as follows: 13 patients (44.8%) had stage I, 7 patients (24.1%) had stage II, 8 patients (27.6%) had stage III and 1 patient (3.5%) had stage IV disease. Surgical treatment was given to 19 patients (65.5%, group 1), multimodality treatment including surgery with pre- or postoperative distant radiotherapy at a total tumor dose 40 to 50 Gy was given to 10 patients (34.5%, group 2). The study groups were well balanced with respect to disease advance.
Results. All patients survived 5 years. Four patients (21%) from group 1 and 2 patients (20%) from group 2 relapsed within 4 to 20 years. The 10-year lethality due to disease progression was 3.4% in both groups, and 10% in the multimodality treatment group. The
2-й группы выявлены рецидивы. Летальность вследствие прогрессирования основного заболевания в течение 10 лет составила 3,4% в обеих группах и 10% в группе больных, получивших комбинированное лечение. Таким образом, 10-летняя выживаемость после хирургического лечения составила 100%, после комбинированного 90%.
Выводы. Ацинозноклеточная карцинома — высокодифференцированная злокачественная опухоль слюнных желез с медленным течением. Статистически достоверных различий 5- и 10-летней выживаемости больных, которым проведено хирургическое и комбинированное лечение, не отмечено. Комбинированное лечение, по-видимому, следует рекомендовать при III—IV стадиях заболевания и при неблагоприятном прогнозе. Больным ацинозноклеточной карциномой слюнных желез I—II стадий показано хирургическое лечение.
Ю. Седова, Г. Синюкова, Л. Костякова, И. Пиличук, О. Бочкарева
ВОЗМОЖНОСТИ ДОППЛЕРОГРАФИИ В ДИАГНОСТИКЕ НОВООБРАЗОВАНИЙ СЛЮННЫХ ЖЕЛЕЗ
РОНЦ им. Н. Н. Блохина РАМН, Москва, Российская Федерация
Цель. Определить возможности допплерографии в дифференциальной диагностике новообразований слюнных желез.
Материалы и методы. Обследованы 30 пациентов (15 мужчин и 15 женщин) в возрасте 23—80 лет. Исследование проводили с использованием режимов серой шкалы, тканевой гармоники, цветового допплеровского картирования (ЦДК) и энергетического картирования (ЭДК).
Результаты. При оценке спектральных показателей артериального кровотока в опухоли мы получили следующие данные. При доброкачественных опухолях средний индекс резистентности (ИР) был равен 0,65, пиковая систолическая скорость (РБ) — 13,65 см/с, при злокачественных опухолях эти показатели составили 0,58 и 20,77 см/с соответственно. При этом максимальный ИР при доброкачественных опухолях составил 0,93, минимальный 0,13, при злокачественных опухолях — 0,02 и 1,44 соответственно. Значения РБ при доброкачественных опухолях колебались от 9,2 до 18,5 см/с, при злокачественных — от 11,5 до 62,7 см/с. Таким образом, ИР и РБ при доброкачественных и злокачественных опухолях находились практически в одних пределах.
Выводы. Изменения спектральных показателей являются неспецифическими. На их основании нельзя проводить дифференциальную диагностику доброкачественных и злокачественных опухолей слюнных желез.
10-year survival was therefore 100% in the surgical treatment group vs. 90% in the multimodality treatment group.
Conclusions. Acinic-cell carcinoma of salivary glands is a well differentiated tumor with slow course. There were no statistically significant differences in the 5- or 10-year survival between the surgical treatment and multimodality treatment groups. Multimodality treatment may therefore be recommended in stage III — IV disease and in cases with poor prognosis. Surgery is indicated to patients with stage I — II acinic-cell carcinoma of salivary glands.
Y. Sedova. G. Sinyukova. L. Kostyakova. I. Pilipchuk. O. Bochkareva
DOPPLER ULTRASOUND IN THE DIAGNOSIS OF SALIVARY GLAND TUMORS
N. N. Blokhin RCRC RAMS. Moscow. Russian Federation
Aim. To define potentials of Doppler ultrasound in differential diagnosis of salivary gland tumors.
Materials and methods. A total of 30 patients (15 men and 15 women) aged 23 to 80 years were enrolled in the study. The study involved gray scale techniques, tissue harmonics, color Doppler mapping (CDM) and energy mapping (EM).
Results. The following findings were made as a result of spectral analysis of tumor arterial blood flow. Mean resistance index (RI) in benign tumors was 0/65, peak systolic (PS) rate was 13.65 cm/s, the respective rates for cancer were 0.58 and 20.77 cm/s. In benign tumors maximal RI was 0.93 and minimal RI was 0.13, vs. 0.02 and 1.44 respectively for cancer. PS ranged 9.2 to 18.5 cm/s in benign tumors vs. 11.5 to 62.7 cm/s in cancer. Therefore, the RI and PS values in benign tumors and cancer were within similar ranges.
Conclusions. Changes in spectral parameters are not specific. They cannot be used as criteria for differentiation between benign tumors and cancer of salivary glands.
Е. Чойнзонов, М. Авдеенко
ФУНКЦИОНАЛЬНО-ЩАДЯЩЕЕ ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ОКОЛОУШНОЙ СЛЮННОЙ ЖЕЛЕЗЫ С ПОСЛЕОПЕРАЦИОННОЙ ЛУЧЕВОЙ ТЕРАПИЕЙ
НИИ онкологии СО РАМН, Томск, Российская Федерация
В последнее время в онкологии все большее внимание уделяется внедрению органосохраняющих и функционально-щадящих методик лечения. Нами изучена возможность функционально-щадящего хирургического лечения злокачественных новообразований околоушной слюнной железы в комбинации с послеоперационной лучевой терапией. Мы наблюдали 28 пациентов, которым на I этапе комбинированного лечения выполнено хирургическое вмешательство в объеме фасциально-футлярного иссечения клетчатки шеи и паротидэк-томии с сохранением лицевого нерва. На II этапе комбинированного лечения проводили лучевую терапию с использованием разных видов ионизирующего излучения. Контрольную группу составили 19 больных, которым во время операции лицевой нерв не сохраняли. Анализ эффективности лечения в зависимости от объема хирургического вмешательства на первичном очаге показал, что в группе функционально-щадящего лечения 1-летняя кумулятивная выживаемость составила 89,2 ± 5,8%, 3-летняя — 78,4 ± 7,8%, 5-летняя — 59,9 ± 10%. В контрольной группе эти показатели составили 67,6 ± 10,8; 45 ± 11,7 и 39,4 ± 11,5% соответственно. Однолетняя безрецидивная выживаемость оказалась выше в группе функционально-щадящего лечения по сравнению с контрольной группой (82,1 ± 7,2 и 63,2 ± 11% соответственно). В группе функционально-щадящего лечения 3- и 5-летняя безрецидивная выживаемость составила 57,9 ± 11,3 и
52,6 ± 11,5%, в контрольной группе — 52,6 ± 9,5 и 48 ± 9,7% соответственно. Функционально-щадящие вмешательства позволили добиться удовлетворительного косметического эффекта и исключить такое послеоперационное осложнение, как ксероф-тальм. Таким образом, функционально-щадящее хирургическое лечение в сочетании с послеоперационной лучевой терапией не снижает общую и безрецидивную выживаемость, что позволяет говорить о целесообразности выполнения данных хирургических вмешательств.
E. Choinzonov. M. Avdeyenko
FUNCTION SPARING TREATMENT FOR PAROTID TUMORS WITH POSTOPERATIVE RADIOTHERAPY
Cancer Research Institute SD RAMS. Tomsk. Russian Federation
Over recent years cancer treatment is increasingly focusing on organ- and function-sparing modalities. We have studied feasibility of function-sparing surgical treatment for cancer of the parotid gland in combination with postoperative radiotherapy. A total of 28 patients received multimodality treatment starting with surgery involving fascial compartmental dissection of cervical cellular tissue and parotidectomy with facial nerve preserved. Then followed radiotherapy with a variety of ionizing radiation types. The control group was composed of 19 patients undergoing surgery without preservation of the facial nerve. Analysis of treatment outcomes with respect to surgery type demonstrated a 1-year overall survival of 89.2 ± 5.8%, a 3-year survival of 78.4 ± 7.8%, and a 5-year survival of 59.9 ± 10% in the function-sparing surgery group. The respective rates in the control group were 67.6 ± 10.8, 45 ± 11.7 and 39.4 ± 11.5%. The 1-year disease-free survival was higher in the function-sparing surgery group than in the control (82.1 ± 7.2 vs. 63.2 ± 11%, respectively). The 3- and 5-year disease-free survival rates were 57.9 ± 11.3 and
52.6 ± 11.5%, respectively, in the function-sparing surgery group vs.
52.6 ± 9.5 h 48 ± 9.7%, respectively, in the control. The functionsparing operations provided satisfactory cosmetic outcomes and allowed postoperative xerophthalmus to be avoided. Therefore, function-sparing surgery in combination with postoperative radiotherapy does not reduce overall or disease-free survival and is a reasonable treatment in the patient category in question.
Низкодиффереицированные формы мукоэпидермоидиых опухолей характеризуются солидным строением, преобладанием эпидермоидных клеток, отсутствием кист. Строма, как правило, фиброзирована.
Положение мукоэпидермоидиых опухолей в Международной классификации опухолей слюнных желез ВОЗ (1972) и их оценка как потенциально злокачественных могут быть подвергнуты сомнению. По мнению большинства исследователей, высокодиффереицироваиные мукоэпидермоидные опухоли не являются доброкачественными. Об этом свидетельствуют постоянно обнаруживаемые в них признаки иифнльтративиого роста и возможность метастазирования. Считают, что мукоэпидермондные опухоли у детей протекают менее благоприятно.
Типичные варианты мукоэпидермоидных опухолей обычно не трудны для распознавания. Трудности возникают при типировании высокодифференцированных мукоэпидермоидиых опухолей в кистозном их варианте. Однородный по структуре характер выстилки и отсутствие признаков инфильтративного роста помогают отличить кисту от мукоэпидермоидной опухоли. Не менее сложна диагностика низкоднфференцированных мукоэпидермоидных опухолей со значительным преобладанием эпидермоидных клеток. В этом случае правильному диагнозу способствует выявление слизеобразующих клеточных элементов с помощью дополнительных методов окраски. Кроме того, необходимо помнить, что ороговение, а тем более образование роговых жемчужин мукоэпидермоидиым опухолям не свойственно.
Считают, что мукоэпидермоидные опухоли возникают из эпителия междольковых и крупных выводных протоков, эпителиальная выстилка которых ие содержит миоэпителиальиых клеток. Особенности развития и регенерации слюнных желез показывают возможность дифференцировки протокового эпителия в сторону слизеобразующих и эпидермоидных клеток. Указанные варианты функциональной дифференцировки в мукоэпидермоидной опухоли подтверждены данными электронно-микроскопического исследования. Возможно, слизеобразующие клетки являются отражением варианта дифференцировки опухолевых клеток в концевые слизистые секреторные отделы слюнных желез.
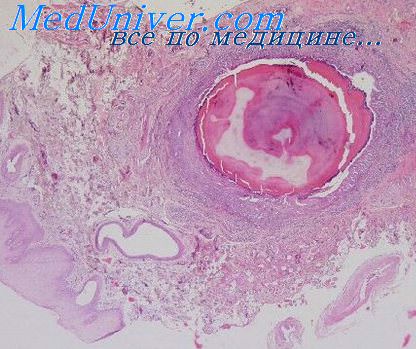
Ацинозно-клеточная опухоль (ацинозно-клеточная аденокарцииома), как и мукоэпидермоидная, занимает в Международной классификации промежуточное положение между аденомами и раком, что означает отсутствие единого мнения в отношении биологической сущности новообразования и прогноза заболевания.
Основным признаком ацинозно-клеточных опухолей считается сходство опухолевых клеток с серозными ацинарными элементами концевых отделов слюнных желез. Это подтверждено исследованием ультраструктуры данных новообразований.
Подавляющее большинство опухолей подобного строения возникает в околоушной железе, составляя 1,8—4% эпителиальных образований данной локализации. Среди больных преобладают женщины среднего возраста. Описаны крайне редкие случаи ацинозно-клеточных опухолей у детей.
Макроскопически в большинстве наблюдений серовато-коричневый узел опухоли нечетко отграничен от окружающей ткани слюнной железы, нередко имеет дольчатый вид.
Микроскопически опухоль представлена солидными пластами из округлых и полигональных клеток с зернистой обильной цитоплазмой и компактным ядром. Цитоплазма характеризуется различной степенью базофилии при обычной окраске. Клеточные элементы часто имеют четко очерченные границы. Зернистость цитоплазмы ярко выявляется при ШИК-реакции. Иногда накопление секрета внутри клетки сопровождается образованием крупной вакуоли — вакуолизированиые клетки. В редких случаях опухолевые клетки принимают кубическую форму и образуют подобие железистых просветов. При некоторых наблюдениях накопление секрета между клетками ведет к образованию решетчатых, фолликулоподобных структур.
Иногда в опухолях наряду с указанными имеются более мелкие клетки, утратившие четкие контуры и характеризующиеся менее выраженной зернистостью цитоплазмы. Иногда такие клетки преобладают что затрудняет постановку правильного диагноза. В этих же случаях чаще отмечается полиморфизм ядер, обнаруживаются фигуры митоза. Выявление специфической характерной зернистости цитоплазмы при проведении ШИК-реакции позволяет правильно типировать новообразование подобного строения.
Как правило, при микроскопическом исследовании ацинозно-клеточных опухолей выявляются признаки инфильтративного роста. Строма опухоли характерная и представлена узкими фиброваскулярными прослойками с тонкостенными сосудами капиллярного типа. Встречаются очаги некроза, кровоизлияний, кальцинации. Иногда, преимущественно по периферии опухоли, отмечается лимфоидная инфильтрация стромы. Чаще всего полиморфизм ядер, некрозы сочетаются с менее дифференцированными опухолевыми клетками, имеющими меньшее количество секреторных гранул н нечеткие контуры цитоплазмы. В случаях с преобладанием менее дифференцированных клеток чаще отмечают формирование фолликуло- и железисто-подобных структур. Строма опухоли также утрачивает характерные черты.
Ранее исследование ацинозно-клеточных опухолей сводилось к изучению единичных наблюдений или небольшого числа случаев, что несомненно затрудняло оценку данного новообразования. В последние годы появились работы, в которых проводится анализ значительного числа опухолей.
Наибольшая серия наблюдений составляет 294 больных (Ellis G L . Corio R L . 1983), причем в нее вошли и те, что были описаны в известной работе Abrams и соавт (1965). Таким образом появилась реальная возможность детального анализа особенностей клинического течения заболевания. Это позволило обоснованно подойти к оценке значимости тех или иных структурных вариантов и биологической сущности опухоли в целом. Большинство исследователей считают, что учет особенностей строения ацинозно-клеточных опухолей не дает возможности выделить из их числа доброкачественные новообразования. При любой структуре возможно возникновение рецидивов, регионарных и отдаленных метастазов, что и диктует необходимость оценки ацинозно-клеточных опухолей как аденокарцином низкой степени злокачест венности. Опухоли солидного строения, построенные из дифференцированных клеток, характеризуются более благоприятным прогнозом.
Распознавание ацинозно-клеточных опухолей типичного строения обычно не вызывает затруднений. Основные трудности возникают при дифференци альной диагностике ацинозно-клеточных опухолей с фолликулярными структурами, вакуолизированными и менее дифференцированными клетками со слабо зернистой цитоплазмой и высокодифференцированными аденокарциномами с разнообразными типами клеток. Основными диагностическими признаками ацинозно-клеточных опухолей являются преимущественно солидное строение, отсутствие железистых структур, однородность опухолевых клеток и их сходство с серозными ацинарными клетками слюнных желез, зернистость цитоплазмы, хорошо выявляемая с помощью ШИК-реакции и отражающая специфическую секреторную функцию опухолевых клеток.
В настоящее время преобладает мнение о возникновении ацинозно-клеточных опухолей из терминальных отделов протоковой системы и элементов вставочных протоков.
- Причины рака слюнной железы и группы риска
- Симптомы заболевания
- Методы диагностики
- Классификация: типы рака слюнной железы
- Стадии заболевания
- Лечение
- Осложнения и рецидивы
- Прогноз жизни при разных стадиях рака и профилактика
Слюнные железы вырабатывают слюну — жидкость, находящуюся в ротовой полости и выполняющую некоторые важные функции: смачивание слизистой оболочки, пищи, облегчение артикуляции, глотания, защиту от болезнетворных бактерий и пр. Выделяют две группы слюнных желез:
- Большие: подъязычные, околоушные, подчелюстные.
- Малые имеют микроскопическое строение, разбросаны по всей ротовой полости — всего их насчитывается несколько сотен.
Рак может развиваться во всех этих железах. Чаще всего (в 7 из 10 случаев) доброкачественные и злокачественные опухоли возникают в околоушных слюнных железах. Примерно 1–2 опухоли из десяти приходятся на подчелюстные слюнные железы, в 50% случаев они имеют злокачественный характер. В редких случаев рак развивается в подъязычной или мелких слюнных железах.
Причины рака слюнной железы и группы риска
Выделяют некоторые факторы риска, повышающие вероятность развития злокачественной опухоли:
- Чем старше человек, тем больше накапливается изменений в его генах, тем выше вероятность развития различных типов рака.
- У мужчин рак слюнной железы бывает чаще, чем у женщин.
- Облучение головы. Например, это может быть ранее перенесенный курс лучевой терапии, воздействие ионизирующих излучений на рабочем месте.
- Есть данные о том, что риск рака слюнных желез повышен у людей, которые имеют определенные профессиональные вредности: контакт с асбестом, пылью сплавов никеля, работа на предприятиях, которые занимаются производством резины, деревообработкой.
Роль наследственности на данный момент считается незначительной. Большинство больных не имеют отягощенного семейного анамнеза (близких родственников, у которых был диагностирован тот же тип рака). Не доказана роль алкоголя и табака. Известно, что эти вредные привычки в целом повышают риск развития рака головы и шеи, но связь со злокачественными опухолями слюнных желез не обнаружена.
Опасен ли мобильный телефон? Во время одного исследования ученые обнаружили, что у активных пользователей сотовых телефонов чаще встречаются опухоли околоушной слюнной железы (как правило, доброкачественные). Но другие исследования такой взаимосвязи не выявили.
Симптомы заболевания
Доброкачественные и злокачественные опухоли слюнных желез проявляются сходными симптомами. Одно из главных отличий в том, что рак растет намного быстрее и чаще приводит к ряду симптомов, связанных с прорастанием в окружающие ткани, сдавлением нервов.

Нужно посетить врача, если вас стали беспокоить следующие симптомы:
Методы диагностики
Во время первичного приема врач-онколог беседует с пациентом, расспрашивает его, пытаясь выяснить факторы риска, проводит осмотр. Доктор ощупывает опухоль на лице и шейные лимфатические узлы, оценивает чувствительность лица и работу мимических мышц. После этого больной может быть направлен на дополнительную консультацию к ЛОР-врачу.
Компьютерная томография и магнитно-резонансная томография помогают оценить размеры, форму и расположение опухоли, обнаружить очаги в лимфатических узлах и других органах. В настоящее время золотым стандартом в поиске отдаленных метастазов является ПЭТ-сканирование. Если опухоль находится рядом с челюстью, проводят рентгенографию. Рентгенографическое исследование грудной клетки помогает обнаружить метастазы в легких, оценить состояние легких и сердца перед хирургическим лечением.
Самый точный метод диагностики рака слюнных желез — биопсия. Во время этой процедуры врач получает фрагмент патологически измененной ткани и отправляет в лабораторию для цитологического, гистологического исследования.
Чаще всего проводят тонкоигольную аспирационую биопсию. Опухолевую ткань получают с помощью полой иглы, напоминающей ту, что используют для инъекций. Если не удается получить нужное количество ткани, врач проводит инцизионную биопсию: делает разрез и удаляет часть опухоли.
Если в образце обнаружены опухолевые клетки, диагноз рака практически не вызывает сомнений.
Классификация: типы рака слюнной железы
Слюнные железы состоят из разных типов клеток, любые из них могут дать начало злокачественной опухоли. Поэтому тут встречаются разные типы рака:
- Мукоэпидермоидный рак слюнной железы — наиболее распространенная разновидность. Чаще всего он встречается в околоушных слюнных железах, реже — в подчелюстных и мелких. Эти опухоли редко бывают агрессивными.
- Аденоидная кистозная карцинома характеризуется очень медленным ростом и редким метастазированием. Однако, от этой злокачественной опухоли бывает очень сложно избавиться: она может рецидивировать спустя длительное время после лечения.
- Аденокарциномой называют злокачественную опухоль, которая развивается из железистых клеток. В слюнных железах могут возникать разные виды аденокарцином: ациноклеточный рак, полиморфная аденокарцинома низкой степени злокачественности, базальноклеточная аденокарцинома, светлоклеточный рак, цистаденокарцинома и др.
- К редким типам злокачественных раковых опухолей слюнных желез относят: плоскоклеточный рак, эпителиально-миоэпителиальную карциному, анапластическую мелкоклеточную карциному, недифференцированные карциномы.
Стадии заболевания
Рак слюнных желез, как и другие злокачественные опухоли, классифицируют по стадиям в соответствии с общепринятой системой TNM. Буква T в аббревиатуре обозначает характеристики первичной опухоли: размеры и степень ее прорастания в окружающие ткани, N — распространение в лимфатические узлы, M — наличие отдаленных метастазов. В зависимости от этих показателей, в течении рака слюнной железы выделяют следующие стадии:
Помимо стадий, выделяют три степени злокачественности рака слюнных желез:
- I степень — низкая степень злокачественности. Такие опухоли называют высокодифференцированными. Опухолевая ткань максимально похожа на нормальную ткань слюнных желез. Она медленно растет, и прогноз для таких пациентов наиболее благоприятен.
- II степень — это умеренно дифференцированные опухоли. Опухолевая ткань более существенно отличается от нормальной. Такой рак более агрессивен и отличается более плохим прогнозом.
- III степень — низкодифференцированные опухоли. Раковые клетки практически полностью утрачивают черты нормальных. Такие опухоли ведут себя наиболее агрессивно.
Определение степени злокачественности помогает врачу спрогнозировать, как будет вести себя рак, и правильно спланировать лечение.
Лечение
Лечением пациента занимается команда врачей, в которую могут входить: клинический онколог, ЛОР-врач, онколог-хирург, челюстно-лицевой хирург, химиотерапевт, радиотерапевт и др. Программа лечения определяется стадией рака, гистологическим типом опухоли, ее локализацией (какая железа поражена), возрастом, общим состоянием и сопутствующими заболеваниями пациента.
Если опухоль не сильно проросла в окружающие ткани, то она является резектабельной, то есть ее можно удалить хирургическим путем. Задача хирурга — иссечь опухоль с захватом окружающих тканей так, чтобы на линии разреза не осталось раковых клеток, то есть обеспечить негативный край резекции. Если опухолевые клетки распространились в лимфатические узлы, или по данным биопсии диагностирован агрессивный рак, лимфоузлы также удаляют.
При раке околоушной слюнной железы хирургическое вмешательство представляет определенные сложности, потому что через железу проходит лицевой нерв, который контролирует работу мимических мышц. Если опухоль затрагивает только поверхностную долю железы, можно удалить ее отдельно — выполнить поверхностную паротидэктомию. При этом нет риска повредить лицевой нерв. В некоторых случаях приходится удалять всю железу, а если опухоль проросла в лицевой нерв — то и его.
При раке подъязычной и поднижнечелюстной железы хирург удаляет саму железу и часть тканей, расположенных вокруг нее, в том числе, возможно, костную ткань. В некоторых случаях приходится иссекать нервы, которые контролируют чувствительность, движения в нижней части лица, в языке, чувство вкуса.
При раке мелких желез удаляют пораженную железу и часть окружающих тканей. Объем операции зависит от размеров и расположения опухоли.
Показания к применению лучевой терапии при злокачественных опухолях слюнных желез:
- Для борьбы со злокачественными опухолями, которые не могут быть удалены хирургическим путем в силу своего расположения или размеров. Иногда облучение дополняют курсами химиотерапии.
- После хирургического лечения. Такую лучевую терапию называют адъювантной, иногда ее сочетают с химиотерапией. Облучение после операции помогает уничтожить оставшиеся раковые клетки и предотвратить рецидив.
- При запущенном раке. В данном случае лучевая терапия направлена на борьбу с болью, нарушением глотания, кровотечением и другими симптомами.
Обычно облучение проводят пять дней в неделю в течение 6–7 недель. Если лучевую терапию применяют в паллиативных целях, курс будет короче.
Химиотерапию применяют при злокачественных новообразованиях слюнных желез довольно редко. Противоопухолевые препараты могут уменьшить размеры опухоли, но не способны полностью ее уничтожить. Чаще всего их назначают при запущенном раке в качестве паллиативного лечения или в дополнение к лучевой терапии.
После лечения могут сохраняться некоторые проблемы, связанные с повреждением нервов: нарушение функции мимической мускулатуры лица, расстройства речи, глотания, косметические дефекты. Некоторые побочные эффекты химиопрепаратов и лучевой терапии проходят после завершения терапии, а другие сохраняются в течение длительного времени. В таких случаях показаны курсы реабилитации. Врач составляет программу восстановительного лечения индивидуально, в зависимости от тяжести и характера расстройств.
Осложнения и рецидивы
Даже если лечение завершилось успешно, и по результатам обследования в организме пациента не обнаруживаются признаки присутствия раковых клеток, в будущем может произойти рецидив. Поэтому нужно регулярно наблюдаться у врача-онколога, приходить на осмотры, проходить различные исследования и сдавать анализы.
Обычно доктор назначает осмотры раз в несколько месяцев в течение нескольких лет, затем — реже.
- Если произошел рецидив рака, варианты лечения могут быть разными:
- Если опухоль может быть удалена, выполняют хирургическое вмешательство с последующим курсом лучевой терапии.
- Если опухоль не получается удалить хирургически, врач назначает лучевую терапию в сочетании с химиотерапией.
- Если имеются отдаленные метастазы, основным методов лечения становится химиотерапия. Лучевую терапию и хирургическое лечение можно использовать для борьбы с некоторыми симптомами.
При запущенном раке с метастазами достижение ремиссии становится крайне маловероятным. В таком случае лечение будет направлено на замедление прогрессирования рака, борьбу с симптомами, продление жизни больного.
Врачи Европейской клиники берутся за лечение рака на любой стадии. Для нас не существует безнадежных пациентов. Всегда можно помочь, и мы знаем, как это правильно сделать, у нас есть все необходимые технологии, препараты последних поколений.
Прогноз жизни при разных стадиях рака и профилактика
Прогноз для онкологических больных принято измерять показателем пятилетней выживаемости. Это процент пациентов, которые остались живы в течение пяти лет после того, как у них была диагностирована злокачественная опухоль.
Пятилетняя выживаемость на разных стадиях при злокачественных опухолях слюнных желез составляет:
- Локализованный рак (не распространился за пределы слюнной железы — 0, I и II стадии) — 93%.
- Рак, распространившийся в окружающие ткани и лимфатические узлы (стадии III, IVA и IVB) — 67%.
- Рак с метастазами (стадия IVC) — 34%.
Злокачественные опухоли в слюнных железах бывают разными, поэтому важно понимать, что это средние цифры, они зависят от типа рака и степени его агрессивности. Кроме того, эти цифры рассчитаны на основании данных о пациентах, у которых заболевание было диагностировано 5 лет назад и раньше. Но онкология развивается, возможности врачей постоянно растут. Поэтому больные, которые проходят лечение сейчас, могут иметь лучший прогноз.
Специальных методов профилактики не существует. Нужно в целом вести здоровый образ жизни, своевременно обращать внимание на подозрительные симптомы и обращаться к врачу.
Читайте также:

