Моноклональная опухоль что это
Патологическая анатомия
Конспект лекций. Минск: Международный государственный экологический университет имени А. Д. Сахарова, 2009.
7.2. Теории развития опухолей
В настоящее время существуют две основных теории возникновения новообразований - это теория моноклонального происхождения и теория “опухолевого поля”.
Согласно теории моноклонального происхождения, первоначальный канцерогенный агент (фактор вызывающий опухоль) вызывает мутации одиночной клетки, при делении которой затем возникает опухолевый клон, составляющий новообразование. Моноклональное происхождение новообразований было доказано на примере опухолей из B-лимфоцитов (B-клеточные лимфомы и плазмоклеточные миеломы), клетки которых синтезируют иммуноглобулины одного класса, а также на некоторых других типах опухолей. Доказано также, что по мере прогрессирования опухоли из начального клона опухолевых клеток могут развиваться субклоны в результате дополнительных продолжающихся генетических изменений ("многократные толчки"; см. ниже).
Теория “опухолевого поля”: канцерогенный агент, воздействуя на большое количество сходных клеток, может вызывать образование поля потенциально неопластических клеток. Новообразование может затем развиться в результате размножения одной или большого количества клеток внутри этого поля. Во многих случаях в результате возникает несколько обособленных новообразований, каждое из которых происходит от отдельного клонального предшественника. Образование опухолевого поля может быть расценено как первый из двух или более последовательных этапов, которые ведут к развитию опухоли ("многократные толчки"; см. ниже). Эта теория объясняет происхождение некоторых новообразований в коже, эпителии мочевыводящих путей, печени, молочной железе и кишечнике. Признание факта существования опухолевого поля имеет практическое значение, так как наличие одного новообразования в любом из этих органов должно насторожить клинициста в отношении возможности наличия второго подобного новообразования. В молочных железах, например, развитие рака в одной из них является фактором риска возникновения рака в противоположной (по статистике риск повышается приблизительно в 10 раз по сравнению с общей заболевае'ecостью раком молочной железы).
Для объяснения механизмов возникновения как опухолевого моноклона, так и “опухолевого поля” в настоящее время предложен ряд других концепций.
Теория генетических мутаций. Нарушения в геноме, обусловленные наследственностью, спонтанными мутациями или действием внешних агентов, могут вызывать неоплазию, если повреждаются регулирующие рост гены. Опухолевая трансформация происходит в результате активации (или дерепресии) специфических последовательностей ДНК, известных как рост-регулирующие гены, или прото-онкогены. Эти гены кодируют ряд факторов роста и рецепторов для факторов роста. Активация — это функциональные изменения, при которых нарушается нормальный механизм регулирования роста в онкогенезе. Активация может происходить несколькими способами: мутация прото-онкогенов; транслокация в более активную часть генома, где регулирующие влияния активируют прото-онкогены; вставка онкогенного вируса в активную часть генома; амплификация (продуцирования многократных копий прото-онкогенов); вставка вирусных онкогенов; дерепрессия (потеря супрессорного контроля). Возникающий функционально активированный ген назывется "активированный онкоген" (или мутантный онкоген, если он изменяется структурно), или просто как клеточный онкоген (c-onc). Увеличение продукции стимулирующих факторов роста или их рецепторов, или уменьшение ингибирующих (супрессорных) факторов роста, или продукция функционально ненормальных факторов может привести к неуправляемому росту клеток. Таким образом на молекулярном уровне неоплазия представляет собой нарушение функции регулирующих рост генов (прото-онкогенов и супрессорных генов опухолей).
Теория вирусных онкогенов. Некоторые РНК-вирусы содержат последовательности нуклеиновых кислот, которые являются комплементарными к прото-онкогену и могут (при действии обратной транскриптазы) синтезировать вирусную последовательность ДНК, которая является по существу идентичной. Эти последовательности названы вирусными онкогенами (v-onc). Многие, возможно все, онкогенные РНК-ретровирусы содержат такие последовательности и они найдены в соответствующих новообразованиях. В настоящее время предполагается, что онкогенные РНК-вирусы приобретают v-onc последовательности путем вставки клеточного онкогена из клетки животного или человека с помощью механизма, подобного участвующему в рекомбинации. Онкогенные ДНК-вирусы также содержат последовательности, которые функционируют как онкогены и встраиваются непосредственно в геном клетки.
Эпигенетическая теория. Согласно эпигенетической теории, основное клеточное повреждение происходит не в генетическом аппарате клетки, а в механизме регуляции активности генов, особенно в белках, синтез которых кодируют рост-регулирующие гены. Различные уровни активности генов, которые ответственны за дифференцировку тканей, как предполагается, определяются наследуемыми эпигенетическими механизмами. Основное доказательство роли эпигенетических механизмов в процессах онкогенеза обнаруживается при образовании опухолей под воздействием некоторых химических веществ, которые не оказывают никакого эффекта на генетической аппарат клетки. Действие некоторых из этих веществ состоит в связывании цитоплазматических белков, а изменения в них, как предполагается, способствуют возникновению некоторых новообразований, т.е. эти вещества выступают в роли промоторов.
Теория отказа иммунного надзора. Согласно этой теории неопластические изменения довольно часто происходят в клетках организма. В результате повреждения ДНК неопластические клетки синтезируют новые молекулы (неоантигены, опухолевые антигены; см. рис. 2). Иммунная система организма распознает эти неоантигены как “чужие”, что приводит к активации цитотоксического иммунного ответа, который уничтожает неопластические клетки. Клинически обнаруживаемые новообразования возникают только в том случае, если они не распознаются и не разрушаются иммунной системой. Доказательством этой теории является то, что большая частота возникновения опухолей наблюдается при иммунодефицитах и у пациентов, получающих иммуносупрессивную терапию после пересадки органов. Объяснением того, что рак в основном является болезнью пожилых, может быть то, что в старости наблюдается прогрессивное снижение иммунной реактивности на фоне увеличения частоты неопластических изменений, возникающих из-за дефектов репарации ДНК, которые наблюдаются при старении. Против данной теории говорят следующие факты: у мышей с недостаточностью Т-клеточного иммунитета частота новообразований не повышается; у людей с иммунодефицитами развиваются главным образом лимфомы, а не полный спектр различных опухолей; у людей с удаленным тимусом частота возникновения опухолей не увеличивается; хотя многие опухоли синтезируют опухолевые антигены и иммунный ответ на них развивается в достаточной мере, но этот ответ часто оказывается неэффективным.
Моноклональная гаммапатия является собирательным понятием, объединяющим ряд заболеваний, в основе появления которых лежит нарушение работоспособности В-лимфоцитов, приводящее к стойким патологическим секрециям одного клона иммуноглобулинов либо же составляющих их цепей.
Доброкачественный и злокачественный характер заболевания
Итак, моноклональная гаммапатия доброкачественной может быть тогда, когда клональные популяции клеток, которые секретируют аномальные иммуноглобулины, не проявляют тенденции к неконтролируемому размножению и росту или к хаотичному возрастанию продукции аномальных белков.
Патология может носить и злокачественный характер, когда клональные популяции, производящие аномальный белок, склонны к неконтролируемому постоянному росту, а вместе с тем и размножению. Как следствие обычно увеличивается секреция этого белка.
К злокачественным формам моноклональных гаммапатий относят, например, макроглобулинемию Вальденстрема, заболевание легких цепей и прочее. Злокачественная форма недуга в целом менее чувствительна к химиотерапии по сравнению с большинством прочих гемобластозов.
Причины патологии
Заболеваемость этим недугом повышается с возрастом (от одного процента у людей, которые находятся в возрасте 25 лет, до четырех процентов у лиц старше семидесяти лет). Моноклональную гаммапатию встречают в сочетании с другими патологиями, при которых причиной продуцирования М-протеина выступают антитела, формируемые в большом количестве в качестве ответа на продолжительный антигенный стимул.
Стоит отметить, что доброкачественные формы моноклональных гаммапатий зачастую развиваются в качестве последствия хронической чрезмерной стимуляции. Последняя как раз и приводит к усиленному размножению некоторых клонов плазматических клеток. К примеру, именно таким характером обладают доброкачественные гаммапатии, которые наблюдаются после пересадки костного мозга. Намного реже подобное фиксируется непосредственно после пересадки тканей или при наличии некоторых хронических инфекций.

Симптомы
Моноклональная гаммапатия нередко протекает у людей бессимптомно, правда, могут также встречаться и периферические нейропатии. Несмотря на то, что большинство примеров заболевания оказываются доброкачественными, в 25 процентах случаев этот недуг может прогрессировать в В-клеточные опухоли, а кроме того, в миелому либо же в макроглобулинемию.
Симптомы моноклональной гаммапатии не должны остаться без внимания.
Диагностика
Содержание иммуноглобулина в сыворотке оценивается с помощью проведения электрофореза. Иммуноглобулины могут двигаться в электрическом поле с различной скоростью и образуют в зоне гамма-глобулинов достаточно широкий пик. При развитии моноклональной гаммапатии (код по МКБ-10 - D47.2) содержание в сыворотке гамма-глобулинов обычно у людей возрастает, и на электрофореграмме в этом районе обнаруживают острый пик, который называют М-градиентом. Реже он может появляться в зоне бета- или альфа-глобулинов. Порог чувствительности данного метода составляет пять грамм на литр. Моноклональную форму М-градиента подтверждают выявлением одного вида тяжелых и легких цепей во время иммуноэлектрофореза. Таким образом, М-градиент оценивается количественно (с помощью проведения электрофореза) и качественно (посредством иммуноэлектрофореза).
В том случае, если моноклональный характер секреции был доказан, то в дальнейшем разумно применять только электрофорез. Величина М-градиента сообщает о массе опухоли. М-градиент выступает надежным, но специфичным для массового обследования опухолевым маркером. Он встречается не только в моноклональных гаммапатиях, но и при различных лимфопролиферативных патологиях. Например, подобное наблюдается при наличии у пациента хронического лимфолейкоза и клеточной лимфомы. Также это фиксируется на фоне злокачественных новообразований в виде хронического миелолейкоза, рака груди и толстой кишки, а кроме того, на фоне ряда аутоиммунных патологий (ревматоидный артрит, миастения, аутоиммунная гемолитическая анемия с холодовыми антителами). А также при прочих заболеваниях (цирроз печени, саркоидоза, паразитарные болезни, гангренозная пиодермия, болезни Гоше).
Редкое кожное заболевание под названием склеромикседема Готгрона тоже, как правило, сопровождается моноклональной гаммапатией. При этом недуге в дерме может откладываться положительно заряженный иммуноглобулин, который несет лямбда-цепи. Не исключается, что данные антитела могут быть направлены против некоторых элементов дермы.
Природа М-градиента при различных гаммапатиях неодинакова. Он представляет собой нормальные иммуноглобулины, аномальные или их фрагменты. Не исключена секреция отдельных цепей: легких либо тяжелых. В двадцати процентах случаев миеломным недугом секретируются лишь легкие цепи, появляющиеся в моче в виде белка Джонса. Некоторыми плазмоклеточными опухолями (в особенности, солитарными костными и мягкотканными плазмоцитомами) секретируется моноклональный белок меньше чем в трети всех случаев.
В процессе диагностики врачи отмечают, что частота секреции иммуноглобулинов при наличии миеломного недуга пропорциональна их обычному содержанию в сыворотке.
Лечение
Терапия моноклональной гаммапатии (по МКБ-10 недугу присвоен код D47.2) обычно не требуется, правда, учитывая повышенный риск гемобластозов, пациентов с этой парапротеинемией нужно регулярно обследовать. У 47 процентов больных парапротеинемия может сохраняться пожизненно (но не выступает причиной смерти). Среди шестнадцати процентов пациентов развивается миеломная болезнь, а у десяти процентов уровень парапротеина может увеличиваться до значений, которые превышают три грамма.
Также стоит отметить, что у трех процентов больных развивается первичный амилоидоз наряду с макроглобулинемией Вальденстрема, у такого же количества больных наблюдаются другие гемобластозы. Гемобластозы могут развиваться у семнадцати процентов больных спустя десять лет. Они развиваются у 33 процентов через двадцать лет непосредственно после установления диагноза о наличии моноклональной гаммапатии доброкачественного характера. Порой пациентов в рамках лечения подвергают химиотерапии.
Таким образом, первичное доброкачественное, хроническое и безсимптомное состояние не требует специального лечения моноклональной гаммапатии. Но пациентам необходим продолжительный контроль количества моноклонального иммуноглобулина в крови. То есть все лечение в данном случае сводится к тому, чтобы ждать и наблюдать.
Моноклональная гаммапатия неясного генеза
Такая гаммапатия нередко отличается потенциально злокачественной опухолью системы крови. Ниже приведены особенности этого типа патологии:
- При неясном генезе у пациента может наблюдаться доброкачественное состояние, которое будет предраковым.
- Риски перехода патологии в опухоль зависят от свойств количества и типа продуцируемого парапротеина, а кроме того, от соотношения тяжелых и легких цепей.
- Состояние может возникать в результате мутаций В-лимфоцитов, являющихся клетками в норме вырабатывающими иммуноглобулины, то есть белки, которые защищают от инфекций.
- Как правило, спустя двадцать лет гаммапатия неясного генеза может переходить в опухоль у сорока процентов пациентов.
- Этот тип гаммапатии никогда не лечат химиотерапией.
Характеристика и особенности гаммапатии, отличающейся неясным генезом
Итак, речь идет о биохимическом состоянии, когда в крови находится аномальный М-белок, являющийся неправильным фрагментом иммуноглобулина либо его легкой цепи, синтезирующегося одной линией плазмоцитарных клеток костного мозга. Неправильным его именуют, так как он не выполняет никаких полезных для организма функций, выступая браком в белковом производстве. В нормальном состоянии его концентрация в крови должна быть минимальная.
В большинстве ситуаций уровень М-протеина бывает низким и не увеличивающимся со временем. Но в некоторых ситуациях он может критически возрастать, переходя во множественную миелому или прочие моноклональные гаммапатии.
Патология, которая отличается неясным генезом, характеризуется медленным делением клона плазмоцитов и выделением М-протеина в низком количестве. Также на фоне этого заболевания отсутствуют признаки множественной миеломы, AL-амилоидоза или прочих лимфопролиферативных недугов.
Частота этой патологии в популяции составляет около одного процента и растет, как правило, с возрастом. После пятидесяти лет недуг обнаруживается у трех процентов населения, а среди мужчин, которые старше восьмидесяти, – у каждого двенадцатого. Моноклональные гаммапатии неопределенного значения составляют шестьдесят процентов всех патологий такого рода.
Причины
Причины такой формы гаммапатии, как это видно из названия, к сожалению, неясны. Известны лишь следующие факторы риска:
- Прежде всего, это возраст, так как чем он больше, тем выше вероятность развития недуга.
- Этим заболеванием преимущественно страдают лица мужского пола.
- Контакты с пестицидами, то есть риску особенно подвергаются сельскохозяйственные работники.
- Наличие множественной миеломы или моноклональной гаммаптии, отличающейся неясным генезом среди близких и прямых родственников.
На сегодняшний день в точности не установлено, вследствие чего образуется опухоль. Существует рабочая гипотеза о последовательном изменении в генах, которые кодируют образование иммуноглобулина и появление М-белка. Непосредственно между моноклональными гаммапатиями и множественной миеломой лежит долгий путь генетической перестройки в плазматической клетке. Патология с неясным генезом предполагает одну линию В-лимфоцитов, которые вырабатывают большее количество М-протеина. Множественной миеломой называют клона опухолевых клеток, который находится первоначально только в костях, а далее распространяется и в остальные органы.

Классификация патологии
Моноклональная гаммапатия неясного генеза в медицине делится на следующие вариации:
- Лимфоплазмоцитарную гаммапатию, которая крайне редко может переходить во множественную миелому, но способна трансформироваться в макроглобулинемию или прочие неходжкинские лимфомы.
- Плазмоцитарную гаммапатию, являющуюся клональной пролиферацией плазматических клеток.
Диагностика
В рамках проведения исследования при моноклональной гаммапатии неопределенного значения MGUS и сдачи лабораторных анализов пациентам необходимо пройти через следующие процедуры:
- Обязательная сдача общего анализа крови в целях выявления пониженного гемоглобина.
- Взятие почечных проб. В основном у больных исследуется креатинин для оценивания функций почек.
- Исследование микроэлементов крови, а именно анализируется кальций, являющийся показателем разрушения костных тканей.
- Проведение электрофореза белков крови наряду с иммунофиксацией белков.
- Определение иммуноглобулинов в крови.
- Установление свободных легких цепей в крови.
- Определение количества бета-2-микроглобулина.
Инструментальные обследования
В качестве инструментальных исследований внимание уделяется следующим процедурам:
- Рентгену костей скелета, таким образом, проводится исследование позвоночника, черепа, костей таза, бедренных и коленных суставов и так далее.
- Выполнение магнитного резонансного исследования, являющегося золотым стандартом в диагностике изменений в костях при моноклональных гаммапатииях. Стоит отметить, что при возникновении боли в любой из костей магнитная резонансная томография обязательна.
- Компьютерная томография в первую очередь нацелена на раннее обнаружение других опухолей крови, в которые может перейти это заболевание.
- Выполнение стернальной пункции или трепанобиопсии. Такая процедура необходима при наличии аномального индекса каппа-лямбды или одного из симптомов.
- Проведение денситометрии, то есть оценки плотности костных тканей.
У детей
Рассматриваемая патология является локализованным и, как правило, самолимитируемым заболеванием среди детей, которые находятся в возрасте от пяти до десяти лет, и молодых взрослых пациентов до тридцати. Зачастую поражаемыми органами при моноклональной гаммапатии у детей являются кости, а кроме того, легкие. Поражение костей нередко превалирует, но часто наблюдается и вовлечение эндокринных желез. Это заболевание крайне неблагоприятно протекает у детей, которые находятся в возрасте до двух лет.
Боли в спине
Боли в спине при моноклональной гаммапатии нередко возникают у тех пациентов, у которых отмечается рост опухоли в позвонке либо же в районе околопозвоночных мягких тканей. Подобные дискомфортные ощущения могут также возникать и при наличии признаков сдавления корешков или спинного мозга. В рамках исследования для устранения дискомфорта пациентам делают магнитную резонансную томографию, позволяющую выявить поражение спинного мозга, а кроме того, оценивать выраженность патологического состояния позвоночника.
Отзывы врачей и пациентов
В отзывах касательно поддержки пациентов с этим заболеванием врачи пишут о том, что проведение электрофореза белковых фракций служит незаменимым инструментом для осуществления скрининга и диагностики злокачественных форм моноклональных гаммапатий, сопутствующих иммунопролиферативным заболеваниям.
В комментариях пациентов по поводу этого заболевания отмечается, что очень важно провести раннюю его диагностику и профилактику. Специалистами подчеркивается, что широкое распространение биохимических анализов и электрофореза крови привело к возможности раннего выявления недуга.

Можно ли жить с моноклональной гаммапатией? Как сообщают пациенты, в случае обнаружения у человека данного заболевания, равно как и после подтверждения такого диагноза согласно современным требованиям, рекомендуется придерживаться определенного алгоритма наблюдения специалиста. В случае отсутствия жалоб у пациента на протяжении первого года проводится исследование количества парапротеина, что необходимо делать каждые три месяца. А магнитное резонансное исследование, по словам пациентов, делают каждые шесть месяцев. Если нарастания парапротеина не будет выявлено, то в дальнейшем исследования производятся раз в двенадцать месяцев.
Таким образом, моноклональные гаммапатии (а их также еще именуют иммуноглобулинопатиями или парапротеинемией) представляют собой неоднородную категорию заболеваний, характеризующихся пролиферацией клеток лимфоидного ряда, которые секретируют иммуноглобулины. Главной отличительной особенностью подобных заболеваний выступает продукция моноклонального иммуноглобулина, определяемого в сыворотке крови либо в моче.
Существуют три основные характеристики, присущие опухолевым клеткам. Во-первых, это бесконтрольный рост вне зависимости от клеточного окружения прилегающих тканей. Во-вторых, раковые клетки всегда находятся на той или иной стадии анаплазии, то есть теряют клеточную специализацию. В-третьих, раковые клетки способны метастазировать, то есть распространяться по организму и проникать в ткани далеко за пределы области развития первичной опухоли.
Эти три характеристики присущи клеткам большинства известных видов рака, однако существуют исключения. Действительно, в опухолевой ткани нарушены нормальные регуляторные механизмы контроля роста. Тем не менее обнаруживаются участки опухолевой ткани, где происходит контактное торможение роста неоплазии.
Более того, поскольку чаще всего именно метастазы становятся причиной смерти больных раком, изучение биологических механизмов метастазирования является одной из ключевых задач современных исследований в онкологии.
Большинство человеческих неоплазий по своей природе являются моноклональными. Это означает, что при канцерогенном воздействии на организм обычно первоначально поражается всего одна клетка и вся опухоль представляет собой результат размножения этой единственной клетки. Существуют две основные группы доказательств этой концепции.
Первая группа доказательств. Некоторые женщины бывают гетерозиготны по двум формам фермента глюкозо-6-фосфатдегидрогеназе (Г6ФД). Ген, кодирующий этот фермент, находится в Х-хромосоме, и женские гетерозиготы наследуют этот ген либо по отцовской, либо по материнской линии.
Если у женщины с гетерозиготным набором генов будет повреждена одна из Х-хромосом, каждая клетка ее тела будет содержать только одну из этих двух форм фермента. Обследования больных гематологическими видами рака, возникающими из гетерозиготности по гену Г6ФД, показали, что их раковые клетки всегда содержат только одну форму фермента. Это является сильным доказательством того, что рак развивается из одиночной клетки, несущей ту или иную форму гена.
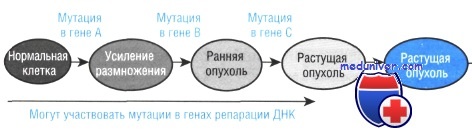
При хронической гранулоцитарной лейкемии у больных обнаруживается рестрикция экспрессии ферментов в клетках гранулоцитарного ряда и, что особенно важно, в эритроцитах и тромбоцитах. Таким образом, процесс злокачественной трансформации поражает стволовые клетки.
Приведенный факт также подтверждает моноклональную теорию происхождения рака. Кроме того, в исследованиях было показано, что хотя делеция 9q участка хромосомы обязательно присутствует во всех раковых клетках, в некоторых клетках была также обнаружена потеря 17р и 18q участков, что предположительно связано с более поздними этапами развития опухоли. Это также говорит о том, что хотя возникновение и первичное развитие опухоли происходят из одной клетки, в процессе ее роста возможно возникновение и нарастание генетической изменчивости составляющих ее клеток.
Вторая группа доказательств моноклональной природы рака происходит из исследований лимфом и различных лимфоидных форм рака. Было показано, что иммуноглобулины, продуцируемые лимфоидными неоплазиями (и встроенные в мембрану, и выделяемые в кровяное русло, как в случае с миеломой), почти всегда являются моноклональными, принадлежащими к одному классу и обнаруживающими одинаковую рестрикцию экспрессии легких цепей.
Безоговорочное принятие теории моноклональности рака иногда заставляет исследователей приписывать раковым опухолям гораздо более предсказуемое поведение, чем это есть на самом деле. Реальное же положение вещей такое, что, несмотря на моноклональное происхождение, неоплазии в процессе своего развития обнаруживают все большую и большую гетерогенность. Этот факт необходимо всегда учитывать при лечении онкологических заболеваний и в оценке природы опухолевых метастазов.
Как же вообще возникает гетерогенность, если раковая опухоль первично моноклональна? Дело в том, что процесс злокачественной трансформации всегда сопровождается общей генетической нестабильностью, что вызывает многочисленные фенотипические изменения первоначально однородных клеток. Некоторые из мутирующих клеток выживают и дают начало новым линиям развития, некоторые погибают в результате мутации. Выживаемость мутировавших клеток зависит от их гормональной и биохимической стабильности, а также от возможности их распознавания иммунной системой.
Таким образом, зрелую опухоль можно рассматривать как конгломерат клеток моноклинального происхождения, но различающихся по способности к метастазированию, устойчивости к цитотоксическим препаратам и атакам иммунной системы организма.
Процесс постепенного накопления хромосомных изменений в ходе прогрессии опухоли показан на рисунке на примере развития рака толстой кишки из полипа толстой кишки. По мере роста опухоли и возрастания генетической нестабильности в ее клетках возникают многочисленные разрывы хромосом, делеции и редупликации генов. Морфологически это сопровождается изменчивостью клеточных ядер и ростом числа плеоморфных цитологических форм.
Опухолевые клетки многих видов рака содержат мутации по гену, кодирующему белок р53. Этот ген кодирует наработку ядерного фосфопротеина, который участвует в контроле клеточного цикла, запрещая вступление клетки в фазу G1, если обнаруживаются повреждения клеточной ДНК. В нормальных клетках под действием ультрафиолетового облучения или цитотоксических препаратов происходит резкое увеличение содержания р53, что связано со стабилизацией белка после трансляции.
Деактивация функций р53 в результате мутации приводит к тому, что клетка вступает в митоз даже с ошибками в своем генетическом коде. Мутации в гене р53 раковых клеток приводят к конформационным изменениям фермента и делают его неактивным. Мутантные формы фермента теряют способность связываться с молекулами ДНК. Таким образом, мутация белка р53 является ключевым моментом опухолевой профессии, когда злокачественные клетки вступают в клеточный цикл без предварительной репарации поврежденных участков ДНК. В дальнейшем происходит процесс все большего накопления мутационных изменений.
Популяция раковых клеток, выросшая как потомство одной единственной клетки, в ходе своего развития обнаруживает значительную изменчивость как по скорости роста отдельных субпопуляций, так и по их цитоплазматической организации, гормонально-рецепторному статусу, чувствительности к радиоактивному облучению и цитотоксическим препаратам. В качестве примера можно привести мелкоклеточный рак легкого.
При этом заболевании клетки первичной опухоли и отдаленных метастазов значительно отличаются друг от друга по уровню цитоплазматического кальцитонина, гистаминазы и L-дофаминовой декарбоксилазы. Обнаруживаются также кариотипические различия клеток первичных и вторичных опухолей.
Гетерогенность опухолей представляет собой громадную проблему для терапии рака. Если опухоль обнаруживает изменчивость клеточных фенотипов и антигенной экспрессии, становится очень трудно оценить, какой вид иммунотерапии может дать положительный лечебный эффект. Аналогично, наличие в единичной опухоли субпопуляций клеток с различной чувствительностью к тем или иным цитостатическим препаратам обусловливает ее резистентность к химиотерапии, которая часто выявляется в ходе проведения лечения.


Моноклональные антитела — это новейшее достижение медицины, которое применяется при лечении тяжелых заболеваний. Среди них злокачественные новообразования, аутоиммунные, системные, заболевания сердечно-сосудистой системы, некоторые инфекции и многое другое. Помимо этого, моноклональные антитела широко используются в диагностике, например, в иммуногистохимии, иммуноферментном анализе, проточной цитофлуориметрии и др. Таким образом, данная технология используется во многих отраслях современной медицины.
- Способы получения моноклональных антител
- Механизм действия моноклоналных антител
- Препараты с моноклональными антителами
- Проблемы при использовании моноклональных антител
Человечество уже давно открыло для себя действие антител — особых молекул, которые вырабатываются клетками иммунной системы для распознавания чужеродных агентов — антигенов и их уничтожения. Антитела обладают специфичностью. Это значит, что они узнают только свой антиген, причем не просто антиген, а отдельный его фрагмент — детерминантную группу. В одном антигене может быть несколько таких детерминантных групп, и к ним будут образовываться разные антитела. Более того, к одной детерминанте может образовываться сразу несколько видов антител, которые могут отличаться по структуре, степени родства и прочности связывания. Таким образом, при введении антигена в организм образуется большое количество разных видов антител, направленных исключительно на один вид антигена. Это позволяет обеспечить адекватную иммунную защиту.
Антитела образуются специальными антителообразующими клетками. Причем каждый их вид образуется отдельной группой генетически однородных клеток — клонов. Чем больше необходимо видов антител, тем больше образуется клонов. Соответственно, антитела, которые вырабатываются одним клоном клеток называются моноклональными антителами.
Раньше для производства антител применялась иммунизация животных, после которой отбиралась их плазма и использовалась для приготовления отдельных препаратов — иммунных сывороток для борьбы с различными токсинами (дифтерия, столбняк), вирусами, ядами и др. Но бывают ситуации, когда нужно конкретное антитело, направленное на конкретную детерминанту антигена. Здесь уже обычной иммунизацией не обойтись. Требуются более прицельные технологии.
Способы получения моноклональных антител
Получение моноклональных антител — это сложный многоступенчатый процесс, который проходит следующие этапы:
- Иммунизация животных. Обычно используются мыши или крысы. Это нужно для того чтобы увеличить количество лимфобластов — клеток, продуцирующих нужные антитела и перевести эти клетки в активное состояние. После выделения из организма эти клетки не могут долго существовать в лабораторных условиях, они погибнут даже на питательных средах с содержанием ростовых факторов. Чтобы это предотвратить, их скрещивают со злокачественными миеломными клетками.
- Подготовка миеломных клеток. Параллельно с иммунизацией животных проводят подготовку опухолевых миеломных клеток. Они, во-первых, обладают способностью синтезировать моноклональные антитела, а во-вторых, обладают неограниченным жизненным потенциалом (они бессмертны и способны к бесконечному воспроизведению). Для того чтобы миеломные клетки не погибли вне организма, их культивируют на специальных средах с использованием факторов роста.
- Гибридизация (слияние) лимфобластов и миеломных клеток для образования гибридомы. Для этого клетки обрабатывают различными антителами, чтобы изменить строение их мембран и спровоцировать образование цитоплазматических контактов. При этом образуются разные типы клеток, имеющих двойной набор хромосом (дикарионы). Это могут быть дикарионы, образованные только лимфоцитами, или только миеломными клетками. Но для производства моноклональных антител нужны именно дикарионы, образованные лимфоцитом и миеломной клеткой — гибридные клетки.
- Отбор гибридных клеток. Для этого используют специальные растворы, которые позволяют выжить только лимфобластным и гибридомным дикарионам. Первые в скором времени погибают, т. к. не обладают возможностью безграничного деления, а гибридомные клетки остаются жизнеспособными.
- Реклонирование гибридомных клонов.
- Определение и отбор гибридом, продуцирующих моноклональные антитела. Обычно для этого используется иммуноферментный анализ.
- Массовое наращивание антител.
- Очистка полученных антител. Степень очистки будет определяться областью применения препарата. Если это диагностика, достаточно 70-95% степени чистоты. Если препарат предполагается использовать для иммунотерапии, требуется более высокая степень чистоты. Для очистки используется аффинная и ионообменная хроматография.
- Удаление оставшихся примесей и обеззараживание полученного препарата от вирусов и бактерий.
В настоящее время идет тенденция отказа в использовании антител животных для лечебных целей. Во-первых, они являются чужеродными агентами для организма и могут спровоцировать аллергические реакции, вплоть до анафилаксии, что напрямую угрожает жизни пациентов. Во-вторых, иммунная система человека, распознавая такие антитела как чужеродные, будет пытаться их инактивировать, что снизит эффективность противоопухолевого лечения. Получить человеческие моноклональные антитела вышеописанным методом не представляется возможным, ввиду следующих проблем:
- Иммунизация человека различными антигенами неэтична.
- Даже если получить иммунизированные лимфоциты человека, будут проблемы на этапе их слияния с клетками миеломы мыши — полученные гибридомы будут нестабильны.
- Клеточные линии миеломы человека, которые можно было бы эффективно использовать в рамках биотехнологий для получения антител, пока получить не удалось.
В этой связи необходимо было искать новые технологии получения антител. Решением проблемы стали гибридные, гуманизированные и одноцепочечные антитела, производство которых подразумевало применение гибридомной технологии, кратко описанной выше, и технологии рекомбинантной ДНК.
Механизм действия моноклоналных антител
Моноклональные антитела широко используются в лечении заболеваний, у которых в патогенезе замешан иммунный компонент. С их помощью лечат псориаз, аутоиммунные заболевания, ревматоидный артрит, рассеянный склероз. Большие перспективы эти технологии получили и в онкологии в рамках таргетной терапии. При этом, их эффект основан на различных механизмах, которые рассмотрены ниже.

В качестве примера изменения клеточных сигналов можно привести рецепторы факторов роста. Некоторые злокачественные клетки имеют на своей поверхности большое количество рецепторов к факторам роста, активирующим каскад реакций, направленный на усиление размножения клетки. Чем больше таких рецепторов, тем активнее протекает этот процесс. Если блокировать рецептор с помощью моноклонального антитела, он не сможет связаться с лигандом (фактором роста), и соответственно каскад этих реакций не будет запущен. Клетка не будет так активно размножаться и в конце концов погибнет.
Этот механизм реализуется следующим образом. Антитело связывается с антигеном, находящимся на поверхности злокачественной клетки, что приводит к активации многоэтапной системы комплемента (механизма иммунного ответа). Конечным этапом этих реакций является образование особого белка С 9, который перфорирует клеточную мембрану раковой клетки, что в конечном итоге приводит к ее гибели.
Препараты с моноклональными антителами
Препараты на основе моноклональных антител уже два десятилетия входят в протоколы противоопухолевого лечения некоторых злокачественных новообразований. В 2008 году ВОЗ были приняты рекомендации относительно непатентованных названий таких препаратов:
- Их название должно заканчиваться на маб, от английского monoclonal antibody.
- Для указания источника получения моноклонального антитела должны использоваться следующие подосновы:
- -аксо — гибридное антитело.
- -о — мышиное антитело.
- -кси — химерное антитело.
- -у — человеческое антитело.
В настоящее время используется два вида противоопухолевых моноклональных антител:
- Неконъюгированные антитела — они оказывают непосредственное действие на процессы, которые приводят к гибели злокачественной клетки.
- Конъюгированные антитела — они связаны (конъюгированы) с токсинами или изотопами. Токсины и изотопы обладают уничтожающим действием на злокачественные клетки, а антитело обеспечивает их прицельную доставку к клеткам-мишеням.
Эти препараты используются чаще всего. Их целью является определенный рецептор на поверхности злокачественной клетки.
К этому типу препаратов относится ритуксимаб — первое моноклональное антитело, которое было одобрено для применения в клинической практике. Его используют для лечения CD20+ В-клеточных лимфом. Рецептор CD20 есть на В-лимфоцитах, как здоровых, так и опухолевых, но он отсутствует на других тканях и клетках, в том числе на стволовых. Поэтому при воздействии ритуксимаба хоть и погибает популяция В-лимфоцитов, но потом она восстанавливается за счет нетронутых стволовых клеток. Причем восстанавливаются именно здоровые клетки.
Неконъюгированные антитела могут помечать злокачественные клетки и делать их видимыми для иммунной системы. Таким способом работает алемтузумаб, который связывается с CD52+ лимфоцитами и привлекает к ним внимание иммунитета.
Также к неконъюгированным моноклональным антителам относятся ингибиторы рецепторов факторов роста. Факторы роста — это специальные молекулы, которые запускают деление клетки. Для того чтобы запустить этот процесс, фактор должен связаться со специальным рецептором, расположенным на мембране клетки, что приведет к каскаду соответствующих реакций. Такие рецепторы есть и у здоровых клеток, и у злокачественных, но у злокачественных их может быть очень много, что позволяет таким клеткам делиться быстрее. Блокирование рецепторов с помощью антител приводит к нарушению этого процесса деления и клетки уже не могут бесконтрольно размножаться. К таким препаратам относится трастузумаб, цетуксимаб и др.
К неконъюгированным антителам относятся и ингибиторы ангиогенеза — образования кровеносных сосудов. Ангиогенез очень важен для злокачественных опухолей, чтобы получать большее количество кислорода и питательных элементов, поэтому опухоли инциируют его образование с помощью специальных химических сигналов. Моноклональные антитела либо блокируют передачу этих сигналов, либо разрушают уже созданную внутри опухоли сосудистую сеть. Это приводит к нарушению ее питания и остановке роста. К группе этих препаратов относится рамуцирумаб, бевацизумаб и др.
Конъюгированные моноклональные антитела связывают с цитотоксическими или радиотоксическими веществами, что позволяет прицельно воздействовать разрушающим агентом на злокачественные клетки. В качестве примера такого препарата можно привести ибритумомаб (Зевалин), в котором моноклональное антитело против CD20 (как мы помним, это маркер В-лимфоцитов) соединено с радиоактивным изотопом — иттрием-90. Препарат применяется для лечения В-клеточных лимфом. В качестве другого препарата можно привести Кадсилу — препарат, в котором антитело трастузумаб конъюгировано с ингибитором микротрубочек DM1, оказывающим цитотоксический эффект. Применяют его для лечения рака молочной железы.
Проблемы при использовании моноклональных антител
Несмотря на, казалось бы, огромные перспективы в лечении онкологических больных, применение моноклональных антител не является панацеей и тоже имеет ряд проблем:
- Препараты на основе моноклональных антител биологически и биохимически нестабильны. Особенно это касается конъюгированных антител. Это требует особых условий производства, хранения и транспортировки.
- Антитела плохо проникают внутрь опухоли.
- Они могут вызывать иммунный ответ против себя, что блокирует их действие. У 75% пациентов, которым вводились мышиные антитела, наблюдалось образование нейтрализующих антител, что снижало эффективность лечения.
- Препараты на основе моноклональных антител оказывают токсическое действие. Конечно, оно не такое выраженное как у цитостатиков, но в ряде случаев токсичность настолько высокая, что требует отмены препарата.
- Наиболее важным моментом является высокая специфичность моноклональных антител и высокая гетерогенность опухолевых клеток. Не все раковые клетки имеют молекулы мишени, на которые направлено действие препарата. Соответственно, они ускользают от его действия и остаются нетронутыми. Постепенно масса этих клеток накапливается и опухоль становится резистентной к данному методу лечения.
Чтобы улучшить результаты лечения, разрабатываются новые виды моноклональных антител. Одним из вариантов являются биспецифические антитела, которые направлены сразу на две молекулярные мишени, например, блинатумомаб — препарат, направленный сразу на две клеточные мишени В-лимфоцита — CD 19 и CD22. Он повышает узнаваемость злокачественных клеток даже после их трансформации в другие виды лейкоза.
В любом случае моноклональные антитела — это новое и высокоперспективное направление в современной онкологии. Разработка современных, более совершенных технологий помогает решать имеющиеся проблемы и делает лечение пациентов эффективнее и безопаснее.
Читайте также:

