Монографии по опухолям почки
12. 1. Злокачественные опухоли почек
Эпидемиология. Опухоли почки у взрослых встречаются сравнительно редко, составляя 2 - 3% всех новообразований. Преобладающий возраст больных 55 - 60 лет. Мужчины болеют раком почки в два раза чаще, чем женщины.
Этиология. Этиологические факторы развития опухолей почки изучены недостаточно. Возникновению опухоли оказывают содействие:
O химическое загрязнение окружающей среды;
O курение табака;
O применение гормональных препаратов и цитостатиков;
O дисбаланс половых гормонов (эстрогенов);
O ионизирующее излучение;
O влияние нитрозаминов и ароматических аминов;
O при болезни Хиппеля - Линдау и поликистозах почки отмечена высокая заболеваемость раком почки.
Патологическая анатомия. Различают опухоли почечной паренхимы и почечной лоханки.
В Украине принята такая классификация опухолей почек:
I. Опухоли почечной паренхимы.
a) Доброкачественные (аденома, липома, фиброма, лейомиома, гемангиома и др.)
b) Злокачественные опухоли (аденокарцинома, саркома, смешанная опухоль Вильмса).
c) Метастатические опухоли почек.
II. Опухоли почечной лоханки.
a) Доброкачественные опухоли (папиллома, ендометриома).
b) Злокачественные опухоли (папиллярный рак, плоскоклеточный рак, саркома).
Большинство опухолей почки - светлоклеточные раки (аденокарциномы). Раковые опухоли почки характеризуются выраженной васкуляризацией и быстрым метастазированием.
Пути метастазирования:
– Лимфогенный - опухоли метастазируют в регионарные лимфатические узлы (паракавальные, парааортальные и в лимфатические узлы ворот почки).
– Гематогенный - метастазирование происходит чаще, чем лимфогенным путем. По поражаемости метастазами на первом месте стоят легкие, потом печень, кости, головной мозг.
Классификация рака почки (код МКХ - О С64) по системе TNM (5-е издание, 1997 год).
TNM Клиническая классификация
Т - Первичная опухоль
Тx - недостаточно данных для оценки первичной опухоли
Т0 - первичная опухоль не определяется
Т1 - опухоль до 7 см в наибольшем измерении, ограничена почкой
Т2 - опухоль свыше 7 см в наибольшем измерении, ограничена почкой
Т3 - опухоль распространяется на крупные вены или надпочечники, или околопочечные ткани, но в границах фасции Герота
Т3a - опухоль распространяется на надпочечник или околопочечные ткани, но в границах фасции Герота
Т3b - массивное распространение опухоли в почечную или полую вену(ы) ниже от диафрагмы
Т3c - массивное распространение опухоли в почечную или полую вену(ы) выше от диафрагмы
Т4 - опухоль распространяется за границы фасции Герота
N - Регионарные лимфатические узлы.
Nx - недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 - нет признаков поражения регионарных лимфатических узлов
N1 - метастаз рака в одном регионарном лимфатическом узле
N2 - метастазы рака в нескольких регионарних лимфатических узлах
М - Отдаленные метастазы
Мx - недостаточно данных для определения отдаленных метастазов
М0 - отдаленные метастазы не определяются
М1 - имеющиеся отдаленные метастазы
Клиника. Опухоль почки продолжительное время протекает безсимптомно. Классическая триада симптомов - опухоль, которая пальпируется; макрогематурия; боли в пояснице или в животе.
Намного чаще встречается один или два из этих симптомов.
O Гематурия - наиболее частое проявление болезни (наблюдается у 70% больных), причем у 45 - 50% больных гематурия - первый симптом заболевания, кровь в моче появляется внезапно, без предвестников боли.
O Боль у больных раком почки отмечается в 60 - 70% наблюдений.
O Повышение температуры тела иногда может быть единственным симптомом опухоли почки. Больные с лихорадкой неясного генеза должны подвергаться детальному урологическому обследованию.
O Потеря массы тела (в 30%).
O Недомогание, ночная потливость, анемия (15 - 30% больных).
O Паранеопластические синдромы (гиперкальциемия, полицитемия, гипертензия, печеночные дисфункции).
Диагностика.
O Общий анализ мочи проявляет гематурию.
O Общий анализ крови проявляет анемию, повышенное СОЭ.
O Цитологическое исследование мочи занимает значительное место при диагностике опухолей мочеточника и почечной лоханки. Исследованию подлежат образцы мочи, взятые в конце мочеиспускания или забранные катетером, соскобы со стенки мочевых путей, взятые при цистоскопии.
O УЗИ выявляет наличие опухолевой ткани (инфильтрат, который не образует “тени”). Кроме того, под контролем УЗИ выполняется прицельная пункционная биопсия опухоли, с забором материала для цитологического исследования.
O Хромоцистоскопия (ХЦС) - ендоскопическая процедура, которая позволяет провести осмотр мочевого пузыря, состояние устьев мочеточников, обнаружить кровотечение или выделение сгустков крови из устья мочеточника на стороне поражения.
O Уретероскопия - ендоскопическая процедура, которая разрешает провести осмотр и прицельную биопсию зоны поражения в мочеточнике.
O Екскреторная урография - один из ведущих исследовательских приемов, часто выявляет дефект заполнения чашечек (симптом ампутации чашечек). Исследование необходимо начинать с обзорной урографии, что дает информацию о локализации почки, ее контурах и размерах.
O Ретроградная уретеропиелография выявляет дефекты наполнения почечных чашечек, однако опасна возможностью инфицирования.
O Рентгенография грудной клетки выявляет легочные метастазы (типичное место метастазирования).
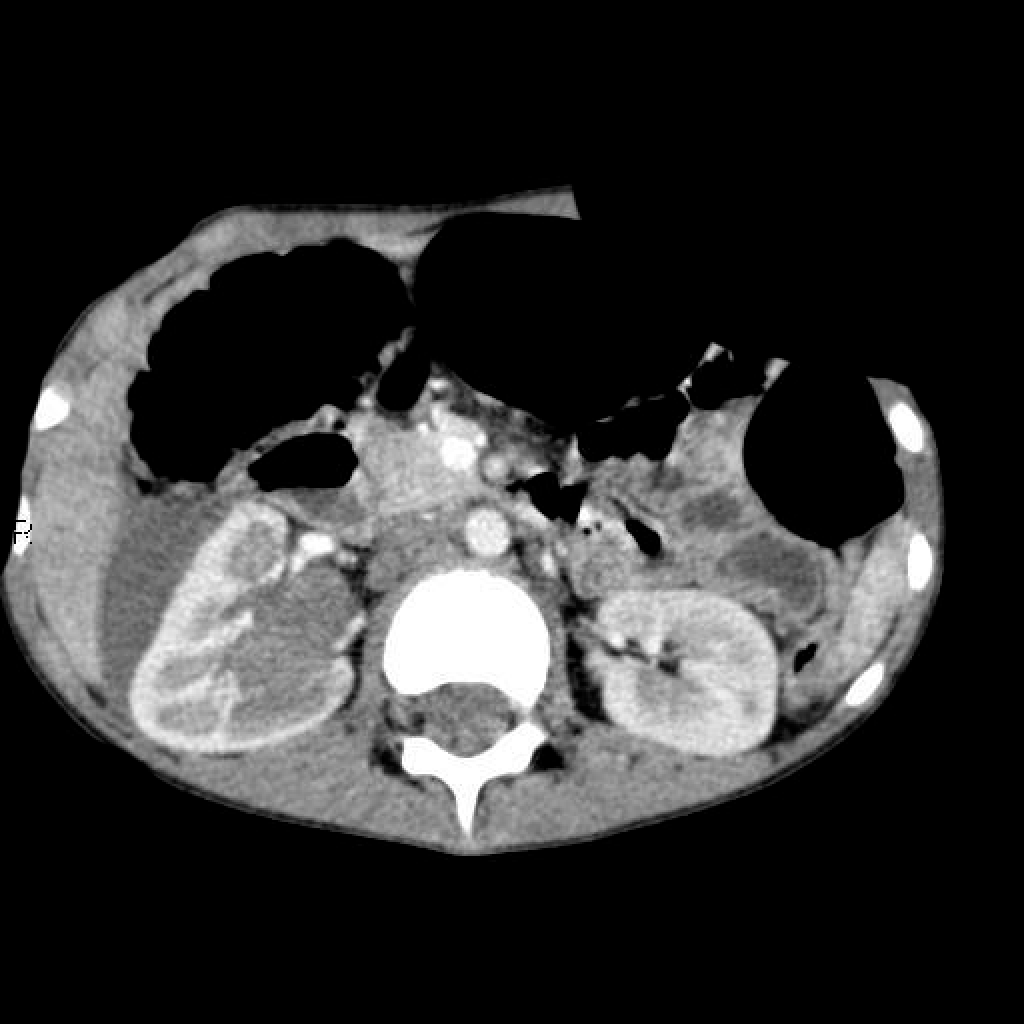
O КТ выявляет опухоль, ее распространение, наличие метастазов в регионарные лимфатические узлы, позволяет дифференцировать очень плотные мочекислые камни от опухолей.
O Ангиография почки разрешает обнаружить васкуляризацию опухоли. Аваскулярные опухоли почки - аденома, аденокарцинома. Гиперваскулярные опухоли - светлоклеточные, полиморфноклеточные, темноклеточные раки.
Лечение.
O Хирургическое лечение - радикальная нефректомия, с удалением лимфатических узлов - метод выбора для почечноклеточного рака I, II и III стадий. При IV стадии проводят симптоматическую терапию, но возможна и паллиативная нефректомия по жизненным показаниями.
O Лучевая терапия и химиотерапия - применяются в комплексном лечении, но они малоэффективны и имеют вспомогательный характер.
O Гормонотерапия - чрезвычайно малоэффективна. Может применяться как вспомогательное лечение после паллиативной нефректомии. Назначают: 17-?-оксипрогестерона капронат, тамоксифен, тестенат.
O Иммунотерапия - в последние годы считается наиболее эффективным и перспективным методом медикаментозного лечения. Применяют препараты a-интерферона.
Прогноз. Эффективность лечения определяется стадией заболевания. Пятилетнее выживание больных раком почки после радикальной операции составляет: при I стадии - до 70%; при II стадии - до 60%; при III стадии - до 30 %; при IV стадия - до 7%.
Б. Нефробластома (опухоль Вильмса)
Опухоль Вильямса встречается в возрасте от 6 мес. до 5 лет и составляет 20 - 30% всех злокачественных новообразований у детей. Двустороннее поражение составляет 3 - 10% случаев.
Этиология. Возможны мезодермальные, мезонефрогенные и метанефрогенные причины опухоли.
Патологическая анатомия. Микроскопическое строение значительно варьирует в разных опухолях и разных участках одного опухолевого узла. Встречаются саркоматозные, веретенообразные или звездчатые клетки, округлые мелкие недифференцированные клетки эмбрионального характера, атипичные эпителиальные клетки разной формы и размера.
Клиника. Безсимптомное образование в подреберье, которое определяется, как правило, родителями при купании ребенка или при клиническом обследовании. Образование с гладкой поверхностью, дольчатое, часто подвижное. Первые проявления в возрасте от 1 до 4 лет жизни; большинство пациентов в возрасте между 1 и 3 годами. Симптомы, которые проявляются на поздних стадиях заболевания - боль в брюшной полости, гематурия, анорексия. Опухоль пересекает срединную линию при увеличении в размерах.
Ассоциированные аномалии - опухоль Вильмса часто связана с врожденными аномалиями (аниридия, гермафродитизм, крипторхизм, аномалии мочевых путей и др.).
Диагностика. Методы диагностики такие же, как и при обследованные больных с подозрением на рак почки.
Клиническая классификация опухоли Вильмса
I стадия - опухоль ограничена почкой и может быть изъята при интактной капсуле;
II стадия - опухоль распространена за границы почки; при резекции выявляют поражение капсулы;
III стадия - наличие остаточной негематогенной опухоли в брюшной полости; прорастание капсулы; метастазы, которые не могут быть целиком удалены;
IV стадия - гематогенные метастазы в печень, легкие, кости, мозг;
V стадия - двусторонняя опухоль (поражение обеих почек).
Лечение. В лечении опухоли Вильмса может быть применен комплексный подход.
· Хирургическое лечение - оперативное вмешательство зависит от стадии опухоли (IV и V стадии оперативному лечению не подлежат).
u Радикальная нефректомия.
u Резекция почки с опухолью (при отсутствии противоположной почки или при его аномалии).
u Диагностическая лапаротомия, ревизия противоположной почки, удаление или биопсия парааортальных лимфатических узлов.
· Химиотерапия в лечебных целях: применяется актиномицин D и винкристин.
u Препараты назначают после операции всем пациентам со II и III стадией опухоли Вильмса и некоторым пациентам с I стадией.
u При IV и V стадиях заболевания химиотерапию назначают до операции.
u Пациентам с распространенной опухолью назначают доксорубицин.
· Лучевая терапия - показана при лечении III - V стадий опухоли.
Прогноз . Выживание пациентов зависит от гистологического строения опухоли. Лечебный 2-годичный уровень выживания составляет: при стадии I - 90%; при стадии II - 80 - 85%; при стадии III - 70 - 75%; при стадии IV - 60 - 65%; при стадии V - 50%.
Обновление статических данных: 04:00:02, 19.07.20
Отдаленные последствия лечения. Одним из главных факторов, позволяющих достоверно оценить эффективность лечения детей с раковыми опухолями, является возможность развития поздних отрицательных эффектов терапии. Известно, что в последнее время при использовании различных современных NWTS-протоколов лечения выживаемость при опухоли Вильмса превышает 85%. Одна из основных целей NWTS-3 и -4 исследований — свести к минимуму интенсивность и продолжительность терапии у детей, принадлежащих к прогностически благоприятным категориям.
Развитие второй злокачественной опухоли. Анализ историй болезни 487 детей с опухолью Вильмса, лечившихся в Dana-Farber Cancer Institute с 1927 по 1981 г., показал, что у 11 пациентов (2%) возникла вторая злокачественная опухоль через 7—34 года после лечения (в среднем через 17 лет). В 10 случаях из 11 это была злокачественная опухоль мягкотканного происхождения в зоне облучения. Анализ данных показывает, что вероятность развития второй злокачественной опухоли составляет 6% через 20 лет и 18% через 34 года. Подобные же результаты имеются в сообщениях как группы по изучению отдаленных результатов, так и NWTS.
Из 2438 пациентов, зарегистрированных в NWTS-протоколах с 1969 по 1982 г., у 15 развилась вторая злокачественная опухоль (SMN - second malignant neoplasm). Этот показатель частоты развития второй опухоли оказался в 8 раз выше, чем предполагалось.
Через 10 лет приблизительно у 1% выживших возникла SMN. Виды вторых опухолей разнообразны: в 6 случаях это были лейкоз или лимфома, в трех — гепатоцеллюлярная карцинома и в трех — мягкотканная саркома. Поэтому для своевременной диагностики SMN дети с опухолью Вильмса, выжившие после лечения и длительно живущие, требуют целенаправленного наблюдения, даже когда они стали уже взрослыми.
Репродуктивные проблемы. Из других отдаленных последствий лечения опухоли Вильмса, хорошо известных и документированных, следует назвать проблемы деторождения, беременности, рождения детей недоношенных или с низкой массой тела. В 1982 году был проведен обзор развития репродуктивных функций у 36 выживших пациентов с опухолью Вильмса (27 женщин и 9 мужчин). У их детей отмечено значительное увеличение, по сравнению с общей популяцией, перинатальной смертности (6,7%), связанной в основном с недоношенностью или низкой массой тела при рождении. Большинство проблем относительно беременности отмечались у женщин, которые в прошлом получали лучевую терапию на живот. Риск рождения маловесных детей в этой группе составил 30%.
Потомство мужчин, лечившихся в детстве по поводу опухоли Вильмса, не относилось к группе риска. Частота больших врожденных аномалий была не выше, чем в общей популяции. Ни у кого из детей в течение всего периода наблюдения не развивались ни опухоль Вильмса, ни другие злокачественные новообразования. Последующие исследования подтвердили эти данные.
В другом исследовании указывается, что из 114 беременных женщин, выживших после лечения опухоли Вильмса и подвергавшихся лучевой терапии, у 34 беременность протекала неблагоприятно, в том числе 17 детей погибли в перинатальном периоде и 17 родились с низкой массой тела. В отличие от этой группы, среди 77 беременных женщин, которые не получали лучевой терапии (или жен мужчин, которые не получали лучевой терапии), только в 2 случаях (3%) отмечались различные неблагоприятные последствия.
Все это говорит о снижении репродуктивной функции у женщин и мужчин, лечившихся в детстве по поводу опухоли Вильмса, а потому при возникновении беременности необходима пренатальная диагностика и всех беременных женщин следует относить к группе высокого риска, обследуя их по соответствующей программе.
Светлоклеточная саркома
Последующее изучение подтвердило наличие характерных морфологических и клинических особенностей СКС, в результате чего ее перестали считать вариантом нефробластомы, выделив как самостоятельную злокачественную опухоль почечного происхождения.
Из 1888 препаратов, представленных в NWTS с 1969 по 1983 год, в 75 случаях (4%) установлен диагноз СКС. Средний возраст, в котором появлялись клинические симптомы, равнялся 3 годам. У мальчиков эта опухоль встречалась намного чаще (мальчики : девочки=1,7 : 1). Макроскопически во время лапаротомии не было никаких определенных признаков, позволявших отдифференцировать СКС от опухоли Вильмса. На разрезе СКС имеет желтовато-коричневый цвет. Часто видны кистозные пространства, но кровоизлияния и некроз встречаются редко.
В большинстве случаев СКС имеет четкую гистологическую картину, которая заключается в наличии четко очерченных полигональных клеток со свет-ловодянистой цитоплазмой и везикулярным ядром, имеющим форму от овоидной до округлой, ядрышки в нем незаметны. Ультраструктуральное строение этих опухолей хорошо описано в деталях в других руководствах.
Что касается клинических особенностей, то здесь можно выделить ряд важных обстоятельств. Не существует сообщений о мультицентричных или двусторонних СКС. Частота метастазов СКС в кости у детей составляет 23%. Для сравнения — только у 0,3% всех детей, вошедших в NWTS-3, развилась опухолевая диссеминация в костные структуры. Стандартное рентгенологическое обследование было более информативным в определении поражения костей, чем радионуклидное сканирование, однако два этих метода должны использоваться вместе, поскольку они дополняют друг друга.
Пациенты с СКС обладают значительно более высоким риском развития метастазов в мозг (17%), что говорит о необходимости проведения не только стандартного рентгенологического обследования костей, но и сканирования головного мозга. Прогноз при костных метастазах у детей плохой — из 19 детей выжили 3 (16%).
Лечение детей с СКС отличается от лечения пациентов с опухолью Вильмса. Согласно последним современным рекомендациям, всем пациентам с СКС (стадии от I до IV) должна производиться нефрэкто-мия и лучевая терапия (1080 сГр) на область ложа опухоли. Применяется трехкомпонентная химиотерапия (актиномицин D, винкристин, доксорубицин). Прогноз при СКС существенно улучшился с тех пор, как к химиотерапевтическому протоколу был добавлен доксорубицин (см. табл. 63-2).
По данным NWTS-1 и -2, из 31 ребенка с СКС у 20 возник рецидив (65%) и 15 умерли (48%), в то время как из 55 детей с СКС, лечившихся в NWTS-3, рецидив развился в 31% случаев, а 2-летняя выживаемость составила 90%.м Поздние рецидивы представляют серьезную проблему у детей с СКС. Выживаемость через 4 года снижается до 72,6%. Все это убеждает в необходимости очень внимательного наблюдения в отдаленном периоде за пациентами, получавшими лечение по поводу СКС.
Рабдоидные опухоли
Рабдоидная опухоль обладает агрессивностью и появляется у детей очень рано. Средний возраст, в котором устанавливается диагноз — 1 год и 4,8 месяца. У мальчиков РОП встречаются чаще, чем у девочек (1,5: 1). В противоположность опухоли Вильмса, РОП редко ограничивается (ко времени ее выявления) пределами почки. Когда возникает клиническая симптоматика, то у 80% детей уже имеется III или IV стадия заболевания.
В противоположность СКС, результаты лечения РОП нельзя назвать сколько-нибудь успешными. Несмотря на трехкомпонентную химиотерапию (актиномицин D, винкристин, доксорубицин), улучшения в отношении отдаленных результатов не отмечено, а 3-летняя выживаемость меньше 20%. Из 57 пациентов с РОП, зарегистрированных в протоколах NWTS, у которых развился рецидив, 55 умерли в результате прогрессирования опухоли (96%).
Метастазы обычно возникают во многих местах, но наиболее часто — в легких (70%). Дети с РОП имеют также предрасположенность к развитию опухолей головного мозга. По данным одной из работ, среди пациентов с РОП и развившимися интракраниальными опухолями у 14% опухоли мозга гистологически отличались от первичной ренальной опухоли. Учитывая сказанное, всем детям с рабдоидными опухолями почек рекомендуется при первом же обследовании проводить сканирование головного мозга.
Врожденная мезобластная нефрома
Врожденная мезобластная нефрома (ВМН) была выделена как самостоятельная опухоль почки в 1967 году после описания ее характерной клиникогистологической картины. До этого сообщения ВМН расценивалась как вариант опухоли Вильмса и поэтому грудным детям с ВМН проводилась лучевая и химиотерапия. Последующий обзор 48 случаев вновь подтвердил доброкачественную природу ВМН, в результате чего было установлено, что методом выбора в лечении ВМН должна быть нефрэктомия, при этом нет необходимости ни в лучевой, ни в химиотерапии.
В 1982 году был проведен анализ наблюдений ВМН, зарегистрированных в протоколах NWTS. 51 случай ВМН составил 2,8% среди всех наблюдений NWTS. Диагноз устанавливался в возрасте (в среднем) 3,4 месяца. У мальчиков опухоль встречалась значительно чаще (1,8: 1). Наиболее характерным клиническим проявлением было обнаружение (пальпаторное) опухолевидного образования в животе (94%). У 9 детей (18%) отмечалась гематурия.
У 43 пациентов опухоль была удалена полностью, однако в 8 случаях она прорастала окружающие периренальные мягкие ткани, поэтому удалить ее полностью не удалось. Нередко (20%) отмечался интраоперационный разрыв опухоли. Несмотря на указанные трудности в лечении, исходы заболевания были благоприятными — выжили 50 пациентов. Только у одного ребенка отмечался рецидив интраабдоминальной опухоли. Умер из этих больных лишь один новорожденный ребенок, у которого развилась нейтропения и сепсис после химиотерапии. Результаты проведенного анализа говорят о том, что в большинстве случаев при лечении ВМН у детей единственным методом выбора является хирургическое удаление опухоли.
Предпринимались попытки установить какие-либо критерии, позволяющие распознавать потенциально агрессивные варианты ВМН, имеющие склонность к метастазированию и локальным рецидивам. К таким вариантам ВМН относятся атипичные или целлюлярные мезобластные нефромы. Они могут требовать адъювантной химиотерапии. При обзоре 38 случаев целлюлярных ВМН рецидив отмечен в 7 наблюдениях (18%).
Нет каких-либо специфических гистологических особенностей, которые позволяли бы предсказать возможность развития рецидива. Хотя у грудных детей более старшего возраста (не новорожденных) отмечается повышенный риск рецидивирования, тем не менее только возраст сам по себе не является показанием к адъювантной терапии.
Единственный прогностический фактор, позволяющий предсказать вероятность развития рецидива, — это невозможность полностью удалить опухоль. Поэтому, если целлюлярная ВМН удалена полностью, то адъювантная химиотерапия не требуется. Пациенты, у которых оставлены элементы опухоли по краям резецированного препарата или у которых произошел интраоперационный разрыв опухоли, являются кандидатами на химиотерапию, которая проводится комбинацией винкристина, доксорубицина и циклофосфамида.
- нефробластома
- опухоль
Нефробласто́ма (опухоль Вильмса) — злокачественная опухоль почки встречающаяся преимущественно у детей до 4 лет.
Опухоль Вильмса наиболее часто встречающаяся в педиатрической практике опухоль почки, составляющая более 85% всех случаев опухолей почек у детей [1,3] и 6% раков детского возраста [2]. Обычно возникает в раннем детском возрасте (1-11 лет) с пиком выявляемости от 3 до 4 лет. Приблизительно 80% опухолей выявляется до достижения ребенком 5-и летнего возраста. Гендерная предрасположенность отсутствует, однако выявляемость происходит несколько позже у девочек [2]. В подавляющем большинстве, поражение одностороннее, менее чем в 5% случаев - двустороннее.
Клинически нефробластома обычно представляет собой безболезненное образование в верхнем квадранте живота. Гематурия встречается в
20% случаев [2], болевой синдром не характерен. При физикальном обследовании у 25% пациентов выявляется повышенное артериальное давление за счет чрезмерной продукции ренина [1], приобретенная болезнь Виллебранда встречается в 8% случаев [2]. Большинство родителей приводят ребенка к врачу, обнаружив у него пальпируемое опухолевидное образование в животе или увеличение объема живота (83%). Другие жалобы включают в себя лихорадку (23%).
Опухоль Вильмса обычно представляет собой крупное гетерогенное солидное объемное образование, оттесняющее прилежащие структуры. Иногда нефробластома бывает преимущественно кистозной.
Метастазирование чаще всего происходит в легкие (85% случаев), печень и регионарные лимфатические узлы [1]. Подобно почечно-клеточному раку, опухолевый тромбоз почечных вен, нижней полой вены и правого предсердия являются признаками запущенного заболевания.
Обзорная рентгенография брюшной полости позволяет визуализировать мягкотканное образование смещающее петли кишечника. Но надо понимать, что это имеет значение только в виде случайной находки, а рентгенография никогда не должна использоваться в виде модальности выбора для диагностики опухолей брюшной полости и забрюшинного пространства, исключением может служить только полное отсутствие других модальностей.
УЗИ практически в любой ситуации является первичной модальностью выбора. Ультразвуковое исследование помогает локализовать опухоль почки, а также исключить другие неопухолевые заболевания почек (напр. гидронефроз). Хотя большинство отличительных черт выявляемых при КТ/МРТ можно выявить и при УЗИ, КТ или МРТ требуются для адекватного стадирования болезни и входит в протокол стадирования в США и Европе [4]. Доплеровское сканирование позволяется оценить наличие опухолевых тромбов в нижней полой вене.
Нефробластома представляет собой образование с гетерогенной мягкотканной плотностью, иногда (
15%) содержащее кальцинаты [5] и включения жировой плотности. Контрастное усиление как правило пятнистое, и позволяет лучше визуализировать границы образования относительно невовлеченной паренхимы почки. В 20% случаев на момент установки диагноза имеется метастатическое поражение легких.
При доступности МРТ, данная модальность является модальностью выбора для стадирования в виду отсутствия ионизирующего излучения. Кроме того МРТ позволяет наиболее адекватно оценить степень вовлечения внутренней полой вены [1]. Опухоль Вильмса гетерогенная на всех видах последовательностей и часто содержит продукты распада гемоглобина.
- T1: гипоинтенсивный сигнал
- T1 с парамагнетиками (гадолиний): гетерогенное усиление
- T2: гиперинтенсивный сигнал
Сцинтиграфия не является рутинной методикой, так как опухоль поздно метастазирует в кости скелета. ПЭТ-КТ с фтордезоксиглюкозой используется для дифференцировки рубцовых изменений и активности в остаточной опухолевой ткани.
Односторонняя опухоль Вильмса, как правило лечится комбинировано путем нефрэктомии и химиотерапии. Иногда химиотерапия назначается до иссечения, для понижения стадии опухоли [1]. Лучевая терапия имеет ограниченное значение, но может использоваться в случаях брюшинного распространения или неполной резекции [1]. При использовании современных методов лечения, излечение возможно в
90% случаев. Рецидивирование встречается как в ложе опухоли так и в отдаленных областях (напр. легких или печени) 2.
В 1899 году Вильмс в своей монографии дал обзор литературы по опухолям почек у детей. С этого времени эти новообразования стали известны как опухоли Вильмса. Многие годы эта бластома служила моделью по изучению проблем детской онкологии в целом.
ОПУХОЛИ МОЧЕПОЛОВЫХ ОРГАНОВ
В последнее время опухоли почки встречаются чаще, что следует объяснять значительным улучшением диагностики, причем в более ранних стадиях заболевания. Доброкачественные новооб-
348
разования паренхимы почки наблюдаются редко. Самым частым видом опухоли почки является рак почечной паренхимы. Эпителиальные опухоли почечной лоханки и мочеточника встречаются значительно реже, чем опухоли паренхимы, составляя 16 % от всех опухолей почки и верхних мочевых путей. Опухоли почки у взрослых составляют 2—3 % от числа всех новообразований. Мужчины болеют чаще (примерно в 2 раза), чем женщины. Преимущественный возраст больных от 40 до 60 лет. Опухоли почек у детей составляют 20—50 % всех опухолей, диагностируемых в детском возрасте. По частоте они диагностируются одинаково у девочек и мальчиков. Среди опухолей почки доброкачественные обнаруживаются редко. Злокачественные опухоли у детей в 95 % смешанные, их принято называть опухолями Вильмса.
Этиология. Причина возникновения опухолей почки изучена еще недостаточно. В некоторых экспериментальных работах показано, что опухоли почки у животных, в частности у хомяков (самцов), могут быть вызваны путем введения гормональных препаратов — эстрогенов. Это позволяет предполагать, что и у человека некоторое значение в генезе опухоли почки может иметь нарушение гормонального баланса. Вместе с тем в эксперименте получены опухоли почки и под воздействием лучевой энергии — развитие аденом и аденокарцином почки у крыс после их облучения.
С приведенными экспериментальными данными перекликаются отдельные клинические наблюдения — появление опухоли почки через многие годы после применения с рентгенодиагностичес-кой целью радиоизотопного препарата торотраста — 232 Т. Канцерогенное действие препарата объясняют его радиоактивностью. В литературе имеются указания и на значение некоторых химических веществ в генезе опухоли почки: антрохинолина и других химических соединений, относящихся к углеводородам, нитрозаминам, ароматическим аминам.
Таким образом, в генезе опухолей почки могут играть роль факторы различного рода — гормональные, лучевые, химические. По-видимому, опухоли почки, как и большинства других органов, представляют собой заболевания полиэтиологические.
Классификация. Поскольку опухоли почечной паренхимы и опухоли лоханки во многом отличаются как по структуре, так и по путям распространения процесса и требуют различных оперативных методов лечения, оправдано их выделение в отдельные группы.
В настоящее время принята следующая классификация опухолей почки.
1. Опухоли почечной паренхимы.
А. Доброкачественные опухоли: аденома, липома, фиброма,
миома, ангиома и гемангиома, лимфангиома, хондрома,
остеома, миксома, дермоид.
Б. Злокачественные опухоли: рак (аденокарцинома), фиб-
ро-, мио-; липо-, ангиосаркома, смешанная опухоль Вильмса. В. Вторичная (метастатическая) злокачественная опухоль почки. 2. Опухоли почечной лоханки.
А. Доброкачественные опухоли: папиллома, ангиома. Б. Злокачественные опухоли: папиллярный рак, плоскоклеточный рак, слизисто-железистый рак, саркома. Весьма важна классификация злокачественных опухолей
почки по стадиям процесса. Наиболее распространена четырех-
Опухоль в пределах почечной капсулы.
Вовлечение сосудистой ножки или околопочечной жировой
Поражение регионарных лимфатических узлов.
Наличие отдаленных метастазов.
Международное агентство по изучению рака предложило классификацию злокачественных опухолей почки по системе TNM, где Т (tumor) — стадия первичной опухоли, N (noduli iympha-tici) — регионарные лимфатические узлы, М (metastases) — отдаленные метастазы.
В этой классификации приняты следующие обозначения: Т1 —опухоль малых размеров, не меняющая контура почки; Т2 — большая опухоль, изменяющая почечный контур, однако
не нарушающая непрерывности почечной капсулы; ТЗ — распространение опухоли в околопочечную ткань; Т4 — опухоль проникает в прилежащие органы или брюшину.
О — нет поражения регионарных лимфатических узлов; N1 — поражение одного регионарного гомолатерального лимфатического узла; N2 — поражение билатеральных или множественных контрала-
теральных регионарных лимфатических узлов; N3 — несмещаемые метастатические регионарные лимфатические
N4 — поражение юкстарегиональных лимфатических узлов; NX — не выполнены минимальные требования для оценки состояния регионарных лимфатических узлов. МО — отсутствие отдаленных метастазов; Ml — наличие отдаленных метастазов; MX—не выполнены минимальные требования для распознавания
Таким образом при опухоли паренхимы почки, имеющей большие размеры и изменяющей контур почки, однако не нарушающей непрерывности почечной капсулы (Т2), при отсутствии признаков поражения регионарных лимфатических узлов (N0), без отдаленных метастазов (МО) следует применить сокращенную форму описания стадии заболевания — T2N0MO.
Кроме обозначений TNM, для характеристики распространенности опухолевого процесса применяют индекс V, описывающий поражение почечной вены опухолью. При отсутствии опухолевого
тромба в вене устанавливают значение индекса V0, поражение почечной вены опухолью обозначают — VI, распространение опухолевого тромба на нижнюю полую вену — V2.
Патологическая анатомия. Злокачественная опухоль почки может Поражать любые ее сегменты. Величина опухоли почки может быть различной: от едва видимых простым глазом узелков до. образований огромных размеров.
Макроскопически раковая опухоль почки состоит из одного или нескольких узелков округлой или овальной формы. Поверхность почки чаще бугристая. На разрезе опухоль имеет характерный пестрый вид, в ее ткани встречаются участки желтовато-коричневого и красного цвета (вследствие кровоизлияний), оранжевого или желтого (от наличия липоидных веществ), серого (от распада мукоидов). Иногда отмечается петрификация паренхимы, в редких случаях — обызвествление всей опухоли. Опухоль может содержать очаги некроза, старые и свежие кровоизлияния. В очагах распада иногда образуются кистозные полости различной величины.
Консистенция опухоли мягкоэластическая. Она растет в сторону фиброзной оболочки, растягивая ее и деформируя почку, но возможен и рост в сторону чашечно-лоханочной системы, когда опухоль частично или даже полностью заполняет ее. Весьма характерно для рака почки прорастание в почечную и нижнюю полую вену в виде языка. Опухоли небольшого размера окружены четкой, видимой на глаз капсулой.
Гистологическое строение аденокарциномы почки разнообразно, однако в типичном случае выявляют тяжи и скопления крупных полигональных клеток со светлой протоплазмой, содержащей гликоген и липоиды.
Значительно более редкими формами опухоли, обнаруживаемыми при гистологическом исследовании, являются липомы, фибромы, миомы, гемангиомы, лимфангиомы, саркомы, гамартомы. Из них чаще всего встречаются гемангиомы и саркомы.
Метастазирование. Злокачественные опухоли почки метастазируют гематогенным и лимфогенным путем, Метастазы наблюдаются более чем у половины больных.
На первом месте по частоте метастазирования рака почки стоят легкие, затем кости, печень, головной мозг. Эта закономерность обусловлена наличием тесной связи между венозной системой почки и магистральными сосудами грудной и брюшной полостей, а также венозной сетью скелета.
Нередко метастаз рака почки проявляется клинически раньше, чем первичный очаг заболевания. Особенностью рака почки является сравнительно частое появление метастазов через много лет (10—15 и даже 20) после удаления первичной опухоли. В то же время другая особенность этого вида рака состоит в том, что его легочные метастазы в некоторых случаях склонны к регрессии после удаления первичного очага.
Читайте также:

