Молекулярная и клеточная медицина рака
Последние научные разработки в области ядерной медицины предусматривают альтернативы дополнительного лечения, особенно для больных неоперабельным раком. Подобное лечение имеет свойство целенаправленного на раковую ткань лечения и позволяет продлить жизнь и повысить её качество.
Лечение отталкиваясь от свойства раковых клеток
Современный подход к лечению рака чаще всего оценивается под названием "целенаправленное лечение". Цель этого лечения это раковые клетки. Имеющие свойство анормального размножения, раковые клетки отличаются от здоровых клеток в связи с разными белками которые находятся на оболочки клетки или с некоторыми молекулами которые находятся внутри клетки. В последние годы, с помощью специальных молекул, которые способны определить характеристику или слабые стороны раковых клеток, разрабатываются новые целенаправленные (умные) методы лечения. Эти специальные молекулы, которые способны находить раковые образования, вводятся в организм через рот или через вену.
Молекулярные технологии нацелены на раковую ткань
Если имеется молекула которая имеет свойство целевого направления на раковую клетку, отталкиваясь от назначенного лечения возможно загрузить в молекулу лекарство, атом или другие уничтожающие агенты. С помощью лечебных агентов загруженных в молекулу-носителя возможно будет целенаправленно уничтожить зараженную ткань на клеточном уровне. Таким образом возможно будет использовать более высокие дозы с минимальным повреждением здоровых тканей.
Новые альтернативы лечения для неоперабельных больных
Молекулярное лечение является новым оружием в борьбе с раком. Подобное лечение даёт ещё один шанс неоперабельным пациентам или пациентам, которые испробовали все остальные методы лечения. Для болезней на более распространённых стадиях, подобное лечение используется в качестве последнего удара по раковым клеткам. Но по мере накопления опыта, в дальнейшем возможно будет использовать подобное лечение на более ранних стадиях заболевания.
Использование молекулы-носителя при сканирование
Сканирование раковых клеток распространенных по всему организму происходит на основании той же логики что и при лечении. Загруженные в молекулу-носителя специальные агенты, которые добываются отталкиваясь от свойства раковых клеток, направляются в область ракового распространения и таким образом позволяют определить распространение заболевания по всему организму. Если сравнивать с предыдущими методами сканирования, молекулярное сканирование позволяет добиться более успешных результатов в качестве анализирования распространения заболевания. С помощью одного и того же метода, возможно использовать агенты позволяющие определять распространение заболевания и одновременно лечить его. Подобные агенты называются тераностические агенты (латинское сочетание слова лечение и диагностика). Подобные агенты помимо лечения так же позволяют более эффективно определить распространение лекарственного препарата по организму и ход заболевания.
Метод эффективно используется при раке простаты (предстательной железы)
Новые молекулярные методы лечения и диагностики начали использоваться, и со временем будут чаще использоваться, при лечении и диагностики рака простаты. В крови имеется раковый показатель более известный как ПСА. После установления диагноза рака простаты, с помощью методов сканирования определяется стадия заболевания. Методы сканирование при раке простаты используют один и тот же путь что и молекулярные целенаправленные методы лечения. Используя белок ПСМА, который специфичен для рака простаты, был создан метод сканирования под названием ПЭТ-КТ. ПСМА ПЭТ-КТ позволяет определить наличие метастазов и таким образом предотвратить ненужные вмешательства и лечения больным с раком простаты. Помимо этого, пациентам с метастазирующим и невосприимчивыми к стандартному лечению заболеванием, возможно провести целенаправленное лечение с использованием высоко энергичного атома лютеций 177. При раке простаты помимо лютеция недавно начали использовать молекулярное лечение с радием 223. С радием 223, возможно нацеливаться на костные метастазы гормонально устойчивого рака простаты. Исследования доказали, что с помощью лечения радием 223 возможно продлить срок выживаемости больным раком простаты с распространенными костными метастазами.
Атомные шарики при лечении рака
При раке печени возможно уничтожить раковую ткань с помощью радиоактивных микрошариков которые внутривенно запускаются в зараженную область. Подобный метод лечения называется радиоэмболизация или лечение радио-микрошариками и проводится совместно со специалистами таких областей медицины как, ядерная медицина, радиология и медицинская онкология. Лечение возможно использовать, как и при раке печени так же и при метастазах в печень от другой первичной опухоли. В лечении используются микрошарики начиненные радиоактивным веществом с высокой энергией; yttrium-90. Радиоактивные микрошарики внутривенно вводятся в область, питающую раковую опухоль с помощью ангиографии. Таким образом, микрошарики способны уничтожить раковые клетки и областные распространения с помощью радиоактивных лучей. Подобное лечение способно остановить рост заболевания, сократить опухоль в размерах и повысить срок выживаемости. Лечение больше всего предпочитается в случаях, когда больной испробовал все имеющиеся лечения и когда опухоль не подлежит хирургическому вмешательству. Для проведения лечения радиоактивными микрошариками такие показатели как возраст, физическое состояние больного, состояние печени, распространение заболевания имеют очень важное значение.
Лечение продлевает продолжительность жизни при нейроэндокринным типе рака
При лечении нейроэндокринных разновидностей рака, так же возможно использовать радиоактивные методы лечения. Подобное лечение называется пептид-рецепторная радионуклидная терапия (ПРРТ). Нейроэндокринные опухоли (НЭО) состоят из пептид рецепторов соматостатина и могут образоваться в таких органах как желудок, поджелудочная железа, кишечник, щитовидная железа и лёгкие. Перед началом лечения с помощью ПЭТ-КТ определяется распространение рецепторов по опухоли и их количество. Помимо этого так же определяется распространение заболевания (метастазирование) по всему организму и устанавливается доза лечения. Во время лечения, радиоактивные пептиды внутривенно вводятся в организм и целенаправленно прикрепляясь к раковым клеткам, уничтожают их за счёт радиоактивных лучей. После лечения пациентам возможно будет необходимо несколько дней остаться в больнице. Обычно подобное лечение продолжается 3-5 курсов. Подобное лечение проводится при неоперабельных, обширно метастазирующих и не подлежащим химиотерапевтическому лечению опухолях. С помощью подобного лечения, из трёх пациентов у одного бывает возможно получить положительный эффект и у половины пациентов бывает возможно остановить рост заболевания.
Лечение радиоактивным йодом рака щитовидной железы
Лечение радиоактивным йодом (атомное лечение) является самым известным и часто используемым радионуклидным лечением при раке щитовидной железы. Лечение используется уже долгие годы и является лечением, чья надежность и эффективность была неоднократно доказана. Подобное лечение проводится после оперативного лечения пациентам с диагноз рака щитовидной железы. После того как вся щитовидная железа удаляется хирургическим вмешательством, радиоактивный йод накопляется в остаточных раковых клетках и с помощью радиоактивных лучей позволяет уничтожить оставшиеся микроскопические клетки. Так же при рецидиве заболевания, при необходимости лечение проводится с более высокими дозами. Радиоактивный йод применяется оральным путём в качестве капсулы или жидкости.
Радиоактивные лечения бывают эффективны при некоторых опухолей детского возраста
Возможно использовать вещества связанные с радиоактивным йодом под названием МИБГ, для лечения одной из опухолей детского возраста, невробластомы. МИБГ имеет похожие свойства с пептидом под названием норепинефрин, который используется раковыми клетками. МИБГ связывается с радиоактивным йодом и вводится в организм внутривенным путём. Подобное лечение, целенаправленно уничтожая раковые клетки, помогает 1/3 пациентам с неоперабельным заболеванием на распространенной стадии. Лечение МИБГ так же может быть эффективным у подходящих пациентов с диагнозом нейроэндокринного рака.
Использование при лимфоме (рак лимфатических узлов)
При раке лимфатических узлов (лимфоме) который не реагирует на другие онкологические методы лечения, радионуклидная терапия может быть альтернативным методом лечения. Подобное лечение возможно применить для подходящих больных лимфомой низкой степени. Связанные с Yttrium-90 или Йод-131 антикоры под названием CD20, целенаправленно направляются к антикорам находящимся в раковых клетках и на микроскопическом уровне уничтожают их методом высокодозными радиоактивными лучами. С помощью данного метода больше чем у половины пациентов, чьё заболевание сопротивляется другим методам онкологического лечения, возможно добиться положительный ответ.
Не травмирует больных
Атомные методы лечения не наносят сильный вред здоровым тканям и таким образом не травмируют больных как химиотерапия и радиотерапия. Во время лечения радиотерапией, радиоактивные лучи помимо раковой ткани так же затрагивают и приносят вред здоровым тканям. При атомных лечениях облучение не затрагивает весь организм. С помощью свойства целенаправленного влияния, только раковая опухоль и её окружность подвергается облучению и таким образом возможно в значительной степени защитить здоровые ткани организма. Но важно принять меры защиты тех мест откуда будет выходить не использованная часть атома.
Видимая часть айсберга
Ядерная медицина не используется при каждой разновидности рака. Ядерная медицина является быстро развивающийся областью медицины и используется при лечении таких заболеваний как; нейроэндокринные опухоли, некоторые разновидности лимфомы, рак печени, диффузный токсический зоб, рак щитовидной железы, некоторые разновидности опухолей детского возраста, специально выбранные больные раком простаты. Для того что бы правильно принять решение о лечении, пациент начиная с диагностики должен оценивается многопрофильной командой состоящей из специалистов разных областей медицины. Учитывая достигнутые успехи, будет правильно назвать сегодняшние достижения видимой частью айсберга.
Молекулярные процессы в опухоли
Каждая здоровая клетка содержит молекулу ДНК, из которой она считывает информацию, какую форму и специальность получить, какие белки и ферменты производить, а главное, когда делиться и умирать. Подробнее о том, как это происходит почитайте в нашем первом материале .
Мутации в протоонкогенах и генах-супрессорах, отвечающие за деление и смерть клетки, приводят к тому, что клетка перестает следовать инструкции и синтезирует белки и ферменты неправильно. Молекулярные процессы выходят из-под контроля: клетка постоянно делится, отказывается умирать и копит генетические и эпигенетические мутации. Поэтому злокачественные новообразования часто называют болезнью генома.
Драйверные мутации создают различные популяции клеток, что обеспечивает разнообразие опухоли. Эти популяции или клоны по-разному реагируют на лечение: некоторые из них устойчивы и приводят к рецидиву. К тому же разная чувствительность клонов к терапии может привести к радикальному изменению молекулярного профиля в ходе лечения: даже незначительные в начале популяции клетки могут получить преимущество и стать доминирующими в конце лечения, что приведет к устойчивости и развитию опухоли.

Источник: Cell .
Иллюстрации: Майкл Ковальски .
Молекулярная диагностика
Драйверные мутации, изменения в количестве или структуре белков используют в качестве биомаркеров — мишеней, по которым подбирают лечение. Чем больше мишеней известно, тем более точным может быть выбор из потенциально эффективных схем лечения.
Отделить драйверные мутации от остальных и определить молекулярный профиль опухоли непросто. Для этого применяется технология секвенирования, флуоресцентной гибридизации in situ (FISH), микросателлитного анализа и иммуногистохимии.
Методы секвенирования нового поколения позволяют выявить драйверные мутации, включая те, что делают опухоль чувствительной к таргетной терапии.
Флуоресцентная гибридизация in situ (FISH).
Микросателлитный анализ показывает степень нарушения системы репарации ДНК, а иммуногистохимия — белковые биомаркеры, расположенные на поверхности, в цитоплазме и ядрах опухолевых клеток.
Специалисты Solo исследуют до 450 генов и биомаркеров, чтобы оценить, как опухоль может ответить на применение более таргетных препаратов для лечения онкологических заболеваний. Для некоторых из них анализ биомаркера продиктован производителем. Для других используют данные клинических исследований и рекомендации международных сообществ онкологов.
Помимо выбора мишеней для таргетной терапии, молекулярное профилирование помогает обнаружить мутации, которые напротив, делают опухоль устойчивой к определенному лечению, или генетические особенности, которые связаны с повышенной токсичностью и требуют индивидуального подбора дозы лекарства.
Для исследований используется материал биопсии или парафинизированные блоки послеоперационного материала.
Молекулярное профилирование дает дополнительную информацию о заболевании, но она не всегда применима для выбора лечения. Например, в ситуациях, когда стандартная терапия обладает достаточной эффективностью или показано хирургическое лечение. Можно определить клинические ситуации когда такое исследование может быть наиболее полезно:
- Редкий вид опухоли;
- Опухоли с неустановленным первичным очагом (неизвестно, где изначально появилась опухоль, давшая метастазы);
- Тех случаев, когда требуется выбор из нескольких вариантов применения таргетной терапии;
- Исчерпаны возможности стандартной терапиии требуется экспериментальное лечение или включение пациента в клинические исследования.
Специалисты проекта Solo консультируют онкологов или пациентов и подсказывают, нужен ли тест в данном случае.
Результат диагностики также включает рекомендации по клиническим исследованиям с подходящим тестируемым препаратом. У пациента есть возможность принять в них участие.
Прецизионная медицина и клинические исследования
Обычно в медицинской практике применяют общие стратегии для лечения пациентов с определенным диагнозом. Для мелкоклеточного рака легкого используется одна стратегия, для немелкоклеточного — другая. Для онкологических заболеваний этот метод подходит не всегда. Из-за различий на молекулярном уровне даже при одном и том же типе опухоли пациенты могут получить неэффективное или лишнее лечение.
С увеличением исследований и изобретением таргетных препаратов, подход к лечению онкологических заболеваний начал меняться. Чтобы увеличить безрецидивный период и продолжительность жизни пациента, нужно учитывать молекулярный профиль опухоли, ответ организма на лекарственные препараты и химиотерапию (фармакогеномика), знать главные биомаркеры.
Прецизионная медицина позволяет существенно улучшить прогноз конкретного пациента, избежать серьезных побочных эффектов онкологических препаратов и значительно повысить качество жизни больного. Но и у этого метода существуют недостатки.
Таргетных препаратов становится все больше, и они имеют два основных ограничения: большинство молекулярно-направленных агентов обеспечивают лишь частичное подавление сигнальных путей и многие из них слишком токсичны для использования в комбинации.
Представьте, что вы архитектор Москвы. Перед вами стоит непростая задача — решить проблему с пробками в час пик, построив один мост. Молекулярные механизмы можно сравнить с движением машин, а мост — главный препарат, который должен решить основную проблему. Кажется, что несколько лекарств (серия мостов), направленные на главные молекулярные нарушения, могут решить эту проблему. Но токсичность препаратов при этом увеличивается и может быть непредсказуемой.
Мы стали лучше понимать молекулярные процессы злокачественных опухолей, но текущие методы внедрения точной онкологии в клиническую практику сильно отстают. Чтобы ускорить изучение таргетной терапии, ученые разработали два новых подхода — Basket и Umbrella.

Суть метода Basket в том, что для исследования выбирают пациентов с определенным биомаркером, независимо от расположения и названия опухоли. В мае 2017 года FDA одобрила такой метод лечения для биомаркера под названием высокая микросаттелитная нестабильность (MSI-H) или дефект восстановления несоответствия (dMMR).
Молекулярные нарушения отличаются не только у разных пациентов, но и в пределах одной опухоли. Гетерогенность — большая проблема в онкологии, для решения которой был разработан дизайн исследования Umbrella. Для метода Umbrella пациентов сначала отбирают по типу злокачественных новообразований, а потом учитывают генетические мутации.
Такие исследования помогают не только собрать информацию о действии таргетных препаратов — иногда это единственная возможность для пациентов, которые не отвечают на стандартное лечение зарегистрированными препаратами.
Клинический пример
Мы решили привести наглядный пример, как может выглядеть использование расширенного молекулярного профилирования.
Пациент с меланомой кожи и метастазами в печени обратился к онкологу. Врач и пациент приняли решение сделать молекулярное профилирование, чтобы получить более полную информацию о заболевании. Пациенту провели биопсию и отправили образцы ткани на исследование. В результате диагностики в опухоли обнаружили несколько важных генетических нарушений:

Ориентируясь на результаты клинических исследований и рекомендации можно прийти к следующим выводам:
- Потенциально эффективными могут быть препараты класса BRAF-ингибиторов (Вемурафениб), более того, наличие мутации NRAS может служить дополнительным основанием для назначения двойной блокады сигнального каскада — комбинацией с MEK-ингибиторами (Траметиниб).
- Несмотря на то что нет одобренной терапии, направленной непосредственно на онкоген NRAS, известно, что мутации в нем повышают вероятность успешного лечения при назначении иммунотерапии (Ипилимумаб и Пембролизумаб).
- Наследственный генетический вариант в гене TPMT указывает на повышенную индивидуальную токсичность Цисплатина, что требует коррекции дозы при назначении платиносодержащих режимов терапии.
Таким образом, врач получает возможность ориентироваться среди возможных вариантов лечения отталкиваясь не только от клинических параметров пациента, но и учитывая молекулярные особенности опухоли.
Молекулярная диагностика — это не панацея для всех онкологических заболеваний. Но это важный инструмент для онколога, который позволяет подойти к лечению злокачественных опухолей с новой стороны.
Спасибо, что читали и комментировали наши материалы об онкологии. Вот полный список статей:
, MD, PhD, Imperial College London
Last full review/revision July 2018 by Robert Peter Gale, MD, PhD
- 3D модель (0)
- Аудио (0)
- Боковые панели (0)
- Видео (0)
- Изображения (1)
- Клинический калькулятор (0)
- Лабораторное исследование (0)
- Таблица (2)
Многие факторы вовлечены в процесс возникновения нерегулируемой пролиферации клеток, возникающей при раке.
Клеточная кинетика
Время деления – время, необходимое клетке для совершения полного цикла клеточного деления (см. рисунок Клеточный цикл [The cell cycle]) и для появления 2 дочерних клеток. Злокачественные клетки, в особенности происходящие из красного костного мозга или лимфатической системы, обычно имеют более короткий жизненный цикл, и, как правило, меньшее количество клеток находится в фазе G0 (фазе покоя). За начальным экспоненциальным ростом опухоли следует фаза плато, где смертность клеток и образование дочерних клеток находятся примерно на одном уровне. Замедление роста клеток может быть связано с истощением запасов питательных веществ и кислорода в быстрорастущей опухоли. В мелких опухолях доля активно делящихся клеток гораздо выше, чем в опухолях больших размеров.
Во многих опухолях отдельная популяция клеток со специфическими поверхностными белками может иметь свойства примитивных "нормальных" стволовых клеток, типичных для эмбриона на ранних стадиях развития. Таким образом, эти клетки способны переходить в стадию пролиферации. Они менее восприимчивы к воздействию противоопухолевых препаратов и лучевой терапии. Предполагается, что именно они ответственны за рост опухолей после хирургического, медикаментозного и лучевого лечения.
Знание клеточной кинетики отдельных опухолей – важный аспект в создании антинеопластических препаратов и может повлиять на дозировку и временные интервалы терапии. Многие противоопухолевые препараты, такие как антиметаболиты, наиболее эффективны, если клетки активно делятся, другие – в определенной фазе клеточного цикла и потому требуют длительного назначения, чтобы поймать клетки в фазу наибольшей чувствительности.
G0 = фаза покоя (отсутствие деления клеток); G1 = фаза начального роста (от 12 часов до нескольких дней); S = Синтез ДНК (обычно от 2 до 4 часов); G2 = подготовка клетки к митозу (от 2 до 4 часов) - в клетках имеется удвоенное количество ДНК ; M1 = митоз (от 1 до 2 ч).
Опухолевый рост и метастазы
Растущая опухоль получает питательные вещества путем прямой диффузии из кровотока. Местный рост обеспечивается ферментами (например, протеазами), которые уничтожают прилежащие ткани. В то время, как объем опухоли увеличивается, вырабатываются опухолевые факторы ангиогенеза для формирования новых сосудов (например, фактор роста эндотелия сосудов [VEGF]), необходимых для дальнейшего опухолевого роста.
Практически с самого начала опухоль может выделять клетки в кровоток. В моделях на животных опухоль размером 1 см в среднем выбрасывает > 1 млн клеток/24 ч в венозное русло. Циркулирующие опухолевые клетки обнаруживаются у многих пациентов с поздними стадиями рака и в некоторых случаях даже при отсутствии распространения опухоли. Хотя большинство циркулирующих опухолевых клеток погибает в сосудистом русле, некоторые клетки могут прикрепляться к эндотелию сосудов и проникать в окружающие ткани, вызывая появление независимых опухолей (метастазов) в отдаленных органах. Метастатические опухоли растут по тому же принципу, что и первичные опухоли, и в последствии могут порождать другие метастазы.
Эксперименты показывают, что к важнейшим особенностям метастатических клеток относятся способности к инвазии, миграции, успешной имплантации и стимуляции роста новых кровеносных сосудов, что, вероятно, отражает особенности отдельного клона клеток в первичной опухоли.
Иммунная система и рак
Хотя иммунная система, очевидно, играет защитную роль, остается непонятной причина, почему люди с врожденным или приобретенным иммунодефицитом имеют повышенный риск возникновения только некоторых распространенных типов раковых заболеваний (например, меланомы, почечно-клеточного рака, лимфомы) и не имеют других (например, рака легких, молочной железы, простаты, толстой кишки). Одно из соображений заключается в том, что давление эволюционного отбора для улучшения иммунного ответа на рак, возникающий после репродуктивного возраста, было незначительным.
С другой стороны, злокачественные клетки испытывают сильное эволюционное давление, чтобы разработать способы обхода иммунной системы. Один защитный механизм включает имитацию нормальных клеток путем экспрессии белков контрольных точек. Белки контрольных точек – это молекулы клеточной оболочки, которые оповещают циркулирующие Т-клетки о том, что клетка, на которой они находятся, нормальна и не должна подвергаться атаке. Примером является лиганд PD-L1, который распознается белком PD-1 на Т-лимфоцитах; когда PD-L1 связывается с PD-1 на поверхности Т-лимфоцитов, функционирование этих клеток ингибируется. Таким образом, терапия рака с использованием моноклональных антител, которые блокируют либо PD-L1, либо PD-1 (так называемые ингибиторы контрольных точек), может позволить иммунной системе атаковать злокачественные клетки, ранее защищенные присутствием белка PD-L1. CTLA-4 – это еще один белок контрольной точки, предотвращающий атаку иммунной системы, который может аналогичным образом блокироваться антителом. Поскольку белки контрольной точки могут присутствовать и в нормальных клетках, терапия с использованием ингибиторов контрольной точки может индуцировать атаку этих клеток иммунной системой.
Еще одним достижением в области иммунотерапии является использование генетически модифицированных Т-клеток (так называемая терапия с использованием Т-клеток с химерными антигенными рецепторами [CAR-T]). Во время данного процесса Т-клетки забираются у пациента и генетически модифицируются для экспрессии рецепторов, содержащих домен распознавания специфического опухолевого антигена, связанного с внутриклеточными сигнальными доменами, которые активируют Т-клетку. После реинфузии модифицированные Т-клетки могут атаковать клетки, несущие этот специфический опухолевый антиген.
Молекулярные нарушения
Причиной появления злокачественных клеток являются генетические мутации, и поэтому они имеют место при всех видах рака. Они изменяют количество или функцию белковых структур, которые регулируют рост и деление клеток, а также репарацию ДНК. Две большие группы мутировавших генов:
Гены супрессоры опухолевого роста
Онкогены представляют собой аномальные формы нормальных генов (протоонкогены), которые регулируют различные процессы клеточного роста и дифференциации. Мутация этих генов может привести к прямой и продолжительной стимуляции сигнальных путей (например, рецепторов факторов роста на поверхности клеток, внутриклеточных путей передачи сигналов, факторов транскрипции, вырабатываемых факторов роста), которые контролируют клеточный рост и деление, клеточный метаболизм, репарацию ДНК, ангиогенез и другие физиологические процессы.
Существует > 100 известных онкогенов, которые могут участвовать в опухолевой трансформации клеток человека. Например, ген RAS кодирует ras-белок, который передает сигналы от рецепторов, связанных с мембраной, через путь RAS-MAP-киназ к ядру клетки, и тем самым управляет ее делением. Мутации могут вызвать патологическую активацию белка ras, приводящую к неконтролируемому клеточному росту. Нарушения белка ras отмечаются у 25% людей, больных раком.
Другие онкогены участвуют в патогенезе отдельных онкологических заболеваний. К ним относятся:
HER2 (амплифицируется при раке молочной железы и желудка, и реже при раке легких)
BCRABL1 (транслокация из 2 генов лежит в основе хронического миелолейкоза и некоторых B-клеточных острых лимфолейкозов)
CMYC (лимфома Беркитта)
NMYC (мелкоклеточный рак легкого, нейробластома)
EGFR РЭФР (аденокарцинома легких)
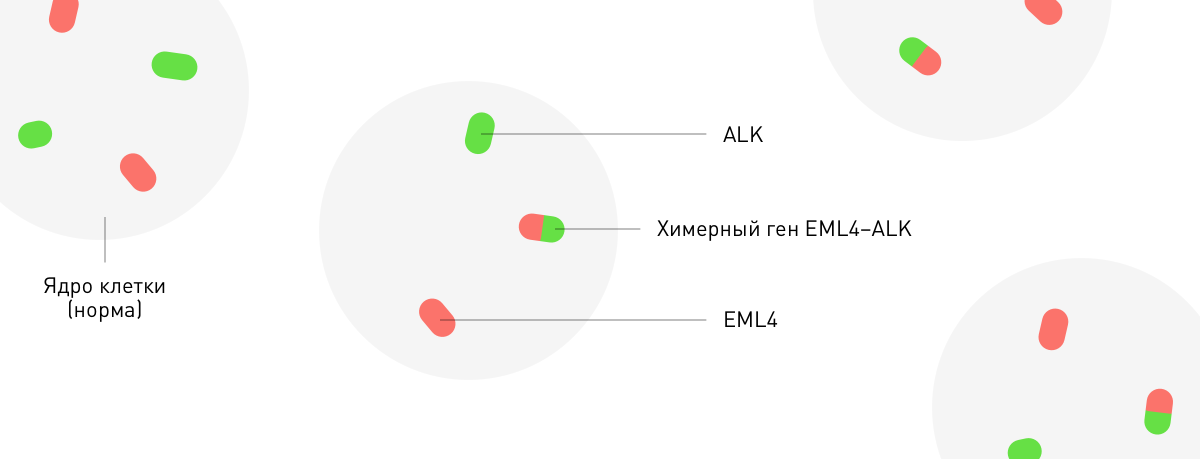
EML4ALK(транслокация, активизирующая тирозинкиназу ALK и вызывающая особый вариант аденокарциномы легких)
Специфические онкогены могут иметь большое значение для постановки диагноза, выбора терапии и определения прогноза (см. описание отдельных онкологических заболеваний).
Онкогены обычно возникают в результате
Приобретенные точечные мутации соматических клеток (например, вызванные химическими канцерогенами)
Амплификации гена (например, увеличение числа копий нормального гена)
Транслокации (в которых участки различных генов объединяются, образуя уникальную последовательность)
Эти процессы могут либо увеличивать активность продукта гена (белка), либо изменять его функцию. В некоторых случая мутация генов в первичных половых клетках приводит к наследованию предрасположенности к раку.
Такие гены, как TP53, BRCA1 и BRCA2 участвуют в нормальном делении клетки и восстановлении ДНК, а также чрезвычайно важны для выявления нарушенного сигнала роста и повреждений ДНК в клетках. Если эти гены, в результате наследственных или приобретенных мутаций, перестают функционировать, система выявления повреждений ДНК становится неэффективной, и клетки со спонтанными генетическими мутациями выживают и начинают размножаться, что приводит к развитию опухоли.
Как и во всех генах, каждый опухоль-подавляющий ген кодируют 2 аллели. Дефектная копия гена может наследоваться, оставляя в гене-супрессоре одну работающую аллель. Если мутация возникает и в работающей аллели, защитная функция второго здорового опухоль-подавляющего гена утрачивается.
Важный регуляторный белок, p53, предотвращает репликацию поврежденной ДНК в нормальных клетках и вызывает клеточную смерть (апоптоз) в клетках с аномальной ДНК. Неактивный или измененный p53 позволяет клеткам с аномальной ДНК выживать и делиться. Мутации TP53 передаются дочерним клеткам вместе с высокой возможностью репликации поврежденной ДНК, что приводит к опухолевой трансформации. TP53 поражается при многих онкологических заболеваниях.
Мутации BRCA1 и BRCA2, которые снижают функциональность, увеличивают риск развития рака молочной железы и яичников.
Другой пример, ген ретинобластомы ( RB) кодирует белок Rb, который регулирует клеточный цикл, тормозя репликацию ДНК. Мутации гена RB встречаются у больных разными онкологическими заболеваниями, обеспечивая непрерывное деление пораженных клеток.
Так же как и у онкогенов, мутация генов супрессоров опухолевого роста, таких как TP53 или RB, в линиях половых клеток может привести к вертикальной передаче и более высокой частоте возникновения рака у потомства.
Хромосомные нарушения могут случиться в результате делеции, транслокации или дупликации. Если эти изменения активируют или инактивируют гены, изменения в которых приводят к усилению пролиферации по сравнению с нормальными клетками, это может привести к развитию раков. Хромосомные нарушения встречаются в большинстве случаев онкологических заболеваний. При некоторых врожденных заболеваниях (синдром Блума, анемия Фанкони, синдром Дауна) процессы репарации ДНК нарушены и хромосомы часто повреждаются, вызывая высокий риск развития острых лейкозов или лимфом у детей.
Большинство эпителиальных злокачественных опухолей, вероятно, является следствием целой череды мутаций, приводящих к злокачественному перерождению. Например, при семейном полипозе развитие рака толстой кишки происходит из последовательности генетических механизмов: гиперпролиферация эпителия (потеря гена-супрессора хромосомы 5), ранняя аденома (изменение в процессе метилирования ДНК), промежуточная аденома (гиперактивность онкогена RAS), поздняя аденома (потеря гена-супрессора хромосомы 18) и, наконец, рак (потеря гена хромосомы 17). Для метастазирования могут потребоваться дополнительные генетические изменения.
Теломеры представляют собой нуклеопротеиновые комплексы, которые кэпируют концы хромосом и поддерживают их целостность. В нормальной ткани укорочение теломер (в результате старения) приводит к ограничению клеточного деления. Фермент теломераза, если она активирована в опухолевых клетках, обеспечивает новый синтез теломер, что поддерживает непрерывную пролиферацию раков.
Факторы окружающей среды
Вирусы также вносят свой вклад в патогенез некоторых видов рака человека (см. таблицу Рак-ассоциированные вирусы [Cancer-Associated Viruses]). Патогенез может включать в себя интеграцию вирусных генетических элементов в ДНК хозяина. Эти новые гены экспрессируются в клетках хозяина; они могут повлиять на клеточный рост или деление, или повредить нормальные гены хозяина, ответственные за контроль над клеточным ростом и делением. Также вирусная инфекция может вызвать нарушения иммунной системы, что приведет к понижению иммунного надзора за ранними опухолями. ВИЧ-инфекция увеличивает риск развития ряда раковых заболеваний (см. Типы рака, распространенные у зараженных ВИЧ пациентов [Cancers Common in HIV-Infected Patients]).
Читайте также:

