Множественная лекарственная устойчивость при раке молочной железы

Большинство опухолей молочной железы содержат на поверхности клеток рецепторы эстрогена — такой рак называют ЭР-положительным.
Исследования показывают, что приблизительно 70% всех случаев рака груди являются ЭР-положительными.
Химические сигналы, которые передает гормон эстроген, способствуют росту опухоли. Чтобы остановить ЭР-положительный рак, врачи назначают специальные препараты — антиэстрогены.
Такие препараты, как тамоксифен и фулвестрант, предотвращают распространение опухоли путем подавления рецепторов эстрогена или выработки гормона в организме. Это называется эндокринной терапией.
Но примерно в трети случаев рак становится устойчив к лечению — развивается резистентность, которая плохо влияет на шансы больных.
Почему так происходит?
Механизмы, лежащие в основе устойчивости опухолей к терапии, не совсем понятны, и в настоящее время представляют серьезную научную проблему.
Новое открытие в генетике рака
За последние месяцы специалисты из Института рака Дана-Фарбер в Бостоне (США) добились значительного прогресса в понимании резистентности рака к эндокринной терапии.
Доктор Майлс Браун (Dr Myles Brown), директор Центра функциональной эпигенетики рака при Институте, рассказал о специфических мутациях, которые делают раковые клетки более устойчивыми и способствуют метастазированию. Открытие американских исследователей может привести к появлению более эффективных препаратов для больных, которым уже не помогают традиционные методы лечения.
Результаты исследования публикуются в журнале Cancer Cell.
Неоморфные мутации мешают лечению рака
Ранее доктор Ринат Джезельсон (Rinath Jeselsohn) — также участвовавший в последнем проекте — сумел выяснить, что мутации гена рецептора эстрогена в значительной степени отвечают за устойчивость опухолевых клеток к лечению.
После этого открытия доктор Джезельсон и ее коллеги проанализировали новые мутации с использованием лабораторных моделей ЭР-положительного рака молочной железы, отметив, что они поддерживают устойчивость опухолей к тамоксифену и фулвестранту.
Теперь же были обнаружены дополнительные механизмы, которые помогут врачам более эффективно бороться с раком. Мало того, что мутантные гены адаптируют клетки к низким концентрациям эстрогенов, они еще и стимулируют появление метастазов.
Подобные мутации, позволяющие генам приобретать удивительные новые функции, называются неоморфными мутациями.
Комбинированная терапия резистентного рака груди
Отметив влияние мутаций на живучесть рака, ученые обратились к современным инструментам редактирования генома — CRISPR-Cas9. Генетический анализ показал, что CDK7 (ген циклин-зависимой киназы 7 типа) может служить более надежной мишенью для лечения рака.
Более того, подходящее лекарство уже существует: несколько лет назад некий ученый Натаниэль Грей (Nathanael Grey) предлагал экспериментальный ингибитор CDK7 — THZ1.
Комбинация фулвестранта и THZ1 оказалась эффективной как в клеточных культурах ЭР-положительного рака молочной железы, так и на животных моделях. Два препарата существенно замедляли рост опухоли, а устойчивость практически не наблюдалась.
Доктор Браун и его коллеги полагают, что такая комбинированная терапия рака груди полностью решит вопрос устойчивости. Первые клинические испытания могут начаться уже в следующем году.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Рак молочной железы. На сегодняшний день рак молочной железы (РМЖ) является одной из наиболее распространённых форм онкологических заболеваний. В 2012 году было диагностировано более 1,7 миллионов новых случаев рака молочной железы, по сравнению с 500 000 в 1975 году. Проанализировав ежегодное увеличение диагнозов РМЖ, к 2030 году ожидается увеличение этого показателя до 2,1 миллионов в год (GLOBOCAN 2012). Кроме того, РМЖ является основной причиной смерти женщин от онкологических заболеваний. Опухоли молочной железы подразделяют на две группы: опухоли, происходящие из базального эпителия и опухоли, образованные из люминального эпителия. Кроме того, работы последнего десятилетия, основанные на методах генного анализа, позволили создать новую молекулярную классификацию РМЖ. Выделенные данной классификацией типы РМЖ обладают различными молекулярными характеристиками и различаются по прогнозам и чувствительности к различным формам терапии [13, 28] (табл. 1).
Важным параметром для классификации по-прежнему является экспрессия рецепторов эстрогена (ER) и прогестерона (PgR) в опухоли, основываясь на которой определяется возможность использования эндокринной терапии. Основываясь на различной комбинации рецепторов ER, PgR и HER2 опухоли РМЖ подразделяют на 4 основных типа: люминальный A, люминальный B, базальноподобный/трижды негативный и HER2 тип.
Классификация рака молочной железы, основанная на экспрессии рецепторов эстрогена (ER), прогестерона (PgR) и HER2
ER+ и/или PgR+, HER2-, низкий уровень Ki67
ER+ и/или PgR+, HER2+ (или HER2- при высоком уровне Ki67)
Базальноподобный/ трижды негативный
Наиболее благоприятным из выделенных четырёх вариантов РМЖ является люминальный A тип рака, характеризующийся наличием ER, PgR рецепторов и отсутствием HER2 [11, 3]. Лишь около 15 % опухолей данного типа обладают мутантным p53, наличие которого коррелирует с более плохим прогнозом заболевания [6, 5]. Кроме того, за счёт наличия ER и PgR рецепторов лечение данного типа опухолей зачастую основывается на более таргетной гормональной терапии.
Люминальный B тип рака также положителен по ER и PgR рецепторам, но в отличии от люминального A типа является HER2 положительным либо обладает высоким уровнем Ki67, что является показателем повышенного количества активно делящихся клеток. Люминальный B тип рака молочной железы часто диагностируется у женщин более молодого возраста [11] и обладает характеристиками, ассоциированными с более неблагоприятным прогнозом: опухоли менее дифференцированы, больший размер опухоли, распространение опухолевых клеток в лимфатические узлы, около 30 % пациентов обладают мутантным p53. В связи с вышеуказанными характеристиками, несмотря на гормонозависимость, химиотерапия играет важную роль для люминального B типа опухолей молочной железы.
HER2 тип РМЖ характеризуется положительным статусом рецептора HER2/neu. Чаще всего опухоли данного типа обладают такими характеристиками, как отсутствие ER и PgR рецепторов, распространение опухолевых клеток в близлежащие лимфатические узлы, а также неблагоприятный прогноз заболевания. Для более 70 % опухолей данного типа РМЖ характерны мутации p53 [24]. Для лечения HER2 типа РМЖ используется один из первых препаратов таргетной терапии трастузумаб (Герцептин).
Последним выделенным типом является базальноподобный/ трижды негативный рак молочной железы, характеризующийся отсутствием рецепторов ER, PgR и HER2. Для базальноподобных опухолей характерна экспрессия HER1 и/или экспрессия цитокератинов 5/6, а также для большинства характерны мутации p53. Большинство BRCA1 опухолей молочной железы обладают молекулярными характеристиками базальноподобного РМЖ [19]. Трижды негативные опухоли чаще всего обладают более агрессивным фенотипом и менее благоприятным прогнозом по сравнению с ER положительными типами РМЖ (люминальный A и B) [29, 26]. Для лечения трижды негативных опухолей не может быть использована ни эстрогенная терапия, ни трастузумаб (Герцептин), так как данный тип РМЖ является гормон ER, PgR и HER2/neu отрицательным. В связи с тем, что гены, потенциально связанные с развитием трижды негативного РМЖ, недостаточно изучены, на сегодняшний день не существует таргетной терапии для данного типа РМЖ. Тем не менее исследователи продолжают характеризовать потенциальные гены-мишени для лечения трижды негативных опухолей, среди которых EGF рецептор (EGFR), альфа-B-кристаллин и циклин E [37]. В настоящее же время для лечения базальноподобных/ трижды негативных опухолей чаще всего используется комбинация хирургического вмешательства, радио- и химиотерапии.
Множественная лекарственная устойчивость. Как было сказано ранее, химиотерапия является центральным звеном в лечении рака молочной железы, но развитие множественной лекарственной устойчивости (МЛУ) остается основной проблемой при лечении данного заболевания. МЛУ называют устойчивость опухолевых клеток к ряду лекарственных препаратов, отличающихся по химической структуре и механизму действия. Именно способность опухолевых клеток формировать МЛУ обусловливает трудность лечения онкологических больных: опухоль становится нечувствительна к химиотерапии независимо от комбинации химиопрепаратов. На сегодняшний день ответ метастатического рака молочной железы на химиотерапию первой линии лечения составляет около 30–70 %, безрецидивный период после лечения зачастую достигает лишь 7–10 месяцев [35].
Механизмы множественной лекарственной устойчивости. МЛУ возникает в результате активации клеткой её естественных защитных механизмов. Существуют различные механизмы клеточной МЛУ, для которых доказана их клиническая значимость (рис. 1). Данные механизмы можно разделить на две группы: первая группа включает в себя механизмы, основанные не на транспорте лекарственных препаратов за пределы клетки; вторая группа – механизмы, основанные на транспорте препаратов за пределы клетки посредством трансмембранных белков.
Рис. 1. Клеточные механизмы формирования МЛУ
Классический клеточный механизм МЛУ основан на транспорте препаратов из клетки посредством трансмембранных белков ABC-транспортеров (ATP Binding Cassette (ABC) transporters, АТФ-зависимые транспортеры), тем самым приводящих к снижению концентрации препарата внутри клетки [17]. Данная группа объединяет трансмембранные белки, использующие энергию гидролиза аденозинтрифосфата (АТФ) для транспортировки лекарственных препаратов за пределы клетки [25]. Было показано, что повышение экспрессии ABC-транспортеров отвечает за развитие феномена множественной лекарственной устойчивости [9].
ABC-транспортеры: структура и механизм действия. В настоящее время известно 49 ABC-транспортеров человека, которые подразделяют на подсемейства A, B, C, D, F и G, основываясь на гомологичности последовательности белков, а также их доменной организации [12]. Структура белков АВС-семейства аналогична для всех подклассов, они содержат трансмембранный домен(ы) (ТМД) и нуклеотид-связывающие домены (НСД) (рис. 2).
Трансмембранные домены образуют лиганд-связывающую область (каталитический центр), а два нуклеотид-связывающих домена, локализующиеся в цитоплазме, связывают АТФ, энергия гидролиза которого необходима для транспорта веществ [30].
На сегодняшний день наиболее изученными ABC-транспортерами, оказывающими влияние на развитие МЛУ при раке молочной железы, являются P-гликопротеин (Pgp) (ABCB1, подсемейство В), BCRP (ABCG2, подсемейство G) и MRP1 (ABCC1, подсемейство С). Повышенная экспрессия данных транспортеров была продемонстрирована в клетках опухолевого происхождения, за счёт этого повышается отток лекарственных препаратов за клеточные пределы, что приводит к снижению его внутриклеточной концентрации и тем самым снижению эффективности химиотерапии [31, 4].
ABCB1 и ABCG2. Наиболее охарактеризованным ABC транспортером является P-гликопротеин (Pgp) или АВСВ1 белок, являющийся членом подсемейства B [2]. Экспрессия Pgp была показана для многих тканей человека. Pgp является первым ABC-транспортером, гиперэкспрессия которого была ассоциирована с феноменом МЛУ клеток рака молочной железы [31]. Гиперэкспрессия Pgp приводит к снижению внутриклеточной концентрации препарата, тем самым уменьшая цитотоксичность противоопухолевых препаратов, таких как антрациклины, винка алкалоиды, подофиллотоксины и таксаны [1]. Много информации накоплено также о BCRP (ABCG2), представителе подсемейства G, гиперэкспрессия которого приводит к устойчивости к широкому спектру лекарственных соединений, включая нуклеотидные аналоги [36]. Несмотря на десятилетия исследований данных транспортеров, на сегодняшний день ни одно из клинических испытаний, основанных на ингибировании транспорта лекарственных препаратов, не увенчалось успехом. Более того, клинические испытания с использованием ингибиторов ABCB1, дающих положительный результат in vitro, не были эффективны для пациентов [32].
Рис. 2. а – пример структуры ABC-транспортера, состоящего из двух трансмембранных доменов (ТМД) и двух нуклеотид-связывающих доменов (НСД); б – при связывании АТФ НСД домены соединяются, что приводит к изменению конформации, за счёт которого осуществляется транспорт субстрата из клетки
ABCC – подсемейство белков множественной лекарственной устойчивости (MRP). Другим из выделенных подсемейств ABC-транспортеров является подсемейство C – подсемейство белков множественной лекарственной устойчивости (Multidrug Resistance Protein subfamily, MRP). Данное подсемейство состоит из 9 ABC белков: ABCC1-6, ABCC10-12. Для многих транспортеров подсемейства C на сегодняшний день описана субстратная специфичность, а также продемонстрированы профили множественной лекарственной устойчивости. Основные данные по субстрат-специфичности транспортеров данного подсемейства представлены в табл. 2.
ABCC1. Наиболее хорошо охарактеризованным представителем данного подсемейства является транспортер ABCC1 (MRP1). ABCC1 экспрессируется на высоком уровне в лёгких, семенниках, почках, плаценте, а также в сердечной и скелетных мышцах [16]. Несколько независимых исследований показали, что экспрессия ABCC1 является маркером неблагоприятного прогноза для некоторых типов РМЖ. Было показано, что повышенная на ранних стадиях экспрессия ABCC1 ассоциирована с более коротким временем до рецидива после постхирургической адьювантной химиотерапии [33]. Также было продемонстрировано, что экспрессия ABCC1 не только ассоциирована с уменьшением времени до рецидива, но также коррелирует с общей выживаемостью [14]. Было показано, что уровень экспрессии данного транспортера в опухолях РМЖ пациентов, прошедших прехирургическую адьювантную терапию, значительно выше уровня экспрессии до прохождения терапии [15].
Субстратная специфичность транспортеров подсемейства MRP (ABCC). Таблица объединяет данные различных исследовательских групп [7, 8, 18, 20, 38]

Рак молочной железы. На сегодняшний день рак молочной железы (РМЖ) является одной из наиболее распространённых форм онкологических заболеваний. В 2012 году было диагностировано более 1,7 миллионов новых случаев рака молочной железы, по сравнению с 500 000 в 1975 году. Проанализировав ежегодное увеличение диагнозов РМЖ, к 2030 году ожидается увеличение этого показателя до 2,1 миллионов в год (GLOBOCAN 2012). Кроме того, РМЖ является основной причиной смерти женщин от онкологических заболеваний. Опухоли молочной железы подразделяют на две группы: опухоли, происходящие из базального эпителия и опухоли, образованные из люминального эпителия. Кроме того, работы последнего десятилетия, основанные на методах генного анализа, позволили создать новую молекулярную классификацию РМЖ. Выделенные данной классификацией типы РМЖ обладают различными молекулярными характеристиками и различаются по прогнозам и чувствительности к различным формам терапии [13, 28] (табл. 1).
Важным параметром для классификации по-прежнему является экспрессия рецепторов эстрогена (ER) и прогестерона (PgR) в опухоли, основываясь на которой определяется возможность использования эндокринной терапии. Основываясь на различной комбинации рецепторов ER, PgR и HER2 опухоли РМЖ подразделяют на 4 основных типа: люминальный A, люминальный B, базальноподобный/трижды негативный и HER2 тип.
Классификация рака молочной железы, основанная на экспрессии рецепторов эстрогена (ER), прогестерона (PgR) и HER2
ER+ и/или PgR+, HER2-, низкий уровень Ki67
ER+ и/или PgR+, HER2+ (или HER2- при высоком уровне Ki67)
Базальноподобный/ трижды негативный
Наиболее благоприятным из выделенных четырёх вариантов РМЖ является люминальный A тип рака, характеризующийся наличием ER, PgR рецепторов и отсутствием HER2 [11, 3]. Лишь около 15 % опухолей данного типа обладают мутантным p53, наличие которого коррелирует с более плохим прогнозом заболевания [6, 5]. Кроме того, за счёт наличия ER и PgR рецепторов лечение данного типа опухолей зачастую основывается на более таргетной гормональной терапии.
Люминальный B тип рака также положителен по ER и PgR рецепторам, но в отличии от люминального A типа является HER2 положительным либо обладает высоким уровнем Ki67, что является показателем повышенного количества активно делящихся клеток. Люминальный B тип рака молочной железы часто диагностируется у женщин более молодого возраста [11] и обладает характеристиками, ассоциированными с более неблагоприятным прогнозом: опухоли менее дифференцированы, больший размер опухоли, распространение опухолевых клеток в лимфатические узлы, около 30 % пациентов обладают мутантным p53. В связи с вышеуказанными характеристиками, несмотря на гормонозависимость, химиотерапия играет важную роль для люминального B типа опухолей молочной железы.
HER2 тип РМЖ характеризуется положительным статусом рецептора HER2/neu. Чаще всего опухоли данного типа обладают такими характеристиками, как отсутствие ER и PgR рецепторов, распространение опухолевых клеток в близлежащие лимфатические узлы, а также неблагоприятный прогноз заболевания. Для более 70 % опухолей данного типа РМЖ характерны мутации p53 [24]. Для лечения HER2 типа РМЖ используется один из первых препаратов таргетной терапии трастузумаб (Герцептин).
Последним выделенным типом является базальноподобный/ трижды негативный рак молочной железы, характеризующийся отсутствием рецепторов ER, PgR и HER2. Для базальноподобных опухолей характерна экспрессия HER1 и/или экспрессия цитокератинов 5/6, а также для большинства характерны мутации p53. Большинство BRCA1 опухолей молочной железы обладают молекулярными характеристиками базальноподобного РМЖ [19]. Трижды негативные опухоли чаще всего обладают более агрессивным фенотипом и менее благоприятным прогнозом по сравнению с ER положительными типами РМЖ (люминальный A и B) [29, 26]. Для лечения трижды негативных опухолей не может быть использована ни эстрогенная терапия, ни трастузумаб (Герцептин), так как данный тип РМЖ является гормон ER, PgR и HER2/neu отрицательным. В связи с тем, что гены, потенциально связанные с развитием трижды негативного РМЖ, недостаточно изучены, на сегодняшний день не существует таргетной терапии для данного типа РМЖ. Тем не менее исследователи продолжают характеризовать потенциальные гены-мишени для лечения трижды негативных опухолей, среди которых EGF рецептор (EGFR), альфа-B-кристаллин и циклин E [37]. В настоящее же время для лечения базальноподобных/ трижды негативных опухолей чаще всего используется комбинация хирургического вмешательства, радио- и химиотерапии.
Множественная лекарственная устойчивость. Как было сказано ранее, химиотерапия является центральным звеном в лечении рака молочной железы, но развитие множественной лекарственной устойчивости (МЛУ) остается основной проблемой при лечении данного заболевания. МЛУ называют устойчивость опухолевых клеток к ряду лекарственных препаратов, отличающихся по химической структуре и механизму действия. Именно способность опухолевых клеток формировать МЛУ обусловливает трудность лечения онкологических больных: опухоль становится нечувствительна к химиотерапии независимо от комбинации химиопрепаратов. На сегодняшний день ответ метастатического рака молочной железы на химиотерапию первой линии лечения составляет около 30–70 %, безрецидивный период после лечения зачастую достигает лишь 7–10 месяцев [35].
Механизмы множественной лекарственной устойчивости. МЛУ возникает в результате активации клеткой её естественных защитных механизмов. Существуют различные механизмы клеточной МЛУ, для которых доказана их клиническая значимость (рис. 1). Данные механизмы можно разделить на две группы: первая группа включает в себя механизмы, основанные не на транспорте лекарственных препаратов за пределы клетки; вторая группа – механизмы, основанные на транспорте препаратов за пределы клетки посредством трансмембранных белков.
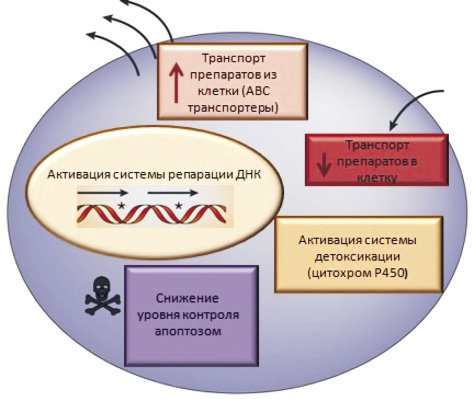
Рис. 1. Клеточные механизмы формирования МЛУ
Классический клеточный механизм МЛУ основан на транспорте препаратов из клетки посредством трансмембранных белков ABC-транспортеров (ATP Binding Cassette (ABC) transporters, АТФ-зависимые транспортеры), тем самым приводящих к снижению концентрации препарата внутри клетки [17]. Данная группа объединяет трансмембранные белки, использующие энергию гидролиза аденозинтрифосфата (АТФ) для транспортировки лекарственных препаратов за пределы клетки [25]. Было показано, что повышение экспрессии ABC-транспортеров отвечает за развитие феномена множественной лекарственной устойчивости [9].
ABC-транспортеры: структура и механизм действия. В настоящее время известно 49 ABC-транспортеров человека, которые подразделяют на подсемейства A, B, C, D, F и G, основываясь на гомологичности последовательности белков, а также их доменной организации [12]. Структура белков АВС-семейства аналогична для всех подклассов, они содержат трансмембранный домен(ы) (ТМД) и нуклеотид-связывающие домены (НСД) (рис. 2).
Трансмембранные домены образуют лиганд-связывающую область (каталитический центр), а два нуклеотид-связывающих домена, локализующиеся в цитоплазме, связывают АТФ, энергия гидролиза которого необходима для транспорта веществ [30].
На сегодняшний день наиболее изученными ABC-транспортерами, оказывающими влияние на развитие МЛУ при раке молочной железы, являются P-гликопротеин (Pgp) (ABCB1, подсемейство В), BCRP (ABCG2, подсемейство G) и MRP1 (ABCC1, подсемейство С). Повышенная экспрессия данных транспортеров была продемонстрирована в клетках опухолевого происхождения, за счёт этого повышается отток лекарственных препаратов за клеточные пределы, что приводит к снижению его внутриклеточной концентрации и тем самым снижению эффективности химиотерапии [31, 4].
ABCB1 и ABCG2. Наиболее охарактеризованным ABC транспортером является P-гликопротеин (Pgp) или АВСВ1 белок, являющийся членом подсемейства B [2]. Экспрессия Pgp была показана для многих тканей человека. Pgp является первым ABC-транспортером, гиперэкспрессия которого была ассоциирована с феноменом МЛУ клеток рака молочной железы [31]. Гиперэкспрессия Pgp приводит к снижению внутриклеточной концентрации препарата, тем самым уменьшая цитотоксичность противоопухолевых препаратов, таких как антрациклины, винка алкалоиды, подофиллотоксины и таксаны [1]. Много информации накоплено также о BCRP (ABCG2), представителе подсемейства G, гиперэкспрессия которого приводит к устойчивости к широкому спектру лекарственных соединений, включая нуклеотидные аналоги [36]. Несмотря на десятилетия исследований данных транспортеров, на сегодняшний день ни одно из клинических испытаний, основанных на ингибировании транспорта лекарственных препаратов, не увенчалось успехом. Более того, клинические испытания с использованием ингибиторов ABCB1, дающих положительный результат in vitro, не были эффективны для пациентов [32].
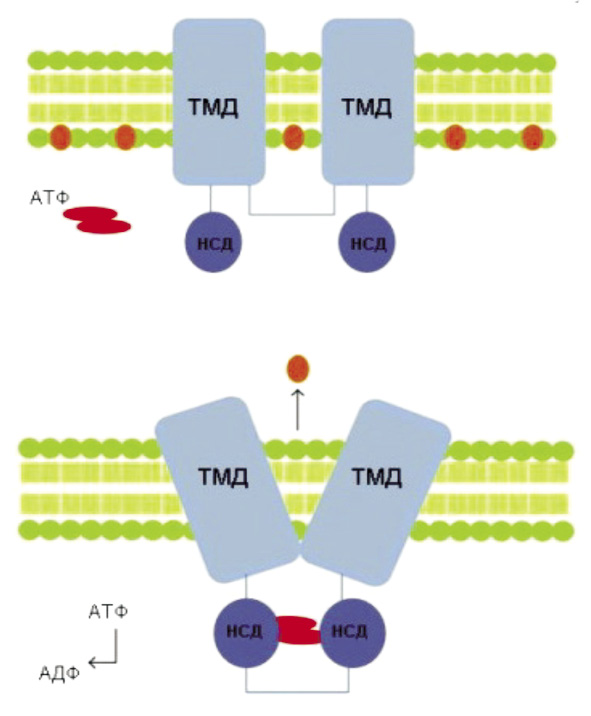
Рис. 2. а – пример структуры ABC-транспортера, состоящего из двух трансмембранных доменов (ТМД) и двух нуклеотид-связывающих доменов (НСД); б – при связывании АТФ НСД домены соединяются, что приводит к изменению конформации, за счёт которого осуществляется транспорт субстрата из клетки
ABCC – подсемейство белков множественной лекарственной устойчивости (MRP). Другим из выделенных подсемейств ABC-транспортеров является подсемейство C – подсемейство белков множественной лекарственной устойчивости (Multidrug Resistance Protein subfamily, MRP). Данное подсемейство состоит из 9 ABC белков: ABCC1-6, ABCC10-12. Для многих транспортеров подсемейства C на сегодняшний день описана субстратная специфичность, а также продемонстрированы профили множественной лекарственной устойчивости. Основные данные по субстрат-специфичности транспортеров данного подсемейства представлены в табл. 2.
ABCC1. Наиболее хорошо охарактеризованным представителем данного подсемейства является транспортер ABCC1 (MRP1). ABCC1 экспрессируется на высоком уровне в лёгких, семенниках, почках, плаценте, а также в сердечной и скелетных мышцах [16]. Несколько независимых исследований показали, что экспрессия ABCC1 является маркером неблагоприятного прогноза для некоторых типов РМЖ. Было показано, что повышенная на ранних стадиях экспрессия ABCC1 ассоциирована с более коротким временем до рецидива после постхирургической адьювантной химиотерапии [33]. Также было продемонстрировано, что экспрессия ABCC1 не только ассоциирована с уменьшением времени до рецидива, но также коррелирует с общей выживаемостью [14]. Было показано, что уровень экспрессии данного транспортера в опухолях РМЖ пациентов, прошедших прехирургическую адьювантную терапию, значительно выше уровня экспрессии до прохождения терапии [15].
Субстратная специфичность транспортеров подсемейства MRP (ABCC). Таблица объединяет данные различных исследовательских групп [7, 8, 18, 20, 38]
Достаточно часто, прогностически неблагоприятно. Множественный рак молочной железы – это различные варианты многоочагового опухолевого поражения груди: выбор лечебной тактики индивидуален для каждой женщины и зависит от множества факторов.
Мультицентрическое поражение можно выявить при ММГ
Множественный рак молочной железы
От 2 и более. Множественный рак молочной железы на дооперационном этапе обследования выявляется у 30% пациенток, а врач-гистолог увеличивает этот процент до 50. Выделяют следующие варианты:
- Двустороннее поражение (синхронный рак груди или метахронное поражение молочных желез);
- Мультицентрический рак (узлы в одной железе располагаются на расстоянии 5 см друг от друга);
- Мультифокальные опухоли (множественные очаги, находящиеся в пределах одного квадранта молочной железы).
По сути, двусторонний и мультицентрический варианты – это истинно множественный рак молочной железы, при котором с одной или с двух сторон в груди возникают несколько независимых опухолевых очагов, а мультифокальный – это местно-метастатическое распространение раковых клеток из одной первичной опухоли.
Кроме этого, важно понимать – к множественному раку следует относить параллельное или последовательное возникновение карцином в груди и в других гормонально-зависимых органах (яичники, матка, толстый кишечник).
Диагностика множественной онкопатологии
Надо использовать все доступные методы. Множественный рак молочной железы обнаруживается при маммографии, но – далеко не всегда и, главное, не все узлы можно обнаружить на рентгеновских снимках. При подозрении на мультиочаговость, необходимо сделать МРТ молочных желез. И, по возможности, томографию всех функционально зависимых органов, где могут быть отдаленные очаги рака. Замечательно, если доступно ПЭТ в сочетании с КТ. Гистологическое и иммуногистохимическое исследования обязательны. Для стадирования выбирается наибольший по размерам опухолевый очаг, на основе которого выводится диагноз по системе TNM. Кроме этого, желательно оценивать:
- Общий объем всех узлов;
- Площадь поверхности всех очагов;
- Сумму диаметров всех раковых опухолей.
Множественный рак молочной железы: прогностические факторы
Любые прогнозы всегда относительны, в том числе, в отношении множественной локализации раковых узлов в молочных железах. На основе результатов всех методов обследования выделяют следующие прогностические факторы риска при мультиочаговом РМЖ:
- Возраст;
- Гормональные нарушения, связанные с детородной функцией (бесплодие, отказ от деторождения и кормления грудью, аборты);
- Наличие дисгормональных дисплазий в молочной железе (мастопатия, фиброаденоматоз);
- Размер наибольшего узла;
- Поражение регионарных лимфоузлов;
- Гистологический тип опухоли;
- Степень злокачественности;
- Наличие или отсутствие рецепторов к эстрогенам, гестагенам и эпидермальному фактору роста (HER2);
- Пролиферативная активность (индекс Ki-67).
Для выбора оптимальной тактики лечения важно все – от хорошо собранного анамнеза пациентки до получения точных иммуногистохимических показателей опухоли. Как и любой другой вариант опухолевого роста, множественный рак молочной железы можно успешно лечить, особенно если удалось выявить карциному на ранних стадиях формирования.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Х имиотерапия и гормонотерапия играют существенную роль в комплексном лечении рака молочной железы практически при всех стадиях заболевания. Это объясняется особенностями данной опухоли – даже на ранних стадиях заболевания велик риск существования отдаленных микрометастазов, особенно при наличии факторов риска (поражении подмышечных лимфоузлов, отрицательных рецепторах эстрадиола и прогестерона, гиперэкспрессии Неr–2/neu и т.д.). Применение адъювантной химио– и гормонотерапии значительно улучшило результаты лечения операбельного рака молочной железы. При запущенном раке молочной железы химиотерапия и гормонотерапия являются основными методами лечения, позволяющими значительно продлить жизнь больного и улучшить ее качество. У 10–25% женщин с диссеминированным раком молочной железы возможно достижение полной регрессии опухоли с длительным безрецидивным периодом.
Адъювантная терапия
Адъювантная терапия рака молочной железы сегодня представляет собой систему стандартов, эффективность которых доказана в большом числе клинических исследований [1].
До настоящего времени остается четыре независимых прогностических фактора при резектабельном раке молочной железы: поражение регионарных лимфатических узлов, размер первичной опухоли, степень дифференцировки и содержание рецепторов к стероидным гормонам (к эстрогенам – РЭ и к прогестерону – РП).
Стандартами химиотерапии и эндокринной терапии являются: 4 цикла химиотерапии в режиме АЦ (адриамицин + циклофосфан) или АЦФ (адриамицин + циклофосфан + фторурацил) или 6 циклов химиотерапии по схеме ЦМФ (циклофосфан + метотрексат + фторурацил), а также тамоксифен 20 мг в день в течение 5 лет.
Первый фактор, положенный в основу назначения адъювантной терапии – поражение регионарных лимфатических узлов, разделяет всех больных на две группы.
Рак молочной железы без метастазов в регионарные лимфоузлы
Для назначения адъювантной терапии в этой группе необходимо определение групп повышенного риска. Граница для назначения адъювантной лекарственной терапии, что означает группу повышенного риска – снижение пятилетней выживаемости до 95% и менее (табл. 1).
Только в группе низкого риска пятилетняя выживаемость больных составляет более 95%. Во всех остальных группах проведение адъювантной лекарственной терапии улучшает результаты хирургического лечения.
Больным в пременопаузе с умеренным или высоким риском и положительным уровнем эстрогенных рецепторов показана химиотерапия с последующим назначением тамоксифена. При гормононезависимых опухолях показано назначение только химиотерапии.
Больным в постменопаузе с умеренным или высоким риском и положительным уровнем эстрогеновых рецепторов показан прием тамоксифена, а в группе высокого риска – комбинация химиотерапии с тамоксифеном. При отрицательном уровне рецепторов к эстрогенам показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена, а в группе высокого риска возможно дополнительное назначение химиотерапии. С уче– том возраста больных дополнительное назначение химиотерапии должно быть индивидуально обоснованным.
Рак молочной железы с метастазами в регионарные лимфоузлы
У всех больных раком молочной железы с метастазами в регионарные лимфатические узлы применение адъювантной лекарственной терапии улучшает результаты лечения.
При положительном уровне рецепторов к эстрогенам вне зависимости от менструальной функции показана комбинированная адъювантная терапия – химиотерапия и эндокринная терапия тамоксифеном.
При гормононезависимых опухолях показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена вне зависимости от уровня эстрогеновых рецепторов. Если уровень рецепторов к эстрогенам отрицательный, возможно дополнительное назначение химиотерапии. С учетом возраста больных дополнительное назначение химиотерапии должно быть индивидуальным.
При всей внешней простоте и схематичности назначения адъювантного лечения лишь методы, доказавшие свою эффективность в результате длительных клинических исследований, применяются для лечения больных. Оптимальная тактика адъювантной терапии постоянно совершенствуется. Совсем недавно химиотерапия рекомендовалась только больным в пременопаузе с метастазами в регионарные лимфатические узлы. В настоящее время только больным с низким риском и пожилым больным с положительными эстрогеновыми рецепторами не показано проведение химиотерапии.
При проведении адъювантной химиотерапии необходимо строго придерживаться оптимального режима (стандартных доз и интервалов между циклами). Неоправданные модификации режимов химиотерапии, несомненно, ухудшают результаты лечения.
Сегодня продолжаются исследования роли выключения функции яичников и рутинное применение данного метода адъювантного лечения нецелесообразно.
Появились данные об эффективности таксанов, как дополнительной химиотерапии к антрациклин–содержащим комбинациям у больных с неблагоприятным про– гнозом.
В связи с широкими исследованиями роли гиперэкспрессии рецептора Her2/neu наметились новые тенденции в оценке прогноза и лечения больных. Однако пока необходимо дополнительное число исследований для изменения практических рекомендаций.
Исследования по адъювантной терапии рака молочной железы интенсивно продолжаются, и можно надеяться, что в ближайшее время все больше и больше женщин будут излечиваться от рака молочной железы.
Неоадъювантная терапия
Неоадъювантная терапия – системное лечение, которое проводится до начала локального лечения (хирургического вмешательства или лучевой терапии).
Задачи неоадъювантной терапии:
- уменьшение размеров первичной опухоли и регионарных метастазов
- уменьшение объема оперативного вмешательства (радикальная резекция вместо радикальной мастэктомии)
- определение чувствительности опухоли к цитостатикам, выявление резистентных случаев с целью использования альтернативных режимов для адъювант– ной химиотерапии
- увеличение общей и безрецидивной выживаемости
- оценка новых режимов лечения по частоте полной клинической и морфологической ремиссии.
Стандартом неоадъювантной химиотерапии по результатам многоцентрового исследования NSABP B–18 признана схема АЦ, при применении которой объективный эффект составил 80%, полная морфологическая ремиссия отмечена у 15% больных.
Предполагалось, что раннее воздействие противоопухолевых лекарств на микрометастазы приведет к увеличению общей и безрецидивной выживаемости. Однако анализ 7 крупных рандомизированных исследований, в том числе NSABP B–18, включившего 1500 женщин с операбельным раком молочной железы, проведенный Wolff [2], не подтвердил эту гипотезу. Продолжительность жизни может быть увеличена только за счет рационального подхода к лечению – использования альтернативных режимов для адъювантной химиотерапии в случае низкой эффективности неоадъювантного лечения.
Продолжается поиск наиболее эффективного режима неоадъювантной химиотерапии. Особенно важным показателем является достижение полной морфологической регрессии опухоли, так как именно этот показатель статистически достоверно коррелирует с ростом общей выживаемости. С этой целью исследуются комбинации, включающие наиболее эффективные препараты, входящие в режимы неоадъювантной химиотерапии в последние годы – цисплатин, навельбин, таксаны. Некоторые авторы показали преимущество комбинаций антрациклинов и таксанов по сравнению со стандартным режимом АС. Разрабатываются новые режимы, включающие препараты, недавно вошедшие в практику химиотерапии, например, кселода и герцептин. Исследуются интенсивные режимы химиотерапии, однако пока не получено достоверных доказательств влияния интенсификации неоадъювантной химиотерапии на отдаленные результаты лечения.
Обсуждается количество курсов неоадъювантной химиотерапии. Признано, что эффект химиотерапии и частота полных регрессий опухоли зависят от количест– ва курсов лечения. Поэтому целесообразно проводить не менее 4 курсов, что безопасно для больных при условии регулярного контроля за динамикой заболевания.
У больных в менопаузе с положительными РЭ и/или РП применяется неоадъювантная гормонотерапия. Объективный эффект гормонотерапии достигает 50–70%. Для неоадъювантной гормонотерапии могут быть рекомендованы тамоксифен, анастразол, летрозол, экземестан.
Диссеминированный рак молочной железы
Для выбора метода лечения перед началом терапии необходимо оценить ряд прогностических факторов, определяющих возможный ответ заболевания на проводимое лечение. Длительный период, прошедший после лечения первичной опухоли до появления отдаленных метастазов, поражение только мягких тканей и костной системы или единичные отграниченные очаги в легких, медленный рост опухоли, удовлетворительное общее состояние больной, пожилой возраст и постменопауза, положительный уровень рецептов эстрадиола и/или прогестерона свидетельствуют о вероятно высокой чувствительности опухоли к гормонотерапии. В случае раннего появления отдаленных метастазов после лечения первичной опухоли, быстрого прогрессирования заболевания, молодого возраста больной, при множественных висцеральных метастазах, наличии лимфангоита кожи или легких лечение необходимо начинать с химиотерапии.
Эффективность гормонотерапии при положительном уровне РЭ и РП достигает 50–70%, снижается при положительных рецепторах одного вида (33%). При отрицательных РЭ и РП существует небольшой процент больных (5–10%), отвечающих на гормонотерапию. Традиционными препаратами, рекомендованными для первой линии гормонотерапии у больных в менопаузе, являются антиэстрогены – тамоксифен и торемифен. В настоящее время в I линии эндокринотерапии альтернативой тамоксифену являются антиароматазные препараты – анастрозол и летрозол. Во II линии эндокринотерапии больных раком молочной железы в менопаузе (при использовании тамоксифена в I линии) в настоящее время вместо прогестинов используются антиароматазные препараты (анастрозол, летрозол, экземестан). Применять прогестины во II линии гормонотерапии считается неэтичным.
У больных в пременопаузе гормонотерапию можно начинать с выключения функции яичников с помощью агониста гонадотропин–рилизинг гормона гипофиза – гозерелина (золадекса), а также хирургическим или лучевым методами.
Эффект гормонотерапии оценивается через 6–8 нед после начала лечения. Положительным ответом считается не только полная или частичная регрессия опухоли, но и длительная стабилизация заболевания (>=6 месяцев). Лечение продолжается до прогрессирования болезни. В случае быстрого прогрессирования болезни после гормонотерапии первой линии следует начать химиотерапию. При прогрессировании после длительного положительного эффекта на фоне первой линии гормонотерапии, а также кратковременной полной или частичной регрессии опухоли начинают гормонотерапию второй линии – ингибиторы (инактиваторы) ароматазы.
Третья линия гормонотерапии – прогестины – медроксипрогестерона ацетат (фарлутал, провера) и мегестрола ацетат (мегейс). Достаточно редко в наше время в III линии гормонотерапии используются андрогены и у женщин в постменопаузе – эстрогены.
Химиотерапия
Стандартами I линии химиотерапии рака молочной железы являются схемы: ЦМФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, метотрексат 40 мг/м 2 в/в дни 1,8, фторурацил 600 мг/м 2 в/в дни 1,8, интервал 4 нед), ЦАФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, доксорубицин 30 мг/м 2 в/в дни 1,8, фторурацил 500 мг/м 2 в/в дни 1, 8, интервал 4 недели), АЦФ (фторура– цил 500 мг/м 2 , доксорубицин 50 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), ЕЦФ (фторурацил 500 мг/м 2 , эпирубицин 100 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), АЦ (доксорубицин 60 мг/м 2 , циклофосфан 600 мг/м 2 каждые 3 нед).
Большинство исследователей отдают предпочтение антрациклиновым комбинациям, учитывая более высокий противоопухолевый эффект этих комбинаций по сравнению с ЦMФ. Комбинация ЦМФ чаще используется у пожилых больных, при противопоказаниях к применению антрациклинов.
Высокую эффективность показали комбинации антрациклинов и таксанов – АТ (доксорубицин 50–60 мг/м 2 , паклитаксел 175 мг/м 2 , интервал 3 нед), ЕД (эпирубицин 100 мг/м 2 , доцетаксел 75 мг/м 2 , интервал 3 нед).
Длительность химиотерапии обычно определяется ответом опухоли: после достижения максимального эффекта проводится дополнительно 2 курса ПХТ. Затем предпочтение может быть отдано наблюдению за больным до прогрессирования. При продолжении лечения до прогрессирования увеличивается время до прогресси– рования, однако общая выживаемость не меняется, при этом снижается качество жизни больных.
Ведется поиск эффективных комбинаций для первой линии лечения диссеминированного рака молочной железы, включающих новые препараты, в частности, капецитабин (кселода). Показано, что капецитабин имеет лечебную активность, сходную с ЦМФ.
У больных, имевших прогрессирование после химиотерапии антрациклинсодержащими комбинациями, стандартом дальнейшего лечения являются таксаны (паклитаксел 175 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед, доцетаксел 100 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед). В монотерапии у резистентных к антрациклинам больных объективный эффект составляет 41%. В последнее время все более популярным становится еженедельное введение таксанов, при этом увеличивается интенсивность лечения без увеличения токсичности. Эффективны комбинации таксанов с другими препаратами: навельбин 20 мг/м 2 в/в дни 1, 5-й + доцетаксел 75 мг/м 2 в/в со стандартной премедикацией день 1-й, интервал 3 нед; паклитаксел 175 мг/м 2 в/в со стандартной премедикацией день 1-й + фторурацил 1 г/м 2 /день в/в кап. 72–часовая инфузия дни 1, 2, 3-й, интервал 3 нед; кселода 1650 мг/м 2 дни 1–14 + паклитаксел 175 мг/м 2 (или доцетаксел 75 мг/м 2 )1 раз в 3 нед; гемцитабин 1 г/м 2 дни 1, 15-й + паклитаксел 135 мг/м 2 дни 1, 15-й, интервал 4 нед.
Для третьей и последующих линий лечения четких стандартов не разработано. Применяются комбинации препаратов, включающие навельбин, препараты платины (цисплатин, оксалиплатин), антиметаболиты (длительные инфузии фторурацила, гемцитабин, томудекс, кселода). Следует отметить высокую эффективность кселоды у больных во II (объективный ответ у 36% больных) и III (20%) линиях химиотерапии. Препарат может быть рекомендован, как альтернатива таксанам во II линии химиотерапии.
Некоторые режимы, эффективные во II–III линии лечения диссеминированного рака молочной железы: МММ – митомицин 8 мг/м 2 в/в день 1 + митоксантрон 8 мг/м 2 в/в день 1 + метотрексат 30 мг/м 2 в/в день 1; МЕП – митомицин 10 мг/м 2 в/в день 1 + цисплатин 40 мг/м 2 в/в дни 2, 7 + вепезид 100 мг/м 2 в/в дни 3 ,4, 5, интервал 4 нед; цисплатин 80 мг/м 2 в/в день 1 + кселода 2000 мг/м 2 внутрь ежедневно дни 1–14; навельбин 25 мг/м 2 в/в дни 1, 8 + митомицин 7 мг/м 2 в/в день 1, интервал 4 недели; навельбин 20 мг/м 2 в/в дни 1, 15 + цисплатин 80 мг/м 2 в/в день 1, интервал 4 нед; циклофосфан 600 мг/м 2 в/в день 1 + лейковорин 500 мг/м 2 в/в кап. в течение 2 часов + фторурацил 1,5 г/м 2 в/в постоянная 24–часовая инфузия, дни 1, 15, интервал 4 нед; навельбин 25 мг/м 2 в/в дни 1, 8 + томудекс 1 мг/м 2 в/в дни 1, 8, интервал 3 нед.
В 25–30% случаев в опухоли молочной железы отмечается гиперэкспрессия Неr–2/neu, коррелирующая с плохим прогнозом заболевания. У таких больных эф– фективен Герцептин – препарат принципиально нового механизма действия – рекомбинантные гуманизированные моноклональные антитела, связывающиеся с рецептором Неr–2/neu. Герцептин применяется еженедельно, первое введение – 4 мг/кг в/в, последующие – 2 мг/кг. Лечение продолжается до прогрессирования заболевания. Герцептин рекомендуется к применению у больных с гиперэкспрессией Неr–2/neu в комбинации с гормонотерапией и химиотерапией. Добавление герцептина к комбинации АС повысило частоту объективных эффектов с 42 до 60%. При резистентности к антрациклинам комбинация герцептина с таксолом была эффективна у 49% больных (при монотерапии таксолом эффект составил 17%). Изучаются комбинации герцептина с другими цитостатиками, например, с кселодой, навельбином [5].
1. Материалы шестой конференции по адъювантной терапии рака молочной железы, Сан–Галлен Швейцария, 1998 год.
2. A.C.Wolff, N.E. Davidson: Primary systemic therapy in operable breast cancer. J Clin Oncol 18:1558–1569, 2000.
3. C.А. Тюляндин: Химиотерапия диссеминированного рака молочной железы. Практическая онкология, 2, 2000.
Читайте также:

