Много голоядерных элементов при раке
уточнение степени распространенности опухоли;
изучение фоновых изменений;
определение некоторых факторов прогноза;
возможность исследования бактериальной флоры.
Критерием достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Достоверность цитологической диагностики РМЖ одна из самых высоких в цитологии и составляет 90-96%. В 3 - 8% случаев пункция оказывается неудачной, т.е. материал не пригоден для анализа.
Не подлежит сомнению, что одним из важных прогностических факторов при РМЖ является морфологическая структура опухоли. По данным литературы, в 70-80% случаев РМЖ не имеет признаков специфичности и описывается как инвазивный протоковый рак (ИПР); 10-17% всех злокачественных опухолей МЖ - это рак комбинированного протоково-долькового строения; 10-15% - редкие формы рака (коллоидный, аденокистозный, секреторный, апокриновый, липидсекретирующий, плоскоклеточный, перстневидно-клеточный, рак Педжета). Выделение указанных гистологических форм обусловлено характерной морфологической картиной и особенностями клинического течения опухолевого процесса.
Например, при коллоидном, тубулярном, аденокистозном, ювенильном и медуллярном раке большинство исследователей отмечают относительно благоприятное течение болезни (относительно редкие локальные рецидивы и отдаленные метастазы), что позволяет проводить органосохраняющее лечение. Другие формы рака (например, инфильтративный дольковый) по клиническому течению мало отличаются от инфильтративного протокового, однако высокая частота первично-множественных (30-85%) и билатеральных (6-47%) поражений обусловливают высокую частоту местных рецидивов и ставят под сомнение возможность выполнения экономного оперативного вмешательства. При некоторых формах рака (таких, как инфильтративный протоковый рак высокой степени злокачественности, перстневидноклеточный, липидсекретирующий) прогноз плохой, поэтому уже на ранних стадиях заболевания, видимо, необходима дополнительная терапия.
Определение степени злокачественности простая и нетрудоемкая процедура. При ИПР выделяют 3 группы по степени злокачественности, которая в случае ИПР без признаков специфичности определяется по модифицированной схеме P. Scarff, H. Bloom, W. Richardson:
Образование тубулярных и протоковоподобных структур:
>10 10 20 митозов - 3 балла.
клетки одного размера и формы, мелкие, с дисперсным распределением хроматина, без ядрышек - 1 балл;
небольшой полиморфизм ядер, некоторое укрупнение клеток - 2 балла;
ядра крупные, различной формы, с одним или несколькими ядрышками, с грубым хроматином - 3 балла.
Сумма баллов определяет степень злокачественности:
I (низкая) - 3-5 баллов;
II (умеренная) - 6-7 баллов;
III (высокая) - 8-9 баллов.
Степень злокачественности отражается на частоте регионарного метастазирования (соответственно 21; 44 и 33%) и отдаленного метастазирования (соответственно 0; 39 и 51%).
Современное цитологическое исследование позволяет не только диагностировать рак: разработаны критерии диагностики различных гистологических типов инвазивного рака, а также степени злокачественности ИПР.
Интраоперационная цитологическая диагностика рака молочной железы
Интраоперационная цитологическая диагностика - одно из основных направлений цитологического метода исследования.
Во время операции, используя цитологический метод, уточняют:
характер патологического процесса,
степень распространенности с выявлением метастазов в лимфатические узлы, печень,
контролируют радикальность выполненной органосохраняющей операции с исследованием краев резекции.
Частота ошибок клинициста в определении стадии заболевания перед началом лечения достигает 60-80%. Роль цитологии возрастает при разработке показаний к расширенной лимфаденэктомии и определении так называемых "сторожевых", или "сигнальных", лимфатических узлов (их может быть 6), при этом применение гистологического метода невозможно из-за длительности исследования. По данным ведущих патологоанатомов Америки (2000), ошибка срочного гистологического исследования "сторожевых" лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. Достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.
Срочное интраоперационное гистологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения (не останется материала для планового гистологического исследования). Цитологические критерии внутриэпителиального рака только разрабатываются. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса. При неуверенности в диагнозе между внутрипротоковой папилломой и раком предпочтительнее склониться в сторону папилломы, так как высокодифференцированный папиллярный рак имеет благоприятное клиническое течение, когда удаление части молочной железы является адекватным вмешательством. При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при 3 совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и при липогранулеме.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
Применение ИЦХ позволяет еще на дооперационном этапе не только уточнить характер и степень распространения опухолевого процесса, гистологический тип и степень злокачественности, но и определить важнейшие прогностические факторы, влияющие на разработку адекватных схем лечения. Основными путями повышения достоверности цитологического метода исследования в диагностике опухолей МЖ являются использование метода жидкостной цитологии, широкое внедрение в практическую работу цитологических лабораторий, иммуноцитохимических и молекулярных методов исследования, использование технологии "клеточного блока" (сеll-blоск), сохраняющей архив клеток, внедрение принципиально новых систем микроскопирования, позволяющих проводить анализ морфологии и прижизненной динамики клеток. Внедрение компьютерных технологий позволяет объективизировать результаты морфологического исследования путем морфометрических измерений различных параметров клеток, а также создавать компьютерные системы обучения и широко внедрять в практику методы телеконсультаций.
Аспекты дифференциальной цитологической диагностики рака молочной железы
Цитологическая картина внутрипротокового рака представлена эпителиальными клетками, преимущественно сгруппированными в мелкие солидные, папиллярные, розетковидные комплексы и единичными, расположенными раздельно. В 75% исследований опухолевые клетки однотипные без дисгармонального полиморфизма. В 25% исследований наблюдали паренхиматозные клетки с признаками “предраковой пролиферации. Митозов не наблюдали. В 75% исследований наблюдали интенсивное прокрашивание центрально расположенных клеток в составе солидного комплекса по сравнению с более бледными, расположенными по его периферии. В 50% исследований в препаратах отмечена высокая интенсивность прокрашивания ядра, проявившаяся формированием “чернильных пятен". При цитологическом исследовании материала больных с высокодифференцированным инфильтративным протоковым раком 82,3% клеток препарата были сгруппированы в солидные, цепочковидные и папиллярные клеточные комплексы. В 71,4% случаев наблюдали солидные группировки, в 85,7% - папиллярные, в 28,5% - цепочковидные комплексы. Цепочковидные группировки сформированы из клеток кубической, цилиндрической и округлой формы, в том числе с признаками деструкции. В преобладающем числе случаев эти группировки были вытянутой формы и состояли из 1-2 поперечных слоёв. В структуре цепочковидного комплекса всегда присутствовали: фиброцит (фибробласт) или деструктивно изменённая эпителиальная клетка, нить фибрина или ядерная нить, вокруг которых с обеих сторон группировались опухолевые клетки. Разрозненные клетки препарата мелких и единичные средних размеров преимущественно кубической формы. Ядра гиперхромные c мелкоглыбчатым хроматином и от 1 до 4 мелкими ядрышками. Цитоплазма гомогенная с включениями. Многоядерных клеток, митозов, признаков клеточной деструкции не обнаружено.
Инфильтративный умеренно дифференцированный протоковый рак
При инфильтративном умеренно дифференцированном протоковом раке 78,7% опухолевых клеток препарата сгруппированы. Всего в 88,6% исследований обнаружены клеточные комплексы цепочковидной, солидной и папиллярной формы, ассоциированные с нитью или деструктивной клеткой. В препаратах низкодифференцированного инфильтративного протокового рака 78,3% клеток расположено раздельно. Много голоядерных элементов и бесструктурного клеточного детрита.
Умеренно дифференцированный инфильтративный дольковый рак
В цитологических препаратах больных с умеренно дифференцированным инфильтративным дольковым раком половина всех клеток сгруппирована в солидные, цепочковидные и единичные розетковидные комплексы. Для цитологической картины фиброаденомы характерна группировка большего числа клеток препарата (80,7%). Солидный и папиллярный комплексы состояли из клеток кубической формы как обычного строения, так и с признаками пролиферации. Розетковидный комплекс формировался из клеток цилиндрического эпителия обычного строения.
Как поставить правильный диагноз по внешнему виду клетки. Для этого существует цитологический метод, основанный на микроскопическом изучении и оценке клеточного материала, полученного различным способом из патологического очага. Однако, цитологический метод — это ветвь онкоморфологии, и он ни в коем случае не должен противопоставляться гистологическому методу исследования.
Достоинства и преимущества цитологического метода очевидны:
- абсолютная безвредность;
- быстрота (в условиях оборудования рабочего места цитолога в пределах операционного блока срочное цитологическое исследование может быть выполнено в течение 10 мин). Современная методика Diff-Quic позволяет окрасить мазки в течение 15 с, но после срочного микроскопического исследования препараты необходимо докрасить по Паппенгейму, только тогда они пригодны для хранения в архиве, т. е. имеют документальное значение;
- относительная простота и доступность метода (цитологическое исследование не требует очень больших материальных затрат, дорогих реактивов, инструментария и оборудования);
- возможность применения многократных цитологических исследований, что особенно важно как для оценки динамики морфологических изменений в течение заболевания, так и для определения терапевтического эффекта проводимого лечения;
- небольшое количество адекватного материала для микроскопического изучения.
Цель рассматриваемого исследования — установить правильный диагноз, сэкономить время, избежать хирургического вмешательства при выполнении биопсии и волнений больного, не задержав при этом начала лечения.
Диагностическое цитологическое исследование сходно с гистологическим исследованием биопсийного материала:
- общей целью (прижизненное распознавание патологического процесса);
- объектом исследования (клеточный и неклеточный компонент патологического процесса);
- принципами окраски.
Вместе с тем при приготовлении мазка неизбежно нарушаются пространственные взаимоотношения структурных элементов ткани, что существенно ограничивает диагностические возможности цитологического метода и делает гистологический метод более информативным в определении нозологии опухоли и абсолютным в установлении ее инвазивности.
Цитологическое исследование предпочтительнее в тех случаях, когда биопсия кусочка ткани и гистологическое исследование невозможны или крайне нежелательны (при подозрении на меланому), при необходимости получения быстрого результата путем микроскопии доступного материала в условиях поликлиники и, наконец, при массовых профилактических осмотрах населения.
Цитологический метод дает возможность оценить характер и степень выраженности пролиферации эпителия, выделить группу дисплазии, что позволяет более обоснованно формировать группы повышенного риска рака разных локализаций. Динамическое наблюдение за этой категорией лиц и выполнение у них морфологического контроля фактически невозможно с помощью других (тем более инвазивных) методов исследования.
Применение цитологического исследования обеспечивает диагностику злокачественных опухолей любой локализации и в любой стадии процесса. Этому в немалой степени способствует развитие эндоскопической техники, позволяющей целенаправленно получать материал для исследования из внутренних органов, ранее недоступных для морфологического анализа без оперативного вмешательства.
Итак, при соответствующих способах забора материала цитологический метод позволяет:
- установить истинный характер процесса;
- оценить распространенность злокачественного процесса;
- констатировать прорастание первичной опухоли в соседние органы и ткани;
- указать на источник метастазирования при наличии адекватного материала (метастазы в кости отдифференцировать от первичных опухолей кости, метастазы в легкие — от первичного рака легкого).
Интерпретация цитологических препаратов — сложный процесс.
В результате многолетней дискуссии о специфичности злокачественных клеток было принято, что патогномоничных признаков, присущих только клетке злокачественной опухоли, нет и морфолог, в частности цитоморфолог, должен использовать в своей работе совокупность признаков атипии клетки, критически оценивая их наличие и степень выраженности. Каждый из признаков не имеет самостоятельного значения.
Общепринятые признаки злокачественности клеток:
К постановке правильного диагноза клиницист и морфолог должны идти в сотрудничестве. Если цитолог в каждом отдельном случае должен располагать клиническими данными, то клиницисту, в свою очередь, нужно усвоить язык морфолога, его подход и требования к материалу, направленному на исследование.
При направлении материала на цитологическое исследование клиницист должен правильно и обстоятельно заполнить сопроводительный бланк, указать возраст, пол, номер амбулаторной карты или истории болезни. Очень важны для цитолога сведения об объекте исследования: локализация патологического очага (или нескольких очагов). В случае взятия материала из нескольких участков одного образования или разных образований клиницист обязан маркировать мазки и дать соответствующую информацию в бланке-направлении. В заключении цитолога также должна быть отражена маркировка мазков.
Результаты цитологического исследования в значительной мере зависят от того, насколько прицельно взят материал, каковы его количество и сохранность. Цитологический материал переносится на специально подготовленные и обработанные предметные стекла (чистые, обезжиренные, сухие) и распределяется тонким слоем. Для равномерного размещения всего полученного материала не следует ограничивать количество предметных стекол. Главное — сделать мазки максимально тонкими, а содержащиеся сгустки и плотные участки осторожно разрыхлить с помощью иглы или перенести и распределить их на нескольких предметных стеклах. Толстые мазки и мазки с большим содержанием крови очень плохо фиксируются, что негативно отражается на качестве окраски клеточного материала и резко ограничивает возможности его микроскопической интерпретации.
Если нужно в консультативных целях пересмотреть цитологические препараты, клиницист в бланке направления кратко излагает цель пересмотра, данные клинического обследования больного и указывает номера всех цитологических и гистологических исследований, выполненных у этого больного. Чтобы избежать ошибочной трактовки изменений клеток, цитологу необходима исчерпывающая информация обо всех видах проведенного лечения (хирургическое, химио-, гормоно-, физио- и лекарственная терапия) с обязательным указанием дозы и даты окончания лечения. При отсутствии таких данных выявленные в цитограмме клетки с изменениями, свойственными терапевтическому патоморфозу или пролиферативным и репаративно-регенеративным процессам, могут быть неправильно расценены цитологом как опухолевые элементы.
Формулирование цитологического заключения — сложный и кропотливый процесс. Прежде чем приступить к микроскопическому изучению цитологических препаратов каждого больного, клинический цитолог должен ознакомиться с его клиническими данными, мысленно представить нормальное строение органа или ткани, из которой взят материал, знать пределы изменчивости этой ткани при различных физиологических состояниях, доброкачественных и злокачественных опухолях. Заключение цитолога основывается на результатах исследования клеточного состава цитограммы с учетом данных клинического обследования.
В клинической цитологии выделяют 3 раздела: эксфолиативная, пункционная, эндоскопическая.
В последние два десятилетия широкое распространение получил метод пункционной цитологии, он тоже имеет давнюю историю, но не в такой степени, как эксфолиативная цитология. Примером пункционной цитологии служит материал лимфатических узлов, костного мозга, костных новообразований, щитовидной, молочной желез. Проведение пункции любого органа требует специальной подготовки и опыта. Большое значение для успешного исследования имеет выбор места прокола, количество и качество полученного клеточного материала. В настоящее время часто осуществляют прицельные пункции образований под контролем УЗИ, компьютерного томографа.
Получение материала для цитологического исследования при помощи пункций в известной мере травматично. В отношении пункционных и аспирационных биопсий до недавнего времени высказывались предположения о возможной диссеминации опухоли при этих процедурах. Сейчас общепризнанно, что имеющийся минимальный риск перекрывается огромной пользой для больных в связи с реальной возможностью точной морфологической диагностики заболевания (особенно на дооперационном этапе и в случае очень распространенного злокачественного процесса, для назначения консервативных методов лечения — лучевого, химиотерапевтического, химиолучевого).
Третий раздел клинической цитологии — эндоскопическая цитология имеет относительно недавнюю историю. Результативность цитоморфологического метода в установлении характера процесса во многом зависит от умения эндоскописта взять материал для цитологического и гистологического исследования. Следует придерживаться правила, что первую биопсию эндоскопист берет из наиболее измененного участка слизистой оболочки. Если он ошибся в выборе места биопсии, то последующие биопсии могут быть выполнены не совсем точно из-за появляющейся кровоточивости слизистой оболочки. Считается, что применение щеточки (браш-цитология) предпочтительно при эзофагеальном раке и плоском типе раннего рака желудка.
Характер патологии, выявленной эндоскопистом, определяет количество материала, которое необходимо взять для морфологического исследования. При визуальной картине язвы желудка достаточно приготовить 3-5 мазков, а при подозрении на малигнизированную язву материал берут со слизистой оболочки всех краев язвы и распределяют на 10-12 предметных стеклах. Лучшей окраской мазков со слизистой оболочки желудка является гематоксилин-эозин, для идентификации участков кишечной метаплазии — муцикармин или альциановый синий.
В клинической картине язвенной болезни желудка выделяют стадии обострения, заживления и ремиссии. При обострении язвенного процесса в цитограмме превалируют элементы воспаления, а в эпителии слизистой оболочки желудка резко выражены дистрофические изменения и явления фагоцитоза. В период заживления язвы на первое место выступают изменения эпителия регенераторного порядка. По мере затухания воспалительного процесса и очищения дна язвы от некротических масс начинается регенерация слизистой оболочки желудка. С практической точки зрения важно учитывать особенности регенераторных разрастаний недифференцированного эпителия, чтобы исключить возможность ошибочного диагноза рака при микроскопическом исследовании как цитологического, так и гистологического материала, особенно в случаях развития дисплазии эпителия III степени.
Согласно данным литературы, при изучении гастробиопсий процент ложноположительного диагноза рака колеблется от 1,5 до 10,0, а при исследовании мазков-отпечатков он несколько ниже — 1,0-6,0. Изучение эндоскопического материала с помощью цитологического и гистологического методов широко используется для дифференциальной диагностики заболеваний желудка, выявления гиперпластических, метапластических и диспластических процессов, а также для определения степени обсемененности слизистой оболочки желудка Helicobacter pylori. Уточнение формы гастрита — прерогатива гистологического метода, что выгодно отличает его от всех прочих компонентов комплексного гастрологического обследования лиц с желудочной симптоматикой.
Ранний рак желудка распознается цитологически в 92-96,5% случаев. У больных развитой формой рака желудка информативность цитологического метода колеблется в широких пределах: максимальное ее значение (95,0%) отмечено при экзофитном раке, минимальное (71,0%) — при стенозирующем. В случаях малигнизации хронической язвы и язвенного рака изучение цитологического материала позволяет достоверно чаще выявить злокачественный характер процесса (в 82,0% наблюдений против 45,0, 59,0 и 68% при использовании соответственно рентгенологического, эндоскопического и гистологического методов исследования).
Весьма целесообразно применение цитологического метода при обследовании больных с подозрением на рак легкого. В специализированных лечебных учреждениях обследование больных с локальными рентгенологическими изменениями должно включать бронхоскопию с обязательным взятием материала для цитологического и гистологического исследований, обеспечивающих диагностику рака в 82,0-85,0 % наблюдений. Более простым, но менее результативным является микроскопическое исследование спонтанно отделяемой мокроты (чувствительность методики — 20-40,0%). Лучше себя зарекомендовал способ получения индуцированной мокроты, т.е. собранной после десятиминутной ингаляции раствором фермента (чувствительность методики — 60-80,0%). Для верификации природы периферических образований легких показана трансторакальная пункция. Изучение мазков пункционного материала позволяет цитологически распознать рак и определить его гистологическую форму (соответственно в 89,0% и 93% наблюдений).
Цитологические признаки различных форм рака легкого достаточно хорошо изучены и представлены в Цитологической классификации опухолей (ВОЗ, 1982). При наличии в мазках адекватного клеточного материала цитолог может идентифицировать все разновидности рака легкого. Трудности объективного и субъективного характера могут иметь место при малочисленности и плохой сохранности опухолевых клеток, при мозаичном строении опухоли, дифференциальной диагностике низкодифференцированного эпидермоидного и аденогенного рака, распознавании бронхоальвеолярной аденокарциномы и промежуточного подтипа мелкоклеточного рака легкого.
Исследование цитологического материала, полученного при пункции новообразований молочной железы, часто сводится к выяснению вопроса о наличии или отсутствии рака, хотя диагностические возможности цитологического метода гораздо шире. Анализ цитограмм позволяет у 80-87,0% больных раком молочной железы установить злокачественный характер процесса, определить степень дифференцировки клеток опухоли, в части случаев идентифицировать особые формы рака (медуллярный, апокринный, слизистый, Педжета). При доброкачественных процессах молочной железы клеточный состав пунктата дает возможность выявить гиперпластические изменения эпителия, оценить степень их выраженности, иногда осуществить нозологическую диагностику (киста, папиллома, фиброаденома, листовидная опухоль).
Цитологический скрининг рака шейки матки признан и широко проводится во всем мире. В задачу цитолога входит диагностика воспалительных процессов, вирусных инфекций, диспластических изменений эпителия шейки матки и раннего рака шейки матки. С этой целью сотрудники цитологических лабораторий обеспечивают квалифицированное микроскопическое исследование первично взятых мазков, а также материала, полученного при углубленном обследовании и динамическом наблюдении за женщинами с выявленной патологией гениталий. Мировой опыт применения цитологического метода доказал его реальную возможность распознавать самые начальные формы рака шейки матки (cr. in situ и I стадию).
С ростом заболеваемости раком тела матки, зарегистрированным во многих странах мира, появилась необходимость использовать цитологический метод для диагностики предрака и рака этой локализации. К предраковому состоянию эндометрия относится атипическая гиперплазия эндометрия. Цитограмма клеточной атипической гиперплазии эндометрия своеобразна: в мазках обнаруживают группы и небольшие пласты клеток эндометрия, имеющих укрупненные, умеренно полиморфные довольно светлые ядра с гомогенным тонкодисперсным хроматином и неконтурированной цитоплазмой. Для распознавания этого варианта атипической гиперплазии эндометрия цитологу необходимо целенаправленное тщательное изучение клеточного состава цитограммы сочетать с умением выявить не столь выразительные признаки атипии клеток эндометрия.
Чрезвычайно важна онконозологическая диагностика мелкоклеточных злокачественных опухолей, встречающихся преимущественно у детей и включающих неходжкинскую лимфому, нейробластому, рабдомиосаркому, саркому Юинга. Их точная дооперационная цитологическая диагностика способствует проведению гистогенетически обоснованного лечения, что позитивно влияет на прогноз заболевания. Для всех видов мелкоклеточных сарком свойствен относительно однородный клеточный состав из округлых недифференцированных бластных клеток, расположенных разрозненно, россыпями, очаговыми скоплениями, рядами и цепочками, что позволяет врачу-цитологу диагностировать злокачественную природу процесса. Распознавание гистогенеза новообразования возможно при обнаружении среди недифференцированных клеток более дифференцированных опухолевых элементов, имеющих светооптически определяемые признаки невральной, миобластной или лимфоидной дифференцировки. Обязательно учитываются данные клинического обследования больного. Следует помнить, что при неходжкинских лимфомах клеточный состав однороден, разрозненные опухолевые клетки лежат в одной плоскости препарата, имеют высокую митотическую активность. В мазках присутствуют лимфогландулярные тельца и функционально активные макрофаги.
Цитологическая картина рабдомиосаркомы характеризуется миксоидным фоном препарата и выраженным полиморфизмом опухолевых элементов с наличием двух- и многоядерных клеток.
Для цитограмм нейробластомных опухолей свойствен клеточный состав из мелких недифференцированных и дифференцирующихся нейробластов, расположенных изолированно и в тесных скоплениях с формированием псевдорозеток, очаговым присутствием нейропиля и одиночных ганглиозных клеток.
В последние годы существенно возрос интерес онкоморфологов к количественным и иммуноморфологическим методам исследования. Применение современной аппаратуры (анализаторы изображения высокого класса), компьютерных методик и специализированных математических программ дает возможность перейти от субъективных и только качественных методов диагностики к объективным и количественным методам цитоморфологического анализа. Использование методов иммуноморфологии наряду со стандартными методами цитологического и гистологического исследования позволяет существенно повысить качество уточняющей диагностики, что важно для решения задач нозологической диагностики опухолей и оценки прогноза заболевания. В клинической цитологии недалекого будущего достойное место займет телепатология, с помощью которой открываются перспективы проведения точной диагностики и квалифицированной консультации препаратов на расстоянии.
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
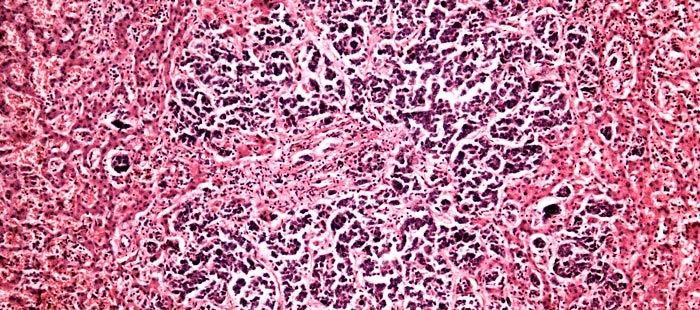
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Читайте также:



