Что такое люмбальная пункция при лейкозе
Казалось бы, о состоянии системы крови можно и нужно судить по общему анализу – с детства известной рутинной медицинской процедуре. Но на самом деле, данные этого анализа — отражение процессов, происходящих в кроветворной системе, и ее главном органе – костном мозге. Поэтому при подозрении на болезнь кроветворной системы анализируют состояние костного мозга. Пункция костного мозга – это вмешательство, которое позволяет получить 0,5-1мл. этой субстанции для дальнейшего исследования.
Что такое костный мозг и зачем его изучают?
Красный костный мозг находится в плоских костях – ребрах, грудине, позвонках, костях черепа и таза – и в эпифизах (концевых частях) трубчатых костей. Он состоит из двух типов клеток – стромы, или, говоря простым языком, основной структуры, и кроветворных ростков из которых, собственно, и формируются форменные элементы: эритроциты, лейкоциты и тромбоциты.

Все элементы крови развиваются из одинаковых стволовых клеток-предшественников. Созревая (в медицине этот процесс называется дифференцировкой), клетки формируют два ростка кроветворения: лимфоидный, из которого потом созревают лимфоциты и миелоидный, создающий остальные форменные элементы. Незрелые клетки крови называются бластами. Обычно 90% всех стволовых клеток находятся в состоянии покоя.
В организме взрослого мужчины в сутки созревает 300г. форменных элементов крови, то есть 9 кг за год и около 7 тонн за 70 лет жизни. Новые клетки формируются взамен состарившихся или погибших по другим причинам (например, в борьбе с инфекциями).
В норме количество вновь созревших клеток строго равно числу погибших. При гемобластозах (лейкозах) клетки кроветворного ростка мутируют, перестают реагировать на регуляторные сигналы организма, и начинают бесконтрольно делиться. Если активность этого процесса настолько велика, что вновь сформированные клетки не успевают созреть, лейкоз называется острым. Если преобладают зрелые формы – хроническим.
Прежде чем выйти в кровоток, измененные лейкозные клетки накапливаются в красном костном мозге. И только инфильтрировав (заполонив) его, поступают сосуды. Изменения в анализе крови далеко не всегда соответствуют происходящему в костном мозге: на некоторых стадиях развития лейкоза количество форменных элементов в крови может не только не увеличиваться, но и уменьшаться.
Именно по этим причинам пункцию костного мозга и миелограммы выполняют при подозрении на любые болезни кроветворной системы.
Как и для чего выполняют пункцию костного мозга?
Чтобы получить материал для исследования, нужно проткнуть (пунктировать) кость там, где она находится близко к коже. В зависимости от возраста (а количество костного мозга в разных анатомических структурах изменяется со временем), это могут быть:
- у детей младше 2 лет – пяточная или большеберцовая кость;
- у детей старшего возраста – гребень подвздошной кости;
- у взрослых – грудина или гребень подвздошной кости.
Прокол делают специальной иглой с ограничителем – иглой Кассирского. 
Она может выглядеть по-разному. Но суть в том, что ограничитель позволяет зафиксировать глубину прокола.
Иногда полученный материал бывает неинформативен. Тогда (и при некоторых других показаниях) делается трепанобиопсия – метод, при котором специальной толстой иглой одним блоком забирают не только красный костный мозг, но и участок костного фрагмента над ним. Такую биопсию обычно делают в области гребня подвздошной кости.

Место прокола закрывается стерильной повязкой или пластырем. Боль может беспокоить и некоторое время после процедуры. Если нет противопоказаний, можно принять обезболивающие. Место прокола нельзя мочить в течение суток, соответственно, не рекомендуют принимать душ или ванну. Какого-то дополнительного ухода после пункции костного мозга не требуется.
Процедура эта безопасна, единственное абсолютное противопоказание – тяжелые нарушения свертывающей системы крови, когда любая травма приводит к обширным гематомам. Относительные противопоказания (когда сравнивают возможную пользу и вред), это:
- острый инфаркт миокарда;
- декомпенсированная сердечнососудистая патология;
- декомпенсированный сахарный диабет;
- гнойные поражения кожи в области предполагаемой пункции.
- кровотечение;
- инфицирование;
- аллергия – при непереносимости обезболивающих средств;
- сквозной прокол грудины, перелом (если пункция выполняется из грудины).
Вероятность осложнений невелика – по данным Британского общества гематологов за время с 1995 по 2001 год на 54890 проведенных пункций пришлось 26 осложнений разной степени тяжести.
Расшифровка и оценка результатов: миелограмма.
В первую очередь, в счетной камере подсчитываются мегакариоциты и миелокариоциты.
Мегакариоциты – это крупные клетки с большими ядрами, предшественники тромбоцитов. Их должно быть более 20, но менее 50 в 1 мкл.
Далее в окрашенных мазках подсчитывают процентные соотношения клеток различных рядов кроветворения. Полученный результат называется миелограммой.

Чтобы оценить по миелограмме качество костного мозга, важно знать не только процентное и количественное содержание гемопоэтических (кроветворных) элементов, но и их соотношение. Вот расшифровка некоторых показателей.
Высчитывается по формуле: (Промиелоциты + миелоциты + метамиелоциты) / (Палочкоядерные + сегментоядерные нейтрофилы). Нормальное значение 0,6 – 0,8.
Формула расчета: (Полихроматофильные + оксифильные нормобласты) / (Все ядросодержащие клетки красного ростка этого пунктата). Норма 0.8 – 0.9 и снижение индекса говорит о чрезмерно медленном наполнении гемоглобином эритроцитов (например, при железодефицитной анемии).
Как и у любого инструментального исследования, референсные значения (нормы) миелограммы могут изменяться в зависимости от лаборатории и используемых аппаратов.
Особенности миелограммы при лейкозах.
Как при остром, так и при хроническом лейкозе усиленный рост патологических клеток сопровождается уменьшением количества эритроцитов и тромбоцитов на всех стадиях созревания.
Если в миелограмме видны признаки лейкоза, пунктат костного мозга дополнительно проходит иммуногистохимическое, цитохимическое и генотипическое исследования – они нужны чтобы определить характерные особенности мутации опухолевого клона. Это важно для выбора схемы лечения конкретного пациента.
Лимфобластный лейкоз крови считается самой распространенной онкологической патологией детей. Она составляет примерно 25% от общего количества раковых опухолей, выявляемых в педиатрии. Далее рассмотрим подробнее лейкоз крови – что это такое, почему он появляется и какие терапевтические мероприятия проводятся при этой патологии.

Общие сведения
Лейкоз крови – что это такое? Данное заболевание относится к группе онкологических. ОЛЛ (острый лимфобластный лейкоз), симптомы которого будут рассмотрены ниже, представляет собой группу гетерогенных новообразований из клеток, которые имеют определенные иммунофенотипические и генетические характеристики. Увеличению выработки и накоплению этих элементов в костном мозге способствуют вторичные аномалии пролиферации, дифференцировки либо того и другого. В результате происходит инфильтрация клетками паренхиматозных органов и лимфатических узлов. Большая часть (порядка 80%) всех лейкемий (лейкозов), выявляемых у детей, имеет лимфоидную природу.
Распространенность
Злокачественные заболевания крови сегодня встречаются в мире повсеместно. Распространенность ОЛЛ в развитых странах составляет 3-4 случая на сто тысяч детей ежегодно. В странах Средней Азии и Африки патология встречается реже. Часто ОЛЛ отмечается в США, Японии, Китае, Европе. Пиком заболеваемости у детей считается возраст 2.5-5 лет. Чаще патология развивается у мальчиков.
Предрасполагающие факторы
В первую очередь к ним следует отнести возраст матери в дородовой период, большой вес новорожденного – больше 4000 г, пост- и пренатальную экспозицию к ионизирующей радиации. В каких случаях еще может возникнуть острый лимфобластный лейкоз? История болезни матери может содержать информацию о гибели плода в предыдущей беременности. Это могло произойти вследствие неблагоприятных условий среды или из-за генетической предрасположенности. В случае наличия в семье онкологически больных родственников, увеличивается вероятность того, что у будущих поколений возникнет острый лимфобластный лейкоз. Причины заболевания могут быть связаны с синдромами нестабильности хромосомных элементов. К ним, в частности, относятся синдром Дауна, нейрофиброматоз, вариабельный иммунодефицит, анемия Фанкони, Х-сцепленная агаммаглобулинемия (врожденная) и прочие. В результате ряда исследований специалисты пришли к выводу, что при остром лимфобластном лейкозе, как и при развитии прочих онкологий, происходит спонтанная мутация клеток-предшественников. Она впоследствии осложняется пусковыми факторами среды, которые активизируют пролиферацию. Это наиболее распространенные явления, которые могут спровоцировать лейкоз. Причины возникновнения патологии являются одним из основополагающих моментов при выборе терапевтических методов.
Диагностика
При выявлении любой патологии онкологического характера принимаются во внимание клинические характеристики и признаки клеток, которые составляют опухолевый субстрат. Диагноз ОЛЛ ставится на основании параклинического и физикального обследований, данных анамнеза и лабораторных исследований.
Клиническая картина
Признаки лейкоза представляют собой комплекс нескольких синдромов:
- Интоксикационный. При остром лимфобластном лейкозе отмечается недомогание, снижение веса, слабость, лихорадка. Последняя может быть спровоцирована вирусной, бактериальной, протозойной (редко) или грибковой инфекцией, в особенности у пациентов с нейтропенией.
- Гиперпластический. При остром лимфобластном лейкозе происходит инфильтрация селезенки и печени. Это, в свою очередь, приводит к гепатоспленомегалии, которая может проявляться болезненностью в животе. Первые признаки лейкоза - патологические переломы трубчатых костей либо позвоночника. Болезненность и отечность суставов изначально могут быть приняты за проявления ревматоидного артрита либо иных нарушений. Поражения костей – за остеомиелит. При лейкемической инфильтрации суставной капсулы и надкостницы, инфаркте кости и опухолевом увеличении костного мозга в объеме появляются обширные боли. Вместе с этим на рентгенограмме выявляются свойственные патологическому состоянию изменения. Особенно явно видны они около крупных суставов и в трубчатых костях. Болезненность может возникнуть и позже, вследствие асептического некроза и остеопороза.
- Анемический. При остром лимфобластном лейкозе отмечается тахикардия, бледность, кровоточивость слизистых во рту, геморрагический синдром на кожном покрове. Вследствие интоксикации и анемии развивается слабость.
Проявление патологии
В 5-30% случаев первичного острого лимфбластного лейкоза у мальчиков наблюдается инициальное увеличение яичек. Отмечаются двух- или односторонние плотные безболезненные инфильтраты. В практике зарегистрированы случаи существенного увеличения почек. При этом могут отсутствовать клинические проявления их поражения. К редким осложнениям относят выпотной перикардит и инфильтрацию миокарда на фоне обструкции лимфооттока между эпикардом и эндокардом. При увеличении лимфоузлов в средостении могут возникать нарушения в деятельности дыхательной системы. Эти признаки лейкоза Т-клеточного типа приводят к развитию синдрома полой верхней вены. Может также возникнуть и дыхательная недостаточность. В ряде случаев отмечается лейкемическая инфильтрация легочных тканей или кровоизлияния в них. Иногда специалистам трудно дифференцировать данные осложнения с инфекционными патологиями. Среди распространенных признаков поражения глаз на фоне острого лимфобластного лейкоза следует отметить кровоизлияние в сетчатку, отек соска в зрительном нерве, инфильтрацию сосудов. При офтальмоскопии могут быть выявлены бляшки на дне глазного яблока. Вероятно также наличие плотных синюшных инфильтративных безболезненных элементов на коже. При любом повреждении покрова может развиться инфекция. В связи с этим в процессе диагностики могут быть выявлены панариции, паронихии, инфицированные укусы различных насекомых, следы уколов и т. п.
Параклинические исследования: ОАК
Гемоглобин может быть пониженным либо нормальным. Гематокрит и количество эритроцитов обычно снижены. Отмечается уменьшение числа ретикулоцитов. Количество лейкоцитов может быть сниженным, повышенным или нормальным. Однако при этом не во всех случаях могут обнаруживаться властные клетки. Для патологии характерен "лейкемический провал". Речь идет о наличии властных клеток на фоне отсутствия промежуточных форм – метамиелоцитов и миелоцитов - в кровяной формуле. Обычно наблюдается тромбоцитопения.
Миелограмма
Данная процедура представляет собой взятие костномозговой пункции. Забор материала должен осуществляться минимум из двух точек. Процедуру проводить желательно под общим наркозом. У детей старше двух лет пункцию берут из передних и задних гребней подвздошных костей, до 2-х лет – из пяточных сегментов или бугристости большеберцовых элементов. При цитологическом морфологическом исследовании, как правило, обнаруживается гиперклеточный костномозговой материал с суженными ростками нормальной системы кроветворения и инфильтрацией бластными клеточными структурами.
Цитохимическое исследование
Это один из обязательных этапов диагностики. С использованием цитохимического окрашивания выявляется, к какой линии принадлежат клетки. Обязательно применяется исследование на миелопероксидазу.
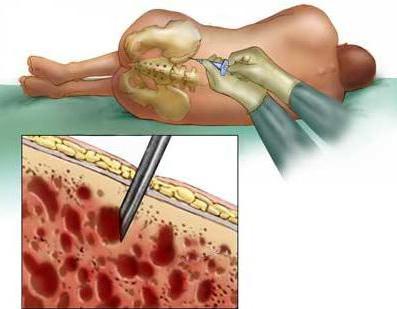
Спинномозговая пункция
Это также обязательная диагностическая процедура при подозрении на острый лимфобластный лейкоз, причины которого указаны выше. Спинномозговая пункция должна проводиться в условиях седации и в случае наличия в периферической крови не менее 30 тыс/мкл тромбоцитов. При необходимости перед проведением процедуры проводят трансфузии тромбовзвеси. Для того чтобы приготовить цитопрепарат, потребуется не меньше двух миллилитров ликвора. При обнаружении властных элементов и признаков повреждения в черепно-мозговых нервах ставится диагноз нейролейкоз - лейкемическое поражение ЦНС. Следует, однако, отметить, что проникновение в нервную систему лимфобластов и инфильтрация оболочек мозга происходят во всех случаях, даже при отсутствии клинических и лабораторных проявлений. Также желательно, а при выявлении неврологических симптомов обязательно, провести компьютерную либо магнитно-ядерную томографию спинного или головного мозга.

Прочие исследования
При помощи УЗИ забрюшинного пространства и брюшной полости можно уточнить размеры паренхиматозных инфильтрированных органов, увеличенных лимфоузлов в брюшной полости и прочих областях, органов в малом тазу, яичек. В рамках диагностики проводят рентгенографию грудной клетки в двух проекциях. Это необходимо для обнаружения увеличения средостения. При наличии показаний назначается рентгенография суставов и костей. В рамках лабораторных исследований проводится биохимический анализ. Он, как правило, показывает увеличение ЛДГ больше 500 МЕ, вероятные нарушения в деятельности печени и почек. Перед началом химиотерапии рекомендованы ЭхоКГ и ЭКГ. Сегодня, кроме прочих методов, в исследовании пораженных клеток используются молекулярно-генетические и цитогенетические способы определения числа хромосом, а также их структурных изменений.
Терапия: общие сведения
Базовым принципом, на котором строится современная педиатрическая онкогематология, является разделение пациентов на группы по интенсивности терапии. Она выбирается в зависимости от тяжести, с которой протекает острый лимфобластный лейкоз. Прогноз состояния также имеет большое значение. Так, к примеру, тем, кому для устранения патологии достаточно умеренной химиотерапии, категорически не рекомендовано получать более токсичные и тяжелые средства. При этом для тех, чья предполагаемая выживаемость не так высока, интенсификация мероприятий может стать шансом на выздоровление. При разделении на группы пациентов, у которых диагностирован лейкоз, прогноз составляется на основании предшествующего опыта, а также отдельных протоколов, внесенных в системы классификации. В каждом из них формируется та или иная стратегия терапевтических мероприятий определенной интенсивности. При существующей классификации принято общее соглашение по распределению по группам риска больных, которым установлен диагноз "острый лимфобластный лейкоз". Лечение детей было разработано еще в конце шестидесятых годов прошлого столетия в Америке. По большому счету принципы, на которых строится терапевтическая тактика, не претерпели особенных изменений. У пациентов в возрасте до года патология проявляется в крайне агрессивной форме и характеризуется нейролейкозом, лейкоцитозом.
Основные терапевтические методы
В лечении используются такие препараты, как "Преднизолон" и "Винкристин". Применяется также эндолюмбальное введение средства "Метотрексат" и краниальное облучение для предупреждения нейролейкемии. Также была разработана специальная программа лечения. Это значит, что все пациенты получали определенные четко дозировки и комбинации химиопрепаратов в установленные конкретные сроки, соответственно протоколу. К концу семидесятых годов стало ясно, что после прохождения такой программы выздоравливали порядка 50% детей, у которых был диагностирован лейкоз. Причины дальнейшего прогресса в терапии патологии обусловлены определением гетерогенности ОЛЛ и введением впоследствии систем международной цитологической классификации и прогностических факторов, распределением пациентов по группам, разработкой дифференцированных программ. Важнейшее значение имела организация мультицентровых исследований, изучение фармакокинетики разных цитостатических средств для формирования более эффективных химиотерапевтических режимов, а также интенсивное развитие сопроводительных мероприятий.
Основные принципы терапии
Благодаря описанным выше мероприятиям, были созданы программы химиолечения нового поколения. Большинство используемых сегодня протоколов строится на принципах инициальной интенсивной терапии, целью которой является максимальное разрушение пула патологических клеток. В основе создания терапевтических программ лежит применение цитостатиков в виде комбинаций, сменяющих друг друга (ротация), высокодозных химиотерапевтических режимов, а также проведение интенсивной профилактики патологии.
Особенности применения препаратов
К основным лечебным и профилактическим мерам при нейролейкемии являются интратекальное введение средств "Преднизолон", "Цитозар", "Метотрексат" (в дозировках согласно возрасту) и краниальное облучение. Последнее осуществляется на начальных этапах терапии. При эндолюмбальном введении препарат "Метотрексат" оказывает системное действие. В связи с этим для уменьшения опухолевой массы необходимо раннее проведение первой люмбальной лечебной пункции. Краниальное облучение обладает отдаленными и непосредственными побочными эффектами. В связи с этим исследования по оптимизации терапии ОЛЛ, проводимые сегодня, направлены на уменьшение дозы и четкое выделение больных из группы пониженного риска, для которых эта лучевая терапия не является обязательной. Все эти достижения позволили в конце восьмидесятых готов прошлого века преодолеть 70-процентный барьер пятилетней выживаемости при лейкозе у детей без рецидивов.
Современные терапевтические программы
Лечение, которое применяется сегодня, включает в себя несколько фаз. Первой является индукция ремиссии с использованием трех и более агентов, которые вводят на протяжении 4-6 недель. Второй – мультиагентная консолидация предыдущей фазы. Третьей – поддерживающая терапия. Как правило, на последней фазе в течение 2-3 лет применяются антиметаболиты. Сопроводительная терапия способствует предупреждению и устранению многих осложнений, связанных с индуцированной цитопенией и иммуносупрессией. Необходимость применять поддерживающую терапию на протяжении 2-3 лет была доказана еще в середине прошлого столетия. Обычно в течение этого периода каждый день пациент принимает препарат "6-Маркаптопуриин". Еженедельно ему вводят средство "Метотрексат". В зависимости от числа лейкоцитов устанавливается дозировка. Как практика показывает, у пациентов удовлетворительная переносимость такого терапевтического режима. Выполнение поддерживающих мероприятий на 80% от требуемого объема считается неблагоприятным прогностическим фактором в плане рецидива.
Дополнительные сведения
Существует ряд проблем в лечение ОЛЛ. В частности, увеличивается количество больных с мутантными клонами клеток опухоли, устойчивых к химиотерапии, высокая стоимость и появление поздних побочных эффектов (нейроэндокринные расстройства, нарушение роста, вторичные опухоли). Неудачи индукционного лечения обусловлены ранней смертью пациентов в связи с токсическими осложнениями либо резистентной опухолью. Также весьма ограничены подходы к терапии больных, не ответивших на стандартный режим. В качестве альтернативных применяют такие средства, как "Тенипозид", "Вепезид", "Цитозар". Сегодня порядка 70% детей имеют 5-летнюю ремиссию. Острый лимфобластный лейкоз у взрослых рецидивирует в каждом седьмом случае. Это говорит о том, что длительности периода ремиссии удается достичь лишь в 20% случаев. Как правило, возврат патологии отмечается в первые 2 года после диагностирования. Состояние ремиссии характеризуется как отсутствие в крови властных клеток, наличие менее 5% бластов в костномозговой ткани, появление признаков восстановления нормы гемопоэза. При анализе спинномозговой жидкости выявляется менее 5 мононуклеаров/микролитр. Для успеха лечения обязательно быстрое достижение состояния ремиссии. У 90% больных, как правило, патологические клетки проявляют чувствительность к химиотерапии.
В заключение
Основной задачей терапии является избавление больного от патологии и возврат его к нормальной общественной жизни и к хорошему состоянию здоровья при минимальном количестве осложнений, обусловленных лечением. Добиться этого сегодня достаточно сложно. Связано это с тем, что большинство антилейкемических медикаментов недостаточно селективны и токсичны. Однако достижения в области понимания клинической и биологической гетерогенности патологии, постоянное проведение различных исследований дают надежду на то, что молекулярный патогенез заболевания будет все же расшифрован до конца. В этом случае знания о механизмах опухолевой трансформации позволят разработать более эффективные и наименее токсичные терапевтические средства.
Спинномозговая пункция позволяет выявить поражение центральной нервной системы (нейролейкоз) специфического характера. Первая диагностическая пункция проводится в первые дни индукционной терапии, что крайне важно в плане ранней диагностики нейролейкоза, когда клинико-неврологическая симптоматика может еще отсутствовать. При анализе ликвора в качестве нормы принимаются следующие показатели:
- 1. Люмбальное давление - 114,8±0,77 мм водн, ст.;
- 2. Цитоз - 2±0,09 клеток в 1 мм;
- 3. Общий белок - 14,5±0,6 мг %;
- 4. Сахар - 60,7±0,8 мг %;
- 5. Хлориды - 93,6±3,4 мг %;
- 6. Натрий - 322,0±1,1 мг %;
- 7. Калий - 10,8±0,1 мг %;
- 8. Кальций - 5,7±0,1 мг %;
- 9. Мочевая кислота - 2,3±0,1 мг %.
5. Рентгенологические исследования имеют важное значение при наличии болевого синдрома в трубчатых костях, суставах, по ходу позвоночного столба. При остром лейкозе у детей изменения в скелете могут быть в виде поперечных полос разрежения в метафизах, деструктивно-очаговых поражений в плоских и трубчатых костях, общего диффузного разрежения костной структуры и периостозов, изменений со стороны надкостницы.
Следует помнить, что данные изменения не являются сугубо специфическими для лейкоза и могут встречаться при различных патологических состояниях опухолевой и неопухолевой природы. Наиболее типичным именно для острого лейкоза является поражение тел позвоночного столба, что проявляется в виде бревиспондилии. Наиболее часто при вовлечении в процесс костной ткани наблюдается поражение тазобедренных суставов, головки и шейки бедренной кости.
6. В комплексе диагностических методов исследования определенное значение придается исследованию иммунологического статуса ребенка как в момент диагностики острого лейкоза, так и в процессе проведения противолейкозной терапии, и во время стойкой ремиссии.
Биохимическое исследование сыворотки крови осуществляется в динамике болезни на фоне проведения активной противолейкозной терапии, что позволяет вносить своевременные коррективы в лечение при развитии таких состояний, как гиперурикемия, токсико-аллергическое поражение печени, почек и т. д.
Исследование свертывающей и противосвертывающей систем крови важно, особенно в период проведения индукционной химиотерапии у больных с нелимфобластными вариантами острого лейкоза, течение которых сопровождается явлениями повышенной кровоточивости. У таких больных на фоне проводимого лечения нередко развитие тромбогеморрагических состояний, ДВС-синдрома, требующих неотложных терапевтических вмешательств.
Методы, направленные на контроль за функциональным состоянием кардио-респираторной системы, почек, печени, желудочно-кишечного тракта, эндокринной системы также применяются в различные периоды острого лейкоза. Однако следует подчеркнуть, что обилие современных инструментально-диагностических методов, которые применяются в онкогематологической практике, требует выбора наиболее значимых и информативных в каждом конкретном случае. Необходим индивидуализированный подход к каждому больному, что во многом определяется квалификацией и опытом лечащего врача.
лейкоз лейкемия заболевание кроветворение
Спасение от лейкоза - ранняя диагностика. Распознать лейкемию можно по первым симптомам, на которые родители не всегда обращают внимание. Если ребенок стал бледным, слабым, чаще хочет прилечь, необходимо сделать анализ крови.
Во всех случаях заболеваний у детей и при отсутствии должного эффекта от проводимой терапии следует проводить исследование периферической крови в динамике. При необычных реакциях со стороны крови необходима консультация гематолога.
При ОЛЛ в анализах крови общее число лейкоцитов может быть ниже 10х109 /л (у 45-55%), (10-50)х109/л (у 30-35% пациентов) и выше 50 109/л (у 20%). У всех больных выявляется анемия, причем у 75% больных уровень гемоглобина ниже 100 г/л. Происходит и значительное снижение количества тромбоцитов (у 75% пациентов).
Лейкоз, при котором в периферической крови выделяют патологические бластные клетки, называют лейкемическим. А лейкоз (или его фазу) с отсутствием бластных клеток в крови расценивают как алекемический.
Диагноз лейкоза может быть установлен только морфологически - по обнаружению несомненно бластных клеток в костном мозге. Острый лейкоз определяется при наличии более 30% бластных клеток в мазке костного мозга. Форму острого лейкоза устанавливают с помощью гистохимических методов.
Спинномозговая пункция при лейкозе - обязательная диагностическая процедура. Цель этой манипуляции заключается в раннем выявлении, профилактике и оценке эффективности лечения нейролейкоза.
Диагноз основывается на клинико-гематологической картине. Особое значение для диагностики имеет пункция костного мозга, исследование которого необходимо проводить при малейшем подозрении на острый лейкоз до назначения специфической терапии. Помимо морфологического исследования, необходимо проводить цитохимические исследования бластных клеток и имуноцитологическое их типирование.
Состоит из следующих этапов.
- 1. Индукция полной ремиссии с помощью 4-- 6 курсов поли-химиотерапии по различным программам с ранним началом профилактики специфического поражения ЦНС (нейролейкоз) с помощью интратекального введения метотрексата или метотрексата в комбинации с цитозаром (для больных группы повышенного риска).
- 2. Консолидация ремиссии (закрепление). Наступление полной ремиссии обязательно должно подтверждаться контрольным исследованием костного мозга. Для уменьшения числа оставшейся популяции лейкозных клеток проводится закрепляющий курс полихимиотерапии. В этот период дополнительно эндолюмбально вводят цитостатические препараты.
- 3. Поддерживающее лечение последовательным (каждые 1,5--2 мес) чередованием 6-меркаптопурина и метотрексата с применением циклофосфана 1 раз в 7-- 10 дней. Больным, относящимся к группе повышенного риска, в начальном периоде поддерживающего лечения проводится дистанционная гамма-терапия области головного мозга.
- 4. Реиндукция ремиссии: проведение 1 раз в 2--2,5 мес курса полихимиотерапии (как в период индукции ремиссии) или 5--7-дневного курса аспарагиназы. Возможно чередование такого курсового реиндукционного лечения. В этот период осуществляется весь комплекс гематологического обследования с продолжением химиопрофилактики нейролейкоза. При нелимфобластных лейкозах положительный эффект оказывает комбинация цитозара с рубомицином по программам 7+5 или 5+3. Эффективность терапии улучшается при использовании различных видов иммунокорригирующей терапии в период проведения поддерживающего и реиндукционного лечения.
При остром лейкозе показана срочная госпитализация. В отдельных случаях при точном диагнозе возможно цитостатическое лечение в амбулаторных условиях. В лечении ОЛЛ используются комбинации химиопрепаратов. Лечение обычно разбивается на 3 фазы. В первой фазе проводится индукционная терапия, в конце которой более чем у 90% больных мазки костного мозга соответствуют ремиссии. Вторая фаза лечения - это консолидация, которая заключается во введении химиопрепаратов и иногда облучении черепа для удаления лимфобластов, которые могут находиться в менингеальных оболочках центральной нервной системы. Третья фаза - поддерживающая терапия.
Особенность лечения заключается в том, что оно проводится длительное время. Поэтому интенсивный курс длится 8-9 месяцев, затем следует облучение головного мозга и после этого еще 2 года пациент принимает поддерживающую терапию уже дома. Именно такое лечение позволяет успешно преодолевать болезнь.
Лечение детей с лейкемией - кропотливый труд врачей и родителей.
Сегодня детские онкогематологи используют передовые методики и последние разработки в лечении лейкозов. Однако еще довольно редко проводится трансплантация костного мозга.
Лечение острого лимфобластного лейкоза
С 1990 года применяют современные терапевтические протоколы лечения острого лимфобластного лейкоза у детей ОЛЛ-БФМ-90 разработанные немецкими коллегами (1988, 1990, 1992 гг.). По протоколам среди детей, больных ОЛЛ, выделяют три группы риска:
- 1. Группа стандартного риска - дети от 1 года до 6 лет. Количество бластов на 8 день терапии в периферической крови не превышает 1000 в 1 мкл. (после 7-дневного приема преднизалона); отсутствует пре-Т иммунофенотип лейкоза (если у пациента не проводилось иммуноспецифическое исследование бластов, но имеется медиастенальная опухоль, то пациент в любом случае из стандартной группы риска); не имеется первичного поражения ЦНС; установлена полная ремиссия на 33 -й день лечения;
- 2. Группа среднего риска - дети до 1 года и старше 6 лет, количество бластов в периферической крови на 8-й день, после 7-дневной преднизолоновой профазы, не превышает 1000 в 1 мкл; полная ремиссия на 33-й день лечения;
- 3. Группа высокого риска - отсутствие полной ремиссии на 33-й день лечений.
Между 65 и 70 днем повторная контрольная костномозговая пункция для подтверждения ремиссии, если на 33 день в костном мозге 5% и более бластов (в гемограмме не более 20 х 109 /л лейкоцитов).
Классификация цитостатических средств
1 Антиметаболиты - нарушают синтез предшественников нуклеиновых кислот, путем конкуренции с последними в лейкозной клетке.
Метотрексат - антогонист фолиевой кислоты (эффект в стадии разгара и в качестве поддерживающей терапии, действует на S фазу).
Ланвис (Tioguaninum) (Glaxo Wellcome) - 1 табл. содержит 40 мг тиогуанина : 25 табл. в упаковке. Тиогуанин является сульфгидрильным аналогом гуанина и проявляет свойства пуринового антиметаболита. Являясь структурными аналогами пуриновых нуклеотидов, метаболиты тиогуонина включаются в пуриновый обмен и ингибируют синтез нуклеиновых кислот в опухолевых клетках.
6-Меркаптопурин (пуринетол) - антогонист пурина, вмешивается в обмен нуклеиновых кислот, действует на S фазу.
Цитозар (цитозинарабинозид) - систематический аналог пиримидина, препятствует превращению цитидина в диоксицитидин (на S фазу лейк. клетки).
2 Алкилирующие соединения - подавляют синтез ДНК и в меньшей степени РНК в лейкозной клетке.
Циклофосфан, обладающий цитостатическим и цитолитическим действием на лейкозные клетки.
3 Алколоиды растений.
Винкристин - практически воздействует на все фазы покоящейся клетки.
Этопозид (вепезид, VP -16) - из растений мондрагоры, предотвращает вхождение клетки в митоз.
4 Ферментные препараты.
L-аспарагиназа (краснитин) - разлагает аспарагин, необходимый для синтеза протеина, на аспарагиновую кислоту и амоний в лейкозной клетке, которая не способна к самостоятельному синтезу аспарагина и поэтому погибает от его эндогенного действия.
5 Противоопухолевые антибиотики.
Адриамицин, рубомицин - обладает цитостатическим действием, подавляет синтез нуклеиновых кислот путем взаимодействия с ДНК и РНК - полимеразами.
6 Гормональные препараты.
Преднизолон - обладает цитолитическим действием на лейкозные клетки (лимфобласты и недифференцируемые бласты) и не вызывает разрушения нормальных лимфоцитов.
Дозировка медикаментов осуществляется в соответствии с площадью поверхности тела пациента. Каждый раз перед началом нового этапа лечения вновь определяется площадь поверхности тела и рассчитывается соответственно доза препаратов. При эндолюмбальной инъекции и при облучении головы дозировка осуществляется в соответствии с возрастом.
Поли-химиотерапия больных со стандартным и средним факторами риска длится в течение 6-ти месяцев.
ПРОТОКОЛ I - (направлен на редукцию ремиссии).
Первая фаза. Преднизолон назначается из расчета 60 мг/м2 с 1-го по 28 день, затем снижение дозы на 50% каждые три дня до полной отмены. У пациента с высокой начальной массой лейкозных клеток или выраженной органомегалией начальную дозу необходимо назначать из расчета 20 мг/м2, до снижения уровня лейкоцитов в периферической крови ниже 20*109/л, чтобы избежать острого синдрома распада белков.
В зависимости от клинического ответа на терапию (уменьшение органов), лабораторных показателей (уменьшение числа лейкоцитов, содержания мочевой кислоты, мочевины, креатинина, калия) дозу преднизалона нужно быстро увеличивать до окончательной (60 мг/м2) не позднее 5-го дня терапии.
Винкристин вводится в дозе 1,5 мг/м2 внутривенно на 8, 15, 22, 29-й день.
Рубомицин вводится из расчета 30 мг/м2 внутривенно капельно в течении 1 часа на 8, 15, 22, 29-й день. Перед первым введением рубомицина делается ЭКГ и эхография сердца (препарат кардиотоксичен).
L-Аспариназа (L-ASP) - вводится в дозе 10000 ед/м2 внутривенно капельно в течении 1 часа на 8, 15, 18, 21, 24, 30, 33-й день.
Возможны тяжелые аллергические реакции, гипергликемия и нарушение свертывания крови. Необходимо проводить лабораторный контроль свертывания крови (фибриноген, АТ-Ш, плазминоген), уровня сахара. При развитии анафилаксии возможна замена на эрвиназу.
Профилактика нейролейкоза проводится эндолюмбальными введениями метотрексата в возрастной дозировке 1 раз в 2 недели.
Вторая фаза. Условия для начала фазы 2 протокола 1 следующие: полная ремиссия в костном мозге, менее 5% бластов в миелограмме; при начальном поражении ЦНС - полная ремиссия в ЦНС; при медиастенальной опухоли - уменьшение размеров опухоли до 30% ее начальной величины; удовлетворительное общее состояние; отсутствие тяжелой инфекции; креатинин в пределах возрастной нормы; лейкоциты более 2*109/л; гранулоциты - более 0,5*109/л.
Циклофосфан (ЦФ) - вводится в дозе 1000 мг/м2 внутривенно капельно в течении часа на 36-й и 64-й день лечения. Контроль диуреза и профилактика геморрагического цистита проводятся следующим образом: гидратация 3000 мл/м2 за 24 часа; фуросемид из расчета 0,5 мг/кг внутривенно на 6 и 12 час после циклофосфана; месна (урометоксан) 400мг/м2 внутривенно на 0,4 и 8 часу от начала инфузии циклофосфана.
6-Меркаптопурин (6-МП) - 60 мг/м2 в сутки внутрь, 36-63-й дни лечения.
Цитозар (ARA-C) - 75 мг/м2 в сутки внутривенно в виде 4 дневных блоков; 38-41 дни, 45-48, 52-55, 59-62 дни. После начала лечения цитозаровые блоки желательно не прерывать.
Если начало цитозаровых блоков откладывается или прерывается, одновременно прекращается прием 6-МП. Выпавшее в лечении 6-МП нужно подтянуть до общей плановой кумулятивной дозы, равной 1680 мг/м2.
ПРОТОКОЛ М - (направлен на консолидацию ремиссии).
Включает в себя 6-меркаптопурин, высокодозированный метотрексат, метотрексат эндолюмбально, лейковорин внутривенно. Начинается через 2 недели после завершения протокола 1. Основные условия для начала этого протокола: лейкоциты больше 1,5*109/л; гранулоциты больше 0,5*109/л; тромбоциты больше 50*109/л.
6-Меркаптопурин назначается из расчета 25 мг/м2 в день (внутрь), в течение 8 недель.
Метотрексат назначается в дозе 1 г/м2 (1/10 общей дозы, вводится в течение 30 мин; 9/10 общей дозы вводится в течение 35,5 ч.) путем непрерывной инфузии, на 8, 22, 36, 50 день от начала протокола М.
Лейковорин (антидот метотрексата) дается из расчета 15 мг/м2 внутривенно струйно или внутрь в таблетках на 42, 48, 54 час от начала введения.
МТХ интралюмбально вводится через 2 часа от начала внутривенной инфузии МТХ в возрастной дозировке.
ПРОТОКОЛ II - (также направлен на консолидацию ремиссии).
Первая фаза. Проводится через две недели после протокола М. Условия начала II протокола следующие: продолжается полная ремиссия; хорошее общее состояние больного; отсутствие инфекции; лейкоциты больше 2,5*109/л; гранулоциты больше 1*109/л; тромбоциты больше 100*109/л.
Дексаметазон 10 мг/м2 внутрь с 1 по 21 день от начала протокола, затем дозу уменьшают каждые 3 дня на 50% до полной отмены.
Винкристин 1,5 мг/м2 - 4 внутривенных введения с интервалом в одну неделю (максимальная доза 2 мг/м2).
Адриамицин (ADR) 30 мг/м2, инфузия в течение 1 часа. Перед 1 и 3 назначением необходимо провести ЭКГ и эхокардиографическое исследование: при признаках снижения сократительной функции миокарда следует прекратить дальнейшее применение ADR.
L-Аспарагиназа 10000 ЕД/м2 - инфузия в течение 1 часа на 8, 11, 15, 18 день.
Вторая фаза. Условия для начала второй фазы протокола II: хорошее общее состояние; отсутствие инфекций; нормальный возрастной уровень креатинина в сыворотке крови; лейкоциты больше 2*109/л; гранулоциты больше 0,5*109; тромбоциты больше 50*109/л.
Циклофосфан 100 мг/м2, инфузия в течение 1 часа на 36 день от начала протокола. Контроль диуреза и профилактика цистита такие же, как в протоколе 1.
6-Тиогуанин (6-TG) 60 мг/м2 внутрь в 36-49 дни, всего 14 дней.
Цитозар (ARA-C) 75 мг/м2 внутривенно двумя блоками через 4 дня: 38-41 день, 45-48 дни.
МТХ интралюмбально вводится в возрастных дозировках на 38 и 45 день от начала протокола.
Облучение головы. При хорошем клиническом состоянии облучение головы начинается с 38 дня протокола II для детей из групп среднего и высокого риска. Доза облучения зависит от возраста и от начального вовлечения ЦНС (от 12 до 18 Гр детям до 2 лет, от 18 до 24 Гр детям старше 2 лет).
В случае выявления нейролейкоза люмбальные пункции метотрексата осуществляются один раз в неделю, с одновременным введением цитозара, преднизолона. В конце полихимиотерапии подключается облучение головы.
Поддерживающая терапия проводится двумя препаратами сроком до 2-х лет.
6-Меркаптопурин 50 мг/м2 внутрь, ежедневно.
Метотрексат 20 мг/м2 внутрь 1 раз в неделю. В день приема необходимо контролировать общий анализ крови и регулировать дозу поддерживающей терапии в зависимости от уровня лейкоцитов.
Читайте также:

