Митоз его значение в онкологии
До начала деления клетка находится в фазе роста G1. Затем наступает фаза активного синтеза ДНК (S-фаза), в результате которой образуются две генетически идентичные копии хромосомальной ДНК клетки. Эти двойные хромосомы получили название сестринских хроматид. На данном этапе еще до начала митоза хроматиды можно четко наблюдать в световом микроскопе.
Непосредственно перед началом митоза клетка вступает в фазу G2, которая инициируется ферментами — циклин-зависимыми киназами. В самом начале митоза, в прометафазе, каждая из сестринских хроматид связывается с белками в своем центромере, что затем приведет к формированию митотического веретена. Когда все хроматиды свяжутся с белками, происходит образование митотического веретена, или собственно метафаза. В конце этого процесса ядерная мембрана исчезает.
Еще одна группа ферментов — комплекс промоторов анафазы — разлагает белки, препятствующие вхождению клетки в анафазу. В период анафазы эти ферменты расщепляют связи, соединяющие сестринские хроматиды друг с другом, и два набора хромосом расходятся к противоположным полюсам клетки. Клетка делится, и две дочерние клетки вступают либо в фазу продолжительного покоя (фаза G0), либо в фазу роста (фаза G1), когда в клетках вновь начинается репликация ДНК.
На каждой фазе клеточного роста существуют механизмы, которые отслеживают корректность проходимых в клетке процессов и не дают клетке вступить в следующую фазу при обнаружении ошибок. Митоз никогда не начнется, пока не будут выявлены все ошибки в клеточном ДНК. За это ответственны ферменты р53, ATM и СНК2. Формирование митотического веретена происходит под контролем белков BUB1 и MAD. При деактивации этих ферментов расхождение хромосом может произойти с нарушениями.
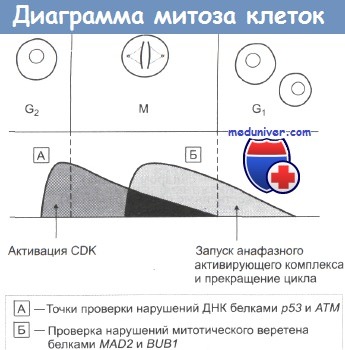
Диаграмма процесса митоза с указанием ключевых точек контроля.
А — точки проверки нарушений ДНК белками р53 и ATM
Б — проверка нарушений митотического веретена белками MAD2 и BUB1
Хромосомная нестабильность является отличительной чертой раковых опухолей, так как их клетки очень часто бывают анеуплоидны. Принимая во внимание сложность митотичес-ких процессов, можно представить себе множество механизмов, которые ответственны за эту нестабильность. В онкологии описано множество мутаций генов, поддерживающих нормальный митотический процесс.
Например, отмечаются мутации в гене р53 при различных локализациях рака. Потеря функциональности у белка р53 приводит к тому, что при делении клеток не выявляются многочисленные нарушения структуры ДНК, что приводит к постепенному дальнейшему нарушению генетической структуры и, в конечном счете, к развитию злокачественных новообразований. Некоторые регуляторные белки являются мишенями для вирусных онкогенов. Так вирус ВТКЛ-1 продуцирует белок TAX.
Последний инактивирует фермент MAD1, что ведет к хромосомной нестабильности. Существует и множество других белков, участвующих в регуляции митоза, мутации в которых приводят к развитию опухоли, как, например, АПК (мутация ведет к аде-номатозному полипоидному колиту).
Нестабильность хромосомной структуры в сочетании с характерными чертами злокачественного фенотипа (подвижность, инвазивность и метастазирование) делает опухолевые клетки более чувствительными к цитостатическим препаратам, чем нормальные клетки. Именно из-за такой высокой чувствительности в лечении рака возможно применять цитостатические агенты в таких дозах, которые оказывают летальное воздействие на опухолевые клетки, но не наносят необратимых повреждений здоровым тканям.
В морфологической характеристике опухолевых клеток большую роль играют исследования митотического режима. Исчерпывающие сведения о митотическом режиме в нормальных клетках можно найти в фундаментальных работах И. А. Алова, а о митотическом режиме в опухолевых клетках—в работах И. А. Алова и И. А. Казанцевой.
Накопленные факты позволили определить следующие основные направления возможного использования исследования митотического режима в опухолях: 1) ранняя диагностика рака; 2) дифференциальная диагностика доброкачественных и злокачественных опухолей сходного гистогенеза; 3) разработка методов прогнозирования малигнизации предопухолевых процессов, 4) дифференциальная диагностика опухолей разного гистогенеза и уточнение гистогенетнческой принадлежности новообразования (первичного н метастатического), 5) оценка степени терапевтического повреждения опухоли.
Суммируя материалы, полученные И. А. Казанцевой, можно следующим образом охарактеризовать особенности митотического режима при гиперпластических и диспластических процессах и в опухолевых клетках.
Для многих нормальных эпителиальных тканей характерны умеренная митотическая активность, которая, однако, значительно выше в быстро обновляющихся тканях; примерно одинаковое количество клеток в стадии профазы и метафазы с преобладанием иногда первой; невысокая частота патологических митозов.
При фоновых процессах (умеренная дисплазня эпителия гортани и шейки матки, эпидермизация псевдоэрозий шейки матки, простая железисто-кистозная гиперплазия эндометрия и др. ) отмечают некоторое увеличение митотической активности, небольшое преобладание клеток в стадии метафазы, повышение количества патологических митозов, среди которых около 90% составляют колхициноподобные метафазы и отставание хромосом в метафазе.
При гиперпластических и диспластических процессах, которые могут рассматриваться как предраковые (тяжелая дисплазня шейки эпителия матки, атипическая гиперплазия эпителия гортани и др ), а также при некоторых доброкачественных опухолях может наблюдаться дальнейшее нарастание нарушений митотического режима, связанных с преобладанием метафаз, учащением числа патологических митозов и их разнообразие с появлением разновидностей, ведущих к анеуплоидин, расширение зоны, где встречаются делящиеся клетки.
Для клеток злокачественных опухолей характерно преобладание метафаз над другими стадиями митоза, резкое возрастание частоты патологических митозов, различная степень повышения митотической активности, нередко незначительная. Существуют опухоли, в которых митотическая активность ниже, чем в нормальных тканях. Мнение, что во всех опухолях клетки делятся чаше, чем в норме, неверно.
Нет, по-видимому, и прямой связи между митотической активностью и быстротой роста опухоли.
Обнаружение соответствующих нарушений митотического режима может быть дополнительным ранним диагностическим признаком наступившей малигнизации или иметь прогностическое значение при оценке предопухолевых процессов чем резче выражены нарушения митотического режима, тем неблагоприятнее прогноз.
Не исключено, что, возможно, имеют место некоторые различия в характере нарушения митотического режима в опухолях разного гистогенеза.
На основании изучения митотического режима может быть получена полезная информация для оценки степени повреждения опухолевых клеток при лучевом или лекарственном лечении новообразований. Например, снижение митотического индекса и нарастание так называемых комковатых митозов, являющихся разновидностью К-митозов и ведущих клетку к гибели, может служить одним из критериев терапевтического эффекта.
Исследование закономерностей митотического режима в новообразованиях имеет решающее значение для понимания механизмов, определяющих книети ку популяции опухолевых клеток, которая по многим параметрам оказывается весьма гетерогенной. Если рассматривать популяцию опухолевых клеток с точки зрения их деления, то следует отметить, что вышедшие из митотического цикла опухолевые клетки могут или вступить на путь диффереицировки, или вновь вступить в митоз и продолжать пролиферировать, или остаться в покоящемся состоянии. Таким образом, в популяции имеется 3 группы клеток, нахо дящихся во взаимосвязи друг с другом недифференцированные покоящиеся клетки, недифференцированные пролиферирующие клетки и дифференцирующиеся, но уже не пролифернрующие клетки.
Покоящиеся опухолевые клетки, как было показано О. И. Епифановой и соавт., сохраняют жизнеспособность и пролиферативный потенциал, они резистентны к химиотерапевтическим препаратам (цитостатикам, алкилирующим соединениям, антибиотикам), митотическим ингибиторам Сохраняя способность при каких-то условиях вновь вступать в митоз, эти клетки являются источником рецидивов, что делает их изучение крайне важным. Хотя существуют сведения о том, что в покоящихся опухолевых клетках ниже проницаемость плазматической мембраны, более резко конденсирован хроматин, возможно, в ДНК имеются участки, более прочно связанные с белком, повы шено обновление молекул, однако их практическая идентификация в опухоли пока еще невозможна, так как мы не знаем их особенностей нх обмена, ни их морфологических, гистохимических или ультраструктурных особенностей, ко торые позволили бы отличить их от других недифференцированных опухолевых клеток.
В связи с тем что недифференцированные пролиферирующие опухолевые клетки чувствительны к лучевому и химнотерапевтическому лечению, делают попытки перевести покоящиеся клетки в группу пролиферирующих путем гормональных воздействий или иных мероприятий.
Катаплазия на светооптическом уровне касается не только морфологии опухолевых клеток (их фенотипа), но еще в большей степени их морфогенетических потенций, что выражается в нарушении обычной тканевой и органной структуры новообразований. Органная и тканевая катаплазия, являющаяся, так же как инвазивный рост и метастазирование, наиболее характерным морфологическим признаком опухолевого роста, наряду с клеточной катаплазией составляют ту сумму признаков, которые позволяют на светооптическом уровне идентифицировать опухоль во всем многообразии ее строения.
Классические гистологические методы поэтому были и остаются основой морфологической диагностики новообразований человека, однако использование только их не дает возможности решать встающие перед онкологией новые задачи. Расширить методические возможности морфологической верификации новообразований можно с помощью таких современных способов исследования, как электронная микроскопия, гистохимия, иммуногистохимия. Анализ ультраструктурных, гистохимических, иммуногистохимических и биологических особенностей опухолевых клеток главным образом в плане диагностики и установления гистогенеза новообразований человека дан в последующих трех разделах.
Митоз — важнейший этап в жизни клетки и всего организма, процесс деления соматической клетки у животных и образования половых клеток у растений.
Биологическое значение митоза:
2) рост отдельных тканей и целых организмов;
3) регенерация клеток и тканей;
4) бесполое размножение.
Итак, митозом делятся именно соматические клетки! При этом абсолютно неверно говорить, что половые клетки делятся мейозом. Половые клетки не делятся, а образуются: у животных в результате мейоза, а у растений в результате митоза. Мейоз — путь образования спор у растений и грибов.
Профаза митоза
2. Поздняя профаза.
1) Формируется веретено деления в цитоплазме. Веретено состоит из тубулиновых микротрубочек.
2) Образуются полюса деления в результате расхождения клеточных центров к разным полюсам. Помните, клеточный центр (он есть у клеток водорослей, грибов, животных) — это центриоли с отходящими от них микротрубочками. Так как центриоли поделились в интерфазе, значит, клеточных центра в профазе будет два.
3) Ядерная оболочка разрушается, ядрышко исчезает. Оболочка ядру уже не нужна, она будет только препятствовать расхождению хромосом. Ядрышко также не требуется — все рибосомы были синтезированы в интерфазе. После исчезновения ядерной оболочки у высших растений тоже образуется веретено деления за счет переориентации хромосом, несмотря на то, что у них нет клеточного центра.
3. Набор хромосом и количество хроматид (молекул ДНК). 2n4c.
Метафаза митоза
1. Прометафаза. Ключевое событие — микротрубочки, берущие начало от пары центриолей, присоединяются к центромерам хромосом.
2. Хромосомы передвигаются к центру клетки за счет сокращений белковых нитей микротрубочек.
3. Метафаза. Хромосомы расположены по экватору клетки. Фактически это один длинный ряд из двухроматидных хромосом. На рисунке показана модель одной из двухроматидных хромосом.
5. Набор хромосом и количество хроматид (молекул ДНК). 2n4c.
Анафаза митоза
1. Центромеры хроматид разъединяются, фактически разделяются.
1) Рассмотрим пример. У нас одна хромосома, состоящая из двух хроматид — А и В. И у нас два полюса клетки — А и В.
2) Хроматида А пойдет к полюсу А, хроматида В пойдет к полюсу В. Выше на рисунке показана модель двух хроматид одной хромосомы, расходящихся к разным полюсам.
3) Мы видим на рисунке только одну хромосому, но на самом деле ниже ее всегда есть парная хромосома, хроматиды которой также разошлись. Так как в двух хромосомах 4 хроматиды, то после их расхождения мы получим по сути 4 независимых хромосомы — и набор станет 4n.
4. Набор хромосом и количество хроматид (молекул ДНК). 4n4c. Для многих учеников остается загадкой, почему здесь 4n. Дело в том, что фактически на данной стадии материнская клетка имеет 2 диплоидных или 4 гаплоидных набора хромосом — 4n, набор, который она передаст дочерним клеткам в телофазе.
Телофаза митоза
1. Создание ядерной оболочки вокруг хромосом.
2. Возникновение двух ядер в двух клетках.
3. Деконденсация хромосом. В окуляр светового микроскопа хромосомы не видны, они как бы распадаются, деспирализуются.
4. Формирование ядрышка. В интерфазе оно будет снова синтезировать рибосомы.
5. Цитокенез — разделение клетки и рождение пары дочерних клеток. При отсутствии данного процесса можно получить двухъядерные или многоядерные клетки.
Сегодня вот захотелось поговорить о митозах и о том, зачем вообще мы тратим время на их подсчет (а то мне уже начинает казаться, что зря вообще мы его тратим).
Итак, митоз – это фаза клеточного цикла, в которой клетка непосредственно делится, то есть, ядро распадается, хромосомы расходятся, и вот это вот все, что мы с трудом, но припоминаем из курса общей биологии 😊
Из курса же общей биологии, а также из какой-нибудь лекции или книги по патофизиологии опухолевого роста мы помним также, что способность делиться – это нормальная способность большинства клеток и тканей организма, но в опухолях в подавляющем большинстве случаев частота деления гораздо выше, чем в исходной ткани, и, таким образом, на одну и ту же единицу объема количество клеток, находящихся в цикле вообще и в фазе М в частности, будет выше.
Собственно, количество митозов, митотический индекс и прочие Ki67 так или иначе отражают вот это повышение митотической активности в виде числа. Мы все любим цифры, ведь их можно потом обсчитать, стандартизировать, нарисовать графики и так далее. 😉
Митоз из учебника по биологии выглядел как-то так:
Морфолог видит это все примерно так же, как на картинке. То есть, мы видим клетку, у которой вместо ядра отдельные хромосомы, которые поделились на группы (в идеале на две) и куда-то идут.
В цитологии считать митозы сложновато. Это связано, конечно, с очень высоким разбросом количества клеток на единицу площади мазка, а также с в принципе меньшим количеством клеток в образце, чем в гистологии, – слишком много переменных получается, и итоговое число митозов варьирует слишком сильно. Тем не менее любой более-менее опытный цитолог может, хоть и с большими допущениями, сказать вам, много митозов для данной ткани или мало. А уж если их в цитологии ну очень-очень много, то знайте, где-то там в ближайшем будущем гистолог по этому же пациенту просто устанет их все считать. =)
Гистология в этом плане позволяет добиться куда более стабильной концентрации клеток и бОльшего их количества для оценки (в зависимости от объема и качества биоптата, конечно!).
Определение количества митозов - это очень простой и доступный метод, не требующий какого-то дополнительного оборудования, за что он давно и очень трепетно любим всеми патологами мира, хоть и имеет (разумеется, а как вы хотели!) ряд ограничений. Он позволяет, пусть и достаточно грубо, оценить скорость роста опухоли, а также в некоторой степени предсказать ответ на некоторые виды лечения. Самый простой пример – высокодозная ХТ убивает преимущественно быстроделящиеся клетки, поэтому на лимфому с количеством митозов 89 ее эффект будет драматическим, а на лимфому с количеством митозов 1 (мы же помним, что они бывают индолентные, да?) подействует слабо, опосредованно и вообще сами опухолевые клетки могут даже не заметить, что что-то пошло не так.
С точки зрения прогнозов, количество митозов может быть независимым прогностическим фактором либо входить в систему оценки степени злокачественности (Grade). Кроме того, для некоторых опухолей количество митозов может влиять на сам диагноз.
Продолжая примеры, в системе оценки мастоцитом кожи по Kiupel, мастоцитома с более чем 7 митозами будет считаться агрессивной, даже если больше никаких критериев для этого нет. (Если кто забыл, то сюда)
Для той же мастоцитомы кожи было показано, что собаки, у которых количество митозов было более 5, имели медиану жизни (MST) 2 месяца, в то время как у собак с количеством митозов менее 5 она составила аж 70. (Пруф)
Меланоцитарная опухоль кожи с количеством митозов более 3 имеет все основания называться меланомой, а не меланоцитомой, с медианой жизни 30 недель, а с количеством митозов менее 3 – 104 недели. Если взять ту же меланому, но в ротовой полости, то из собак с количеством митозов более 4 80% не переживают один год, в то время как при меньшем количестве митозов 90% были живы через год после постановки диагноза. (источники по теме 1, 2, 3, 4)
Для гистиоцитомы количество митозов вообще не имеет значения, потому что она все равно ведет себя доброкачественно и обычно сама регрессирует.
Для опухоли эндокринной ткани, например, карциномы надпочечника, количество митозов также не имеет доказанного значения, потому что даже с 1-2 митозами они умудряются быть инфильтративными и метастатически активными.
Конечно же, все не могло быть слишком просто, и с определением количества митозов есть ряд проблем и затыков, а именно:
- путаница митотического индекса с количеством митозов
- необходимость стандартизации поля, про которую не все, оказывается, знают
- существенная разница между подсчетом в последовательных или случайно выбранных полях
-проблемы чисто технические, связанные с визуализацией митозов и дифференцировкой их от апоптозов, к примеру
Из того, что нам наиболее важно. Во-первых, не нужно путать понятие митотический индекс и количество митозов, хотя в огромном (я не шучу) количестве статей, даже в том же Vet Pathol, они перепутаны или указаны так, что не понятно, какой из показателей имелся в виду.
Митотический индекс (МИ) – это отношение количества клеток, находящихся в митозе, к общему количеству клеток в ткани, обычно выраженное в штуках на 1000 клеток.
Количество митозов (КМ) – это, собственно, количество митозов (в штуках), увиденных патологом в какой-то объектив в каком-то количестве как-то взятых полей зрения. Количество митозов считать гораздо проще и быстрее, поэтому именно его вам в подавляющем большинстве случаев укажут в заключении по хирургическому биоптату. Просто потому что сидеть считать еще и тысячи неделящихся клеток долго, дорого и тяжело.
Разумеется, КМ и МИ отнюдь не тождественны и существенно варьируют в зависимости, например, от размера клеток и от количества межклеточного вещества между ними. Сравните лимфому и саркому, снятые, это важно, на одном и том же объективе в одних и тех же условиях, вот тут:

В лимфоме, конечно, что МИ, что КМ гораздо выше, чем в саркоме, но если допустить гипотетически, что МИ у обеих опухолей одинаковый, то КМ у лимфомы будет выше – потому что клетки лимфомы маленькие и межклеточного вещества между ними нет, и в одно и то же поле одного и того же микроскопа попросту войдет больше лимфоцитов, чем фибробластов.
Чтобы не быть голословной, вот в этом медицинском исследовании посчитали количество клеток в РМЖ у человека на 1 поле микросокпа, и значение варьировало от 1200 до 9000. И это в одном и том же РМЖ! А, да, и еще они посчитали CV для количества митозов, и при невысоком КМ (до 11.4 на 10 полей х400, если переводить в привычный нам формат), CV получился… 147%. Специалисты, работающие в КДЛ и привычные к CV не выше 5-10%, наверное сейчас за сердце схватятся.
Мировая общественность почти единодушна в том, что количество митозов надо считать на 10 полей объектива х400, хотя есть рекомендующие считать и на 20, и на 30 (хотя бы даже и в статье выше). И тут встает другая проблема – не все микроскопы одинаковы. Если вы когда-либо участвовали в закупке микроскопов для клиники или просто интересовались вопросом, то знаете, что к каждой части микроскопа прилагается довольно длинный ряд цифирек, характеризующих отдельные его параметры. Среди них нам сегодня очень важен диаметр окуляра, или field number, FN, потому что именно он определяет разницу между площадями полей зрения в разных микроскопах (остальное, слава помидорам, более-менее одинаково у всех микроскопов).
Итак, при использовании одного и того же объектива на двух разных микроскопах, в том, у которого FN больше, площадь поля зрения тоже будет больше. Соответственно, 10 полей на микроскопе с FN 16 будут много меньше, чем с FN 22. Да-да, не все 10 полей х400 одинаково полезны.
В связи с этим у каждого гистопатолога должна быть (да и скорее всего в каком-то виде уже есть) эта табличка:
Ну или хотя бы надо запомнить, сколько полей надо считать именно на ЭТОМ микроскопе, чтобы выдать максимально близкое к стандартным 10 полям х400 на FN 22, что составляет 2.37 мм2. У моего Olympus CX41 FN=20, то есть я считаю всегда реально на 12 полей, а не на 10. Хотя пишу в заключениях про 10, чтобы не путать народ и дальше.
При работе со сканами все еще веселее. Есть некоторые программы, которые обрезают твое поле зрения слайда до кругленького поля, привычного в микроскопе, как например тут:

Расчеты просты, очевидны и, кроме того, приведены в той же статье Meuten и ко:

И да, эти расчеты надо переделывать каждый раз, как меняешь разрешение и формат монитора или вообще рабочий комп.
Да, таким образом мы подходим к еще одной проблеме – проблеме концентрации внимания патолога. Пока что, по крайней мере в вет патологии, львиную долю работы все же приходится делать людям, а не ИИ, а с людьми проблема в том, что они могут уставать, болеть, быть отвлечены болтовней коллег в том же помещении (а вы думаете, почему я сбежала из лаборатории в офис? А вооот!). Митозы считать – дело весьма тупое и механическое, особенно если это уже 31й пациент за сегодняшний день, и ошибиться, особенно к концу дня, когда хочется пИсать, спать и вообще домой, несложно. Опять же, пропустить два митоза в лимфоме с КМ 89 - невелика потеря. А в меланоме с КМ 4.
И еще одно. Все помнят про правила фиксации материала для гистологии? Надеюсь, что да, потому что, да, черт побери, фиксация влияет и на это тоже! Чем больше времени прошло между извлечением материала из животного и фиксацией, тем меньше становится количество видимых митозов в ткани и больше – количество апоптозов, которые в некоторых случаях, особенно при лимфомах, не так уж и просто отличить от митозов. Так что операционный материал, забытый на час и не помещенный в формалин, или помещенный, но большим куском и не пропитавшийся фиксатором в центре – та-даа! – наврет вам в отношении реального количества митозов в данной ткани. Как и еще много в чем. (Пруф)
Ах да, а еще есть некоторые особенности у разных опухолей, например, есть такая лимфобластная лимфома, LBL, в которой в принципе сложно считать митозы, потому что они выглядят очень мелкими и размытыми. И это не я сказала, а Тед Валли (см. Vet Comp Hematopathology), но я на собственном опыте подтверждаю, это вообще смерть глазам.
Ну и само собой, чем меньше биоптат, тем меньше вероятность подсчитать количество митозов адекватно. А если площадь опухоли в образце меньше, чем 2.37 мм2, то извините. Максимум можно подсчитать на то количество полей, какое есть.
Пролиферативная активность может быть уточнена также рядом дополнительных методик, несть им числа, включая PCNA, AgNOR, Фельгена и всяческие молекулярно-генетические методики, несть числа им, но я для примера остановлюсь на наиболее часто упоминаемой в последнее время в литературе ИГХ на Ki-67.
В рутине по МДЖ, по крайней мере на момент написания этого поста и в -этой стране-, Ki-67 не особенно широко в ходу, и это, естественно, преимущественно связано с финансовыми ограничениями и проблемами доступности ИГХ в разных регионах. Кроме того, важный нюанс – далеко не для всех опухолей Ki-67 вообще имеет доказанное прогностическое значение. Ну, то есть, сделаем мы его на редкой опухоли чегонибудь-оме, по которой статей в принципе в литературе кот наплакал, ну и куда нам девать эту ценную информацию? Конечно, эта ценная информация может пригодиться впоследствии, когда мы наберем 5-10-150 пациентов с чегонибудь-омами, сможем стандартизировать их лечение и получить полную информацию по срокам безрецидивного периода и жизни, и вот тогда написать чудесную статью о том, коррелировали высокие значения Ki-67 с PFI или нет, но все же это вотчина тех из нас, у кого есть время, деньги и ресурсы на исследования. Ну или дождемся, пока такую статью опубликует кто-то другой и скажем – ага, теперь-то мы знаем! Это один момент. Второй – я вот лично не стану заказывать Ki67 для лимфомы, у которой количество митозов за 200. Я и так знаю, что она активно пролиферирует, а значение Ki-67 никак не влияет на данный момент на принятие мной или онкологом терапевтических решений.
Таким образом, самое актуальное применение Ki-67 – это если надо уточнить какие-то невысокие цифры по количеству митозов или уточнить пролиферативную активность, когда количество митозов получилось где-то возле порога для данной конкретной опухоли. Помните про пример мастоцитомы? Если я насчитала в ней 34 митоза, я не стану заказывать Ki67, он не даст мне новой информации. Если количество митозов 0-2, я порекомендую Ki-67 как одну из опций, хотя в 95% случаев у такой масто и Ki-67 будет низким. А вот если количество митозов где-то поблизости от порога – то есть, от 4 до 7, в зависимости от ситуации, вот тут рекомендация Ki-67 актуальна, потому что от этого может зависеть окончательная категоризация опухоли как высоко- или низкоагрессивной. (Тут конечно же надо напомнить себе о грехе излишней категоризации, но об этом мы поговорим в другой раз).
Есть, кстати, интересные данные, что в некоторых меланомах у собак индекс Ki67 оказывался непропорционально низким по отношению к количеству митозов. Но это так, к слову.
ВАЖНО. По состоянию на 2020год, митотический индекс больше не влияет на стадирование T, но остается очень важным прогностическим фактором.
В статью коррективы не вносятся, так что просто имейте ввиду.
Так же, имейте пожалуйста ввиду, что вся инфа 2010г! Т.е. если само стадирование меланомы не изменилось с того времени, то данные по выживаемости конечно уже совсем другие, но раз идет ссылка на эти таблички, то нужно чтобы они тут были.
МИТОТИЧЕСКИЙ ИНДЕКС
И вот у нас случился такой диалог на днях (картинку я делать не стал, ибо она слишком длинная получится):
— Привет! Помнишь, у меня был вопрос про то, как митозы в полях зрения перевести в мм2? Кое что нашел. 1 mm2 corresponds to approximately four 400x fields in most, but not all, microscopes. Т.е., в большинстве микроскопов 1 мм2 = 4 полям зрения при 400-кратном увеличении (примерно). 10 полей зрения при 400Х получается примерно равным 2,5 мм2. Там еще и методика описана и много графиков.
Пересмотр системы стадирования меланомы и воздействие митотического индекса
Изменения в системе стадирования меланомы были опубликованы в 7-ом издании американского объединённого онкологического комитета (AJCC) в 2009 году и были осуществлены в январе 2010 г. Хотя изменений и не много, они имеют большое значение. [Последние критерии классификации по системе TNM и группы стадирования представлены в таблицах 1a и 1b, а коэффициенты выживаемости согласно стадии заболевания показаны на рисунке 1].
Основные моменты пересмотренной системы стадирования меланомы:
И толщина опухоли и изъязвление формально использовались с 2002 года для стадирования больных меланомой, основываясь на фактических данных. Позже клеточная пролиферация в первичной опухоли, отраженная митотическим индексом опухоли, появилась в качестве другого важного показателя выживаемости.
Митотический индекс первичной опухоли был введен в этом году как главный критерий стадирования меланомы и прогноза . Подробный анализ базы данных стадирования меланомы AJCC продемонстрировал значительную обратную корреляцию между митотическим индексом первичной опухоли (гистологически определяемый как число митоз/мм²) и выживаемостью (таблица 2).
Таким образом, митотический индекс первичной опухоли, как теперь признают, является важным независимым неблагоприятным прогностическим фактором выживаемости; число митоз/мм² увеличивается, выживаемость уменьшается .
Примечательно, что, хотя митотический индекс – это непрерывная переменная (как и толщина опухоли меланомы), никакие различимые пороги, которые очерчивают особенно увеличенный метастатический риск, не могут быть идентифицированы вне 1 митоз/мм². Напротив, когда не было определено никакой митотической активности — показательной для более медленно растущей первичной меланомы — прогноз был более благоприятным, чем для пациентов, у первичной опухоли которых был по крайней мере 1 митоз/мм². Это было особенно значительно в подгруппе пациентов с опухолью стадии T1.
Основываясь на этом анализе, митотический индекс первичной меланомы был включен в 7-ое издание руководства по стадированию рака AJCC как необходимый элемент для определения стадирования меланомы. Эти рекомендации были даны после рассмотрения статистической информации, включающей 4861 больных меланомой стадии T1 из обновленной базы данных стадирования меланомы AJCC, которая продемонстрировала, что митотический индекс был самым сильным показателем выживаемости для больных меланомой стадии T1, и наоборот, что уровень инвазии по Кларку больше не был статистически значимым, когда были включены митотический индекс и изъязвление.
Десятилетние коэффициенты выживаемости составили:
Тем не менее, стоит отметить, что недавно были представлены предварительные данные большой группы пациентов, демонстрирующие корреляцию между митотическим индексом и статусом сторожевого лимфатического узла среди пациентов со стадией меланомы T1.
Так как гистологические особенности первичной меланомы — толщина опухоли, митотический индекс и изъязвление — являются признаками прогноза и стадирования меланомы, начальная биопсия – это важный компонент и диагностирования и стадирования.
Эксцизионная биопсия всего клинически очевидного поражения с узким 1-2 мм краем смежной нормально появляющейся кожи, является предпочтительной техникой биопсии, когда предполагается меланома.( и единственно правильной в условиях РФ. Об этом уже писано переписано. прим. Дядя Вадик)
Инцизионная биопсия может быть приемлемой для поражений больших по размеру.
Глубокая бритвенная биопсия может быть достаточной, когда поражение плоское и риск подозрения на меланому не высок.
Система стадирования меланомы AJCC рекомендует проводить биопсию сторожевых лимфатических узлов как процедуру стадирования у больных, для кого информация будет полезна в планировании последующего лечения и последующих режимов.
Особенно процедуру следует рекомендовать (и обсуждать) пациентам, у которых меланома T2, T3 или T4 стадии и клинически невовлеченные региональные лимфатические узлы (клинические стадии IB и II), а так же для пациентов с меланомой стадии T1 и вторичными признаками, связанными с увеличенным риском для микрометастазов лимфатических узлов: изъязвление, митотический индекс ≥1/ мм², или IV уровень по Кларку, особенно когда первичная меланома превышает 0,7 мм по толщине.
Наконец, прогностическими факторами, включенными в систему стадирования меланомы, должны быть основные критерии стратификации и результаты, сообщающие о критериях клинических испытаний меланомы. Использование непротиворечивого множества критериев облегчит сообщение способов лечения меланомы и сравнимость клинических испытаний меланомы. Потенциально это также ускорит продвижение мультидисциплинарных подходов к лечению меланомы (об этом , кстати, говорил профессор Хаим Гутман на конференции по меланоме ).
А что у нас? А у нас все это до сих пор идет лесом, ибо «ну и чё вам это даст?«
В общем, этот пост прикрепляется справа в теоретической части.
З.Ы И еще, по моим наблюдениям, если в результатах гистологии что-то отсутствует, то и толщина обычно оказывается ВЕСЬМА приблизительная.
Читайте также:

