Метастаз рака молочной железы с фенотипом
Биологические особенности карциномы. Люминальный тип рака молочной железы можно успешно лечить лекарственными препаратами, особенно подтип A, который относится к наиболее благоприятным вариантам опухоли.

Подтип опухоли кодируется генетически
Основные молекулярные критерии опухоли
Чтобы победить врага, надо его хорошо узнать. Плохо, что вообще возникла опухоль в груди, но хорошо, если выявлен люминальный тип рака молочной железы – есть прекрасные шансы для избавления от карциномы. Морфологическая оценка биопсийного материала или удаленных тканей включает исследование биологических характеристик опухоли: на основе этих результатов выбирается лечебная тактика в послеоперационном периоде. Выделяют следующие молекулярные критерии:
- Наличие или отсутствие достаточного количества рецепторов к гормонам – эстрогенам (РЭ) и прогестерону (РП);
- Выявление специфического белка-рецептора HER2, определяющего клеточный рост – негатив или позитив кодируется генетически (в здоровых клетках her2 очень мало, в агрессивно-раковых – много);
- Индекс пролиферации (Ki-67), который должен быть низким (менее 14%).
Все эти критерии выявляются с помощью специфичных иммуногистохимических методик обследования. Комбинация этих факторов формирует тот вариант карциномы, с которым надо будет бороться. И лучше бы это был гормоночувствительный подтип опухоли с негативным her2 и низкой пролиферативной активностью.
Люминальный тип рака молочной железы: фенотип опухоли
Это только сначала кажется сложным и непонятным. Столкнувшись с врагом лицом к лицу, пациентки быстро начинают разбираться в медицинских аббревиатурах. Люминальный тип рака молочной железы разделятся на 3 подтипа:
- A – выявляется достаточное количество РЭ и РП, негативный HER2, низкий Ki-67;
- B HER2- есть положительные РЭ и РП, негативный HER2, но Ki-67 превышает 14%;
- B HER2+ обнаружено достаточно РЭ и РП, но положительный HER2 и любое значение Ki-67.
Первый вариант является самым оптимальным из зол: в процессе лечения можно ожидать хорошую реакцию опухоли на препараты, потому что есть рецепторы к стероидам (гормонотерапия будет давать лучший эффект, чем химиотерапия). Если мало HER2 и низкая пролиферативная активность, то агрессивность опухолевой ткани невысока, а, значит, риск раннего метастазирования ниже.
При HER2+ раковые клетки имеют много шансов для быстрого роста, а высокий индекс пролиферации указывает на вероятность быстрого увеличения массы опухолевой ткани.
Лечебная тактика
Оценив молекулярный подтип опухоли, врач назначит терапию. На первом этапе люминальный рак (подтип A) можно смело лечить гормональными и химиотерапевтическими препаратами – положительный эффект будет обязательно. При подтипе B HER2- лучше использовать только химиотерапию, а гормоны применять в послеоперационном периоде. При подтипе B HER2+ оптимальны химия и таргетная анти-her2 терапия.
После хирургической операции и курсов лучевой терапии надо продолжить лекарственную терапию. Люминальный тип рака молочной железы хорошо поддается гормонотерапии, но важно всегда учитывать значение HER2 (позитивное или негативное), чтобы по показаниям применять таргетные препараты.
По статистике, люминальный тип рака молочной железы выявляется у большинства пациенток 60-75% (более 40% подтип A, более 20% – подтип B HER2-), что позволяет надеяться на положительный результат комплексной терапии.
Целью данного исследования было изучение экспрессии связанных с метаболизмом белков в соответствии с метастатическим сайтом при метастатическом раке молочной железы и оценка импликации специфической для конкретного участка дифференциальной экспрессии.
Был построен тканевый микрочип, содержащий 162 случая метастатического рака молочной железы (52 метастаза в легкие, 47 метастазов в кости, 39 метастазов в мышцы и 24 метастаза в печени). Он подвергался иммуногистохимическому окрашиванию следующих белков: связанных с гликолизом: Glut-1, гексолиназа II, карбоангидраза (CA) IX и монокарбоксилатный транспортер (MCT) 4; связанные с глутаминолизом: глутаминаза (GLS) 1, глутаматдегидрогеназа (GDH) и переносчик аминокислот (ASCT) 2; митохондриальный метаболизм: АТФ-синтаза, сукцинатдегидрогеназа (SDH) A и SDHB; и метаболизм серина / глицина: фосфоглицератдегидрогеназа (PHGDH), фосфосерина аминотрансфераза (PSAT), фосфосеринфосфатаза (PSPH), глициндекарбоксилаза (GLDC) и серингидроксиметилтрансфераза (SHMT).
Биологические особенности карциномы. Люминальный тип рака молочной железы можно успешно лечить лекарственными препаратами, особенно подтип A, который относится к наиболее благоприятным вариантам опухоли.
Основные молекулярные критерии опухоли
Чтобы победить врага, надо его хорошо узнать. Плохо, что вообще возникла опухоль в груди, но хорошо, если выявлен люминальный тип рака молочной железы – есть прекрасные шансы для избавления от карциномы. Морфологическая оценка биопсийного материала или удаленных тканей включает исследование биологических характеристик опухоли: на основе этих результатов выбирается лечебная тактика в послеоперационном периоде. Выделяют следующие молекулярные критерии:
- Наличие или отсутствие достаточного количества рецепторов к гормонам – эстрогенам (РЭ) и прогестерону (РП);
- Выявление специфического белка-рецептора HER2, определяющего клеточный рост – негатив или позитив кодируется генетически (в здоровых клетках her2 очень мало, в агрессивно-раковых – много);
- Индекс пролиферации (Ki-67), который должен быть низким (менее 14%).
Все эти критерии выявляются с помощью специфичных иммуногистохимических методик обследования. Комбинация этих факторов формирует тот вариант карциномы, с которым надо будет бороться. И лучше бы это был гормоночувствительный подтип опухоли с негативным her2 и низкой пролиферативной активностью.
Люминальный тип рака молочной железы: фенотип опухоли
Это только сначала кажется сложным и непонятным. Столкнувшись с врагом лицом к лицу, пациентки быстро начинают разбираться в медицинских аббревиатурах. Люминальный тип рака молочной железы разделятся на 3 подтипа:
- A – выявляется достаточное количество РЭ и РП, негативный HER2, низкий Ki-67;
- B HER2- есть положительные РЭ и РП, негативный HER2, но Ki-67 превышает 14%;
- B HER2+ обнаружено достаточно РЭ и РП, но положительный HER2 и любое значение Ki-67.
Первый вариант является самым оптимальным из зол: в процессе лечения можно ожидать хорошую реакцию опухоли на препараты, потому что есть рецепторы к стероидам (гормонотерапия будет давать лучший эффект, чем химиотерапия). Если мало HER2 и низкая пролиферативная активность, то агрессивность опухолевой ткани невысока, а, значит, риск раннего метастазирования ниже.
При HER2+ раковые клетки имеют много шансов для быстрого роста, а высокий индекс пролиферации указывает на вероятность быстрого увеличения массы опухолевой ткани.
Лечебная тактика
Оценив молекулярный подтип опухоли, врач назначит терапию. На первом этапе люминальный рак (подтип A) можно смело лечить гормональными и химиотерапевтическими препаратами – положительный эффект будет обязательно. При подтипе B HER2- лучше использовать только химиотерапию, а гормоны применять в послеоперационном периоде. При подтипе B HER2+ оптимальны химия и таргетная анти-her2 терапия.
После хирургической операции и курсов лучевой терапии надо продолжить лекарственную терапию. Люминальный тип рака молочной железы хорошо поддается гормонотерапии, но важно всегда учитывать значение HER2 (позитивное или негативное), чтобы по показаниям применять таргетные препараты.
По статистике, люминальный тип рака молочной железы выявляется у большинства пациенток 60-75% (более 40% подтип A, более 20% – подтип B HER2-), что позволяет надеяться на положительный результат комплексной терапии.
Эрибулин в лечении метастатического рака молочной железы с тройным негативным фенотипом
Больные раком молочной железы (РМЖ), опухоли которых не имеют экспрессии рецепторов эстрогена, прогестерона и HER-2 (РМЖ с тройным негативным фенотипом – ТН РМЖ) имеют наихудший прогноз, т.к. в отличие от гормоно-позитивного и HER-2-позитивного РМЖ, мы не можем предложить им никакого иного лечения, кроме химиотерапии. Проблема выбора тактики лечения после проведения стандартных первых трех линий (антрациклины, таксаны, капецитабин) весьма трудна для любого подтипа РМЖ. Но особенно актуальна эта проблема для больных ТН РМЖ, т.к. общая выживаемость этих больных после выявления отдаленных метастазов по-прежнему немногим превышает полуторагодовалый рубеж. Эрибулин – препарат с принципиально новым механизмом действия – продемонстрировал себя как действительно эффективный вариант третьей и более линий терапии метастатического РМЖ, увеличивающий общую выживаемость. В данной статье будут приведены результаты объединенного анализа двух рандомизированных исследований III фазы по изучению эффективности эрибулина у больных метастатическим РМЖ после антрациклинов и таксанов в зависимости от подтипа.
Особенности течения рака молочной железы с тройным негативным фенотипом
Рак молочной железы (РМЖ) является гетерогенным заболеванием, неоднородным по прогнозу и чувствительности к противоопухолевой терапии, что обусловлено разнообразием генетических аббераций, приводящих к его развитию и прогрессированию. На основании профиля генной экспрессии была создана генетическая (молекулярная) классификация РМЖ, позволившая выделить несколько подтипов заболевания, значимо отличающихся по прогнозу и чувствительности к различным видам лечения [1]. Среди этих подтипов, которые включают HER2-позитивный, люминальный А, люминальный В и базально-подобный РМЖ, последний вариант обладает наихудшим прогнозом [2]. По результатам анализа O. Baser и соавт. [3], включившего 579 больных диссеминированным РМЖ, 134 (23%) из которых имели тройной негативный (ТН) фенотип, медиана выживаемости больных ТН РМЖ составила 1,71 года для больных ТН РМЖ по сравнению с 3,19 года в среднем для остальных подгрупп (р 6 месяцев) и выживаемость без прогрессирования, общая выживаемость больных в группе терапии эрибулином оказалась достоверно выше (табл. 5).
Данные различия в общей выживаемости можно объяснить тем фактом, что после окончания лечения в рамках исследования 70% больных группы эрибулина и только 62% группы капецитабина получили последующее лечение. Три и более линий было проведено 23,7% пациенток группы эрибулина и только 17,7% больных группы капецитабина. Интересным представляется анализ лечения больных после выхода из исследования. Практически 50% больных из группы эрибулина получали в дальнейшем капецитабин, в то время как возможности получать эрибулин больным группы капецитабина на тот момент не было, и наиболее частым вариантом последующего лечения для этих больных были винорельбин (24%), таксаны (21,5%) и др., в т.ч. таргетные препараты (27,0%).
Анализ переносимости терапии не выявил никаких новых нежелательных явлений, обусловленных применением эрибулина. Наиболее частым нежелательным явлением для больных группы эрибулина была нейтропения (54,2%) и алопеция (34,6%), в то время как в группе капецитабина частота этих нежелательных явлений составила 15,9 и 4,0% соответственно. В то же время ладонно-подошвенный синдром (45,1%) и диарея (28,8%) закономерно чаще встречались среди больных, получающих капецитабин. В группе терапии эрибулином частота ладонно-подошвенного синдрома составила лишь 0,2%, диареи – 14,3%. Таким образом, еще в одном исследовании был подтвержден благоприятный профиль безопасности эрибулина. Частота серьезных нежелательных явлений была несколько ниже в группе эрибулина: 17,5% и 21,1% – в группе капецитабина, соответственно [30].
Запланированный анализ выживаемости в зависимости от подтипа опухоли [31] показал, что наилучшие результаты общей выживаемости были получены у больных ТН РМЖ, получавших эрибулин (табл. 6)
На ASCO (American Society of Clinical Oncology) 2014 г. были доложены результаты объединенного анализа общей выживаемости в зависимости от подтипа опухоли (HER2+ и ТН) двух исследований (EMBRACE и Исследование 301), включившего более 1800 больных. Основные характеристики больных, вошедших в объединенный анализ, представлены в табл. 7.
По результатам объединенного анализа [32] было продемонстрировано достоверное улучшение общей выживаемости больных, получавших эрибулин: 15,2 и 12,8 месяца в контрольной группе соответственно (ОР=0,85, 95% ДИ – 0,77–0,95; р=0,003). При этом различия в общей выживаемости больных HER2-негативными опухолями составили 15,2 месяца в группе Эрибулина и 12,3 месяца – в контрольной группе (ОР=0,82, 95% ДИ – 0,72–0,93; р=0,002).
Закономерно худшая по сравнению с общей популяцией общая выживаемость была отмечена среди больных, опухоли которых не имели экспрессии ни эстрогенов, ни прогестерона, ни HER2 (ТН РМЖ). В то же время именно в этой подгруппе были получены наиболее выраженные различия общей выживаемости больных, получавших эрибулин, по сравнению с контрольной группой: 12,9 и 8,2 месяца соответственно (ОР=0,74, 95% ДИ – 0,60–0,92; р=0,006). В группе HER2+ различий в общей выживаемости получено не было.
Стратификационный анализ показал достоверное улучшение общей выживаемости больных, получавших эрибулин, вне зависимости от стратификационного фактора. Тем не менее наиболее достоверные различия были выявлены в зависимости от числа зон поражения, наличия рефрактерности к таксанам (прогрессирование в течение 60 дней после последней дозы) и между больными ТН и не-ТН РМЖ (табл. 8).
Эффективность эрибулина для больных РМЖ после применения антрациклинов и таксанов была подтверждена в двух рандомизированных исследованиях. Крайне важным остается то, что эрибулин, являясь хорошо переносимым препаратом, показал способность увеличивать общую выживаемость больных (чего не было показано в исследованиях других препаратов, до настоящего времени применявшихся в данной когорте больных).
Несмотря на то что при подгрупповом анализе эффект эрибулина отмечен практически у всех категорий больных, наибольший выигрыш от его использования получили пациентки с остающимся до настоящего времени наиболее прогностически неблагоприятным подтипом РМЖ – с тройным негативным фенотипом.
В связи с этим эрибулин можно назвать предпочтительным препаратом для лечения больных ТН РМЖ после прогрессирования на антрациклинах и таксанах.
В настоящее время эрибулин наиболее активно изучается при ТН РМЖ и HER2+-РМЖ. Ведутся исследования по изучению эффективности эрибулина в комбинации с различными цитостатиками (преимущественно в неоадъювантных режимах). Также инициирован ряд новых исследований I/Ib фазы по изучению переносимости и эффективности комбинации эрибулина с таргетными препаратами (эверолимусом и олапарибом при ТН РМЖ и трастузумабом и пертузумабом при HER2+РМЖ).
Аннотация научной статьи по клинической медицине, автор научной работы — Хасанова Альфия Ирековна, Хусаинова Гульнара Наильевна, Гатауллин Ильгиз Габдуллович, Петров Семен Венедиктович, Хасанов Рустем Шамильевич
Исследовано 409 больных раком молочной железы в клинических и иммуногистохимических аспектах. Среди больных РМЖ были пациентки с метастазами в надключичные лимфатические узлы, печень, легкие, кости, яичники и головной мозг, которым проводили сравнительное фенотипирование определение экспрессии эстрогеновых и прогестероновых рецепторов, гена HER-2-neu. Полученные данные указывают на различие строения первичной опухоли и метастазов .
Похожие темы научных работ по клинической медицине , автор научной работы — Хасанова Альфия Ирековна, Хусаинова Гульнара Наильевна, Гатауллин Ильгиз Габдуллович, Петров Семен Венедиктович, Хасанов Рустем Шамильевич
The phenotyping of breast cancer. The modern algorithms of treatment and diagnostics of metastatic breast cancer
Decision making on systemic treatment of women with metastatic breast cancer is based on features like estrogen receptor (ER), progesterone receptor (PgR), and HER2 status assessed on the primary tumor. We evaluated the concordance of receptor status between primary tumor and liver metastases (mts), lung metastases, limph.nodules metastases and mts in adnexis its impact on treatment choice. We retrospectively and prospectively analyzed pacients a performed from 1998 to 2010. All tissue samples, both from primary tumor and liver, lung, nodules and adnexx mts, were analyzed for ER, PgR and HER2 status. Changes in ER status were observed in 29,5%. Changes in PgR status were observed in 25,8%.Changes in HER2 status were observed in 26%. There was a discordance in receptor status, and HER 2 status between primary tumor and mts, which led to change in therapy
ФЕНОТИПИРОВАНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. СОВРЕМЕННЫЕ АЛГОРИТМЫ ЛЕЧЕНИЯ И ДИАГНОСТИКИ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
А.И. Хасанова1-3, Г.Н. Хусайнова3, И.Г. Гатауллин1, С.В. Петров2, Р.Ш. Хасанов1-3,
3Республиканский клинический онкологический диспансер МЗ РТ, г. Казань
Хасанова Альфия Ирековна - e-mail: haalfy@gmail.com
Исследовано 409 больных раком молочной железы в клинических и иммуногистохимических аспектах. Среди больных раком молочной железы были пациентки с метастазами в надключичные лимфатические узлы, печень, легкие, кости, яичники и головной мозг, которым проводили сравнительное фенотипирование - определение экспрессии эстрогеновых и прогестероновых рецепторов, гена HER-2-neu. Полученные данные указывают на различие строения первичной опухоли и метастазов.
Ключевые слова: рак молочной железы, метастазы, иммуно-гистохимический анализ. Decision making on systemic treatment of women with metastatic breast cancer is based on features like estrogen receptor (ER), progesterone receptor (PgR), and HER2 status assessed on the primary tumor. We evaluated the concordance of receptor status between primary tumor and liver metastases (mts), lung metastases, limph.nodules metastases and mts in adnexis its impact on treatment choice. We retrospectively and prospectively analyzed pacients a performed from 1998 to 20010. All tissue samples, both from primary tumor and liver, lung, nodules and adnexx mts, were analyzed for ER, PgR and HER2 status. Changes in ER status were observed in 29,5% . Changes in PgR status were observed in 25,8% .Changes in HER2 status were observed in 2Б%. There was a discordance in receptor status, and HER 2 status between primary tumor and mts, which led to change in therapy
Key words: metastatic breast cancer, liver metastasis, lung metastasis, limph. nodules metastasis.
Рак молочной железы (РМЖ) является самой распространенной злокачественной патологией у женщин в мире и составляет более четверти всех новых случаев злокачественных новообразований у женщин в Европе. При этом у 37,3% впервые заболевших женщин диагностируется III или IV стадии заболевания [1]. Заболеваемость раком молочной железы в России неуклонно растет: прирост показателя заболеваемости за десять лет составляет 22,2%; среднегодовой темп прироста - 2,3% [2].
За последние десятилетия в онкологии отмечены значительные достижения в области молекулярной биологии, расшифровки генов, факторов роста, белков, участвующих в трансдукции сигналов и апоптоза, что в конечном итоге позволило создать в онкологии новое направление в лечении злокачественных опухолей - таргетную терапию.
Первичные опухоли молочной железы, состоящие из биологически различных популяций клеток, отличаются по многим параметрам, в частности по скорости роста, кариотипу, наличию или отсутствию гормональных рецепторов, продукции опухольассоциированных белков, иммуногенности, чувствительности к гормоно- и химиотерапии.
Выбор тактики адъювантного (профилактического) и лечебного режимов лечения рака молочной железы во многом определяется отсутствием или наличием в опухоли определенных рецепторов, экспрессии гена HER-2-neu. Данный вопрос решается во всех онкологических клиниках на основании данных иммуногистохимического исследования (фенотипирования) первичной опухоли. Однако, остаются сложными и пока не решенными вопросы послеоперационной адъювантной химио-гормонотерапии рака молочной железы, так как значительного увеличения безрецидив-ной выживаемости не достигнуто [4].
Согласно данным исследования, проведенных в Эдинбурге, из рассматриваемых 385 больных в 46,9% случаев рецепторный статус рака молочной железы различался в первичной опухоли и пораженных регионарных лимфатических узлах. При раке молочной железы с отсутствием рецепторов эстрогенов и прогестерона в первичной опухоли эти
же рецепторы могут оказаться положительными в пораженных лимфатических узлах, такая же ситуация и с экспрессией гена HER-2-neu [5].
Исследования последних лет показали, что не все клетки первичной опухоли могут давать метастазы. По данным Н.М. Аничкова (2003) [6] лишь 0,05% опухолевых клеток обладают метастатическим потенциалом, т. е. 1 из 2000 клеток. До сих пор неясен механизм метастазирования при злокачественных опухолях. Известно, что при локальных формах рака молочной железы Т1^0М0 у 10-20% больных развиваются метастазы в отдаленные органы и ткани в течение 2-3 лет после радикальной операции. Более того, у больных с Т2-3М-2М0 у 30-40% метастазы диагностируются в сроки 5-10 и более лет [7, 8].
Целью настоящего исследования является проведение сравнительного анализа фенотипов первичной и вторичной (метастатической опухолей) молочной железы.
Материалы и методы
Проанализированы ретроспективно и проспективно 409 историй болезни и амбулаторных карт больных раком молочной железы стадий Т1-4 N0-3 М0-1 в возрасте от 20 до 80 лет, получавших комбинированное лечение, основанное на анализе результатов клинических, лабораторных методов диагностики, иммуногистохимического исследования гормонального статуса и тканевых маркеров первичной опухоли. Среди больных РМЖ были пациентки с метастазами в надключичные лимфатические узлы, печень, легкие, кости, яичники и головной мозг.
Иммуногистохимические исследования проводили с помощью набора моноклональных антител к эстрогеновым и прогестероновым рецепторам, белку онкогена НЕ^2-пеи.
Собственные исследования: больным поводили оперативное лечение в зависимости от локализации первичной опухоли и локорегионарного распространения. По показаниям проводили лучевую терапию в режимах среднего или классического фракционирования, неоадъювантную, адъювантную химиотерапию. Преобладающим оперативным вмешательством была мастэктомия по Пейти. Основным морфологическим вариантом опухоли являлся инфильтрирующий рак, составивший 384 случая (93,9%).
Из 409 наблюдаемых большинство находились в возрасте от 40 до 49 лет - 169 человек (42%); от 20 до 29 лет - 6 больных (1,46%); от 30 до 39 лет - 63 человека (15,4%), от 50 до 59 - 120 пациентов (29,3%), от 60 до 69 - 29 человек (7%), от 70 до 79 - 18 человек (4,4%), от 80 до 89 - 3 человека (0,73%).
Распределение пациентов по стадиям заболевания представлено в таблице.
За 3-летний период наблюдения умерли 72 пациентки (17,6%). При анализе причин смертности больных раком молочной железы выявлено, что основной причиной стала раковая интоксикация, вызванная диссеминацией опухолевого процесса. Раковая интоксикация стала причиной смер-
ти в 41% случаев, метастазы в печень - в 23%, в легкие - в 21%, метастазы в головной мозг - в 14%, метастатический плеврит - в 1% случаев.
Адъювантную химио- и гормональную терапии проводили в зависимости от возраста, результатов гистологического исследования (размер первичной опухоли, наличие регионарных метастазов), иммуногистохимического исследования гормонального статуса и тканевого маркера опухоли НЕ^2-пеи (ИДО).
Распределение больных по стадиям заболевания ТАБЛИцА 2.
Распределение больных по размеру первичной опухоли (Т)
Распределение пациентов в зависимости от поражения регионарных лимфатических узлов
Стадия заболевания ов “ ° ш х и оа а: = Размер опухоли Количество пациентов 2 1 I ст ен И оа Кп
I 69 (16,8%) Т1 121 (29,6%) N0 160 (39,1%)
Т2 202 (49,3%) N1 143 (35%)
III А 57 (13,9%) Т3 18 (4,4%) N2 91 (22%)
Т4 68 (16,6%) N3 15 (4%)
При определении гормонального статуса и онкомаркера HER-2-neu в исследовании преобладали пациентки с эстроген-рецепторнегативными опухолями - 266 человек (45%), прогестерон-рецепторнегативными опухолями -309 человек (75,3%) и пациентки с опухолями негативными по статусу НЕР-2-пеы - 343 человека (83,9%).
Результаты исследования. Отдаленные результаты лечения в зависимости от рецепторного статуса первичной опухоли представлены в таблице 4.
Отдаленные результаты лечения
Рецепторный статус Количество наблюдений Количество умерших Летальность (%)
Эр + Пр + Neu + 9 (2,2%) 0 0
Эр + Пр - Neu + 6 (1,46%) 2 33,3
Эр + Пр + Neu - 64 (15,6%) 5 7,8
Эр + Пр - Neu- 55 (13,4%) 4 7,3
Эр - Пр - Neu - 162 (39,6%) 37 22,8
Эр - Пр + Neu- 7 (1,7%) 2 28
Эр - Пр - Neu + 31 (7,58%) 22 71
Эр - Пр + Neu- 3 (0,73%) 0 0
Таким образом, на основании анализа таблицы 4 выявлено, что наибольшая летальность больных раком молочной
железы наблюдалась при триплет-негативном фенотипе опухоли и при гиперэкспрессии гена НЕК-2-пеи.
Из 409 пациенток у 27 больных с метастатическим раком молочной железы проведено фенотипирование первичной
и вторичной (метастатической) опухоли на гормональные рецепторы и статус НЕК-2-пеи. У всех пациентов имелись отдаленные метастазы: у 2 пациентов - метастазы в головной мозг, у 10 пациентов - очаги в легких, у 9 пациентов -метастазы в печень и у 5 пациентов кожная диссеминация, у 1 больной метастазы в яичник. Все метастазы морфологически и фенотипически верифицированы.
Настоящие исследования показали, что только в 42% случаев отмечалось полное совпадение фенотипа первичной и метастатической опухоли. В остальных 58% наблюдалось расхождение иммунофенотипов первичной и вторичной опухоли; из них в 26% случаев фенотип первичной опухоли не совпадал со вторичной по экспрессии гена НЕК-2-пеи. В 29,6% отмечалось несоответствие по экспрессии эстрогеновых рецепторов и в 25,8% несовпадение по рецепторам прогестерона.
В настоящее время выбор препарата и определение тактики лечения метастатического рака молочной железы основывается на гистологическом варианте первичной опухоли, а также известных клинических и иммуно-морфологических прогностических и предсказывающих факторах. Согласно современным исследованиям более логичным является определение фенотипа метастатической опухоли, что позволяет основывать выбор тактики лечения и препарата на индивидуальных характеристиках метастатической опухоли.
Определение прогноза любого онкологического заболевания, включая и рак молочной железы, предполагает по существу идентификацию маркеров, которые в той или иной
1. Писарева Л.Ф., Ананина О.А., Одинцова И.Н.,Муранова О.Ю., Фокин В.А //Материалы V съезда онкологов и радиологов СНГ. 2008. С. 27.
2. Ганцев Ш.Х. Рак молочной железы. /Ш.Х. Ганцев, А.М. Ханов, С.М. Демидов, А.Г. Пухов, М.Г. Галеев, Э.А. Харипова. М.: МИА. 2004. 120 с.
3. Имянитов Е.Н. Молекулярная онкология. Санкт-Петербург. 2008.
4. Новик А.В., Моисеенко В.М. Теоретические предпосылки адъювантной терапии злокачественных опухолей. 2008.
5. Aitken S.J., Thomas J.S., Langdon S.P., Harrison D.J., Faratian D. Quantitative analysis of changes in ER, PR and HER2 expression in primary breast cancer and paired nodal metastases. Division of Pathology, University of Edinburgh, Edinburgh, UK. 2010. Jun. № 21 (6). Р. 1254-1261. Epub. 2009. Oct. 25.
6. Аничков Н.М. Биологические и клиникоморфологические аспекты учения о метастазировании злокачественных опухолей. Мед. акад.журнал. 2003. С. 1, 3-13.
7. Летягин В.Я. Опухоли молочной железы. Клиника, диагностика, лечение. Проноз. М. 2000. 244 с.

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
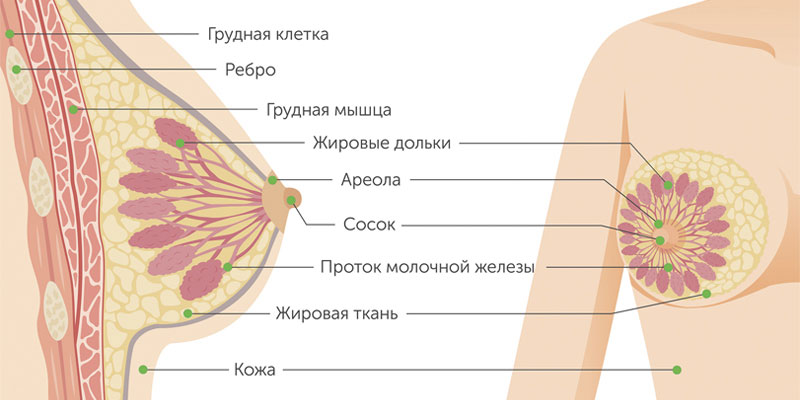
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
Читайте также:

