Метан взаимодействует с хлором и образует
Выберите один или несколько ответов: хлористый метилен (СН2Сl2) и хлороводород (НСl).
![]()
1) хлорметан и хлороводород; хлористый метилен и хлороводород
2) а – [–СН3 ]; б – [–(СН2) 2СН3 ];в – [–СН2СН3 ];
г – [–СН(СН3) 2 ];
3)месторождения природных газов, попутные газы, нефть;
4) гетеролитический, ионный;
5)4;
6)
Другие вопросы из категории
г/см3?
2)Какие массы нитрата калия и воды необходимо взять для приготовления 2 л раствора (плотность раствора равна 1,3 г/см3) с массовой долей KN03 равной 0,05?
3)Молярность раствора едкого калия КОН равна 3,8 моль/л, его плотность 1,17 г/мл. Вычислить массовую долю (%) КОН в этом растворе. Объём раствора 0,5 л.
4)Вычислить молярную концентрацию раствора серной кислоты, если массовая доля H2S04 в этом растворе 12%. Плотность раствора 1,08 г/мл при 20°С. Масса раствора 500 грамм.
5)Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200 мл, если его молярная концентрация 2 моль/л.
какая реакция если можно объяснение
Читайте также
А)толуол
Б) метаналь
С)глицерин
Д) пропанол
2)сложный эфир образуется при взаимодействии метановой кислоты с
А) метаном
Б) этанолом
С) гидроксидом натрия
Д) карбонатом натрия
3) раствор перманганата калия обесцвечивается при взаимодействии с
А) бензол
Б) этилен
С) этанол
Д) метан
4) какой из следующих процессов не является окислительно-востановительным?
А) гашение извести
Б) горение природного газа
С) коррозия металла
Д) разложение воды
5) Хлорид железа(II) можно получить при взаимодействии:
А) хлора и железа
Б) соляной кислоты
С) растворов хлорида железа(II) и сульфата меди(II)
Д) железа и раствора хлорида магния
6)почему вода не горит?
А) вода имеет жидкое состояние
Б) вода состоит из углерода
С) вода-продукт полного сгорания водорода
Д)вода-продукт неполного сгорания
7) Почему при зажигании спички иногда бывают небольшие взрывы с искрами?
А) много серы
Б) мало кислорода
С) приминяют кристаллическую бкртолетову соль
Д) много кислорода
8) Какой камень под действием воды выделяет горючий газ?
А) мрамор
Б)карбид кальция
С) известняк
Д)кварц
9)Атомную кристаллическую решетку имеет
А) железо
Б)оксид углерода(IV)
С) оксид кремния(IV)
Д)водород
10)Атомы углерода и кремния сходны:
А) числом пртонов в ядре
Б)числом энергетических уровней
С) общим числом электронов
Д) числом валентных электронов
11)Углекислый газ в лабораторных условиях получают:
А) окислением угарного газа
Б) брожением глюкозы
С) разложением малахита
Д) действием кислоты на мрамор, мел или известняк
12) кислотным оксидом является
А) оксид углерода(II)
Б) оксид азота(I)
С)оксид азота(V)
Д) оксид азота(II)
13) наибольшее количество катионов образуется при полной диссоциации 1 моль
цинка
А)фосфата натрия
Б) нитрата алюминия
С) хлорида железа(III)
Д) сульфата железа(III)
14) И сера, и хлор вступают в реакцию
А) с кислородом
Б) с сульфатом калия
С) с железом
Д) с оксидом
15) при комнатной температуре реагируют
А) сера и кислород
Б) азот и кислород
С) барий и вода
Д) цинк и вода
вещество В, способное к сублимации, вызывающее посинение ломтика картофеля. При взаимодействии раствора вещества А с бесцветным раствором вещества С образуется тяжелый желтый творожистый осадок D. Определите вещества А,В,С и D и составьте уравнения упомянутых реакций
1. Аминоуксусная кислота и нитроэтан являются
1) структурными изомерами 3) гомологами
2) геометрическими изомерами 4) одним и тем же веществом
2. С аланином взаимодействует каждое из двух веществ
1) водород и оксид кремния(IV) 3) пропан и пропанол-2
2) вода и толуол 4) глицин и соляная кислота
3. Верны ли следующие суждения об аминоуксусной кислоте?
А. Водный раствор аминоуксусной кислоты окрашивает лакмус в красный цвет.
Б. Аминоуксусная кислота взаимодействует и с гидроксидом натрия, и с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
4. Какие из приведенных утверждений о белках и их свойствах верны?
А. Белки - природные высокомолекулярные соединения.
Б. При нагревании до 90 ˚С яичный белок альбумин подвергается обратимой денатурации.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Аланин взаимодействует с
1) соляной кислотой 4) пропанолом-1
2) толуолом 5) оксидом кремния(IV)
3) гидроксидом кальция 6) метаном
6. Масса 20%-ного раствора гидроксида натрия, которая может вступить во взаимодействие с 15 г аминоуксусной кислоты, равна _________ г. (Запишите число с точностью до целых.)
7. Одноосновная моноаминокислота массой 1,5 г при взаимодействии с избытком хлороводорода образует соль массой 2,23 г. Установите формулу аминокислоты.
ароматических углеводородов нефти с серной кислотой с
образованием
поверхностно-активных алкилбензолсульфокислот. Какое
теоретическое
количество пропилбензолсульфокислот может образоваться при
обработке
конц. серной кислотой (98 %) 100 кг нефти, содержащей 1,5 %
масс.
2) Вычислите массовую долю хлора в водном кристаллогидрате хлорида кальция.
3) Оксид магния массой 10 г обработали раствором, содержащим 49 серной кислоты. Сколько граммов соли образовалось?
4) Запишите электронную формулу атома алюмения. Сколько протонов, нейтронов, электронов содержится в этом атоме.
5) какой из приведенных оксидов является основным
1)ClO3; 2)No2; 3)P2O5; 4)Cuo 5)CO2
6) Какой из привеленных веществ может образовать кислую соль:
1)НВг 2)NaOH 3)H2CO3 4)HCl 5)HNO3.
Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
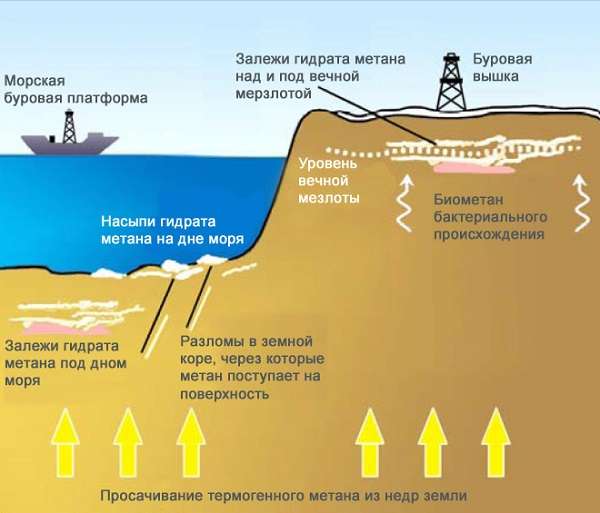
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3Cl + Cl2 → CH2Сl2 + НСl
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
- спирты: 2СН4 + O2 → 2СO3OН
- альдегиды: СН4 + O2 → НСОН + Н2O
- карбоновые кислоты: 2СН4 + 3O2 → 2НСОOН + 2Н2O
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Одной из характерных особенностей насыщенных углеводородов является их способность активно вступать в реакцию с таким химическим элементом как хлор. Молекулярный хлор обладает невысокой способностью вступать в реакцию с алканами, поэтому они хлорируются катионами или атомами хлора, обладающими большей активностью. Для осуществления процесса распада хлорной молекулы на атомы необходимо затратить энергию, составляющую 242,8 кДж/моль. Подобная диссоциация может быть легко проведена при обычных температурных условиях под воздействием ультрафиолетового света. В ходе процесса молекула хлора, поглощая ультрафиолет, получает энергию в 293,0 кДж/моль. Реализация термической диссоциации хлорной молекулы на атомы должна происходить в условиях достаточно высоких температур - около 300ºC. Затраты энергии на диссоциацию молекулы для получения ионов хлора составляют порядка 1130,2 кДж/моль. Анализируя энергетические показатели разнообразных вариантов хлорирования можно сделать вывод о том, что наиболее предпочтительным способом хлорирования насыщенных углеводородов является процесс, проводимый на свету.
Процесс хлорирования алканов по сравнению с фторированием представляет собой процесс менее экзотермический, сопровождаемый выделением теплоты в количестве 108,8 кДж/моль. Осуществление хлорирования алканов фотохимическим способом проходит с применением рассеянного света, по причине того, что воздействие прямого света при проведении реакции приводит к взрыву. В ходе реакции хлорирования происходит постепенное замещение в алканах атомами хлора атомов водорода. Для реакций данного вида характерно образование в их результате хлорпроизводных насыщенных углеводородов.
Таким образом, нагревая до 200ºC смесь метана и хлора или подвергая её воздействию ультрафиолетового света, обладающего длиной волны подходящей величины, запускается реакция, сопровождаемая достаточно сильным выделением теплоты:
Для расчёта теплового эффекта, получаемого в ходе хлорирования метана, находящегося в газовой фазе, на первой стадии до состояния CH3Cl и HCl применяется закон Гесса.
Величина суммарного теплового эффекта ∆Hº равна 25 ккал/моль. Рассматриваемые показатели позволяют сделать вывод о полной вероятности проведения процесса хлорирования метана, причём сопровождающий реакцию тепловой эффект никак не связан со скоростью её протекания, определяемой количеством свободной энергии активации.
Радикальный механизм хлорирования метана
Осуществление реакции хлорирования метана, сопровождаемой нагревом и облучением, а также участием в ней инициаторов, способствующих образованию радикалов, реализует механизм радикально-цепного типа SR (Семенов), состоящий из следующих трёх базовых стадий:
инициирования цепи, или её зарождения
рекомбинация или обрыв цепи
Под воздействием света (hv) или под воздействием температуры молекула хлора Cl2 обретает избыточную энергию и переходит в возбуждённое состояние, которое заканчивается её распадом на два атома, являющиеся по своей природе радикалами. Взаимодействие или столкновение атома-радикала хлора с другими молекулами метана CH4 приводит к отщеплению от них водородных атомов, при котором образуется метильный радикал ●CH3. В свою очередь он отщепляет от следующей молекулы атом хлора Cl2 и т.д. Образование одного радикала, таким образом, инициирует многократное повторение стадии, при которой растёт цепь. Для протекающей реакции длина кинетической цепи определяется в соответствии с количеством подобных повторений. Для процесса хлорирования число повторений может достигать 10 и более тысяч.
Энергетическая диаграмма взаимодействия метановой молекулы и атома хлора изображена на рисунке.
Закономерности радикального хлорирования метана
Согласно общетеоретическим положениям, взаимодействие атомов хлора и молекулы метана будет происходить исключительно в случае равенства их свободной энергии величине энергии активации (или энергетического барьера), составляющего 16,7 кДж/моль. Сама по себе свободная энергия, как правило, немного больше простой разницы между энергией разрыва существующей в молекуле связи C–H (+425 кДж/моль), и образования связи нового вида H-Cl (-431 кДж/моль), которая составляет -6 кДж/моль. По этой причине взаимодействие реагирующих частиц запускается не каждым столкновением между ними, а только обладающими достаточной энергией для преодоления барьера.
Возникновение дополнительной активационной энергии связано с нагревом либо облучением молекул. В возбуждённом состоянии молекулы движутся с достаточно высокой скоростью, что позволяет при столкновении превратить их кинетическую энергию в энергию потенциальную. В переходном состоянии ПС1, соответствующем первой вершине кривой энергетической диаграммы, практически одновременно происходят разрыв старых связей C-H и образование связей нового вида H-Cl в активированном комплексе, который сформировался. Метильный радикал, образуемый в ходе реакции, обладает достаточной потенциальной энергией и впоследствии взаимодействует с молекулой хлора Cl2 сравнительно легко. Энергия, необходимая для активации данной стадии относительно не высока и составляет всего 2 кДж/моль. Окончательное образование соединения CH3Cl осуществляется в находящемся в переходном состоянии ПС2 активированном комплексе, сформировавшемся повторно.
Процесс хлорирования алканов и метана в частности, протекающий при температурах такой величины, представляет собой процесс, плохо поддающийся управлению. Обычно он не прекращается на стадии формирования соединения хлористого метила CH3Cl и способен протекать далее с получением промежуточных соединений – хлористого метилена, хлороформа и тетрахлорометана.
Ионный механизм хлорирования метана
Реакция хлорирования, осуществляемая в кислой среде в присутствии способствующих её протеканию по ионному механизму катализаторов (ими обычно являются кислоты Льюиса SbF5, AlCl3), обладает электрофильным характером (Se). Сущность процесса реагирования молекулы хлора с электроноакцепторного хлорида алюминия, в химическом плане, состоит в значительной поляризации связи C-C, являющейся до этого неполярной, приводящей к образованию электрофильного агента после её диссоциации. При отсутствии катализаторов хлорирование, происходящее по ионному механизму, практически не может осуществляться, по причине того, что для гетеролитического расщепления на анион и катион молекулы хлора необходима значительная энергия – порядка 1130 кДж/моль.
Цепной ионный электрофильный механизм (Se), по которому осуществляется хлорирование в присутствии катализаторов насыщенных углеводородов, изображен на рисунке:
Под воздействием катализатора происходит гетеролитический распад молекулы хлора, сопровождаясь возникновением ионной комплексной пары [AlCl4] – Cl +, из-за того, что алюминий соединён с атомами хлора, имеющими отрицательный электрический заряд, и нуждается в электронах. По этой причине алюминием от атома хлора Cl2 отщепляется пара электронов, сопровождаясь одновременным образованием катиона хлора, взаимодействующего впоследствии с молекулой метана гетеролитично разрывая связь C-H. Результатом данного процесса является образование метильного карбкатиона, который затем реагирует с хлорной молекулой, образуя, в конце концов, хлористый метил и катион хлора, взаимодействующий впоследствии со следующей молекулой. Ионные реакции, у которых промежуточными частицами являются ионы с положительным зарядом, имеют название реакций электрофильных.
По причине того, что для диссоциации хлорных молекул на ионы необходима значительная энергия, хлорирование углеводородов в насыщенном состоянии в присутствии катализаторов должно сопровождаться нагревом реакционной смеси.
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^\circ \ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
- Курсовая работа Хлорирование метана 450 руб.
- Реферат Хлорирование метана 220 руб.
- Контрольная работа Хлорирование метана 210 руб.
Итак, если смесь метана с хлором нагреть до $200^\circ \ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
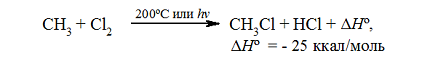
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
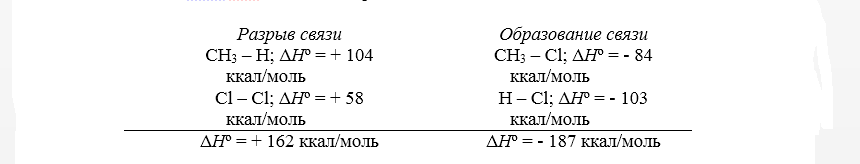
Рисунок 2. Хлорирование метана
Суммарный тепловой эффект $\Delta \underline
Задай вопрос специалистам и получи
ответ уже через 15 минут!
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
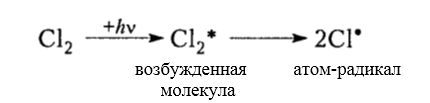
Рисунок 3. Хлорирование метана
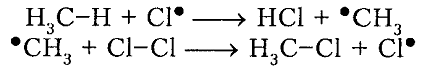
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
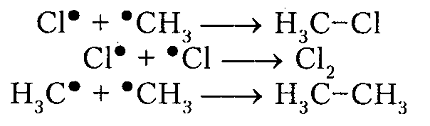
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h \nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 \ 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
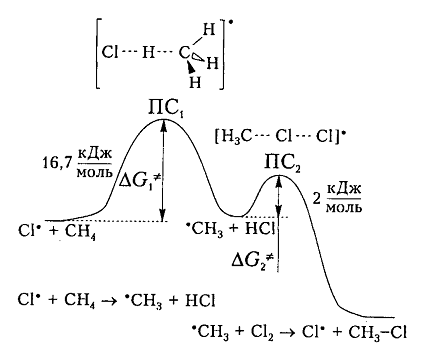
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи - связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой $<\rm H>-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах - плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
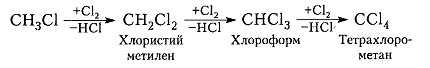
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов ( кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
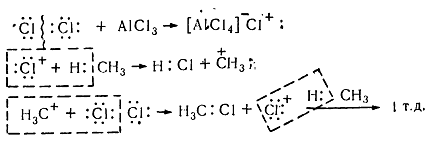
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Так и не нашли ответ
на свой вопрос?
Просто напиши с чем тебе
нужна помощь
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:

Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:

Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:

Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:

- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.

4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Читайте также:

