Механизм защиты от опухоли
Организм любого человека способен противостоять раку, но для этого необходим хороший противоопухолевый иммунитет. Защитная система постоянно удаляет образующиеся раковые клетки, предотвращая опухолевый рост и снижая риск наступления болезни. Важно понимать – в большинстве случаев человек сам нарушает созданный природой барьер, открывая ворота для опухоли.
Иммунитет защищает человека постоянно и эффективно
Виды иммунной защиты
Иммунитет – это специальная система в живом организме, созданная для защиты от любых чужеродных влияний. Выделяют 4 основных вида иммунных барьеров:
- Противомикробный (защита от любых видов микроорганизмов – бактерий, вирусов, грибков);
- Противопаразитарный (борьба с гельминтами и паразитами);
- Трансплантационный (отторжение любой чужеродной ткани или органа);
- Противораковый (подавление клеток со злокачественной трансформацией).
Противоопухолевый иммунитет в постоянном режиме защищает человеческий организм от любых вариантов мутантных клеток, количество которых может достигать 1 миллиона в сутки (не все из них могут стать раком, но иммунная система работает неустанно, устраняя потенциальный риск для здоровья).
Противоопухолевый иммунитет – принцип работы
Основная задача организма – выжить. Природа создала универсальную защитную систему, цель которой – выявить любой чужеродный и опасный биологический или неорганический материал. Но иммунитет неспособен разделять внешних агентов на вредных и неопасных, поэтому у части людей бывает сильная аллергическая реакция на пыльцу безопасных растений.
Противоопухолевый иммунитет работает максимально точно, отсеивая чужие клетки с помощью специальных клеток, которые способны поглощать или разрушать клеточные структуры с генетическими мутациями (до 99% всех раковых клеток гибнет в первые 5-10 часов после возникновения). Выделяют 2 вида защиты:
- Врожденную;
- Приобретенную (вакцинация).
Врожденный противоопухолевый иммунитет обладает следующими несомненными достоинствами:
- постоянная и немедленная готовность к борьбе с опухолевыми клетками;
- независимость иммунных механизмов от вида опухоли (неспецифическая реакция на любые варианты раковых клеток);
- эффективная борьба с любым количеством опухолевых клеток (реакция будет даже на одну-единственную раковую клетку).
Врожденный барьер – это первый ряд эффективной защиты. Опухолевые клетки могут проскользнуть в организм и начать размножаться, формируя рак, что объясняется следующими особенностями:
- Изменчивость (раковые клетки постоянно мутируют, пытаясь обмануть противоопухолевый иммунитет);
- Генетическая предрасположенность (исходные дефекты в генах человека, способствующие наступлению рака);
- Отсутствие у опухоли чувства самосохранения (в отличие от любого паразита);
- Подавление защитных сил организма (в какой-то момент наступает истощение и ослабление защиты);
- Влияние внешних факторов, действующих на иммунитет негативно (вредные привычки, профессиональные вредности, канцерогенные факторы).
Постоянный иммунный надзор за опухолевыми клетками однажды может прекратиться. И с этого времени начинается рост злокачественного новообразования.
Раковые клетки неутомимо пытаются пробиться через иммунный барьер
Роль иммунной защиты в лечении рака
В борьбе с раком все средства хороши. Противоопухолевый иммунитет можно и нужно использовать в битве с врагом. Для этого следует использовать следующие факторы:
- профилактику рака (устранение причин для подавления иммунной защиты);
- применение лекарственных препаратов для иммунотерапии;
- использование вакцин, защищающих от определенных видов опухолей.
В большинстве случаев самоизлечение рака – это эффективное влияние иммунной системы. Таргетная терапия лежит в основе успешного лекарственного лечения в послеоперационном периоде. Важно помочь организму самому справиться с болезнью, и не создавать условий для подавления защитных сил, отказавшись от курения, переедания и влияния внешних канцерогенных факторов.
Мысли об онкологии: просто о сложном на Дзен.Канале Onkos
Воздействие канцерогенных этиологических факторов само по себе недостаточно, чтобы вызвать опухоль, так как организм располагает определенными способами противодействия.
Возможности противоопухолевого иммунитета в противостоянии канцероген-опухоль мы уже рассмотрели (часто их называют антицеллюлярными).
Однако имеются и другие механизмы, препятствующие реализации канцерогенеза.
Система защиты организма от возможного развития рака включает многоступенчатый контроль. Первыми его звеньями будут элиминация попавших в организм канцерогенов (антиканцерогенные механизмы) и нивелирование воздействия генетических повреждений (антитрансформационные механизмы).
Антиканцерогенные механизмы
Очевидно, что уже само попадание в организм канцерогенов (или их продуктов) будет активировать механизмы защиты, направленные на предотвращение их взаимодействия с нормальными клетками.
В этом случае защита организма осуществляется путем разрушения, инактивации, связывания и выведения канцерогенов, т.е. антиканцерогенные механизмы реализуются преимущественно на стадии инициации опухолевого процесса.
В зависимости от вида агентов или точки их приложения на различных этапах опухолевого процесса, антиканцерогенные механизмы имеют признаки специфичности.
Химический канцерогенез
Противодействовать канцерогенному влиянию химических агентов организм может путем:
а) инактивации канцерогенов посредством реакций окисления оксидазами печеночных микросом (ПАУ), или реакций восстановления микросомальными редуктазами (амино- и азокрасители), или реакций конъюгации с глюкуроновой кислотой и др.;
б) элиминации экзо- и эндогенных канцерогенов из организма в составе желчи, мочи и кала;
в) подавления свободных радикалов антиоксидантами (альфа-токоферолом, глутатионом и др.);
г) пино- и фагоцитоза канцерогенов и их обезвреживанием; д) образованием антител против канцерогенов, которые являются гаптенами.
Физический канцерогенез
Вирусный канцерогенез
Антитрансформационные механизмы
По своей сути они являются внутриклеточными механизмами защиты от малигнизации и направлены на восстановление нормального генома клетки и/или предотвращение дальнейшей трансформации инициированной клетки в опухолевую.
Очевидно, что основные события этих механизмов происходят на стадии промоции канцерогенеза. Среди них наиболее изучены антимутационные и антионкогенные.
Выделяют три этапа репарации поврежденной канцерогеном ДНК:
Антионкогенные — осуществляются нормальными антионкогенами, которые подавляют процесс неконтролируемого деления клеток и стимулируют их дифференцировку. В результате происходит ингибирование/элиминация отдельных опухолевых клеток и/или опухолевых клонов, что более характерно для стадии прогрессии.
Функциональное состояние систем организма (гомеостаза)
Возможность реализации канцерогенеза в организме человека и развитие злокачественной опухоли во многом зависит и от состояния гомеостаза и, прежде всего, нервной и эндокринной систем. Так, нервная система выполняет трофическую функцию благодаря внутриаксональному току цитоплазмы (аксоплазмы), содержащей биогенные амины, фосфолипиды, циклические нуклеотиды, простагландины и др.
Поскольку аксоплазма перемещается в двух направлениях (от нейрона к исполнительным органам и обратно), то, не вызывает сомнений, возможность опосредованного, через нервную систему, изменения направленности метаболических процессов в зоне разветвления нервных терминалей.
Это проявляется комплексом нейродистрофических нарушений в виде дедифференцировки клеток, изменения их генетического аппарата, что важно для формирования опухоли.
Эндокринный дисбаланс в развитии опухолей может проявляться в двух аспектах. Гормоны могут непосредственно участвовать в реализации механизмов канцерогенеза или играть важную роль в предрасположенности к возникновению новообразований.
Известно, что увеличение концентрации стероидных и пептидных гормонов повышает митотическую активность тканей-мишеней. Естественно, возможность повреждения генома пролиферирующих клеток и последующей злокачественной трансформации повышается, риск развития новообразований возрастает.
Влияние гормонов на канцерогенез может осуществляться через экспрессию ряда онкогенов. В качестве примера можно привести значение гиперпродукции эстрогенов в развитии рака молочной железы, тела матки. Кроме того, гормоны оказывают влияние на метаболические процессы, предрасполагающие к развитию рака.
Наиболее значимыми являются снижение толерантности к глюкозе, реактивная гиперинсупинемия, ожирение, повышение в крови свободных жирных кислот, холестерина, липопротеидов низкой плотности, кортизона и т.д. Часто эти факторы сочетаются и, в конечном итоге, формируется сумма метаболических условий, повышающих вероятность злокачественной трансформации клетки.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Исследование противоопухолевого иммунитета и устранение факторов, вызывающих его ухудшение, являются важными проблемами в современной медицине. Злокачественные новообразования занимают одно из лидирующих мест среди причин смертности и инвалидизации населения в развитых странах. В норме баланс количества делящихся и отмирающих клеток регулируется естественным образом. Если размножение клеток приобретает неконтролируемый характер, то возникают злокачественные опухоли. Механизм контроля этого процесса со стороны иммунной системы зависит от нескольких факторов, подавляющих или стимулирующих процесс избыточного деления.
Общее описание
Под иммунитетом принято понимать совокупность защитных механизмов живого организма от негативного воздействия чужеродных агентов. Чаще всего эти процессы связаны с инфекционными (бактериальными, вирусными, грибковыми, протозойными) заболеваниями. Однако существуют и другие способы защиты, одним из которых является противоопухолевый иммунитет.
В деятельности любого живого организма возникают моменты, когда ему необходимо быстрое деление клеток (травма, воспалительный процесс и другие). При развитии определенного иммунного ответа количество клеток, чувствительных к воздействию антигена (молекулы, связанной с антителом), увеличивается в несколько тысяч раз. При нормальном течении процесса после завершения данной реакции ускоренное деление клеток останавливается.
Для злокачественной опухоли характерно нарушение этого механизма. Размножение клеток продолжается постоянно и имеет независимый характер. Постепенно происходит замещение нормальных тканей в пораженном органе и прорастание опухоли в окружающие области. Перемещаясь по кровяному руслу, клетки опухоли продолжают делиться и в другой локализации, что приводит к появлению метастаз. Этот дефект непрерывного деления наследуется всеми потомками опухолевых клеток. Их мембраны изменены таким образом, что человеческий организм воспринимает объекты как чужеродные.
С другой стороны, в организме имеется способ, который может остановить этот процесс, – противоопухолевый иммунитет. В иммунологии возникновение опухолей является свидетельством того, произошли нарушения естественного защитного механизма.
История открытия
Еще в 18 веке было замечено, что у некоторых больных, перенесших инфекционные болезни, исчезали злокачественные опухоли. В конце 19 века американский хирург-онколог Вильям Коли выявил взаимосвязь между заражением гемолитических стрептококком Streptococcus pyogenes и уменьшением (а в некоторых случаях – и полным исчезновением) опухолей злокачественного характера. Им была разработана противораковая вакцина на основе этих бактерий для лечения пациентов с саркомой. В то время еще не были известны механизмы противоопухолевого иммунитета в иммунологии, поэтому его работы подвергались сильной критике, а впоследствии были забыты почти на 100 лет.
В середине XX века было открыто, что введение макромолекул липосахарида, из которых состоят оболочки клеток микробов, может приводить к отмиранию опухолей. Однако в 70-е гг. XX в. ученые установили, что этот процесс вызывает не сам липосахарид, а белковый фактор (фактор некроза опухоли, или ФНО), вырабатываемый следующими типами клеток иммунной системы при контакте с микробами:
- активированные макрофаги;
- нейтрофилы;
- Т-лимфоциты;
- тучные клетки;
- астроциты;
- NK-клетки (натуральные киллеры).
Взаимосвязь иммунитета и образования опухолей
В пользу наличия связи между состоянием иммунитета и развитием злокачественных опухолей свидетельствуют следующие факты:
- увеличенная распространенность таких новообразований у пациентов с иммунодефицитным состоянием, а также в пожилом возрасте (что связано со снижением защитных сил организма);
- выявление у больных специфических антител и Т-клеток, чувствительных к антигенам опухолей;
- возможность формирования противоопухолевого иммунитета и иммунопролиферативных заболеваний (при искусственном введении антител и подавлении иммунитета соответственно).
Защитная функция иммунитета заключается не только в уничтожении чужеродных агентов (вирусов, грибков и бактерий), но и клеток-мутантов, из которых образуются опухоли. Для них характерна антигенная специфичность, которая зависит от причины появления новообразования:
- вирусы (папилломы, лейкоза и другие);
- химические канцерогены (метилхолантрен, бензопирен, афлотоксины и другие);
- эндокринные нарушения (метаболическая иммунодепрессия);
- физические факторы окружающей среды (все виды излучений).
Естественный противоопухолевый иммунитет очень слабо влияет на уже сформировавшееся злокачественное новообразование. Это связывают со следующими факторами:
- быстрый рост опухоли, опережающий активизацию иммунных сил;
- выделение опухолевыми клетками антигенов, которые связывают соответствующие рецепторы на поверхности лимфоцитов-киллеров;
- подавление клеточного иммунитета со стороны новообразования.
Принцип действия
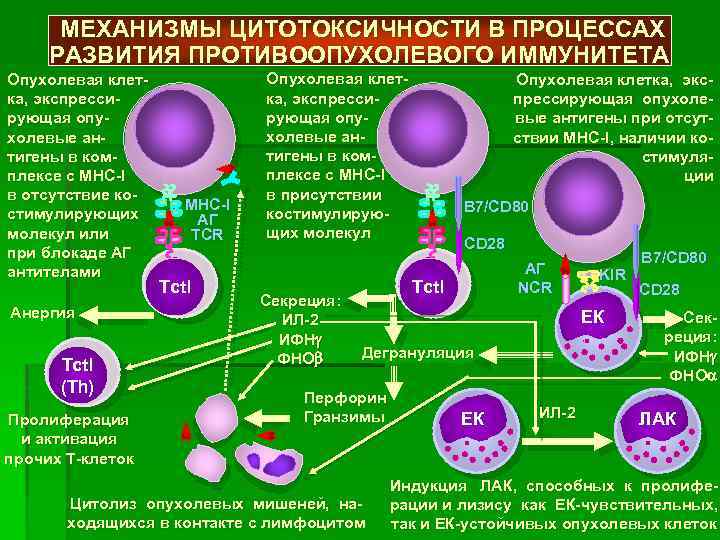
Механизм противоопухолевого иммунитета в медицинской науке еще мало изучен. Несмотря на то что выявлена его защитная функция, антитела могут отражать опухолевые антигены, не вызывая разрушения злокачественных клеток. В некоторых случаях иммунотерапия даже дает обратный эффект, способствуя увеличению новообразования.
Согласно современным представлениям, ключевую роль в данном процессе играют активизированные макрофаги и клетки-киллеры. Особенностью противоопухолевого иммунитета является то, что он характеризуется сложным механизмом взаимодействия организма-хозяина и новообразования. Выделяют 4 основные группы факторов:
- Антибластомные – гуморальные и клеточные (Т-лимфоциты, ФНО, макрофаги, ЕК- и К-клетки, специфические антитела, интерфероны, интерлейкины), подавляющие развитие опухоли и разрушающие ее клетки.
- Иммунорезистентность новообразования, или его способность противостоять противоопухолевому иммунитету.
- Пробластомные: угнетающие иммунитет (вещества-супрессоры, вырабатываемые макрофагами и лимфоцитами; гормоноподобные соединения, интерлейкин-10, циркулирующие иммунные комплексы, протеины группы TGFβ, состоящие из антигенов, антител и компонентов комплемента); усиливающие иммунитет (ФНО, вырабатываемый макрофагами; гамма-интерферон, интерлейкины 2 и 6, фактор роста эндотелия; иммунодефицитные состояния).
Эффекторные механизмы
Основной функцией эффекторных механизмов противоопухолевого иммунитета является блокирование и уничтожение патогенов. Выделяют 2 группы рецепторов, избирательно связывающиеся со специфическими антигенами. На основании этого различают также 2 типа эффекторных механизмов:
- Гуморальный, функционирующий за счет растворимых (гуморальных) факторов – антител, которые связывают и удаляют антиген.
- Клеточный (антителонезависимый), реализующийся с участием клеток иммунной системы, важнейшими из которых являются Т-лимфоциты, макрофаги, NK-клетки. Они непосредственно разрушают чужеродные, инфицированные и опухолевые клетки.
Если патологически измененная клетка избежала гибели при воздействии эффекторных механизмов, то может наступить период равновесия между ее делением и подавляющим влиянием иммунитета. При прогрессировании злокачественного процесса происходит выход опухолевой ткани из-под контроля иммунных механизмов.
Важнейшую роль в подавлении деления клеток играют 2 типа лимфоцитов, запускающих процесс некроза – Т-лимфоциты и NK-клетки, распознающие стрессорные молекулы, которые выделяет новообразование. Т-лимфоциты формируются в течение более длительного времени, а их предшественники распознают опухолевые антигены. Th1-лимфоциты запускают механизм воспаления, что приводит к активизации макрофагов. Продукты секреции последних способствуют нарушению местного кровоснабжения тканей, что также влечет гибель тканей опухоли.
Участие Т-лимфоцитов проявляется в пропитывании злокачественного новообразования лимфоидными клетками, которые разрушают его клетки путем растворения, или цитолиза. Активизация лимфоцитов происходит под действием цитокинов – белковых информационных молекул, с которыми они вместе проникают в опухоль.
Большое значение среди внутренних факторов, присущих иммунной системе организма человека, имеет также гамма-интерферон. Его функции заключаются в следующем:
- Подавление деления опухолевых клеток.
- Активизация процесса их запрограммированной гибели.
- Стимулирование выработки цитокинов, которые привлекают в новообразование Т-лимфоциты.
- Активация макрофагов и развития Т-хелперов, необходимых для укрепления противоопухолевого иммунитета.
- Подавление образования новых кровеносных сосудов, что ухудшает питание опухоли и способствует более быстрой гибели ее клеток.
Противоопухолевый иммунитет: причины его низкой эффективности
Рост злокачественных новообразований и их устойчивость к иммунитету объясняются следующими причинами:
Эти механизмы неэффективности противоопухолевого иммунитета приводят к тому, что новообразование становится мало иммуногенным и не воспринимается организмом как чужеродный элемент. В результате снижается защитная реакция. Иммунные механизмы не могут привести к отторжению уже сформировавшейся злокачественной опухоли.
Особенности
К особенностям противоопухолевого иммунитета относятся:
- Основную роль в иммунном ответе играют Т-лимфоциты, макрофаги и NK-клетки, разрушающие опухолевую ткань. Значение гуморального иммунитета значительно меньше.
- Раковые антигены распознаются или непосредственно макрофагами и дендритными клетками, отвечающими за врожденный и адаптивный иммунитет, или через Th1-хелперы.
- Взаимодействие организма и опухоли происходит по трем направлениям: естественная и приобретенная резистентность к злокачественным новообразованиям, иммунодепрессия со стороны опухоли. Совокупность этих факторов и составляет противоопухолевый иммунитет.
- Злокачественные клетки в процессе естественного отбора приобретают механизмы защиты против врожденного иммунитета. Формируется их новый фенотип, происходит эволюция новообразования.
Опухолеассоциированные антигены разделяют на 2 группы – первого типа (характерны для многих видов новообразований, имеют вирусное происхождение) и второго, очень специфичные и обнаруживаемые у всех пациентов, имеющих данный вид опухоли.
Одной из общих особенностей противовирусного и противоопухолевого иммунитета является то, что он носит как специфический характер, то есть направлен против определенных видов патогенов, так и неспецифический (уничтожает все чужеродное организму). Неспецифическими факторами служат мононуклеарные и NK-клетки, активизирующиеся под влиянием интерлейкина 2 и интерферонов, а также лимфокин-активированные киллерные клетки и цитокины.
Иммунодиагностика
В последние годы в медицине находит применение иммунодиагностика злокачественных новообразований. В ее основе лежит выявление в крови следующих белковых соединений:
- антигены, ассоциированные с опухолями;
- антитела;
- лимфоциты, восприимчивые к опухолевым антигенам.
Малоинвазивная иммунодиагностика позволяет выявить рак различных органов на ранней стадии развития опухоли по наличию специфических антигенов (в скобках указана локализация злокачественного новообразования):
- PSA (простата).
- P-53 (мочевой пузырь).
- SCC (легкие, пищевод, прямая кишка).
- СА-19-9 (поджелудочная железа).
- СА-125 (яичники).
- СА-15-3 (молочная железа).
Однако антитела к определенному антигену в крови пациентов с раком определяются нечасто (в 10 % случаев). Иммуноглобулины к опухолеассоциированных антигенов выявляют чаще – у 50 % больных. В настоящее время в медицинской научной среде ведутся поиски и других антигенов, помогающих в диагностике рака.
Иммунопрофилактика и лечение
Для повышения противоопухолевого иммунитета используют иммуномодуляторы, опосредованно активизирующие клетки иммунной системы:
- Интерлейкины 1 и 2. Эти белковые соединения относятся к группе провоспалительных цитокинов (информационных молекул) и являются биологически активными веществами, вырабатываемыми лейкоцитами. Интерлейкины – главные участники в процессе формирования иммунного ответа при внедрении патогенов в микробиологии. Противоопухолевый иммунитет активизируется за счет активного деления лимфоцитов (Т-киллеры, NK-клетки, Т-хелперы, Т-супрессоры и продуценты антител). Интерлейкин 2 также активизирует выработку фактора некроза опухолей.
- Препараты из группы интерферонов. Они стимулируют иммунный ответ путем представления Т-лимфоцитам антигенов, которые были захвачены макрофагами и дендритными клетками. Т-хелперы выделяют белковые информационные молекулы, активирующие работу других клеток иммунной системы. В результате происходит повышение противоопухолевого иммунитета. Отдельные виды интерферонов (гамма-интерферон) могут непосредственно воздействовать на макрофаги и киллеры.
- Адъюванты. Они вводятся вместе с основными иммунобиологическими медицинскими препаратами и служат для усиления ответа со стороны защитных сил организма. Чаще всего их используют для здоровых людей при вакцинации. Одной из особенностей противоопухолевого иммунитета в микробиологии, касающейся данного типа веществ, является то, что они могут концентрировать на своей поверхности антигены. Это обеспечивает более длительный эффект. Для целенаправленной доставки антигенов в органы лимфатической системы применяют липосомы – пузырьки с липидными биослоями. Наиболее распространенными веществами этой группы являются полный и неполный адъювант Фрейнда, гидроксид алюминия, коклюшная палочка, осажденная на алюминиевых квасцах; Полиоксидоний.
- Элементы клеток бактерий (иммуностимуляторы Продигиозан, Ликопид, Ромуртид и другие).
Проведенные на животных эксперименты показывают, что при введении опухолевых антигенов происходит формирование иммунологической памяти. В результате после этого отторгается трансплантируемая злокачественная опухоль. В последние годы в медицине ведутся активные разработки, которые дадут возможность создания противоопухолевой иммунной памяти путем вакцинации. Пока в этом направлении создан один тип прививок – для повышения иммунитета к вирусам папилломы человека, которые индуцируют возникновение рака шейки матки у женщин ("Гардасил" и "Церварикс" зарубежного производства).
Виды опухолей
Иммунотерапия является эффективной в отношении следующих видов опухолей:
- меланома, возникающая из меланоцитов – пигментных клеток;
- неходжкинские лимфомы, происходящие из лимфоцитов;
- рак почек, прямой кишки, яичников;
- волосатоклеточный лейкоз (поражение В-лимфоцитов, белых клеток крови);
- глиома (опухоль мозга);
- саркома мягких тканей, происхождение которой связано с эпителиальными клетками и соединительной тканью.
Механизмы противоопухолевой защиты организма функционируют на всех этапах развития опухолевого процесса. В свою очередь, опухоль довольно успешно защищается от действия противоопухолевых механизмов организма путем изоляции клеток от их влияния, а также нарушением работы самих этих механизмов, и в
первую очередь иммунных. Многие исследователи связывают начало развития опухолевого процесса с нарушениями механизмов противоопухолевой резистентности организма. Подтверждением этому является более частое развитие опухолей у человека при наследственных иммунодефицитах.
Механизмы противоопухолевой резистентности подразделяются на следующие группы:
1. Антиканцерогенные механизмы направлены на защиту организма от действия канцерогенных факторов.
2. Антимутационные механизмы направлены на предотвращение трансформации нормальных клеток в опухолевые, это требует подавления активности онкогенов.
На этапе возникновения онкогенов клетка активирует антионкогенные механизмы (супрессорные гены). Генетический фонд клетки защищен мощным ферментным аппаратом, обеспечиваю-
щим восстановление (репарацию) ДНК. С помощью эндо- и экзонуклеаз, щелочных фосфатаз и ДНК-полимераз клетки вырезают измененные нуклеотиды и за счет соответствующих комплементарных участков второй нити ДНК (если она не повреждена) воссоздают исходную, генетически запрограммированную нуклеотидную последовательность поврежденной нити. Особенно важна в этих механизмах роль гена-супрессора клеточного деления (антионкогена) р53 (см. раздел 13.3.5). Практически все известные канцерогены индуцируют в клетках репаративный синтез ДНК.
3. Антицеллюлярные механизмы направлены на обнаружение и уничтожение уже возникших опухолевых клеток.
который быстро превращается в фибрин. Фибриновая пленка защищает эти клетки от противоопухолевых факторов организма. При этом среди неиммунных механизмов резистентности организма следует выделить лаброцитарный эффект, который связан со способностью тучных клеток продуцировать гепарин, препятствующий образованию зищитной фибринной пленки на поверхности опухолевых клеток. Изоляции опухолевых клеток от факторов неспецифической резистентности служат редукция микрокровообращения в ткани опухоли, ускользание их от влияний глюкокортикоидов, ингибирующих процесс пролиферации (это происходит, например, из-за уменьшения количества рецепторов для гормонов на мембране опухолевых клеток).
Специфический противоопухолевый иммунитет формируется на поздних стадиях опухолевого роста и малоактивен. Слабая антигенность опухолей (за счет антигенной дивергенции, антигенной реверсии и антигенного упрощения опухолевых клеток), развитие иммунодефицитного состояния в организме являются основными факторами, обеспечивающими неэффективность противоопухолевого иммунитета. Появление иммунодефицита в процессе развития опухоли может быть связано с эндокринно-обменными нарушениями в организме и, в частности, с увеличением продукции кортикостероидов. Их действие приводит к угнетению иммунной системы, а проявляется это в угнетении лимфопролиферации и образования антител. Нарушение иммунной системы считается одним из важных факторов и условий в возникновении, развитии и прогрессии опухолевого процесса.
ТРАНСПЛАНТАЦИЯ КЛЕТОК, ТКАНЕЙ И ОРГАНОВ
Пересадка клеток (в том числе стволовых), тканей и органов находится в центре внимания современной медицины.
Наибольшие успехи достигнуты в клеточной трансплантологии, исторически связанной с переливанием крови, отдельных ее компонентов (эритроцитов, лейкоцитов, тромбоцитов) и трансплантацией костного мозга. Первое случайно успешное переливание цельной крови ягненка 15-летнему мальчику с лихорадкой и геморрагическим синдромом было выполнено во Франции в 1667 г. профессором математики и медицины Жаном-Батистом Дени и хирургом Эммерицем. Широкое научно обоснованное применение
метода стало возможным после открытия групп крови (конец XIX - начало XX в.) и изучения иммунологической совместимости донора и реципиента-больного.
Русским исследователям принадлежат выдающиеся достижения в теоретическом, экспериментальном и клиническом развитии трансплантологии. И.И. Мечников выдвинул идею о наращивании количества клеток посредством их трансплантации в организм. М.А. Новинский впервые в мире осуществил гомо- и гетеротрансплантацию опухолей. В.П. Филатов разработал методы гомотрансплантации роговицы и кожных стеблей. Н.П. Синицын осуществил гомотрансплантацию сердца лягушки. В.И. Демихов разработал технику гомотрансплантации головы собаки, а также гомотрансплантацию передней и задней частей туловища у собак (рис. 13-10). Собаки, оперированные В.И. Демиховым, жили в отдельных случаях несколько лет. Б.В. Петровский впервые провел успешную пересадку почки у людей.
С точки зрения хирургии основные проблемы трансплантации были решены в первой половине XX в., однако в большинстве случаев со временем происходило отторжение пересаженных тканей и органов. Широкое использование метода долгое время не представлялось возможным, пока в 1944 г. английский ученый П. Медавар не доказал, что успех во многом зависит от иммунологических факторов, прежде всего от совместимости по антигенам главного комплекса гистосовместимости (HLA у человека, H-2 у мышей). После этого стала успешно развиваться и совершенство-

Рис. 13-10.Гомотрансплантация передней части туловища у собак по В.И. Демихову
ваться техника трансплантации костного мозга для лечения заболеваний системы крови у детей и взрослых, прежде всего лейкозов, агранулоцитозов, апластической анемии, миелодиспластического синдрома.
Существуют две главные проблемы трансплантологии:
1. Технические, этические и юридические вопросы заготовки, криоконсервации (замораживания), доставки и пересадки клеток, тканей и органов.
2. Вопросы генетической, иммунологической и морфофункциональной совместимости трансплантата. Так, наибольшее количество поверхностных трансгшантационных HLA-антигенов находится на лимфоидных клетках селезенки, лимфатических узлов и костного мозга, в меньшей степени (по убыванию концентрации) в ткани печени и легких, кишечника, почки, сердечной мышцы, желудка, аорты, мозга. Неравномерное распределение антигенов является одним из патогенетических факторов, объясняющих различный клинический успех при пересадке тех или иных органов и тканей.
В любом случае ответная реакция организма на трансплантацию является патологическим процессом, связанным с хирургической травмой, токсическим воздействием наркоза. Кроме того, пересаженная биологическая ткань, даже собственная (аутологичная), ставится в условия, неестественные по отношению к ее обычному месту существования (гетеротопия Вирхова). Р. Вирхов считал гетеротопию одним из основных условий для патологического состояния ткани.
С точки зрения иммунологии различают аутологичный, аллогенный, изогенный и ксеногенный типы трансплантации.

Рис. 13-11.Восстановление дефекта носа по В.П. Филатову - миграция ножки стебля к дефекту носа
с руки стебель пересаживают на лицо и выкраивают из него нос или другие части поврежденного лица. Эффективность этого метода весьма высока, и он широко применяется в настоящее время (рис. 13-11).
Аллогенная трансплантация (аллоили гомотрансплантация)- обмен биологическим материалом между представителями одного и того же вида животных или между разными людьми, которые не являются генетически идентичными. Успех и неудача во многом определяется степенью тканевой совместимости донора и реципиента. Так, примером гомотрансплантации является переливание крови одной группы по системе АВ0. Тем не менее возможен иммунологический конфликт по другим антигенам эритроцитов. Пересадка органов и тканей (сердца, печени, почки, легких отдельно или в комбинации) от одного человека к другому также широко применяется хирургами. Однако преодолеть иммунологическую несовместимость между неродственными людьми достаточно эффективно еще не удалось. Для этой цели применяются различные подходы (см. ниже).
Изогенная трансплантация (изотрансплантация)осуществляется между генетически тождественными однояйцевыми близнецами. При пересадке биологического материала у животных одной генетически чистой линии того же пола говорят о сингенной трансплантации.
Ксеногенная трансплантация (ксеноили гетеротрансплантация) -
это пересадка тканей, клеток и органов в пределах двух разных биологических видов. Трансплантация гетерогенных клеток, тканей и органов также была предметом интенсивного изучения в начале XX в. В истории медицины известна попытка пересадки мужских половых желез от обезьян человеку с целью его омолаживания (Э. Штейнах, С. Воронов). Временный стимулирующий эффект в этих случаях определяется действием половых гормонов. Применялись для трансплантации эмбриональные клетки и ткани
животных и человека. Результаты такой терапии крайне противоречивы и носили скорее коммерческий характер, без серьезного патогенетического обоснования.
Гетеротрансплантация надпочечников, селезенки и других органов проводится в медицине с целью так называемой неспецифической стимулирующей терапии. Она не нашла широкого распространения вследствие неизбежного возникновения резкого иммунологического конфликта, связанного с сенсибилизированными лимфоцитами и специфическими антителами.
С точки зрения места пересадки выделяют:
• ортотопическую трансплантацию, когда клетки (ткань, орган) вводятся в аналогичную ткань;
• гетеротопическую трансплантацию, при которой биологический материал пересаживают в несвойственное ему место. Например, костный мозг трансплантируют под капсулу почки, а клетки поджелудочной железы - в переднюю брюшную стенку или сальник.
С точки зрения биомеханики, структура биологических тканей и органов, в отличие от искусственных материалов, обладает одновременно свойствами упругости, эластичности и твердости (например, кость). Для воспроизведения структуры живой ткани при конструировании протезов используют сочетание различных искусственных материалов. В таком случае материал (имплантат) называют композитным.Для улучшения функциональных свойств создают гибридные имплантаты,комбинируя искусственные материалы с биологическими молекулами (ферменты, цитокины, коллаген и т.п.), клетками и тканями.
В настоящее время наибольшие успехи достигнуты в области эндопротезирования крупных суставов (бедренный, коленный, голеностопный, плечевой, локтевой). При этом срок службы имплантатов, состоящих из металла, керамики и полимера, достигает 15-20 лет.
Несмотря на тот факт, что введение имплантата не вызывает иммунологического конфликта, для предотвращения реакции отторжения применяют биологически совместимые изделия, не вызывающие асептического (неинфекционного) воспаления, интоксикации и аллергизации организма. Наиболее биосовместимым считается имплантат, имеющий как можно более полное структурно-функциональное соответствие с биологическим органом или тканью (биомиметический принцип создания имплантатов). Имплантат, функционирующий в организме, интегрированный в его кровеносную систему и выполняющий требуемые задачи заместительной терапии, называется искусственным органом (тканью).
Воздействие организма реципиента на трансплантат.Каждая пересаженная ткань или целый орган попадают в организм реципиента в условиях: 1) почти полной денервации (за исключением собственных вегетативных узлов и их аксонов); 2) резкого нарушения кровообращения и питания пересаженного органа; 3) резкой клеточной и гуморальной иммунной реакции со стороны организма реципиента.
Деструктивные и реактивные изменения, развивающиеся в месте приживления трансплантата, наиболее показательны при пересадке аллогенного кожного лоскута. Через 6-7 дней после пересадки наблюдаются набухание эндотелия и базальных мембран
сосудов, отек, геморрагии, дистрофические изменения паренхимы органа. Позже возникают фибриноидный некроз, тромбоз крупных внутриорганных сосудов.
С первых же дней вокруг пересаженной ткани или органа развивается воспалительная инфильтрация, прежде всего вокруг кровеносных сосудов. Инфильтрат состоит из лимфоидных клеток, гистиоцитов, плазмоцитов. Соотношение этих клеток бывает различным в зависимости от вида трансплантируемой ткани и стадии развития отторжения трансплантата. К 10-14-му дню наступает отторжение. После отторжения в ткани происходит процесс рубцевания и эпителизации.
Вторичный трансплантат от того же донора отторгается в среднем в два раза быстрее, без латентного периода, что говорит о развитии специфического трансплантационного иммунитета.
Иммунология реакции отторжения трансплантата.Отторжение трансплантата происходит вследствие тканевой несовместимости донора и реципиента (см. главу 7).
Сущность болезни отставания роста заключается в том, что иммунокомпетентные клетки взрослого донора реагируют на ткани реципиента как на чужеродный для них антигенный материал. Они внедряются в лимфатические органы и селезенку, разрушают лимфоидные и другие клетки и ткани реципиента, вырабатывают против них антитела. В целом этот процесс называется реакцией трансплантата против хозяина (РТПХ). Сила РТПХ зависит от многих причин: 1) природы и количества трансплантируемых клеток; 2) степени генетических различий между донором и реципиентом; 3) состояния иммунитета у реципиента; 4) места трансплантации.
РТПХ у взрослых развивается в случае пересадки аллогенных клеток системы крови пациентам с подавленным иммунитетом, например, при иммунодефиците, химиоили радиотерапии опухолевых заболеваний. РТПХ при пересадке костного мозга для лечения лейкозов может иметь двоякое значение:
2) исход РТПХ в острую или хроническую вторичную болезнь, часто приводящую к гибели реципиента.
Острая вторичная болезнь развивается у взрослых в 50-70% случаев после приживления аллогенных клеток с летальностью до 60%. Хроническая вторичная болезнь отмечается у 40% больных через 3-15 мес после трансплантации как самостоятельная форма или исход острой формы болезни. Клинические проявления I-IV степени выраженности связаны с иммунным поражением кожи, серозных и слизистых оболочек, желудочно-кишечного тракта и паренхиматозных органов.
Пути преодоления тканевой несовместимости (формирование толерантности к трансплантату).Преодоление тканевой несовместимости является важнейшей задачей при пересадке органов и тканей. Существуют неспецифические и специфические методы преодоления тканевой несовместимости.
К неспецифическим методам относятся: 1) подавление иммунологической реактивности организма реципиента с помощью различных иммунодепрессантов (циклоспорин А, цитостатические препараты, антилимфоцитарная сыворотка, облучение γ-лучами и лучами Рентгена); 2) создание иммунологической устойчивости (толерантности) организма-хозяина (реципиента) к трансплантируемым донорским тканям (органам). С этой целью (экспериментально) эмбрионам и новорожденным вводят различные дозы трансплантата, далее во взрослом состоянии - ткани.
Специфическим методом является, например, подбор иммунологически совместимых пар донора и реципиента.
ЦВЕТНАЯ ВКЛЕЙКА

Рис. 5-1.Синдром Марфана (фенотип пробанда И., из архива генетической клиники НИИ медицинской генетики ТНЦ СО РАМН). Основные диагностические признаки: высокий рост, арахнодактилия, гиперподвижность суставов, подвывих хрусталика, аневризма аорты, черепно-лицевые дизморфии: долихоцефалия, узкое лицо

Рис. 5-5.Мукополисахаридоз, тип I (фенотип пробанда И., из архива генетической клиники НИИ медицинской генетики ТНЦ СО РАМН). Основные диагностические признаки: грубые черты лица: макро- и скафоцефалия, гипертелоризм, запавшая переносица, увеличение губ. Короткая шея, воронкообразная грудная клетка. Тугоподвижность суставов коленных, локтевых. Задержка роста, умственная отсталость

Рис. 10-11.Экссудативная реакция в воспаленной коже при пеллагре

Рис. 10-16.Скопление мононуклеаров в ткани мозга при воспалении

Рис.13-12.Гигантская многоядерная клетка инородных тел в полимерном матриксе. Окраска гематоксилином-эозином, ув. 600
Читайте также:

