Механизм ускользания опухоли от иммунологического надзора
Доказано существование нескольких механизмов, с помощью которых мутантная клетка может избежать разрушительного действия иммунной системы.
Пониженная антигенность опухолевых клеток (антигенная изменчивость). Антигенность спонтанных опухолей значительно ниже по сравнению с индуцированными экспериментально. Многие опухоли человека характеризуются отсутствием или пониженным содержанием антигенов, присущих ткани, из которой возникла данная опухоль.
Кроме того, имеет место антигенная изменчивость, в результате которой происходит потеря антигенности или изменение антигенных детерминант. Благодаря этим процессам опухолевые клетки преодолевают иммунный надзор. Антигенная изменчивость была продемонстрирована на лейкозных клетках мышей, экспрессирующих антигены Т-лимфоцитов. При выращивании опухолевых клеток в присутствии сыворотки, содержащей антитела к антигенам Т-лимфоцитов, клетки теряли эти антигены путем сбрасывания или с помощью интернализации мембранных рецепторов.
Эти варианты клеток становились доминирующими в клеточной культуре. После удаления сыворотки антигены Т-лимфоцитов появлялись вновь. Этот эксперимент указывает на то, что исчезновение антигенов не обусловлено антигенной селекцией, а вызвано воздействием специфических антител.
Гистогематические барьеры. Некоторые органы (глаз, нервная система) недоступны эффекторным клеткам иммунной системы и таким образом избегают иммунного надзора.
Иммунорезистентность. Устойчивость злокачественных клеток к действию иммунной системы может развиваться по тем же механизмам, что и бактериальная резистентность к антителам после повторного заражения, — с помощью снижения содержания антигенов на поверхности клетки (антигенной изменчивости) или уменьшения соответствующих участков, связывающих антитела.
Другой механизм — сбрасывание антигенных молекул или цитокиновых рецепторов с поверхности опухолевой клетки в окружающую внеклеточную жидкость, вследствие чего опухолевые клетки становятся относительно иммунорезистентными. Свободные молекулы антигенов и рецепторов можно считать блокирующими факторами. Некоторые полагают, что сбрасывание антигенов ведет к снижению иммуногенности и повышает риск метастазирования.
Васкуляризация. Без васкуляризации опухоль может достигать не более 1—2 мм в диаметре. Folkman и Hochberg предположили, что сосуды опухоли формируются за счет врастания в нее клеток эндотелия самого организма, вследствие чего иммунная система распознает их как свои и не отторгает. Таким образом, защищенные аутоантигенами эндотелия опухоли могут уходить от атаки лимфоцитов и беспрепятственно пролиферировать.
Иммуносупрессия. Установлено, что любая злокачественная опухоль может значительно снижать способность организма отвечать на целый ряд антигенов. В сыворотке крови онкологических больных выявлены иммуносупрессорные факторы, что было подтверждено и in vitro. Механизм иммуносупрессии неизвестен, но некоторые авторы полагают, что он связан с подавлением функции макрофагов. Определенная степень иммуносупрессии обнаруживается практически у всех онкологических больных.
2,4-динитрохлорбензол, 2,4-динитрофторбензол и другие антигены, предназначенные для диагностической кожной пробы, применяли у больных с онкогинекологическими заболеваниями. Величина опухолевой массы коррелировала со снижением ответа на эти тесты, оба фактора связаны с плохим прогнозом.
Некоторые типы опухолей синтезируют вещества, такие как простагландины, которые супрессируют многие звенья иммунного ответа. Роль простагландинов в механизме ускользания опухолей от иммунного надзора неясна.
Выше было указано на неспецифическую супрессию, кроме которой важную роль в регуляции иммунного ответа играют антигенспецифические Т-супрессоры. Увеличение количества опухолеспецифических Т-супрессоров показано во многих экспериментальных системах,особенно у больных на последних стадиях онкологического заболевания. Неизвестно, относится ли это повышение к специфическим супрессорным механизмам или к генерализованной супрессии, опосредованной опухолевыми клетками.
Блокирующие факторы. Опухоли могут избегать иммунного надзора, секретируя факторы, нарушающие защитные свойства организма. Некоторые сывороточные факторы были обнаружены in vitro: блокирующие антитела, комплексы антиген — антитело и избыток растворимого антигена. Блокирующие факторы усиливают рост опухоли по механизму, напоминающему иммунорезистентность. Избыток антител приводит к экранированию антигенов на клеточной поверхности, а избыток свободных антигенов — к анергии лимфоцитов.
Предполагают, что некоторые клеточные факторы иммунной системы могут способствовать усилению роста опухоли. У некоторых животных и в моделях in vivo наблюдается явление, когда небольшое количество сенсибилизированных (опухолеспецифических) лимфоцитов усиливает опухолевый рост, в то время как большее количество тех же самых лимфоцитов тормозит его. Этот факт объясняет чувствительность опухоли к реакциям иммунного ответа на субклинической стадии, когда количество злокачественных клеток невелико. Задача становится еще более сложной, если учесть наличие деблокирующих факторов сыворотки крови, обнаруживаемых у больных в состоянии регрессии или после максимально возможного удаления объема опухолевых масс. Деблокирующий механизм остается неизвестен.
· интоксикация иммуннокомпетентных органов;
· слишком интенсивное размножение;
· фибриновая пленка, мешающая распознаванию опухолевых антигенов;
· антигенное упрощение ® иммунокомпетентной системе нечего распознавать;
· синтез собственных экранирующих антител-колпачков на чуждые антигены;
· увеличение продукции глюкокортикоидов, угнетающих иммунитет, в ответ на гипогликемию.

Рис. 13.9. схема противоопухолевого иммунитета.
Принципы фармакологического торможения опухолевого роста.
Главное направление этой области фармакотерапии - препятствовать повышенной митотической активности опухолевой клетки.
С этой целью применяются цитостатики, или цитотоксичные препараты (допан, циклофосфан, тиотэф, миелосан). Поскольку данная группа препаратов не может действовать избирательно только на опухолевые клетки, в значительной степени страдают и те органы и ткани, в которых изначально велика интенсивность клеточного деления: эпителиальная (что может проявиться в виде плохого заживления ран после операций) и, особенно, кроветворная система (что может проявиться анемией и лейкопенией). Тем более, что данные симптомы возникают и вследствие интоксикации красного костного мозга продуктами жизнедеятельности опухолевых клеток, а также феноменом "ловушек" аминокислот и глюкозы, каковыми являются опухолевые клетки с их неестественно повышенным метаболизмом. Последнее требует коррекции прежде всего в виде стимуляторов эритро- и лейкопоэза.
Поскольку среди условий возникновения опухолей, а также неизбежных звеньев патогенеза присутствует ослабление иммунной системы, лечение опухолей включает назначение иммуностимуляторов в качестве этиотропной и патогенетической терапии. В последние годы предпринимаются успешные попытки лечения лейкокинами - интерлейкинами (ИЛ2, α-интерферон).
БЦЖ (ослабленные туберкулёзные бациллы) применяется для лечения больных с меланомой, саркомой и другими опухолями. Главное воздействие направлено на активацию макрофагов и NK-клеток. Большое количество бактериальных и других иммуностимулирующих агентов используется в активации противоопухолевой защиты.
Пассивная иммунизация моноклональными антителами к опухолеассоциированным антигенам, конъюгированными с токсическими препаратами и др., могут усилить разрушение опухоли.
Из соображений возможности ятрогенного канцерогена, надо также с осторожностью (особенно при предопухолевых состояниях) применять лекарственные препараты, содержащие в составе тяжелые металлы и их аналоги, полициклические ароматические углеводороды (например, стероидные структуры), ароматические амины (например, производные анилина), нитриты и нитраты (возможность образования нитрозаминных групп). Вместе с тем, учитывая высокую интенсивность метаболизма в опухолевых клетках, делаются попытки заблокировать его путем назначения именно тяжелых металлов как блокаторов многих ферментов. Еще издавна делались попытки лечить опухоли препаратами ртути, в частности, сулемой - HgCl2, но из-за высокой токсичности последней метод не получил распространения. Теперь этот подход переживает второе рождение. Менее токсичные органические препараты ртути более избирательно поражают опухолевые клетки благодаря идее "кондуктора" - проводника, который интенсивно поглощается именно опухолевой клеткой и проводит за собой нужную часть молекулы противоопухолевого препарата.
Несмотря на то, что, как говорилось выше, многие стероиды могут служить по крайней мере коканцерогенами и синканцерогенами (особенно половые гормоны при предраковых состояниях в своих органах - мишенях), при гормон-зависимых опухолях половой сферы применяют блокаторы секреции половых гормонов за счет торможения секреции гонадотропных гормонов (леупролид, гозерелин) и блокаторы рецепторов к половым гормонам – антигормоны (антагонист эстрогенов тамоксифен или антагонист андрогенов флутамид). Оригинален метод лечения таких гормон-зависимых опухолей половыми гормонами противоположного пола, что основано на выключении секреции собственных половых гормонов по механизму обратной связи.
Некоторые опухолевые клетки (лимфобласты при остром лимфолейкозе) не могут синтезировать необходимый им метаболит (аспарагинат), поэтому для большего уменьшения поступления этой аминокислоты в опухолевые клетки применяют введения в организм фермента (L-аспарагиназа).
Среди других групп лекарственных препаратов, применяющихся при опухолях, следует отметить еще ряд адаптогенов растительного и животного происхождения, повышающих неспецифическую резистентность организма (апилак, чага, жень-шень), а также другие средства симптоматической терапии - препараты для нормализации белкового и углеводного состава плазмы крови, при необходимости - обезболивающие.
38. – Патология углеводного обмена. Гипогликемические состояния. Нарушения всасывания, синтеза, депонирования и расщепления углеводов.
Углеводы – это альдегидоспирты (кетоспирты) с одной карбонильной и несколькими гидроксильными группами, а также их производные.
В организме углеводы выполняют следующие функции:
1. Источник энергии (обеспечивают около 67% суточного потребления энергии).
2. Резерв энергии (в виде гликогена).
3. Пластическая функция (продукты обмена участвуют в синтезе липидов, аминокислот, мукополисахаридов тканей).
4. Защитная функция (углеводные компоненты иммуноглобулинов участвуют в иммунитете).
Источник углеводов в питании человека - преимущественно пища растительного происхождения. Суточная потребность в углеводах составляет 400-500 г.
Пищевые углеводы в основном представлены крахмалом, сахарозой (преобладают в пище взрослых людей) и лактозой (является основным углеводом в питании детей грудного возраста).
Переваривание углеводов начинается в тонком кишечнике. Кратковременное воздействие амилазы слюны на крахмал пищи существенной роли не играет, так как в просвете желудка кислая среда инактивирует этот фермент.
В тонком кишечнике крахмал под действием амилазы поджелудочной железы, выделяющейся в двенадцатиперстную кишку с панкреатическим соком, расщепляется до мальтозы и изомальтозы. Эти дисахариды, а также лактоза и сахароза, расщепляются специфическими ферментами (гликозидазами), продуцируемыми слюнными железами, поджелудочной железой и щеткообразным эпителием кишечника. Ферменты работают не в просвете кишечника, а на поверхности клеток (это т.н. пристеночное пищеварение). В результате образуются моносахариды (глюкоза, фруктоза, галактоза), которые затем транспортируются через плоский кишечный эпителий в воротную систему крови.
Всасывание моносахаридов из кишечника происходит с помощью специальных белков-переносчиков (транспортеров). Кроме того, глюкоза и галактоза транспортируются в энтероцит путем активного транспорта, зависимого от градиента концентрации ионов Na + . Он обеспечивает перенос глюкозы в энтероцит против ее градиента концентрации. Энергия, необходимая для этого активного транспорта, обеспечивается Nа + /К + -АТФазой. Это обеспечивает всасывание глюкозы и галактозы даже при низкой концентрации в кишечнике.
В отличие от глюкозы и галактозы фруктоза транспортируется системой, не зависящей от ионов Na + . На этом основана возможность лечения синдрома нарушенного всасывания глюкозы и галактозы.

Рис. 14.1. Схема переваривания углеводов [по Е.С. Северину, 2000].
Крахмал частично переваривается в полости рта под действием амилазы слюны, расщепляющей a1-4-гликозидные связи. Амилаза слюны инактивируется в желудке, так как оптимальное значение рН для ее активности составляет 6,7. Панкреатическая амилаза, расщепляющая a1-4-гликозидные связи, продолжает гидролиз крахмала в тонкой кишке, способствуя образованию дисахаридов мальтозы и изомальтозы. Далее мальтоза и изомальтоза вместе с другими пищевыми дисахаридами гидролизуются специфическими глюкозидазами на поверхности клеток кишечника (возможно, и внутри клеток) до соответствующих мономеров.

Рис. 14.2. Схема всасывания углеводов в кишечнике [по Dawn В., Marks, 1996], объяснение в тексте.
Из этих простых сахаров глюкоза по своей распространенности в качестве углеводного компонента пищи намного превосходит все остальные.
Поскольку внутри клеток свободная глюкоза как таковая практически отсутствует, вся поглощаемая тканями глюкоза подвергается следующим основным метаболическим превращениям:
- накопление в виде гликогена;
- окисление через анаэробный гликолиз (путь Эмбдена-Мейергофа) до пирувата и лактата;
- окисление через цикл трикарбоновых кислот (цикл Кребса) или в меньшей степени через пентозный цикл до СО2;
§ превращение в жирные кислоты и накопление в виде триглицеридов;
- высвобождение из клетки в виде свободной глюкозы.
Нарушения всасывания углеводов могут возникать при врожденной недостаточности специфического фермента или транспортной системы, необходимой для обмена определенного сахара. В том и другом случаях сахар накапливается в просвете кишечника, повышая осмолярность кишечного сока и тем дополнительно увеличивая всасываемость воды в просвет кишечника.
Общие признаки синдромов нарушения всасывания углеводов:
§ вздутие живота после приема в пищу определенного сахара,
§ кислая реакция кала (pH + на внешнюю сторону митохондриальной мембраны, а 2 электрона - на внутреннюю, что сопровождается выделением энергии, достаточной для синтеза 3-х молекул АТФ, т.е. всего 30 молекул АТФ за цикл.
Переход ФАД в ФАД Н2 дает укороченную цепь тканевого дыхания с 4-мя молекулами АТФ. Этот процесс, окислительное фосфорилирование сопряженное с дыханием, дает всего 34-е молекулы АТФ. Субстратное фосфорилирование еще 6 молекул АТФ.
Итого 40 молекул АТФ минус 2 молекулы (затраченные на фосфорилирование глюкозы) = 38 молекул АТФ и 6 молекул СО2 на 1-ую молекулу глюкозы. КПД около 44%.

Рис. 14.3. Цикл трикарбоновых кислот (цикл Кребса) [по Т.Т. Березову, Б.Ф. Коровкину, 1998].

Рис. 14.4. Образование 38 молекул АТФ в результате окисления 1 молекулы глюкозы [по Б. Гринстейн, А. Гринстейн, 2000].
Анаэробный гликолизсовпадает до стадии пирувата. Далее вместо окислительного декарбоксилирования пируват подвергается восстановлению, приняв на себя 2Н + от дегидрогенозы НАД Н2 с образованием лактата (молочной кислоты). Катализирует лактатдегидрогеназа. В эритроцитах только анаэробный гликолиз и большое значение в работающих мышцах. Эффективность - 2-е молекулы АТФ на 1-у молекулу глюкозы.
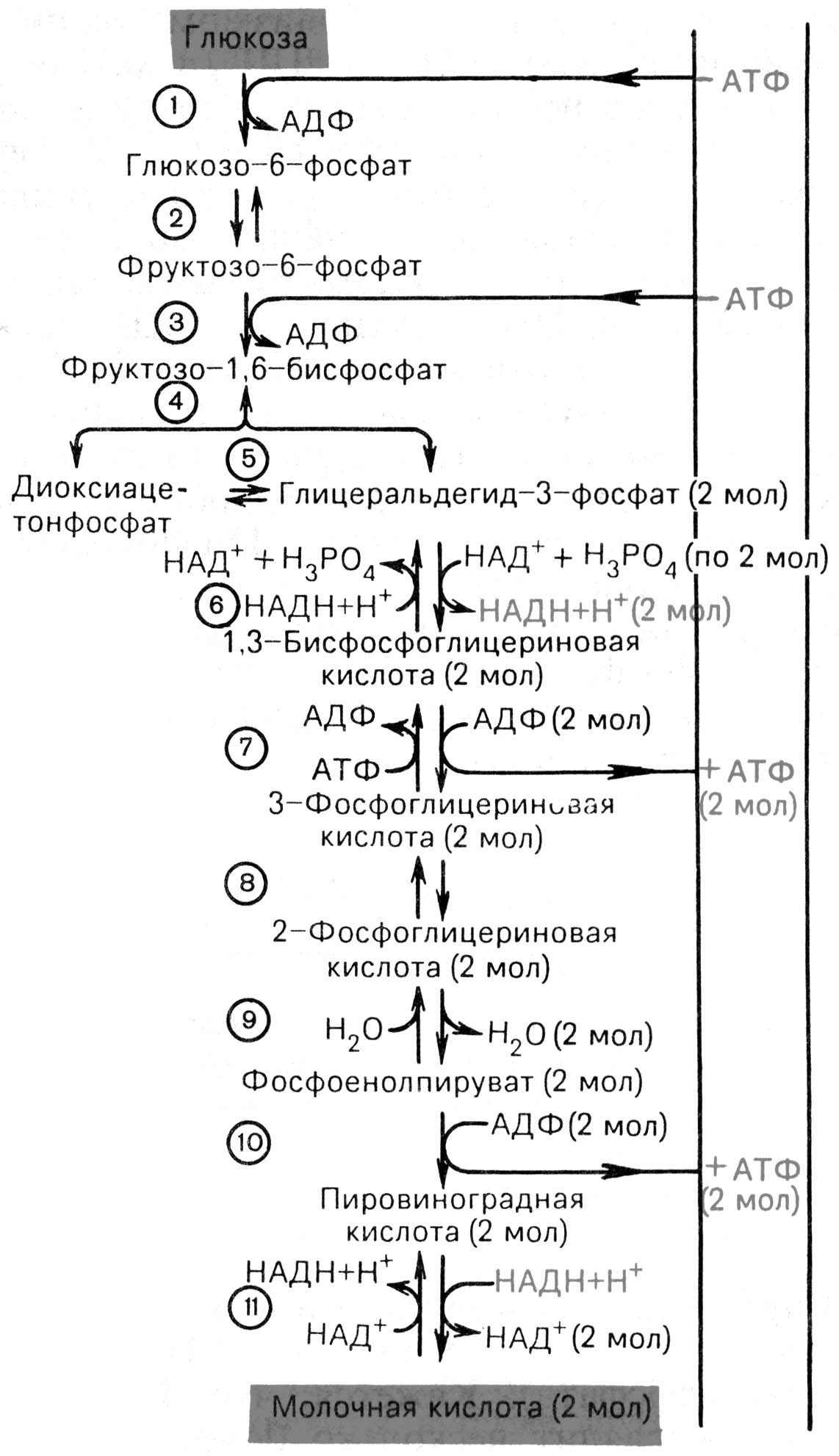
Рис. 14.5. Последовательность реакций гликолиза [по Т.Т. Березову, Б.Ф. Коровкину, 1998]. 1 - гексокиназа; 2 - фосфоглюкоизомераза; 3 - фосфофруктокиназа; 4 - альдолаза; 5 -триозофосфатизомераза; 6 - глицеральдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 - фосфоглицеромутаза; 9 - енолаза; 10 - пируваткиназа; 11 - лактатдегидрогеназа.
Пентозофосфатный путь -окислительная ветвь образует 2 молекулы НАДФ Н2 (необходимый для биосинтеза жирных кислот, холестерина и т.д.). В неокислительной ветви – рибозо-5-фосфат, который используется для синтеза РНК, ДНК, АТФ, КоА, НАД и ФАД.

Рис. 14.6. Схема пентозофосфатного пути метаболизма углеводов [по Т.Т. Березову, Б.Ф. Коровкину, 1998].
Глюконеогенез. Синтез глюкозы из неуглеводных продуктов; в первую очередь лактат и пируват, гликогенные аминокислоты, глицерол и ряд др. соединений. Т.е. предшественниками глюкозы может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла Кребса.
Нарушения депонирования углеводов. После приема пищи большая часть глюкозы, метаболизирующейся в печени, превращается в гликоген, который при первой необходимости служит готовым источником глюкозы. Однако общее содержание его в печени довольно ограничено (в среднем 70-100 г) и способно обеспечить потребности организма в глюкозе в течение не более 8-12 часов.
Реакция образования гликогена зависит от активности гликогенсинтетазы, которая, в свою очередь, находится в обратной в зависимости от внутриклеточного уровня цАМФ.
До сих пор нет ясности в вопросе, опосредована ли активность гликогенсинтетазы главным образом гормонами (например, инсулином, глюкагоном или адреналином - первый ее повышает, два остальных - понижают) или субстратом, т.е. глюкозой.
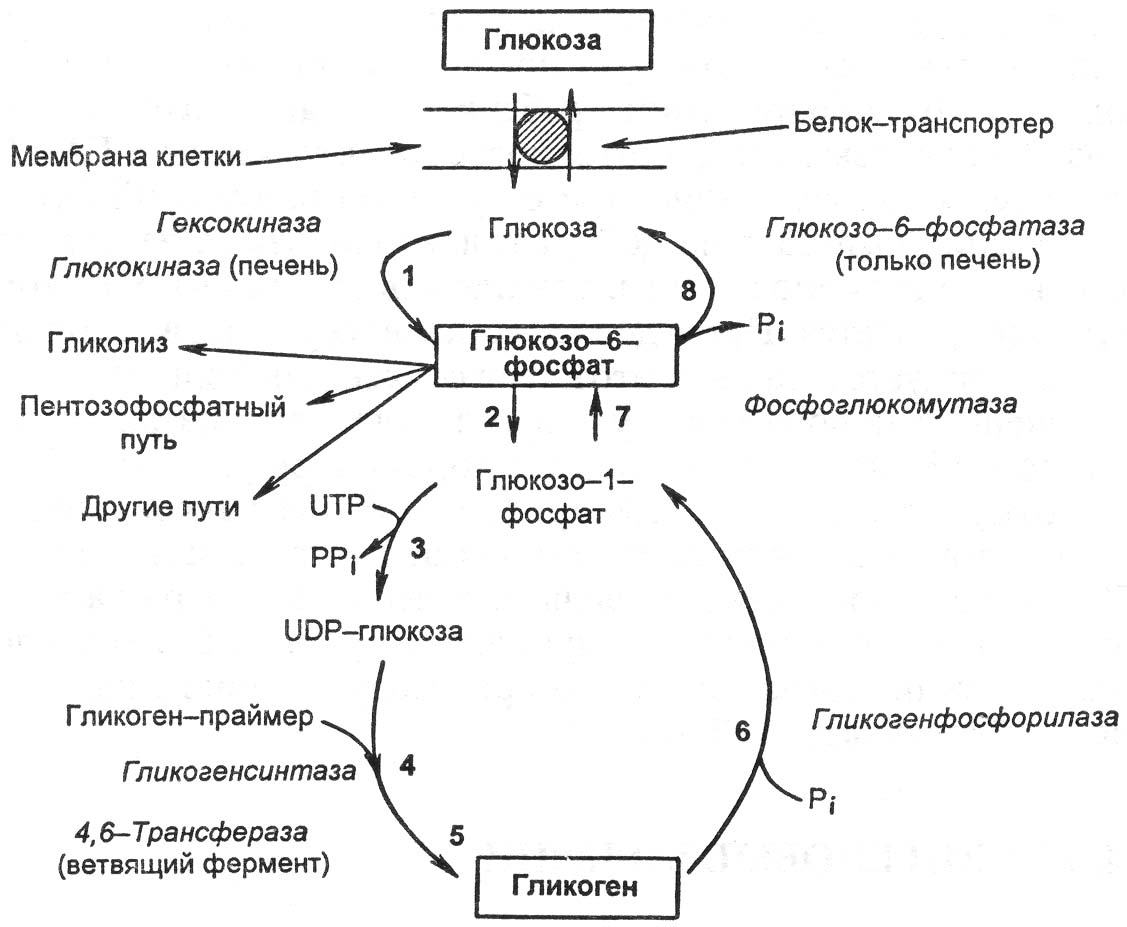
Рис. 14.7. Синтез и распад гликогена [по Е.С. Северину, 2000]. 1, 2, 3, 4, 5 - реакции синтеза гликогена; 6, 7, 8 - реакции распада гликогена.
Снижение синтеза гликогена отмечается при миастении, гипоксии, тогда как повышенный распад наблюдается при охлаждении, перегревании, боли, судорогах, эмоциональном стрессе.
Выделяют т.н. агликогеноз - наследственное заболевание, вызванное дефектом гликогенсинтетазы. В печени почти или полностью отсутствует гликоген, выражена гипогликемия.
Следует сказать, что гликогенолиз контролируется ферментом фосфорилазой, которая, подобно гликогенсинтетазе, существует в неактивной форме и должна активироваться.
Гликогенолиз в печени и мышечной ткани приводит к образованию различных продуктов: в печени - к образованию свободной глюкозы, в мышцах - к высвобождению лактата и пирувата, поскольку глюкозо-6-фосфат не может превращаться в глюкозу, а вступает на гликолитический путь.
Гликогенолиз может рассматриваться как средство адаптации только к острым потребностям организма в глюкозе. В условиях длительного дефицита глюкозы (голодание, нарушение реабсорбции глюкозы в почках, диабет) в ход идет другой, более продолжительный механизм – глюконеогенез. Единственной другой тканью (помимо печени), в которой возможен глюконеогенез и превращение глюкозо-6-фосфата в глюкозу, является корковый слой почек.
Особую группу представляют болезни накопления гликогена, или гликогенозы. В основе этой патологии лежит энзиматический дефект, который проявляется необычной структурой гликогена или его избыточным накоплением в печени, почках, нервной системе. Характерны гепатоспленомегалия, задержка роста. Наиболее часто встречаются 6 типов гликогенозов.
I тип (гликогеноз Гирке) - следствие дефицита глюкозо-6-фосфатазы. Встречается наиболее часто, проявляется гипогликемией, накоплением гликогена в печени и почках, ацидозом (за счет накопления лактата) и гепатоспленомегалией. Больные отличаются малым ростом.
II тип (гликогеноз Помпе) - обусловлен дефектом кислой альфа-1,4-глюкозидазы. Отличается от других гликогенозов тем, что дефектным становится лизосомальный фермент. Проявляется генерализованным накоплением гликогена, поражением печени, почек, нервной системы, гипертрофией миокарда. Болезнь быстро прогрессирует и никакое лечение не в состоянии предотвратить смерть больного.
III тип (лимитдекстриноз, болезнь Кори, Болезнь Форбса) - вызывается дефицитом амило-1,6-гликозидазы. Больным свойственны гепатомегалия, мышечная, слабость, гипогликемия натощак, "кукольное личико". Течение относительно доброкачественное.
IV тип (амилопектиноз, болезнь Андерсена) - редко встречающаяся тяжелая форма гликогенозов. Для нее характерен цирроз печени с желтухой и печеночной недостаточностью, развивающийся в грудном возрасте. Отложение гликогена генерализованное, гликоген структурно изменен с очень длинными наружными ветвями. До сих пор не предложено никакого лечения, кроме симптоматического.
V тип (недостаточность миофосфорилазы, болезнь Мак-Ардла) - вызван дефицитом фосфорилазы, активирующей бета-киназу в мышцах и печени. Интересна история этого заболевания. Первый случай был расценен как психосоматическое нарушение. У больного в покое отсутствовали какие бы то ни было симптомы, но даже после умеренной нагрузки возникали боли в мышцах. Первые проявления болезни возникают обычно в 25-30 лет. Печень не поражается, структура гликогена нормальна, нет смертельных исходов, т.к. гамма-амилаза совместно с амило-1,6-гликозидазой расщепляют гликоген до глюкозы. Единственный признак - миастения, особенно после физической активности.
VI тип (недостаточность печеночного фосфорилазного комплекса, болезнь Херса) - дефект печеночной фосфорилазы, ведущий и избыточному накоплению нормального гликогена в печени. Отмечают гепатомегалию, легкое замедление темпов роста. Прогноз для жизни хороший, умственное развитие нормальное.
Достаточно редко встречается гликогеноз VII типа (дефект мышечной фосфофруктокиназы, болезнь Терье), схожий с болезнью Мак-Ардла и проявляющийся нарастанием уровня лактата и пирувата в крови после мышечной работы.
Этиология и патогенез гипогликемических состояний.
Последнее изменение этой страницы: 2016-06-19; Нарушение авторского права страницы
В связи с вышеизложенным возникает законный вопрос, почему, несмотря на столь мощные антицеллюлярные механизмы, направленные против опухолевой клетки, последняя нередко сохраняется и превращается в источник рака. Происходит это потому, что причины, вызывающие опухоли, приводят к развитию иммунодепрессии. Теперь уже возникшая опухоль сама по себе усиливает возникшую иммунодепрессию. А если есть иммунодепрессия независимо от генеза, т.е. приобретена в процессе жизнедеятельности или носит врожденный характер, то многократно увеличивается риск возникновения опухоли. Например, индуцированная иммунодепрессия вследствие пересадки органов повышает риск развития опухоли в 50-100 раз. Препятствуют уничтожению злокачественного новообразования и способствуют сохранению опухолевых клеток ряд других феноменов: 1) антигенное упрощение (раковые клетки становятся трудно распознаваемыми для ИКС); 2) реверсия антигенов – появление эмбриональных белков-антигенов, к которым в организме имеется врожденная толерантность; 3) появление особых антител (блокирующие антитела), защищающих опухолевые клетки от Т-цитотоксиче-ских лимфоцитов (Т-киллеров).
Несмотря на типовые стандартные реакции иммунной системы (антибластомная резистентность), развивающиеся в организме в ответ на рост и прогрессию новообразований, опухоли могут ускользать из-под влияния иммунного надзора ИКС. К основным путям ускользания относятся (1) разнонаправленные изменения антигенного состава, (2) синтез опухолью иммуносупрессивных факторов, (3) синтез блокирующих факторов, (4) иммуностимуляция, (5) избирательное ускользание опухолевых клеток, (6) способность опухолевых антигенов угнетать через Т-лимфоциты супрессоры Т-цитотоксические лимфоциты.
Опухолевые клетки могут регулировать экспрессию раковых антигенов на поверхность клеток, интенсивность которой может изменяться под действием множества факторов организма (цАМФ, интерферонов, интерлейкинов, различных ростовых факиров, промоторов опухоли некоторые другие), а также маскировать их. Так, например, глиома - опухоль мозговой ткани мо-жет маскировать поверхностно расположенные антигены с помощью гиалуроновой кислоты, что затрудняет эффективный иммунный ответ.
Некоторые опухоли синтезируют растворимые иммуносупрессивные факторы, например простагландины. Так, под влиянием простагландина Е в лимфоцитах повышается уровень циклического аденозинмонофосфата (цАМФ), в результате чего блокируется стимулируемая раковыми антигенами пролиферация Т-лимфоцитов, которые обеспечивают клеточные механизмы противоопухолевого иммунитета.
Опухолевая прогрессия сопровождается появлением новых более агрессивных клонов, приобретающих способность синтезировать новые раковые антигены, которые могут ускользать из-под влияния ИКС, последствием чего является быстрое нарастание массы новообразования до критического значения, когда сама опухоль приобретает способность угнетать активность иммунной системы.
У некоторых пациентов с опухолевым ростом в крови обнаруживаются блокирующие антитела. Блокирующие антитела могут связываться с раковыми антигенами, без последующей активации комплемента и механизма антитело зависимой клеточно опосредуемой цитотоксичности. Блокирующие антитела тормозят отторжение опухоли следующими механизмами: (1) маскировка опухолевых антигенов, (2) образование комплексов АНГ+АНТ, которые не могут быть переработаны антиген презентирующей клеткой, (3) торможение процесса взаимодействия цитотоксических лимфоцитов с опухолью.
Одним из механизмов, регулирующих надежность функции иммунной системы организма, в том числе и у больных опухолевым ростом, является избыточная активность Т-лимфоцитов супрессоров, которые подавляют иммунный ответ в процессе роста злокачественного новообразования. У пациентов с опухолью чрезмерное количество Т-супрессоров образуется под влиянием различных раковых антигенов, экспрессируемых опухолевыми клетками по ходу их прогрессии. Супрессорная функция таких лимфоцитов обеспечивается (1) блокированием остальных типов иммунного ответа, (2) выключением текущего иммунного ответа или (3) модуляцией интенсивности и характера иммунного ответа. Подчеркнем, что повышенное содержание в крови Т-лимфоцитов супрессоров обнаружено в организме раковых больных.
Кроме Т-супрессорных лимфоцитов аналогичное снижение иммунного потенциала у больных с опухолями могут вызывать активированные опухолевым ростом макрофаги. Механизм супрессорного влияния на состояние иммунного потенциала у таких пациентов пока остается неизвестным, однако полагают, что он носит неспецифический характер и является результатом общей депрессии иммунной системы.
1. Выберите правильное утверждение (1). Для обозначения опухоли наиболее часто используют следующие термины:
Несмотря на то, что звенья противоопухолевого иммунологического ответа такие же, как при инфекционных заболеваниях, иммунный ответ при опухолях имеет свои особенности.
Казалось бы, опухоль генотипически и антигенно отличающаяся от организма носителя, с ним несовместимая, должна быть отторгнута (подобно аллотрансплантату) или уничтожена.
Поэтому правомочно допустить, что в организме существуют какие-то изъяны в иммунном надзоре, позволяющие опухолевым клеткам избегать действия эффекторных систем иммунитета и в конечном итоге приводить к смертельному исходу. Существует множество механизмов, с помощью которых опухоль ускользает от иммунного ответа.
Особенности антигенов злокачественных клеток
Опухолевые антигены игнорируются иммунной системой по причинам, которые пока до конца не понятны. Однако одной из главных считается низкая антигенность и поэтому иммуногенность опухолевых клеток, что можно рассматривать как способ защиты новообразования от иммунного подавления.
Другой механизм — недостаточная продукция опухолеспецифических антигенов на клетках — антигенное упрощение, что не позволяет лимфоцитам активироваться и запустить механизмы клеточного иммунитета. В тоже время возможно появление новых антигенов или увеличение концентрации тех, которые в норме имеются в небольшом количестве — антигенное усложнение.
Вариантом усложнения является антигенная реверсия, когда клетки опухоли синтезируют эмбриональные антигены, к которым в организме имеется врожденная толерантность, Неоантигены могут возникнуть в опухолях и вследствие антигенной дивергенции, под которой понимают появление антигенов, характерных для тканей иного гистогенеза (например, антигенов почки в гепатомах).
Наконец, ускользанию клеток опухоли от иммунного надзора способствует появление антител, защищающих раковые клетки от Т-лимфоцитов — феномен блокирования.
Естественный отбор опухолевых клеток
Еще одной из важнейших причин неэффективности иммунного надзора является естественный отбор опухолевых клеток, способных к локальной защите против иммунитета хозяина.
Как известно, в основе отбора и эволюции клеток опухоли, как фактора ее естественной профессии, лежат генетическая нестабильность генома и мутации, а также состояние неспецифического иммунитета хозяина.
Процесс отбора идет по множеству признаков (скорость автономного роста, уровень дифференцировки, антигенные свойства, чувствительность к ростовым факторам, клоногенность, гормонозависимость, метастатическая активность и др.).
Однако к наиболее рано отбираемым признакам относится приобретение свойств, обеспечивающих клетки опухоли способностью противостоять цитотоксическому действию эффекторных клеток иммунитета и/или оказывать иммунодепрессивное влияние на них.
Подобно патогенным микробам и вирусам, обладающим способами защиты против антибактериальных и антивирусных систем организма, генетически лабильная злокачественная клетка в процессе прогрессии также развивает различные механизмы защиты, позволяющие ей выжить во враждебном клеточном окружении. Соответственно опухолевые клетки приобретают селективные преимущества, развивая и используя для своей защиты вполне адекватные и специфические механизмы.
Последствием этой активной защитной реакции опухолевых клеток является быстрое (практически немедленное) подавление цитотоксического действия NK-клеток и Т-лимфоцитов и способности макрофагов и нейтрофилов к кислородному взрыву. Параллельно включается механизм защиты опухолевых клеток непосредственно против продуктов кислородного взрыва активированных макрофагов и нейтрофилов.
Он связан с активацией катаболизма Н2О2 и позволяет опухолевым клеткам выживать в присутствии в 10-100 раз более высоких концентраций перекиси водорода по сравнению с нормальными клетками. Еще один механизм защиты опухолевых клеток против активированных макрофагов, Т- лимфоцитов и NK-клеток связан с FAS-FAS-L. Эта система белка (FAS-L) и его рецептора (FAS) продуцируется опухолевыми клетками и вызывает апоптоз иммунокомпетентных клеток.
Таким образом, селективные преимущества при росте опухолей в организме иммунокомпетентного хозяина имеют клетки:
а) утратившие, или содержащие в меньшем количестве, или имеющие специфические антигены в достаточном количестве, но в менее доступной для распознавания форме (при блокировании антителами);
б) утратившие антигены главного комплекса гистосовместимости (HLA-антигены) I класса, которые необходимы для их распознавания Т-лимфоцитами;
в) обладающие способностью локальной защиты (секреция простагландинов, нейтрализация цитолиза, подавление кислородного взрыва, активация FAS-FAS-L системы) от цитотоксической активности Т-киллеров, NK-клеток, макрофагов и гранулоцитов. Эффективность защиты опухолевых клеток намного повышается на фоне иммунодепрессии организма хозяина.
Сейчас известны лишь некоторые механизмы, определяющие неэффективность защиты организма против опухолевых клеток. По-видимому, приведенные примеры не исчерпывают все возможности защиты опухолевых клеток против иммунитета, но позволяют лучше понять, в чем состоят биологические отличия злокачественной клетки от трансформированной.
В процессе отбора и прогрессии трансформированные клетки перестают быть пассивными мишенями для иммунной системы организма и отбираются, по-видимому, в первую очередь по способности к активной локальной защите.
Приобретение выжившими вариантами опухолевых клеток в процессе такого отбора резистентности к цитотоксическому действию активированных макрофагов и NK-клеток определяет их лучшую выживаемость и соответственно более высокий уровень злокачественности.
Доказано, что чем выше уровень злокачественной (и метастатической) активности опухолевых клеток, тем эффективнее они преодолевают реакции отторжения специфического и неспецифического противоопухолевого иммунитета и тем меньше опухолевых клеток (в абсолютных значениях) будет отторгнуто.
Эти данные обнаруживают наличие важной для иммунотерапии опухолей обратной зависимости между уровнем злокачественности опухолевых клеток и возможностями иммунологического контроля их роста.
Помимо селекции опухолевых клонов имеют значение и другие факторы. Так, вследствие дисбаланса между скоростью развития иммунного ответа и ростом опухоли, последняя быстро увеличивается в размерах. В результате происходит истощение контролирующего влияния на опухоль иммунокомпетентных клеток, и возникает иммунологическая беззащитность организма по отношению к опухоли.
Иммунодефицитные состояния и иммуносупрессия организма
Наконец, ослабленная реактивность иммунной системы у онкологических больных также позволяет злокачественным опухолям ускользать от иммунологического надзора.
Иммунодефицитные состояния и иммуносупрессия организма является основной закономерностью онкогенеза. Как уже указывалось выше, у больных с иммунодефицитом или иммуносупрессией вследствие утраты активности отдельных компонентов систем защиты, опухоли некоторых локализаций возникают чаще, чем в норме.
Происходит это еще и потому, что, независимо от природы, сами этиологические канцерогенные факторы задолго до возникновения опухоли детерминируют и подавляют иммунный ответ организма, а развивающаяся опухоль — потенцирует иммуносупрессию.
Так, многими злокачественными новообразованиями вырабатываются в большом количестве фактор роста бета, простагландины, являющиеся мощными иммуносупрессорами. У онкологических больных отмечена недостаточная продукция активатора иммунных реакций ИЛ-2.
Кроме того, опухоли сами могут секретировать иммуносупрессорные цитокины. Ниже суммированы некоторые особенности канцерогенеза, позволяющие опухоли избежать иммунного надзора.
Основные причины низкой эффективности иммунного ответа на опухоль:
3. Экспрессия на поверхности опухолевой клетки нетипичных подтипов молекул главного комплекса гистосовместимости (HLA-G и HLA-E), которые ингибируют иммунные эффекторы;
4. Дефекты антигенной презентации;
5. Нарушения в микроокружении опухоли (синтез простагландинов, факторов роста);
6. Способность опухоли синтезировать/активировать сулрессорные цитокины (например, ИЛ-10);
9. Отсутствие специфических Т-клеток-предшественников, недостаточное образование клеток памяти;
10. Анергия на поздних стадиях болезни.
Заключая данный раздел, необходимо подчеркнуть, что многочисленные исследования на экспериментальных системах и в клинике создали новую область онкологии — иммунолегию опухолей человека. Считалось, что в первых рядах покорителей рака непременно будут иммунологи. К сожалению, в свете последних событий приходится признать, что вряд ли они там окажутся.
Во взаимоотношении с хозяином опухолевую клетку можно сравнить с паразитом, но при наличии у него дополнительных защитных механизмов, таких, как слабая антигенность, множественные перекрестные реакции с антигенами хозяина, иммуносупрессия и антигенная изменчивость.
В отличие от паразитов, спонтанные опухоли индивидуальны и уникальны Опухоль лишена чувства самосохранения, заставляющего например, хорошо адаптировавшихся паразитов не подвергать опасности жизнь хозяина.
Более того, рак часто наблюдается в позднем возрасте, когда организм не успевает существенно повлиять на развитие иммунной защиты. Тем не менее, есть и положительные факторы. Как ни мала антигенность опухолей, она все-таки есть, и это, вероятно, позволит в будущем проводить специфическую иммунизацию хотя бы против некоторых из них.
Обнадеживает также способность опухолей регрессировать самопроизвольно или после частичного повреждения в результате химиотерапии либо хирургического вмешательства.
Кроме того, достижения современной иммунологии рака позволили выяснить многие вопросы взаимоотношений иммунной системы и опухолей, чем обеспечили внедрение в практическую онкологию иммунодиагностики ряда опухолей, включая иммунофенотипирование лейкозов; открыли перспективы иммунопрофилактики и возможности, пока скромные, иммунотерапии новообразований.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Читайте также:

