Медиана длительности ответа в онкологии

Все пациенты по-разному реагируют на диагноз онкологического заболевания. Многие предпочитают избегать информации, которая может быть неприятной, в то время как другие ищут максимально точные ответы. Никто не может сказать, какая из этих стратегий является более правильной. Тем не менее, одним из частых вопросов онкологических пациентов является вопрос к врачу о предполагаемой продолжительности жизни. В онкологии для предполагаемой оценки продолжительности жизни пациентов используются различные статистические термины, многие из которых непонятны для пациента. В данном материале описаны основные термины, которые используют врачи для определения прогноза при онкологических заболеваниях.
Важно понимать, что ни один врач не может точно ответить пациенту на вопрос о его продолжительности жизни. Срок жизни любого человека зависит от многих факторов, не все из которых связаны с болезнью. Предполагаемая продолжительности жизни онкологического пациента зависит от:
- Вида злокачественной опухоли и её расположения в организме (локализации);
- Стадии заболевания, включая размеры и распространенность опухоли;
- Биологических особенностей опухоли. её агрессивности и скорости роста, а также некоторых генетических особенностей раковых клеток;
- Чувствительности опухоли к проводимому лечению;
- Возраста и общего состояния здоровья пациента.
Для оценки эффективности различных методов лечения применяются статистические методы, которые позволяет оценить выживаемость групп пациентов. Наиболее часто оцениваются следующие показатели выживаемости:
Разновидностью общей выживаемости является относительная выживаемость пациентов, которая является наиболее удобным показателем для оценки выживаемости пациентов пожилого возраста. При оценке этого показателя оценивается соответствие выживаемости пациентов определенного возраста со злокачественным новообразованием с выживаемостью людей схожего возраста, но без наличия онкологического заболевания.
Пример 1: 5-летняя выживаемость пациентов с диагнозом рака шейки матки составляет 68%. Это означает, что 68 пациенток из 100 переживает 5 лет с момента постановки диагноза.
Пример 2: медиана выживаемости пациенток с диагнозом определенной злокачественной опухоли составляет 60 месяцев. Это означает, что 50% пациенток с данным заболеванием переживают 5-летний срок с момента постановки диагноза.
Именно указанные выше показатели используются в клинических исследованиях (подробнее про клинические исследования – здесь) для того, чтобы оценить эффективность различных методов лечения и сделать вывод о целесообразности их применения.
Для графического отображения показателей выживаемости используются специальные графики, на которых изображаются так называемые "Кривые Каплана-Майера" (Рисунок 1).
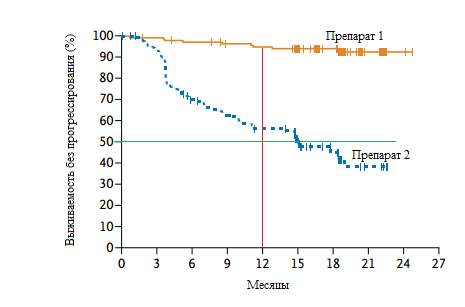
Рисунок 1. Пример кривых Каплана-Мейера по выживаемости без прогрессирования пациентов в одном из исследований. Красной линией обозначена 1-летняя выживаемость без прогрессирования, зеленой - медиана выживаемости без прогрессирования. Из графика видно, что препарат 1 демонстрирует значительные преимущества перед препаратом 2.
Таким образом, предсказать точную продолжительность жизни для отдельного пациента является крайне трудной задачей. Для предположительной оценки выживаемости врачи используют статистические данные, полученные в ходе проведения клинических исследований, в которых участвовало большое количество пациентов с определенными видами и стадиями опухолей. Такие оценки позволяют оценить среднюю выживаемость в больших группах пациентов, однако эту статистику бывает трудно перенести на отдельного пациента. Кроме того, методы лечения злокачественных опухолей постоянно совершенствуются, по этой причине данные такой статистики могут не учитывать все многообразие доступных методов лечения.
К примеру, Ваш врач может сообщить, что он оценивает прогноз течения заболевания как благоприятный. Это означает, что имеющиеся данные указывают на чувствительность опухоли к терапии и высокую вероятность хорошего контроля болезни в течение длительного времени, достижения длительной ремиссии – или даже излечения.
Подводя итоги, следует еще раз подчеркнуть следующие основные моменты:
- Статистика позволяет оценить выживаемость больших групп пациентов, но не позволяет предсказать прогноз течения заболевания и точную продолжительность жизни отдельного пациента;
- Статистика выживаемости может значительно отличаться при различных типах и стадиях опухолевого процесса, возраста пациента и проводимого лечения;
- Показатели общей выживаемости и выживаемости без прогрессирования широко применяются в клинических исследованиях для того, чтобы оценить эффективность изучаемого метода лечения;
- Статистические данные дают врачам полезную информацию для выбора наиболее подходящего метода лечения, но являются лишь одним из факторов, которые необходимо учитывать при выработке плана лечения.
Комбинация бевацизумаба с иринотеканом, фторурацилом и лейковерином для лечения метастатического колоректального рака
The new England journal of medicine, Established in 1812, June 3, 2004; 350(23): 2335–42
Аннотация
Бевацизумаб – моноклональное антитело против васкулярного эндотелиального фактора роста, в комбинации с химиотерапией продемонстрировал многообещающую эффективность в доклинических и клинических исследованиях при лечении метастатического колоректального рака.
Метод
Рандомизированы на группы 813 пациентов с ранее не леченным метастатическим колоректальным раком: 402 пациента в одной группе получали иринотекан, 5-фторурацил болюсно, лейковерин (схема IFL) плюс бевацизумаб (5 мг на 1 кг массы тела каждые 2 нед), 411 пациентов получали IFL плюс плацебо. Первичным критерием оценки была оценка общей выживаемости, вторичным – выживаемость без прогрессирования заболевания, уровень и длительность ответа, безопасность и качество жизни.
Результаты
Медиана выживаемости составила 20,3 мес в группе пациентов, получавших IFL плюс бевацизумаб, в то время как в группе IFL плюс плацебо этот показатель составил лишь 15,6 мес (при соотношении рисков 0,66, p Заключение
Добавление бевацизумаба к схеме терапии, содержащей фторурацил, приводит к статистически значимому и клинически важному улучшению выживаемости у больных метастатическим колоректальным раком.
From Duke University, Durham, N.C. (H.H.); Kaiser Permanente, Vallejo, Calif. (L.F.); Genentech, South San Francisco, Calif. (W.\\\N., S.G., E.H., N.F., G.F., B.R., R.R.); Ocala Oncology, Ocala, Fla. (T.C.); Sarah Cannon Cancer Genter, Nashville (J.H.); Hematology and Onclogy Associates of Northeastern Pennsylvania, Scranton, Pa. (W.H.); Vanderbilt University, Nashville (J.B.); California Pacific Medical Center, San Francisco (A.B.); and the University of California at Los Angeles, Los Angeles (F.K.). Address reprint requests to Dr. Hurwitz at the Department of Medical Oncology and Transplantation, Rm. 3802 Red Zone, Duke South Clinics, Box 3052, duke University Medical Center, Durham, NC 27710, or at hurwi004@mc.duke.edu .
В аскулярный эндотелиальный фактор роста – растворимый гликопротеин, синтезируемый как нормальными, так и неопластическими клетками, являющийся важным регулятором физиологического и патологического ангиогенеза [1]. Результаты доклинических исследований продемонстрировали, что мышиное античеловеческое моноклональное антитело против VEGF может ингибировать рост ксенографтной человеческой опухоли [2], а гуманизированный вариант этого антитела (бевацизумаб/авастин) [3] используется в клинических исследованиях как средство лечения опухолей различного типа. Кроме оказания непосредственного антиангиогенного эффекта, бевацизумаб может также улучшать качество доставки химиотерапии, изменяя кровоснабжение опухоли и снижая парциальное давление в опухоли [4, 5].
В исследовании II фазы добавление бевацизумаба к комбинации фторурацил плюс лейковерин [6] приводило к увеличению уровня ответа, медианы времени до прогрессии заболевания и медианы времени выживаемости.
В ходе исследования III фазы показана эффективность добавления бевацизумаба к комбинации иринотекан, фторурацил, лейковерин (IFL) [7] – произошло увеличение выживаемости среди пациентов с метастатическим колоректальным раком по сравнению с использованием режима химиотерапии IFL плюс плацебо.
Пациенты
Пациенты, вошедшие в исследование были с исторически подтвержденным диагнозом: метастатическая колоректальная карцинома. Другими критериями включения были возраст старше 18 лет, статус заболевания, подтвержденный Восточной кооперативной онкологической группой (ECOG) [8], 0 или 1, ожидаемая продолжительность жизни более 3 мес и подписанное информированное согласие. Кроме того, необходимыми были адекватные гематологическая, печеночная и почечная функции (включая показатель количества белка в моче 500 мг в день). Критериями исключения были проводимая ранее химио- или иммунотерапия (адъювантное использование фторпиримидинов с или без лейковерина или левамизолом менее 12 мес до исследования), получение лучевой терапии за 14 дней до инициации исследования, основная хирургическая операция не позднее чем за 28 дней до инициации исследования, клинически значимое кардиоваскулярное заболевание, определяемый клинический асцит, беременность или лактация, регулярное употребление аспирина (более 325 мг в день) или других нестероидных антиинфламаторных или полных доз антикоагулирующих препаратов и подтвержденные метастазы в ЦНС.
Протокол исследования был единым для всех институтов, принимающих участие в исследовании, соответствовал принципам Хельсинской декларации, принципам GCP и был одобрен местными этическими комитетами.
Дизайн исследования
Пациенты, удовлетворяющие критериям включения, были разделены на группы в соответствии с динамическим алгоритмом рандомизации. Рандомизация проведена в соответствии с центром исследования, с определенным ECOC статусом (0 против 1), местом локализации заболевания (прямая против ободочной кишки), числом сайтов метастазирования (1 против более чем 1). В начале пациентов рандомизировали в соотношении 1:1:1 для получения схемы IFL плюс плацебо, IFL плюс бевацизумаб или фторурацил и лейковерин плюс бевацизумаб (табл. 1), каждая из перечисленных схем была назначена вплоть до прогрессирования заболевания или наступления нежелательного явления, или в течение максимум 96 нед.
Промежуточный анализ проведен в период, когда в исследование были включены уже 300 пациентов, в ходе которого независимым комитетом мониторинга результатов были изучены данные по безопасности схемы IFL плюс бевацизумаб. На основе доступных данных по безопасности, включая количество смертельных исходов в каждой группе, но исключая данные, связанные с ответом опухоли на лечение, независимый комитет сделал заключение о прекращении набора пациентов в группу FL плюс бевацизумаб, и все остальные пациенты, включенные в исследование, были рандомизированы в соотношении 1:1 для лечения или IFL плюс плацебо, или IFL плюс бевацизумаб.
Схемы используемые в начале лечения
Таблица 1. Режимы лечения первой линии терапии*
в течение 4 нед,
курс повторять каждые 6 нед
в течение 4 нед,
курс повторять каждые 6 нед
в течение 6 нед, курс повторять каждые 8 нед
Примечание. * Лечение по схеме фторурацил, лейковерин, бевацизумаб было остановлено после подтверждения безопасности схемы IFL плюс бевацизумаб. Подтверждение поступило после включения в исследование 313 пациентов. Все препараты вводили внутривенно.
Таблица 2. Основные характеристики пациентов*
IFL + плацебо (n=411)
Средний возраст, лет
Австралия или Новая Зеландия
Число мест метастазирования, %
Проведенная ранее терапия, %
Медиана времени метастазирования, мес
Примечание. *Значительных различий в показателях между группами не было. IFL – иринотекан, фторурацил, лейковерин.
Рис. 1. Общее выживание.

Таблица 3. Анализ эффективности*
Уровень 1-летней выживаемости, %
Выживаемость без прогрессирования, мес
Общий уровень ответа, %
Медиана длительности ответа, мес
Примечание.* IFL – иринотекан, фторурацил, лейковерин.
Рис. 2. Выживаемость без прогрессирования.

Таблица 4. Нежелательные явления
IFL+ плацебо (n=397)
Любое нежелательное явление
3-й и 4-й степени
приведшее к госпитализации
вызвавшее отмену лечения
приведшее к смерти
Смертельный исход в течение 60 дней
Лекопения 3-й и 4-й степени тяжести
Диарея 3-й и 4-й степени тяжести
3-я степень тяжести
Тромбоцитарное нежелательное явление
При определении ответа опухоли на лечение и прогрессии использованы критерии оценки ответа для солидных опухолей [9].
При прогрессировании заболевания во время лечения и установленной связи с лечением с согласия пациентов могла быть назначена вторая линия терапии. Такие пациенты, получавшие ранее бевацизумаб, продолжали прием бевацизумаба в процессе лечения второй линии. Не было допущено пересечения в группе IFL плюс плацебо. Пациенты, принимавшие бевацизумаб в процессе лечения и не имевшие признаков прогрессирования в течение 96-недельного периода, могли продолжать получать бевацизумаб в отдельный дополнительный период исследования.
Пациентам из группы, получавшей бевацизумаб с подтвержденным полным ответом при условии ненаступления нежелательных явлений со стороны химиотерапии могли отменить химиотерапию и назначить монотерапию бевацизумабом.
Бевацизумаб (или плацебо) назначали в комплексе с химиотерапией. Дозы бевацизумаба и химиотерапии пересчитывались, если в процессе лечения происходило изменение массы тела пациента по меньшей мере на 10%.
Пациентам со связанными с терапией побочными эффектами производили модификацию стандартных доз иринотекана и фторурацила в соответствии с инструкциями к этим препаратам [10]. Дозы лейковерина и бевацизумаба не изменяли. Анализ выживаемости и адекватности лечения для всех пациентов производили в случае наступления смертельного исхода или окончания лечения.
Оценка результатов
После проведения оценки пациентов при включении в исследование оценку статуса опухоли проводили каждые 6 нед до наступления 24-й недели лечения, и каждые 12 нед в остальное время лечения. Все случаи наступления полного или частичного ответа [9] были подтверждены спустя по крайней мере 4 нед после первого обнаружения.
Оценку безопасности проводили на основании отчетов о нежелательных явлениях, результатах лабораторных тестов. Все нежелательные явления были категоризированы в соответствии с общими критериями токсичности Национального института рака, версия 2, по которым степень тяжести 1 определяется как слабое нежелательное явление, степень 2 соответствует средней степени токсичности, степень тяжести 3 – это серьезное нежелательное явление, а степень токсичности 4 обозначает нежелательное явление, связанное с риском для жизни пациента.
Все зарегистрированные нежелательные явления, связанные с приемом бевацизумаба, – гипертензия, тромбоз (степени тяжести 3 и 4), протеинурия, а также диарея (степени 3 и 4) были оценены лабораторными методами в сравнении с исходными показателями.
Статистический анализ
Не было допущено перекрещивания данных по разным группам пациентов. Для пациентов, которые были живы к моменту проведения анализа, показатель выживаемости оценен на момент последнего визита к врачу. Выживаемость без прогрессирования определена как время от рандомизации до прогрессирования или смертельного исхода, смерть во время исследования определяли как наступление смертельного исхода в течение 30 дней после последней дозы бевацизумаба или химиотерапии. Для пациентов без прогрессирования заболевания к концу лечения показатель времени без прогрессирования определяли на момент последней оценки статуса опухоли или на день 0, если больше оценки статуса опухоли не производили. Пациенты без соответствующих результатов наблюдения характеризовались как не ответившие на лечение.
Исследование было проведено Genentech при сотрудничестве с исследователями. Genentech собирал и анализировал результаты. Решение опубликовать результаты было выражено всеми участвующими исследователями. Статья написана доктором Hurwitz.
Результаты
Характеристика пациентов
В период с сентября 2000 г. по май 2002 г. 923 пациента были рандомизированы в 164 центрах США, Австралии и Новой Зеландии. После того как 313 пациентов были распределены в одну из трех групп – 100 пациентов в группу для получения IFL плюс плацебо, 103 – IFL плюс бевацизумаб и 110 – в группу для лечения фторурацилом, лейковерином и бевацизумабом – набор пациентов в последнюю группу был остановлен (результаты лечения в этой группе не доложены в данной публикации). Данное действие совершено в соответствии с проведенным по протоколу промежуточным анализом данных безопасности режима IFL плюс бевацизумаб. При проведении промежуточного анализа были оценены результаты лечения 411 пациентов из группы лечения IFL плюс плацебо и 402 пациента из группы IFL плюс бевацизумаб. В табл. 2 представлены основные характеристики пациентов, включенных в исследование. Характеристики пациентов из двух групп сходны.
Лечение
Медиана длительности терапии составила 27,6 мес в группе IFL плюс плацебо и 40,4 мес в группе, принимавшей IFL плюс бевацизумаб. Уровень планируемой дозы иринотекана в обеих группах был сходен (78% в группе IFL плюс плацебо и 73% в группе IFL плюс бевацизумаб). К апрелю 2003 г. 33 пациента из группы IFL плюс плацебо и 71 пациент из группы IFL плюс бевацизумаб по-прежнему принимали запланированные в начале исследования дозы терапии.
В обеих группах приблизительно 50% пациентов получали некоторые формы терапии второй линии: 25% всех пациентов получили оксалиплатин, менее 2% больным проведена операция по удалению метастазов.
Эффективность
Медиана времени общей выживаемости в первичной точке оценки была выше у пациентов, рандомизированных в группу IFL плюс бевацизумаб, чем у пациентов из группы IFL плюс плацебо, – 20,3 мес по сравнению с 15,6 мес, с определенным соотношением рисков 0,66; p
Литература
1. FerraraN, Gerber HP, LeCouter J. Nat Med 2003; 9: 669–76.
2. Kim KJ, Li B, Winer J et al. Nature 1993; 362: 841 4.
3. Presta LG, Chen H, O'Connor SJ et al. Cancer Res 1997; 57: 4593 9.
4. Jain Rk. Nat Med 2001; 7: 987–9.
5. Willett CG, Boucher Y, di Tomaso E et al. Mat Med 2004; 10: 145–7.
6. Kabbinavar F, Hurwitz H, Fehrenbacher L et al. J Clin Oncol 2003; 21: 60–5.
7. Saltz LB, Cox JV, Blanke C et al. N engl J Med 2000; 343: 905–14.
8. Oken MM, Creech RH, Tormey DC et al. Am J Clin Oncol 1982; 5: 649–55.
9. Therasse P, Arbuck SG, Eisenhauer EA et al. J Natl Cancer Inst 2000; 92: 205 16.
10. CPT-11 (Camptosar). Kalamazo, Mich.: Pharmacia & Upjohn, 2002 (package insert).
Аннотация научной статьи по клинической медицине, автор научной работы — Gianoukakis A.G., Dutcus C.E., Batty N., Guo M., Baig M.
В статье представлены новые данные о длительности ответа на терапию ленватинибом у пациентов с радиойодрефрактерным дифференцированным раком щитовидной железы (РР ДРЩЖ). Длительность ответа не оценивалась в рамках первичного анализа, поэтому новые данные позволяют скорректировать выводы, сделанные в рамках последнего. В многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование III фазы были включены пациенты в возрасте ≥18 лет с гистологически подтвержденным РР ДРЩЖ и радиологическими признаками прогрессирования заболевания в течение последних 13 мес, которые оценивались 2 независимыми экспертами. Участники были рандомизированы в соотношении 2:1 на 2 группы: принимавшие ленватиниб перорально в дозе 24 мг/сут и принимавшие плацебо. В качестве главных критериев эффективности лечения оценивали длительность ответа и выживаемость без прогрессирования (ВБП). Среди пациентов группы ленватиниба , у которых наблюдался полный или частичный ответ на терапию (частота объективного ответа 60,2 %; 95 % доверительный интервал (ДИ) 54,2–66,1), медиана длительности ответа составила 30 мес (95 % ДИ 18,4–36,7), данные по подгруппам в целом были схожи. Длительность ответа была меньше у пациентов с тяжелым течением заболевания и с метастазами в головной мозг и печень. Уточненная медиана ВБП у пациентов, принимавших ленватиниб , была выше, чем у пациентов, принимавших плацебо (19,4 мес против 3,7 мес; отношение рисков (ОР) 0,24; 99 % ДИ 0,17–0,35; номинальное значение р ленватинибом , медиана ВБП составила 33,1 мес (95 % ДИ 27,8–44,6), у пациентов, не ответивших на терапию, – 7,9 мес (95 % ДИ 5,8–10,7). Большая длительность ответа на терапию ленватинибом (30,0 мес), наблюдавшаяся у пациентов с полным или частичным ответом (60,2 %), свидетельствует о том, что у них возможен длительный, стабильный и клинически значимый терапевтический ответ. Кроме того, у таких пациентов зафиксирована высокая ВБП (33,1 мес).
Похожие темы научных работ по клинической медицине , автор научной работы — Gianoukakis A.G., Dutcus C.E., Batty N., Guo M., Baig M.
Prolonged duration of response in lenvatinib responders with thyroid cancer (Russian translation)
We present an updated analysis of lenvatinib in radioiodine-refractory differentiated thyroid cancer (RR-DTC) with new duration of response (DOR) data unavailable for the primary analysis. In this randomized, double-blind, multicenter, placebo-controlled phase 3 study, patients ≥18 years old with measurable, pathologically confirmed RR-DTC with independent radiologic confirmation of disease progression within the previous 13 months were randomized 2:1 to oral lenvatinib 24 mg/day or placebo. The main outcome measures for this analysis are DOR and progression-free survival (PFS). The median DOR for all lenvatinib responders (patients with complete or partial responses; objective response rate: 60.2 %; 95 % confidence interval (CI) 54.2–66.1) was 30.0 months (95 % CI 18.4–36.7) and was generally similar across subgroups. DOR was shorter in patients with greater disease burden and with brain and liver metastases. Updated median PFS was longer in the overall lenvatinib group vs placebo (19.4 vs 3.7 months; hazard ratio (HR) 0.24; 99 % CI 0.17–0.35; nominal P lenvatinib responders, median PFS was 33.1 months (95 % CI 27.8–44.6) vs 7.9 months (95 % CI 5.8–10.7) in nonresponders. The median DOR of 30.0 months seen with patients who achieved complete or partial responses with lenvatinib (60.2 %) demonstrates that lenvatinib responders can have prolonged, durable and clinically meaningful responses. Prolonged PFS (33.1 months) was also observed in these lenvatinib responders.
Увеличенная длительность ответа на терапию ленватинибом у пациентов с раком щитовидной железы
A.G. Gianoukakis1' 2, C.E. Dutcus3, N. Batty3, M. Guo3, M. Baig3
1Los Angeles Biomedical Research Institute and Division of Endocrinology and Metabolism, Department of Medicine at Harbor-UCLA
Medical Center; Torrance, California, USA; 2David Geffen School of Medicine, University of California — Los Angeles; Los Angeles, California, USA; 3Eisai Inc.; Woodcliff Lake, New Jersey, USA
Контакты: Andrew Gianoukakis agianoukakis@mednet.ucla.edu
В статье представлены новые данные о длительности ответа на терапию ленватинибом у пациентов с радиойодрефрактерным дифференцированным раком щитовидной железы (РР ДРЩЖ). Длительность ответа не оценивалась в рамках первичного анализа, поэтому новые данные позволяют скорректировать выводы, сделанные в рамках последнего. В многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование IIIфазы были включены пациенты в возрасте >18лет с гистологически подтвержденным РР ДРЩЖ и радиологическими признаками прогрессирования заболевания в течение последних 13 мес, которые оценивались 2 независимыми экспертами. Участники были рандомизированы в соотношении 2:1 на 2 группы: принимавшие ленватиниб перорально в дозе 24 мг/сут и принимавшие плацебо. В качестве главных критериев эффективности лечения оценивали длительность ответа и выживаемость без прогрессирования (ВБП). Среди пациентов группы ленватиниба, у которых наблюдался полный или частичный ответ на терапию (частота объективного ответа 60,2 %; 95 % доверительный интервал (ДИ) 54,2—66,1), медиана длительности ответа составила 30 мес (95 % ДИ 18,4—36,7), данные по подгруппам в целом были схожи. Длительность ответа была меньше у пациентов с тяжелым течением заболевания и с метастазами в головной мозг и печень. Уточненная медиана ВБП у пациентов, принимавших ленватиниб, была выше, чем у пациентов, принимавших плацебо (19,4 мес против 3,7 мес; отношение рисков (ОР) 0,24; 99 % ДИ 0,17—0,35; номинальное значение р '8 years old with measurable, pathologically confirmed RR-DTC with independent radiologic confirmation of disease progression within the previous '3 months were randomized 2:' to oral lenvatinib 24 mg/day or placebo. The main outcome measures for this analysis are DOR and progression-free survival (PFS). The median DOR for all lenvatinib responders (patients with complete or partial responses; objective response rate: 60.2 %; 95 % confidence interval (CI) 54.2—66.') was 30.0 months (95 % CI '8.4—36.7) and was generally similar across subgroups. DOR was shorter in patients with greater disease burden and with brain and liver metastases. Updated median PFS was
'Публикуется на русском языке с разрешения авторов. Оригинал: Gianoukakis A.G., Dutcus C.E., Batty N. et al. Prolonged duration of response in lenvatinib responders with thyroid cancer. Endocr Relat Cancer 2018;25(6):699-704. DOI: 10.1530/ERC-18-0049. PMID: 29752332.
longer in the overall lenvatinib group vs placebo (19.4 vs 3.7 months; hazard ratio (HR) 0.24; 99 % CI 0.17—0.35; nominal P 18 лет с гистологически подтвержденным диагнозом РР ДРЩЖ и радиологическими признаками прогресси-рования заболевания в течение последних 13 мес, которые оценивались 2 независимыми экспертами. Допускалось включение пациентов, ранее получивших не более 1 курса терапии ИТК. Участники исследования были рандомизированы в соотношении 2:1 на 2 группы: принимавшие ленватиниб перорально (в дозе 24 мг/сут) и принимавшие плацебо. Прием препарата/плацебо продолжался до появления признаков прогрессирова-ния заболевания, развития серьезных токсических реакций или отзыва согласия на участие в исследовании. Сбор данных для первичного анализа был завершен 15 ноября 2013 г., после чего началась открытая фаза исследования, во время которой пациенты, ранее получавшие ленватиниб, могли продолжить его прием, а пациенты группы плацебо при прогрессировании заболевания могли начать терапию ленватинибом. Те пациенты группы плацебо, которые отказались от лечения ленватинибом в открытой фазе исследования (n = 22), также находились под наблюдением для сбора данных об их выживаемости. Все пациенты дали письменное информированное согласие на участие в исследовании. Протокол исследования был одобрен экспертными советами участвующих в исследовании
учреждений. Все процедуры проводились в соответствии с Хельсинкской декларацией и местным законодательством.
Анализ эффективности. Сбор данных для уточняющего анализа был завершен 1 сентября 2016 г. Оценку опухолевого процесса проводили ученые, задействованные в данном клиническом исследовании. Пациентами, ответившими на терапию, считали тех, у кого наблюдался полный или частичный ответ в соответствии с критериями оценки ответа солидных опухолей (версия 1.1) (Response Evaluation Criteria in Solid Tumors v1.1.). Длительность ответа определяли в целом у пациентов, у которых наблюдался полный или частичный ответ на терапию ленватинибом, а также у пациентов различных подгрупп, выделенных в зависимости от возраста, пола, подтипа опухоли, исходной тяжести заболевания, исходного общего состояния по шкале ECOG (Eastern Cooperative Oncology Group, Восточная объединенная онкологическая группа), локализации метастазов и наличия предшествующей терапии ингибиторами VEGF. В качестве конечных точек для оценки эффективности принимались частота объективного ответа, частота достижения контроля над заболеванием и частота клинической эффективности. Частота объективного ответа — доля пациентов, у которых наблюдался полный или частичный ответ на терапию. Частота достижения контроля над заболеванием — доля пациентов, у которых зафиксирован полный или частичный ответ на терапию либо стабилизация заболевания (наблюдаемая через 7 нед и более от 1-го дня открытой фазы исследования). Частота клинической эффективности — доля пациентов, у которых зафиксирован полный или частичный ответ на терапию либо стабилизация заболевания на срок > 23 нед.
В исследовании SELECT первичной конечной точкой являлась ВБП, которая рассчитывалась для всех участников, независимо от наличия ответа на терапию. ВБП определяли как время с момента рандомизации до подтвержденного прогрессирования опухоли или смерти пациента. Медиану ВБП рассчитывали методом Каплана—Майера, а 95 % ДИ — обобщенным методом Брукмайера и Кроули. Для расчета ОР использовали регрессионную модель Кокса со стратификацией пациентов в зависимости от факторов, учитываемых при рандомизации. При оценке общей ВБП рассчитывали ОР для пациентов, принимавших ленватиниб, и пациентов группы плацебо, а при анализе ответа на терапию — для пациентов, ответивших и не ответивших на терапию.
Медиана длительности ответа 30 мес. Результаты обновленного анализа указывают на то, что у пациентов с полным или частичным ответом на терапию ленватинибом данный ответ мог быть длительным
и стабильным. Медиана длительности ответа у всех пациентов, ответивших на терапию ленватинибом, составила 30 мес (95 % ДИ 18,4-36,7) (табл. 1). Подгруппы почти не отличались по медиане длительности ответа, но наблюдалась тенденция к ее уменьшению у пациентов с более тяжелым течением заболевания (при размере опухоли 92 мм — 15,7 мес), а также у пациентов с метастазами в печень (при наличии метастазов — 15,7 мес, при отсутствии — 30,5 мес) и головной мозг (при наличии метастазов — 9,3 мес, при отсутствии — 30,5 мес). Подгруппы пациентов, ранее получавших и не получавших лечение ингибиторами VEGF, не различались по медиане длительности ответа (29,9 и 30 мес соответственно).
Скорректированные данные о выживаемости без про-грессирования. В исследовании SELECT 261 пациент (125 мужчин и 136 женщин) получал ленватиниб
Таблица 1. Медиана длительности ответа у пациентов, получавших терапию ленватинибом и ответивших на лечение, и по подгруппам Table 1. Median duration of response for the lenvatinib treatment group in all responders and by subgroup
Читайте также:

