Mcf 7 рак молочной железы
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: JLD VG HV. Выполняли эксперименты: HV VG JLD. Проанализированы данные: HV VG JLD FG. Написал документ: HV VG JLD FG. Выполнены in vivo эксперименты и статистический анализ: HV JLD.
Муцин MUC5B имеет критическую защитную функцию в нормальных легких, слюнных железах, пищеводе и желчном пузыре, и, как сообщается, аберрантно выражается в раке молочной железы, второй ведущей причиной смертей от рака среди женщин во всем мире. Чтобы лучше понять влияние MUC5B на патогенез рака, просветную линию клеток MCF7 рака молочной железы человека трансфицировали вектором, кодирующим рекомбинантный мини-муцин MUC5B, и затем заражали вирусом для доставки короткой шпилечной РНК, чтобы сбить мини- муцин. Пролиферативные и инвазивные свойства в Matrigel субклонов и субпопуляций MCF7 оценивали in vitro. Модель ксенотрансплантата была установлена путем подкожной инокуляции клонов MCF7 и субпопуляций у мышей SCID. Измеряли рост опухоли, а опухоли и метастазы оценивали гистологическим и иммунологическим анализом. Мини-муцин MUC5B способствовал пролиферации и инвазии клеток MCF7 in vitro. Эксперименты ксенотрансплантата показали, что мини-муцин способствует росту опухоли и распространению клеток MCF7. В заключение, экспрессия MUC5B связана с агрессивным поведением MCF7 клеток рака молочной железы. Это исследование показывает, что MUC5B может представлять собой хорошую мишень для замедления роста опухоли и метастазов.
Муцины представляют собой высокомолекулярные O-гликозилированные белки, присутствующие на поверхности большинства эпителиальных клеток. Человеческие муцины классифицируются структурно в два семейства: связанные с мембраной муцины (MUC1, MUC3A / B, MUC4, MUC12, MUC13, MUC16 и MUC17) и секретируемые или гелеобразующие / полимеризующиеся муцины (MUC2, MUC5AC, MUC5B, MUC6 и MUC19) [1] — [3]. Секретируемые муцины включают амино- и карбокси-концевые области, которые разделяют сходные домены с коэффициентом про-фон Виллебранда. Эти муцины полимеризуются через эти области с образованием длинных полимеров, которые секретируются в просвете многих органов. Центральная часть муцинов содержит большие области, обогащенные гидроксиаминокислотами и пролинами (Ser / Thr / Pro), которые широко замещены O-гликанами. Эти последовательности Ser / Thr / Pro различаются по размеру и последовательно между муцинами, не сохраняются между видами и обычно организованы в тандемных повторах (TR). Во многих полимеризующихся муцинах эти тандемно повторяющиеся последовательности связаны или прерываются голой и гидрофобной областью, богатой остатками цистеина и называемой CYS-доменом [4].
Мы широко охарактеризовали структуру гена MUC5B человека [5] — [7]. Центральная часть MUC5B состоит из трех чередующихся поддоменов: (i) субдомен по имени R, найденный пять раз и выполненный из повторений нерегулярного повторения 29 аминокислот (aa), богатых Ser, Thr и Pro; (ii) сохраняющийся субдомен 111aa, называемый доменом R-конца, и найденный четыре раза; и (iii) высококонсервативный домен, названный CYS-доменом [4], который составляет около 110 а.о. и обнаружен семь раз в белке MUC5B. Переменный домен CYS / R-домен / R-конец создает большую составную повторную единицу 528 aa [6].
Рак молочной железы является второй ведущей причиной смертей от рака у женщин во всем мире [8]. Мюцин MUC1, связанный с мембраной, является наиболее изученным муцином при раке молочной железы [9] и является наиболее широко изученным муцином для разработки терапии для лечения рака молочной железы [8]. Среди четырех полимеризующихся муцинов MUC2, MUC5B, MUC5AC и MUC6, чья измененная экспрессия была зарегистрирована в тканях рака молочной железы, роль MUC5B плохо документирована. Только несколько исследований были сосредоточены на MUC5B. Муцин был обнаружен иммуногистохимией в первичных опухолях молочной железы (81%) и в образцах нормального появляющегося грудного эпителия, прилегающих к раковым клеткам (42,1%), тогда как MUC5B не был обнаружен в нормальных контрольных образцах молочной железы [10]. MUC5B-мРНК-транскрипты были обнаружены в аспиратах костного мозга 9/46 пациентов (19,5%), которые подверглись первичной резекции опухоли [11], но не в 36 образцах образцов нормальной периферической крови, что указывает на то, что MUC5B может быть специфическим маркером с высокой специфичностью ( 100%) для диагностики распространения рака молочной железы [10], [11]. Чтобы проанализировать роль MUC5B в опухолегенезе молочной железы, мы трансфицировали линию клеток опухоли молочной железы MCF7 [12] с помощью плазмиды, кодирующей муцин MIN-MUC5B, сделанный из большой составной единицы MUC5B со многими O-гликозилированными сайтами и окруженный двумя доменами CYS , Мы обнаружили, что мини-муцин MUC5B способствует клеточной пролиферации и in vitro инвазии опухолевых клеток рака молочной железы. Используя модель мышиной иммунодефицитной мыши, мы показываем, что MUC5B способствует росту опухоли и метастазированию. Эти данные свидетельствуют о том, что MUC5B представляет собой хорошую терапевтическую мишень для замедления роста опухоли и распространения рака молочной железы.
(A) Схематическое представление управляющих векторов Ires-Luc и Mini5B-Luc. Вставка, кодирующая Mini5B, была выполнена с помощью сигнальной последовательности, 11 TR 29 aa, одного R-конца домена 111 aa и двух доменов CYS 110 aa. (B) Используя анализ активности люциферазы, были получены четыре стабильных клона, экспрессирующих трансген Ires-Luc (клоны B2, C5, C7 и C10) и два стабильных клона, экспрессирующих трансген Mini5B-Luc (клоны A3 и D6). (C) экспрессию мРНК MUC5B изучали с помощью qRT-PCR (TaqMan) в линии родительских клеток MCF7 (белая коробка), в клонировании IRE-Luc (MCF7) и в клон Mini5B-Luc (черный ящик). Уровни экспрессии были нормированы на уровни мРНК 18S и показаны как x-fold относительно нормализованной экспрессии гена MUC5B в родительских клетках MCF7. Относительные количества генов-мишеней рассчитывали с использованием метода ΔΔCt. Значения — это среднее ± стандартное отклонение от четырех до шести независимых образцов. (D) MUC5B иммунофлюоресцентный анализ родительских клеток MCF7, клоны Ires-Luc и Mini5B-Luc. Mini5B был секретирован на клеточной поверхности клонов Mini5B-Luc. Ядра были противопоставлены йодидом пропидия. Шкала шкалы 50 мкм. (E) Выражение Mini5B оценивали с помощью RT-PCR. Продукт ПЦР 159 п.о. был обнаружен только в клон Mini5B-Luc. (F) Вестерн-блот-анализ лизатов из клонов Ires-Luc, клонов Mini5B-Luc и субпопуляции Mini5B-Luc CYS shRNA. (G) Было определено количественно ингибирование продукции Mini5B, обнаруженное путем Вестерн-блоттинга. Производство Mini5B клона Mini5B-Luc было установлено на уровне 100, а производство Ires-Luc было установлено на уровне 0.
Клеточная линия MCF7 рака молочной железы человека была приобретена в Американской коллекции типовых культур (ATCC HTB22, полученной из аденокарциномы молочной железы человека). Клетки поддерживали в минимальной существенной среде (MEM) (технологии Invitrogen / Life, Villebon-sur-Yvette, Франция), дополненной 2 мМ l-глутамина, 1,5 г / л бикарбоната натрия, 0,1 мМ несущественного аа, 1 мМ пирувата натрия, 0,01 мг / мл бычьего инсулина и 10% фетальной бычьей сыворотки (Thermo Scientific) при 37 ° С в увлажненной атмосфере с 5% СО2.
(A) Кривые роста клонов Mini5B-Luc и Ires-Luc. Данные выражаются как среднее ± SEM. Кривая представляет собой три эксперимента. Для двух клонов было рассчитано удвоение времени. (B) Инвазивные проценты клонов Ires-Luc и Mini5B-Luc и популяции Mini5B-Luc KD. Данные выражаются как среднее ± SEM. Диаграмма представляет собой два эксперимента. (C) Иллюстрация окклюзионных клеток, окрашенных толуидиновым синим. Шкала шкалы 50 мкм.
IRES-Luc (отмеченная в дальнейшем Ires-Luc) кассета, фланкированная двумя сайтами рестрикции EcoRI, была получена путем двухступенчатой ПЦР-амплификации и субклонирована в вектор pCR4 (Invitrogen) с использованием pMG (InvivoGen, Тулуза, Франция) и pGL3 Basic ( Promega, Leiden, The Netherlands) в качестве шаблонов. Люк-последовательность 1,7 т.п.н. амплифицировали с использованием двух олигонуклеотидных последовательностей 5′-AGATCTTACGCGTGCTAGCC-3 ‘(вперед) и 5′-GGATCCGACTCTAGAATTACAC-3′ (обратный), вводящих соответственно BglII и сайт рестрикции BamHI (подчеркнутый). Последовательность Ires 0,7 т.п.н. амплифицировали с использованием двух олигонуклеотидных последовательностей 5’-GAATTCGAACGTAGCTCTAG-3 ‘(вперед) и 5′-AGATCTCCTACCGGTGATCTC-3’ (обратного), введя соответственно сайт рестрикции EcoRI и BglII (подчеркнутый). Использовался пустой эукариотический вектор pcMG и pcMG, несущий последовательность mini5B [13]. Плазмида pcMG является производным плазмиды pcDNA3.1, но промотор был заменен композиционным промотором EF1α-HTLV из pMG и содержит небольшой интрон. Последовательность Mini5B составлена из лигирующей цепи IgK в кадре с двумя идентичными доменами CYS MUC5B, фланкирующими большой участок Ser / Thr / Pro (430 аа) муцина. Кассета EcoRI-EcoRI-Ires-Luc объемом 2,5 кб была субклонирована в уникальный сайт рестрикции EcoRI pcMG или в pcMG-Mini5B, расположенный ниже по потоку от стоп-кодона Mini5B. Использовались только векторы с правильной ориентацией кассеты (pcMG-Ires-Luc и pcMG-Mini5B-Ires-Luc). Mini5B содержит в своей карбокси-концевой последовательности N-гликозилирующий сайт NSS.
(A) Окрашивание ОН проводили на парафиновых срезах печени, легких и лимфатических узлах мышей, которым вводили клоны Mini5B-Luc. Метастаз показан в увеличенном изображении. (B) Иммунофлуоресцентный анализ проводили на парафиновых срезах печени у мышей, которым вводили клоны Mini5B-Luc и окрашивали анти-PCNA-антителом. Метастатические клетки были положительными. (C). Двойной иммунофлуоресцентный анализ с использованием антител против человеческого E-кадгерина и антител против MUC5B проводили на парафиновых срезах грудных лимфатических узлов у мышей, которым вводили клоны Mini5B-Luc. Метастатические клетки экспрессировали как эпителиальный маркер E-cadherin, так и секретируемый белок MUC5B. Ядра были контрастированы с Hoechst 33258 или йодидом пропидия. Mt, метастазы. Шкала шкалы 50 мкм.
Клетки MCF7 трансфицировали с использованием набора Effectene (Qiagen, Courtaboeuf, France) с 2 мкг плазмиды pcMG-Mini5B-Ires-Luc или pcMG-Ires-Luc (Luc clone), линеаризованной с помощью уникального рестрикционного фермента SspI. Трансфицированные клетки затем отбирали с помощью аналога неомицина G418 (650 мкг / мл, Invitrogen) в течение 10 дней через ген устойчивости к неомицину вектора pcMG. Клоны, устойчивые к G418, отбирали индивидуально и высевали в 96-луночный планшет для культивирования, расширивали в 48-луночный планшет, затем шестизонный планшет и, наконец, в культуральной колбе на 25 см2.
(A) Mini5B-Luc, Ires-Luc, пурпурная shRNA Mini5B-Luc или ксенотрансплантаты SHRNA Mini5B-Luc CYS. Рост опухоли контролировался один раз в неделю в течение 118 дней. * P 2 мм в наибольшем размере) наблюдались в легких у одной мыши в группе Ires-Luc и у 4/4 мышей в группе Mini5B-Luc (рис.5C и таблица 1) , Напротив, только одна мышь в группе SHRNA Mini5B-Luc CYS показала метастазы в печени (таблица 1). Индекс тяжести заболевания был выше у мышей, которым вводили клетки, экспрессирующие Mini5B (клоны Mini5B-Luc и пустые популяции SH5NA Mini5B-Luc), чем у мышей, которым вводили клетки, которые не экспрессировали группы Mini5B (Ires-Luc и Mini5B-Luc CYS shRNA, P = 0,002) (фиг.6). Эти доклинические данные свидетельствуют о том, что мини-муцин Mini5B способствует росту опухоли и распространению клеток в этой модели s.c. ксенографты.
В физиологических условиях муцины играют защитную роль в эпителиальных тканях и участвуют в процессе эпителиальной дифференциации, регуляции роста, модуляции клеточной адгезии и клеточной передачи сигналов [22]. Многочисленные исследования показали, что аномальное гликозилирование муцина обычно связано со злокачественной трансформацией эпителиальных клеток [9], [23]. Сверхэкспрессия муцинов, наблюдаемая во многих раковых образованиях, важна для адгезии и инвазии раковых клеток, выхода из раковых клеток из иммунной системы, захвата биологических молекул, таких как факторы роста и роста клеток [22].
При некоторых раковых заболеваниях наблюдалась несостоятельная или эктопическая экспрессия муцинов. Это имеет место для MUC5B, который выражается ненормально в желудочных карциноматозных тканях и клеточных линиях [24] и в аденокарциномах легких [25], [26]. В ткани молочной железы белок MUC5B обнаруживается с высокой частотой в тканях рака молочной железы, тогда как муцин не экспрессируется в нормальных контрольных образцах молочной железы [10]. Ранее сообщалось, что все опухоли молочной железы развиваются спонтанно в трансгенном штамме мыши MMTV-ras, продуцированном Muc5b [27]. Среди рака молочной железы люминальный подтип составляет 68% всех случаев рака молочной железы и связан с высоким риском (70%) для развития метастазов [28]. Клеточная линия MCF7, экспрессирующая E-кадгерин, рецептор эстрогена и рецептор прогестерона, считается хорошей моделью для имитации рака молочной железы [29]. Чтобы далее понять последствия MUC5B в патогенезе рака молочной железы, мы трансфицировали клетки MCF7 рекомбинантным мини-муцином MUC5B, и мы оценили инвазивный и метастатический потенциал этих клеток in vitro и s.c. ксенотрансплантата.
Прогнозируемый транскрипт MUC5B составляет 17,9 кб в длину [5] — [7], [24] в соответствии с экспериментами с нозерн-блоттингом [30]. Центральный экзон MUC5B имеет длину 10713 bp и кодирует пептид 3571 aa, состоящий из семи доменов CYS и областей, богатых Ser / Thr / Pro, из муцина, которые несут многочисленные олигосахаридные цепи. Большой размер пептидного фрагмента MUC5B (> 5000 аа) заставил нас исследовать его роль in vitro и in vivo, используя мини-муцин, сделанный из области, специфичной для домена, 650 аа, что является репрезентативным для центральной области полный O-гликозилированный муцин. Ранее было показано, что этот мини-муцин выделяется как N-гликозилированные и экстенсивно O-гликозилированные молекулы, когда вектор трансфицируется в клетках COS-7 [13].
Мы обнаружили, что мини-муцин способствовал пролиферации клеток MCF7 in vitro и инвазии в Матригеле. Эксперименты ксенотрансплантата показали, что мини-муцин, продуцируемый клетками MCF7, заметно влияет на рост опухоли и связан с агрессивным поведением опухоли. Этот вывод согласуется с предыдущими исследованиями о роли другого гелеобразующего муцина MUC2 в раке молочной железы [31] — [33]. Одно исследование показало, что клеточная линия рака толстой кишки LSLiM6 секретирует MUC2, который при инокуляции мышам индуцирует метастазы в печени [34]. Уменьшение экспрессии MUC2 с помощью антисмысловой стратегии ингибирования уменьшало способность клеток колонизировать этот орган.
Сравнение частоты развития опухоли и метастазов между мышами, инъецированными клоном Ires-Luc, и мышами, инъецированными клоном SHRNA Mini5B-Ires-Luc CYS, говорит о том, что лучший результат был для группы SHRNA Mini5B-Ires-Luc CYS. Это удивительно, поскольку мы ожидали подобных результатов для этих двух групп. В то время как экспрессия эндогенного MUC5B казалась весьма схожей между клонами и родительской клеточной линией на уровне гена и уровнем белка, мы не можем полностью исключить, что экспрессия MUC5B дикого типа, которая не должна ингибироваться в клоне Ires-Luc, может быть частично ответственным за наблюдаемые различия.
Функция полимеризации муцинов в биологии рака молочной железы неясна, и механизмы, с помощью которых экспрессия муцина влияет на опухолегенез раковых клеток молочной железы, плохо изучены. Влияние экспрессии муцина на поведение раковых клеток может различаться в зависимости от клеточной линии и изученного муцина. Было высказано предположение, что избыточная экспрессия MUC6-доменов муцина ингибирует инвазию раковых клеток in vitro
[35], тогда как в некоторых случаях экспрессия этого секретируемого муцина, по-видимому, коррелирует со степенью гистопатологии, которая связана со злокачественным потенциалом [36].
Вполне вероятно, что экспрессия и аномальное гликозилирование нашего мини-муцина в клетках MCF7 приводит к модуляции клеточных и клеточных матричных взаимодействий, что облегчает инвазию клеток MCF7. Было показано, что с использованием двух линий MCF7 и T47D рака молочной железы тандемы повторения MUC6 являются хорошими кандидатами на высокую плотность общего антигена Tn, связанного с раком человека, обнаруженного в этих клеточных линиях [37]. Поэтому мы можем предположить, что избыточная экспрессия тандемных повторов MUC5B в клетках MCF7 может способствовать более высокой экспрессии антигена Tn. Аномальное гликозилирование MUC2 в клетках LSLiM6 обнажает антигены Tn и sialyl Lex на поверхности опухолевых клеток [34], и эти гликановые эпитопы важны при адгезионных взаимодействиях с базальной мембраной и сосудистым эндотелием путем связывания E-селектина, который способствует метастазированию [23 ], [34].
В заключение, сверхэкспрессия MUC5B в раковых клетках MCF7 может стимулировать агрессивное поведение опухолевых клеток за счет увеличения клеточной пролиферации, роста опухоли и распространения. Наше исследование предполагает, что разработка вакцин, направленных против аномально гликозилированных доменов MUC5B, должна оцениваться на предмет рака молочной железы.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Матчук О.Н., Чурюкина К.А., Яббаров Н.Г., Никольская Е.Д., Жунина О.А.
Известно, что опухолевые стволовые клетки (ОСК) представляют собой наиболее радиои химиорезистентную популяцию в составе широкого ряда злокачественных новообразований, включая рак молочной железы . В связи с этим усилия многих специалистов в области экспериментальной онкологии и радиобиологии направлены в последнее время на разработку средств/способов элиминации ОСК и (или) повышения их чувствительности к известным противоопухолевым воздействиям. В частности, создаются новые препараты на основе использования наночастиц. В данной работе были использованы полиамидоаминовые (РАМАМ) дендримеры второго поколения (G2), ковалентно конъюгированные с доксорубицином (Докс) и векторным белком (рекомбинантным фрагментом третьего домена альфа-фетопротеина 3D). Сравнивали внутриклеточное содержание Докс и изменение количества стволовых и нестволовых клеток рака молочной железы линии MCF-7 при одиночном и комбинированном действии ионизирующего излучения , свободного Докс, дендримеров второго поколения, нагруженных Докс (G2-Докс), и конъюгатов тех же дендримеров с векторным белком и Докс (3D-G2-Докс). ОСК идентифицировали с помощью проточной цитометрии по способности этих клеток откачивать во внеклеточную среду флуоресцентный краситель Хёхст33342 и формировать популяцию, слабо окрашенную этим красителем (side population SP). Результаты исследования свидетельствуют об относительно низком внутриклеточном содержании Докс в ОСК (SP) по сравнению с остальными клетками (NSP) при использовании всех изученных соединений, что в значительной мере объясняет различие цитотоксического действия этих соединений на разные популяции клеток. Под влиянием использованных соединений Докс абсолютное количество клеток NSP уменьшалось, в то время как количество клеток SP имело тенденцию к увеличению. В итоге, средняя доля клеток SP возрастала до 13,1%, 4,2% и 3,4% после инкубации со свободным Докс, G2-Докс и 3D-G2-Докс соответственно, составляя в контроле 1,8% (р научных работ по фундаментальной медицине , автор научной работы — Матчук О.Н., Чурюкина К.А., Яббаров Н.Г., Никольская Е.Д., Жунина О.А.
Effect of ionizing radiation exposure and combined effect of radiation and conjugates of dendritic polymers with doxorubicin on the population of MCF-7 breast cancer stem cells
DOI: 10.21870/0131 -3878-2017-26-4-52-62
Изменение популяции стволовых клеток рака молочной железы линии MCF-7 при одиночном и комбинированном действии ионизирующего излучения и конъюгатов дендритных полимеров с доксорубицином
Матчук О.Н., Чурюкина К.А., Яббаров Н.Г., Никольская Е.Д., Жунина О.А.1, Кондрашева И.Г.1, Северин Е.С.1, Замулаева И.А.
Известно, что опухолевые стволовые клетки (ОСК) представляют собой наиболее радио- и химиорезистентную популяцию в составе широкого ряда злокачественных новообразований, включая рак молочной железы. В связи с этим усилия многих специалистов в области экспериментальной онкологии и радиобиологии направлены в последнее время на разработку средств/способов элиминации ОСК и (или) повышения их чувствительности к известным противоопухолевым воздействиям. В частности, создаются новые препараты на основе использования наночастиц. В данной работе были использованы полиамидоаминовые (РАМАМ) дендримеры второго поколения (G2), ковалентно конъюгированные с доксорубицином (Докс) и векторным белком (рекомбинантным фрагментом третьего домена альфа-фетопротеина -3D). Сравнивали внутриклеточное содержание Докс и изменение количества стволовых и нестволовых клеток рака молочной железы линии MCF-7 при одиночном и комбинированном действии ионизирующего излучения, свободного Докс, дендримеров второго поколения, нагруженных Докс (32-Докс), и конъюгатов тех же дендримеров с векторным белком и Докс (3D-G2-Докс). ОСК идентифицировали с помощью проточной цитометрии по способности этих клеток откачивать во внеклеточную среду флуоресцентный краситель Хёхст33342 и формировать популяцию, слабо окрашенную этим красителем (side population - SP). Результаты исследования свидетельствуют об относительно низком внутриклеточном содержании Докс в ОСК (SP) по сравнению с остальными клетками (NSP) при использовании всех изученных соединений, что в значительной мере объясняет различие цитотоксического действия этих соединений на разные популяции клеток. Под влиянием использованных соединений Докс абсолютное количество клеток NSP уменьшалось, в то время как количество клеток SP имело тенденцию к увеличению. В итоге, средняя доля клеток SP возрастала до 13,1%, 4,2% и 3,4% после инкубации со свободным Докс, и 3D-G2-Докс соответственно, со-
ставляя в контроле 1,8% (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
На рис. 2 представлены полученные данные об интенсивности флуоресценции Докс, по которой судили о содержании этого соединения в разных клеточных популяциях. Прежде всего, обращает на себя внимание факт значительно менее интенсивной флуоресценции Докс в клетках SP по сравнению с NSP (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
8. Ahmed M., Chaudhari K., Babaei-Jadidi R., Dekker L.V., Shams Nateri A. Concise review: emerging drugs targeting epithelial cancer stem-like cells //Stem Cells. 2017. V. 35, N 4. P. 839-850.
9. Kuhlmann J.D., Hein L., Kurth I., Wimberger P., Dubrovska A. Targeting cancer stem cells: promises and challenges //Anticancer Agents Med. Chem. 2016. V. 16, N 1. P. 38-58.
10. Shen S., Xia J.X., Wang J. Nanomedicine-mediated cancer stem cell therapy //Biomaterials. 2016. V. 74. P. 1-18.
11. Bonner J.A., Lawrence T.S. Doxorubicin decreases the repair of radiation-induced DNA damage //Int. J. Radiat. Biol. 1990. V. 57, N 1. P. 55-64.
12. Ницветов М.Б., Москалева Е.Ю., Посыпанова Г.А., Макарова О.В., Степанов В.А., Рогов К.А., Коромыслова И.А., Караулов А.В., Северин С.Е., Северин Е.С. Изучение экспрессии рецептора АФП в опухолевых и нормальных тканях человека с помощью иммуногистохимического метода //Иммунология. 2005. Т. 26, № 2. С. 122-125.
13. Яббаров Н.Г., Посыпанова Г.А., Воронцов Е.А., Попова О.Н., Северин Е.С. Направленный транспорт доксорубицина: система доставки на основе РАМАМ дендримеров //Биохимия. 2013. Т. 78, № 8. С. 1128-1140.
14. Ahmad Fuaad A.A., Azmi F., Skwarczynski M., Toth I. Peptide conjugation via CuAAC 'click' chemistry //Molecules. 2013. V. 18, N 11. P. 13148-13174.
15. Матчук О.Н., Замулаева И.А., Ковалев О.А., Саенко А.С. Механизмы радиорезистентности клеток SP культуры мышиной меланомы В16 //Цитология. 2013. Т. 55, № 8. С. 553-559.
16. Замулаева И.А., Чурюкина К.А., Матчук О.Н., Яббаров Н.Г., Никольская Е.Д., Макаренко С.А., Жунина О.А., Кондрашева И.Г., Северин Е.С. Цитотоксические эффекты комбинированного действия ионизирующего излучения и конъюгатов доксорубицина с дендритным полимером и векторным белком на опухолевые клетки in vitro //Радиация и риск. 2016. Т. 25, № 3. С. 46-56.
17. Kapse-Mistry S., Govender T., Srivastava R., Yergeri M. Nanodrug delivery in reversing multidrug resistance in cancer cells //Front. Pharmacol. V. 5. Article 159. P. 1-22.
18. Zhao Y., Alakhova D.Y., Kabanov A.V. Can nanomedicines kill cancer stem cells? //Adv. Drug Deliv. Rev. 2013. V. 65, N 13-14. P. 1763-1783.
19. Malhi S., Gu X. Nanocarrier-mediated drugs targeting cancer stem cells: an emerging delivery approach //Expert Opin. Drug. Deliv. 2015. V. 12, N 7. P. 1177-1201.
20. Sun R., Liu Y., Li S.Y., Shen S., Du X.J., Xu C.F., Cao Z.T., Bao Y., Zhu Y.H., Li Y.P., Yang X.Z.,
Wang J. Co-delivery of all-trans-retinoic acid and doxorubicin for cancer therapy with synergistic inhibition of cancer stem cells //Biomaterials. 2015. V. 37. P. 405-414.
Effect of ionizing radiation exposure and combined effect of radiation and conjugates of dendritic polymers with doxorubicin on the population of MCF-7 breast cancer stem cells
Matchuk O.N., Churyukina K.A., Yabbarov N.G., Nikolskaja E.D., Zhunina O.A.1, Kondrashova I.G.1, Severin E.S.1, Zamulaeva I.A.
A. Tsyb MRRC, Obninsk;
It is known that cancer stem cells (CSCs) represent the radio- and chemoresistant fraction of many malignant tumors, including breast cancer. Therefore efforts of specialists in the fields of experimental oncology and radiobiology have been directed towards the development of means/methods for eliminating CSCs and (or) increasing its sensitivity to known anticancer agents, in particular na-noparticles-based compounds. Polyamidoamine dendrimers of the second generation (G2), cova-lently conjugated with doxorubicin (Dox) and vector protein (alpha-fetoprotein recombinant third domain - 3D) were used in the presented study. Effect of ionizing radiation and combined effect of radiation and anticancer agents, such as free Dox, second generation dendrimers loaded with Dox (G2-Dox), and conjugates of the same dendrimers with the vector protein and Dox (3D-G2-Dox), on intracellular Dox content and the changes in the number of stem and non-stem cancer cells of MCF-7 breast cancer line were compared. CSCs were identified with flow cytometry by their ability to pump the fluorescent dye Hoechst33342 into the extracellular medium and form slightly stained side population (SP). The use of all studied compounds resulted in relatively low intracellular content of Dox in CSCs (SP) compared to that in the other cells (NSP). These findings largely explained the different cytotoxic effects of these compounds on different cell populations. The absolute number of NSP cells decreased, while the number of SP cells tended to increase under the influence of all Dox compounds used in the study. As a result, the average number of SP cells increased by 13.1%, 4.2%, and 3.4% after incubation with free Dox, G2-Dox and 3D-G2-Dox, respectively (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
8. Ahmed M., Chaudhari K., Babaei-Jadidi R., Dekker L.V., Shams Nateri A. Concise review: emerging drugs targeting epithelial cancer stem-like cells. Stem Cells, 2017, vol. 35, no. 4, pp. 839-850.
9. Kuhlmann J.D., Hein L., Kurth I., Wimberger P., Dubrovska A. Targeting cancer stem cells: promises and challenges. Anticancer Agents Med. Chem., 2016, vol. 16, no. 1, pp. 38-58.
10. Shen S., Xia J.X., Wang J. Nanomedicine-mediated cancer stem cell therapy. Biomaterials, 2016, vol. 74, pp. 1-18.
11. Bonner J.A., Lawrence T.S. Doxorubicin decreases the repair of radiation-induced DNA damage. Int. J. Radiat. Biol., 1990, vol. 57, no. 1, pp. 55-64.
12. Niеtsvetov M.B., Moskaleva E.Ju., Posypanova G.A., Makarova O.V., Stepanov V.A., Rogov K.A., Koromyslova I.A., Karaulov A.V., Severin S.E., Severin E.S. Research of expression of receptor of alpha-fetoprotein in human healthy and tumor tissues by immunohistochemica methods. Immunologiya -Immunology, 2005, vol. 26, no. 2, pp. 122-125. (In Russian).
13. Yabbarov N.G., Posypanova G.A., Vorontsov E.A., Popova O.N., Severin E.S. Targeted delivery of doxorubicin: drug delivery system based on PAMAM dendrimers. Biokhimiya - Biochemistry, 2013, vol. 78, no. 8, pp. 1128-1140. (In Russian).
14. Ahmad Fuaad A.A., Azmi F., Skwarczynski M., Toth I. Peptide conjugation via CuAAC 'click' chemistry. Molecules, 2013, vol. 18, no. 11, pp. 13148-13174.
15. Matchuk O.N., Zamulaeva I.A., Kovalev O.A., Saenko A.S. Radioresistance mechanisms of side population cells in melanoma B16 cell line. Tsitologiya - Cytology, 2013, vol. 55, pp. 553-559. (In Russian).
16. Zamulaeva I.A., Matchuk O.N., Churyukina K.A., Yabbarov N.G., Nikolskaja E.D., Makarenko S.A., Zhunina O.A., Kondrashova I.G., Severin E.S. Cytotoxic effects of the combined action of ionizing radiation and doxorubicin conjugates with dendritic polymer and a vector protein to tumor cells in vitro. Radiatsiya i risk - Radiation and Risk, 2016, vol. 25, no. 3, pp. 46-56. (In Russian).
17. Kapse-Mistry S., Govender T., Srivastava R., Yergeri M. Nanodrug delivery in reversing multidrug resistance in cancer cells. Front. Pharmacol., vol. 5, article 159, pp. 1-22.
18. Zhao Y., Alakhova D.Y., Kabanov A.V. Can nanomedicines kill cancer stem cells? Adv. Drug Deliv. Rev., 2013, vol. 65, no. 13-14, pp.1763-1783.
19. Malhi S., Gu X. Nanocarrier-mediated drugs targeting cancer stem cells: an emerging delivery approach. Expert Opin. Drug. Deliv., 2015, vol. 12, no. 7, pp. 1177-1201.

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
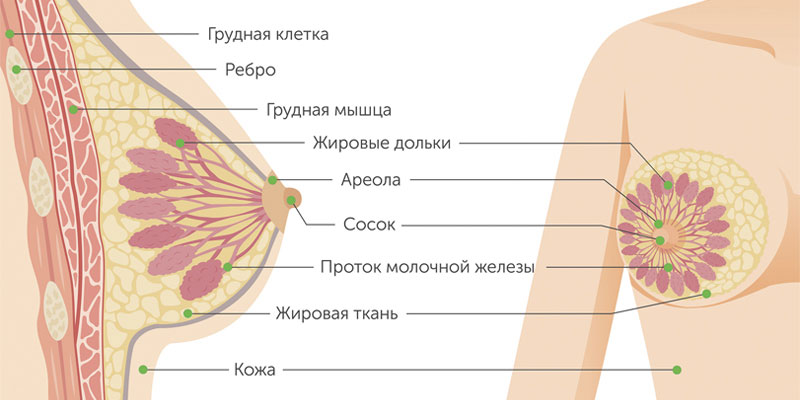
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
Читайте также:

