Магний может взаимодействовать с хлором
Химическое название
Химические свойства
Вещество – магниевая соль соляной кислоты.
Формула магния хлорида – МgCl2, в природе находится в виде минерала бишофита.
Соединение представляет собой гигроскопичные кристаллы прозрачные или белого цвета, без запаха.
Водородный показатель раствора Хлорида Магния – от 5 до7. Вещество плавится при 713 и кипит при 1412 градусах Цельсия, растворимо в воде.
В медицине средство используют в виде магния хлорида гексагидрата, формула — MgCl2х6H2O.
Минерал бишофит получают путем упаривания морских рассолов. Его сначала обезвоживают до MgCl2х2H2O и подвергают дегидратации с участием соляной к-ты при 100-200 градусах.
Хлорид магния реагирует с солями, имеющими в своем строение катион, который способен образовать нерастворимую соль с анионом хлора или же, если соль содержит анион, который образует растворимую соль с катионом магния. Более подробно химические свойства соединения можно изучить, посмотрев обычную таблицу растворимости солей.
Вещество используют во множестве отраслей промышленности (строительство, коммунальное хоз-во, животноводство, химической, текстильной и пищевой). В медицине же соединение применяют в качестве бактерицидного и анаболического средства. Хлорид магния входит в состав различных препаратов и используется для их производства.
Фармакологическое действие
Противовоспалительное, метаболическое, бактерицидное.
Фармакодинамика и фармакокинетика
Магний – один из важнейших микроэлементов, принимающих участие в метаболических процессах в организме человека, находящийся практически во всех клетках. Вещество способствует передаче нервных импульсов, сокращении мышц. При использовании бишофита в виде аппликаций, средство способствует восстановлению позвоночника, суставов, сердечно-сосудистой и нервной систем.
Данное вещество усваивается организмом несколько хуже, чем органические соединения с магнием. Однако его активно используют и добавляют в состав различных препаратов. После попадания в организм, соединение быстро и практически полностью метаболизируется.
Показания к применению
Хлорид магния применяют:
- при хроническом остеохондрозе и остеоартрозе;
- для лечения гипомагниемии;
- при артрозе, артрите, радикулите;
- для профилактики и лечения катаракты;
- при различных заболеваниях периферической нервной системы;
- в дерматологиии гастроэнтерологии.
Соединение входит в состав заменителей плазмы, регуляторов водно-электролитного баланса, парентерального питания.
Противопоказания
При некоторых заболеваниях сердечно-сосудистой системы, почек или ЖКТ использование соединения и препаратов на его основе крайне не рекомендуется.
При инъекционном использовании вещества следует прекратить грудное вскармливание. Производить уколы с хлоридом магния в составе нельзя беременным женщинам.
Аппликации и ванны с Бишофитом противопоказаны:
- при сердечно-сосудистой недостаточности, ишемической болезни;
- лицам со склерозом сердца, почек, сосудов головного мозга;
- при заболеваниях кожи и новообразованиях на коже.
Побочные действия
При использовании разных препаратов и лекарственных форм могут проявляться различные побочные реакции:
- бромизм, головокружение, сердцебиение, учащенное дыхание (аппликации и ванны, следует прекратить прием лекарства);
- боль в воспаление в месте введения, ощущение тепла, головокружение (для р-ов для инъекций).
Магния Хлорид, инструкция по применению (Способ и дозировка)
В зависимости от препарата и его лекарственной формы существуют различные схемы лечения.
Передозировка
Во время приема ванн с Хлоридом магния может развиться бромизм, головокружение, головные боли. В таком случае следует прекратить лечение.
Нет сообщений о передозировке Хлоридом магния для инъекций.
Взаимодействие
Хлорид магния, как правило, хорошо сочетается с прочими веществами в составе различных препаратов. Следует внимательно изучить пункт лекарственное взаимодействие в инструкции к препарату.
Реакция взаимодействия магния с хлором.










Уравнение реакции взаимодействия магния с хлором:
Реакция магния с хлором протекает при обычных условиях.
Для проведения реакции используется влажный хлор .
В результате реакции магния с хлором происходит образование хлорида магния .










- ← Реакция брома и водорода
- Реакция брома и натрия →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 885)
- Экономика Второй индустриализации России (101 440)
- Программа искусственного интеллекта ЭЛИС (22 617)
- Метан, получение, свойства, химические реакции (15 883)
- Мотор-колесо Дуюнова (15 091)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 448)
- Природный газ, свойства, химический состав, добыча и применение (13 925)
- Крахмал, свойства, получение и применение (13 494)
- Прямоугольный треугольник, свойства, признаки и формулы (13 047)
- Целлюлоза, свойства, получение и применение (11 898)
- Пропилен (пропен), получение, свойства, химические реакции (11 641)
- Этилен (этен), получение, свойства, химические реакции (11 157)
- Бутан, получение, свойства, химические реакции (9 838)
- Оксид алюминия, свойства, получение, химические реакции (9 358)
- Оксид железа (III), свойства, получение, химические реакции (9 131)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.

Для начала он регулирует функции мышц и нервов, а также кровяное давление и уровень сахара в крови.
По данным Национального института здравоохранения , не все добавки магния созданы равнозначными. Некоторые формы являются более биодоступны, чем другие. Считается, что хлоридные и цитратные формы лучше усваиваются организмом, чем сульфатные или оксидные формы магния.
Что такое хлорид магния?
Формула хлорида магния MgCl2. Это означает, что он состоит из одного атома магния и двух атомов хлорида.
Что такое хлорид магния? Это тип соли, который представляет собой комбинацию магния и хлорида.
Естественно его можно получить путем солнечного испарения морской воды.
Растворим ли хлорид магния?
Растворимость хлорида магния в воде или другой жидкости высока. Это означает, что он лучше всасывается в кишечнике по сравнению с менее растворимыми формами магния.
Хлорид магния можно найти в добавках, которые можно принимать внутрь. Либо местно для повышения уровня магния в организме.
Действие хлорида магния на организм человека и его использование
Чем хорош хлорид магния?
Известно, что польза и применение хлорида магния как внутрь, так и местно включают:
С возрастом всасывание магния кишечником уменьшается, а выделение магния почками увеличивается. Пожилые люди также чаще страдают хроническими заболеваниями, которые влияют на уровень магния и повышают риск дефицита.
Вы можете получить магний в своем рационе, употребляя в пищу полезные продукты, богатые магнием, например, темно-листовую зелень. Однако, если этого не хватает для восполнения его уровня в организме можно, подумать о приеме добавок с магнием.
Нередко возникает диарея в результате приема магниевых добавок внутрь. Поэтому, многие люди обращаются к хлористому магния в актуальной форме для повышения его уровня в организме. Например, масла или лосьона.
MgCl2 иногда используется для компенсации снижения секреции желудочной кислоты в желудке.
Желудочная кислота вырабатывается желудком, и это абсолютно необходимо для правильного пищеварения. Он помогает расщеплять продукты на более мелкие поглощаемые единицы. Без достаточного количества желудочной кислоты у нас может нарушится пищеварение. Может нарушиться всасывание основных питательных веществ.
Желудочная кислота также помогает предотвратить попадание инфекционных бактерий в кишечный тракт и его заселение.
Многие люди, такие как спортсмены, используют магниевое масло для повышения энергии и выносливости. Магниевое масло также может помочь расслабить мышцы и уменьшить мышечные боли или спазмы.
Проблемы со сном иногда могут быть связаны с дефицитом магния.
По данным Национального фонда сна:
Дополнение и информация о дозировке
Если вы ищите добавки с хлористым магнием, у вас есть несколько вариантов, в том числе:
- Таблетки хлорида магния: принимать внутрь в жидком виде (обычно в воде).
- Хлорид магния жидкий: если вы предпочитаете добавки в жидкой форме, это еще один вариант для приема внутрь. Внимательно прочитайте инструкцию на упаковке, потому что его часто необходимо разбавлять в 220 мл жидкости.
- Порошок хлорида магния. Принимается перорально после разведения в напитке.
- Масло хлористого магния: масляная форма магния, которую можно наносить на кожу.
- Лосьон с хлористым магнием: актуальный вариант для наружного применения.
- Хлопья хлорида магния: еще один внешний способ использования соли хлорида магния в ваннах для тела или ног.
Суточная потребность в магнии зависят от возраста, пола и состояния здоровья. Поэтому подходящая дозировка хлорида магния зависит от нескольких факторов.
Внимательно прочитайте рекомендации продукта и всегда консультируйтесь со своим лечащим врачом относительно наилучшей дозировки.
Если вы решили принимать добавки, рекомендуем рассмотреть следующие варианты:
- Alta Health, Хлорид Магния, 100 Таблеток
- Life-flo, чистое магниевое масло, 237 мл
- Sunfood, чистое и мощное масло магния, 4 жидких унции (118 мл)
- Здоровье и мудрость, кристаллы для ванн с магнием, 2,5 кг
- Life-flo, чистые хлопья магния, рассол хлорида магния, 1,25 кг
- Nutricology, жидкость хлорида магния, 236 мл
Риски, побочные эффекты и взаимодействия
Как со всеми добавками магния, побочные эффекты хлорида магния могут включать расстройство желудка и диарею. Эти потенциальные побочные эффекты можно уменьшить или избежать, если не принимать больше, чем рекомендуется. А также принимать во время еды.
Актуальные формы магния с меньшей вероятностью вызывают пищеварительные побочные эффекты. Однако после применения магниевого масла кожа нередко чувствует зуд . Если это происходит, зуд должен исчезнуть после того, как вы смоете продукт.
Вы можете попробовать магниевый лосьон, который часто сочетается с другими успокаивающими компонентами кожи, такими как алоэ. Другой вариант — использовать магниевые хлопья при приеме ванны или ванночек для ног.
Известно, что следующие препараты взаимодействуют с хлоридом магния:
- Демеклоциклина
- Доксициклин
- Eltrombopag
- Лимециклин
- Миноциклин
- Окситетрациклин
- Тетрациклин
- Ципрофлоксацин
- Флероксацин
- Гемифлоксацин
- Левофлоксацин
- Моксифлоксацин
- Норфлоксацин
- Офлоксацин
- Пеницилламин
- Рилпивирин
Это не полный список лекарственных препаратов. Поэтому проконсультируйтесь с вашим лечащим врачом, прежде чем сочетать хлорид магния с любыми другими лекарствами или добавками.
Иногда медицинские работники дают хлорид магния в виде инъекций. Однако это не рекомендуется тем, кто страдает аллергией на него или имеет тяжелые заболевания сердца или почек. Есть более потенциально серьезные побочные эффекты от приема инъекций хлорида магния. Это угнетение дыхания или значительное снижение артериального давления.
Как и в случае любых добавок, возможна передозировка магния. Поэтому важно изучать инструкцию препарата на упаковке и консультироваться с врачом об идеальной дозировке хлорида магния.
Это особенно необходимо, если вы беременны, кормите грудью, имеете заболевание или в настоящее время принимаете лекарства.
Обратитесь за неотложной медицинской помощью, если у вас есть признаки аллергической реакции, такой как крапивница, сильное головокружение. А также проблемы с дыханием или отек лица, губ, языка и/или горла.

Рис. Схемы строения атомов и ионов серы и хлора
При взаимодействии свободных галогенов со сложными веществами они также ведут себя как окислители, например при взаимодействии с водой. Вначале галоген растворяется в воде с образованием соответственно хлорной, бромной или йодной воды (Cl2aq, Br2aq или I2aq), а затем постепенно между водой и галогеном начинается реакция;
Взаимодействие хлора с водой выражается конечным уравнением
Сl2 + H2O = 2НСl + [О]
Однако эта реакция не сразу протекает до образования конечных продуктов. На первой стадии процесса образуются две кислоты — соляная НСl и хлорноватистая НСlO:
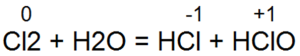
Затем происходит разложение хлорноватистой кислоты:
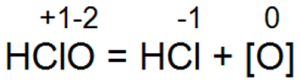
Образованием атомарного кислорода объясняют в значительной мере окисляющее действие хлора, которое он оказывает на микроорганизмы, находящиеся в воде, вследствие чего они погибают. Выделение атомарного кислорода объясняет также отбеливающее действие хлора, которое он оказывает на предварительно увлажненные органические вещества. Органические красители, помещенные в хлорную воду, обесцвечиваются. Лакмус, который при наличии соляной кислоты должен окрашиваться в розовый цвет, в хлорной воде, где в небольших количествах присутствует соляная кислота, не приобретает характерной для него в кислоте окраски, а полностью теряет ее. Это объясняется наличием атомарного кислорода, который оказывает на лакмус окисляющее действие.
Аналогично реагируют с водой и другие галогены: бром и иод — более медленно, фтор — значительно быстрее и энергичнее.
Пары воды горят во фторе, а стадии образования кислородной кислоты у фтора нет, либо такая кислота не существует.
Галогены реагируют и с органическими веществами. Например, если внести в атмосферу хлора бумажку, смоченную скипидаром (органическое вещество, состоящее из водорода и углерода), то можно заметить выделение большого количества сажи и ощутить запах хлористого водорода. Иногда скипидар даже самовоспламеняется в хлоре. Хлор вытесняет углерод из соединения с водородом и образует хлористый водород, а углерод выделяется в виде сажи в свободном состоянии.
Все галогены энергично взаимодействуют с каучуком и резиной. По этой причине при работе с галогенами стараются не использовать в приборах резиновых деталей.
Среди реакций с органическими веществами важно от-метить реакцию иода с крахмалом, который синеет при наличии в растворе даже незначительного количества свободного иода. Реакция очень чувствительная и является качественной реакцией на иод.
Особый интерес представляют окислительно-восстановительные реакции галогенов, происходящие между свободным галогеном и солью другого галогена. Например, если взять раствор какого-либо бромида и смешать с хлорной водой, то бесцветный раствор мгновенно окрашивается в желтый цвет. При взбалтывании с бензолом характерная окраска бензольного кольца указывает на наличие свободного брома. Это объясняется тем, что хлор как более активный галоген окисляет бром, вытесняя его из соли по уравнению:
2КВr + Cl2 = 2КСl + Вr2
Естественно, что свободный галоген должен обладать большей окислительной активностью, чем галоген, входящий в состав соли поэтому возможны реакции между иодидом и бромом, иодидом и хлором, бромидом и хлором.
Некоторые из этих реакций находят применение в технике. Например, наиболее дешевым способом получения брома является вытеснение его хлором из солей, часто из бромида магния:
MgBr2 + Сl2 = MgCl2 + Вr2
■ 17. Докажите, составив электронный баланс, что взаимодействие галогенов с водой и с солями других галогенов является окислительно-восстановительными реакциями, и объясните, почему хлорная вода обладает обеззараживающим действием. (См. Ответ)
Окислительное действие галогенов проявляется и при реакциях с другими сложными веществами. Например, если через бромную воду пропускать сероводород, то очень скоро бромная вода обесцветится и образовавшаяся жидкость помутнеет вследствие восстановления Вr0 до Вr -1 и окисления S -2 до S 0 .
Иод довольно легко окисляет серу в степени окисления +4, например в Na2SO3, до S +6 . Схема реакции:
Na2SO3 + I2 → Na2SO4 + HI
■ 18. Составьте уравнения окислительно-восстановительных реакций между бромом и сероводородом, а также между иодом и сульфитом натрия. (См. Ответ)
19. Составьте и заполните таблицу:
Какие химические процессы протекают при горении магния
Из этой статьи вы узнаете, что такое магний, и увидите настоящее химическое чудо — горение магния в воде!
Магний — один из самых распространенных элементов в земной коре. Больше всего соединений магния находится в морской воде. Этот элемент играет важную роль в жизни человека, животных и растений.
Как металл, магний не используют в чистом виде — только в сплавах (например, с титаном). Магний позволяет создавать сверхлегкие сплавы.
Физические свойства магния
Магний представляет собой легкий и пластичный металл серебристо-светлого цвета c характерным металлическим блеском.
Магний окисляется воздухом, на его поверхности образуется достаточно прочная пленка MgO, которая защищает металл от коррозии.
Температура плавления серебристого метала составляет 650 °C, а кипения — 1091 °C.
Химические свойства магния
Этот металл покрыт защитной оксидной пленкой. Если ее разрушить, магний быстро окислится на воздухе. Под температурным воздействием металл активно взаимодействует с галогенами и многими неметаллами. Магний реагирует с горячей водой, образуя гидроксид магния в виде осадка:
Mg + 2H₂O = Mg(OH)₂ + H₂
Если на газовой горелке в специальной химической ложке поджечь порошок магния, а затем опустить его в воду, порошок начнет гореть интенсивнее.
Вот как это происходит:
Из-за интенсивно-выделяющегося водорода горение будет сопровождаться ослепительными вспышками. При этом образуется оксид магния, а затем его гидроксид.
Магний относится к активным металлам, а потому бурно взаимодействует с кислотами. Однако это происходит не так бурно, как в случае с щелочным металлом калием, то есть реакция проходит без воспламенения. Зато с характерным шипением активно выделяются пузырьки водорода. И хотя пузырьки водорода поднимают металл, он не настолько легкий, чтобы оставаться на плаву.
Уравнение реакции магния и соляной кислоты:
Mg + 2HCl = MgCl₂ +H₂
При температуре выше 600 °C магний воспламеняется на воздухе, испуская при этом крайне яркий свет практически во всем спектре, подобно Солнцу.
Внимание! Не пытайтесь повторить эти опыты самостоятельно!
Такая ослепительная вспышка может травмировать глаза: можно получить ожог сетчатки, а в худшем случае — потерять зрение. Поэтому подобный опыт относится не только к самым красивым, но и к самым опасным. Не рекомендуется проводить этот опыт без специальных защитных темных очков. Здесь вы найдте эксперимент с горением магния, который можно безопасно проводить дома.
В процессе реакции образуются белый порошок оксида магния (его еще называют магнезией), а также нитрид магния. Уравнения горения:
Магний продолжает гореть как в воде, так и в атмосфере углекислого газа, поэтому потушить такой огонь довольно сложно. Тушение водой только усугубляет ситуацию, так как начинает выделяться водород, который также воспламеняется.
12-й элемент очень похож на щелочной металл литий. Например, он также взаимодействует с азотом, образуя нитрид:
Также, подобно литию, нитрид магния можно легко разложить с помощью воды:
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует без нагревания.
2) сульфат меди(II)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Ответ: 24
Хлорид цинка относится к солям, а железо - к металлам. Металл реагирует с солью только в том случае, если он является более активным по сравнению с тем, который входит в состав соли. Определяется относительная активность металлов по ряду активности металлов (по-другому, ряду напряжений металлов). Железо в ряду активности металлов находится правее цинка, значит, оно менее активно и не способно вытеснить цинк из соли. То есть реакция железа с веществом №1 не идет.
Сульфат меди (II) CuSO4 будет реагировать с железом, так как железо находится левее меди в ряду активности, то есть является более активным металлом.
Концентрированная азотная, а также концентрированная серная кислоты не способны без нагревания реагировать с железом, алюминием и хромом в виду такого явления, как пассивация: на поверхности данных металлов под действием указанных кислот образуется нерастворимая без нагревания соль, выполняющая роль защитной оболочки. Тем не менее, при нагревании эта защитная оболочка растворяется и реакция становится возможной. Т.е. так как указано, что нагрева нет, реакция железа с конц. HNO3 не протекает.
Соляная кислота в независимости от концентрации относится к кислотам-неокислителям. С кислотами-неокислителями с выделением водорода реагируют металлы, стоящие в ряду активности левее водорода. К таким металлам как раз относится железо. Вывод: реакция железа с соляной кислотой протекает.
В случае металла и оксида металла реакция, как и в случае с солью, возможна, если свободный металл активнее того, что входит в состав оксида. Fe, согласно ряду активности металлов, менее активен, чем Al. Это значит, Fe с Al2O3 не реагирует.
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует бром.
1) азотная кислота
Запишите в поле ответа номера выбранных веществ.
Ответ: 35
Очевидно, что любая реакция простого вещества с любым другим веществом (веществами) является окислительно-восстановительной.
Бром (Br2) прежде всего следует рассматривать как вещество с сильными окислительными свойствами. Реакций, в которых свободный бром проявляет восстановительные свойства крайне мало (взаимодействие со фтором, диспропорционирование в щелочи).
1) Азотная кислота содержит два элемента в высших степенях окисления (водород +1 и азот +5), т.е., очевидно они окислены бромом быть не могут. Кислород же, имеющий степень окисления -2, не может быть окислен Br 0 ввиду большей чем у брома электроотрицательности. Вывод реакция HNO3 с Br2 не протекает.
2) Кислород, хлор и бром - не реагируют между собой - все три указанных вещества могут проявлять практически только окислительные свойства и "не готовы" делиться электронами друг с другом. Вывод реакция O2 c Br2 не протекает.
3) NaOH (водн.). Из простых веществ с щелочами реагируют только Be, Zn, Al, Si, P, S и галогены. Бром - галоген, следовательно, реагирует с щелочью. При этом в зависимости от температуры несколько различаются продукты реакций:
2NaOH + Br2 = NaBrO + NaBr + H2O (на холоду)
6NaOH + 3Br2 t° > NaBrO 3 + 5NaBr + 3H2O
4) Хлорид калия. Свободный галоген реагирует с галогенидом металла в том случае, если исходный свободный галоген более электроотрицателен (находится выше в таблице Менделеева). Бром находится в таблице ниже, чем хлор, следовательно, реагировать с хлоридом калия не будет.
5) Аналогично пункту 4. Бром находится в таблице выше йода, следовательно реагирует с иодидом лития, вытесняя свободный йод:
Из предложенного перечня веществ выберите два таких, с которыми в обычных условиях реагирует магний.
1) концентрированная серная кислота
3) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Ответ: 14
Пояснение:
1) Концентрированная серная кислота реагирует при обычных условиях практически со всеми металлами кроме платины, золота и пассивирующихся металлов (Cr, Fe, Al). Магний - сильный восстановитель, поэтому восстановит S +6 до минимальной степени окисления серы -2 (H2S):
2) Хлорид бария с магнием не реагирует так как барий более активный металл, чем магний.
3) С гидроксидом натрия магний не реагирует, т.к. с щелочами из металлов реагируют только Be,Zn,Al
4) С нитратом цинка магний реагирует, т.к. магний более активен чем цинк, т.е. находится левее цинка в ряду активности:
5) С серой магний реагирует, но только при нагревании. Без нагревания реакция не протекает. Практически все реакции между твердыми веществами требуют нагревания.
Из предложенного перечня веществ выберите два вещества, с каждым из которых медь реагирует без нагревания.
1) разбавленная серная кислота
2) разбавленная азотная кислота
3) 10%-ная соляная кислота
4) раствор нитрата серебра
5) раствор нитрата железа (II)
Запишите в поле ответа номера выбранных веществ.
Ответ: 24
Медь относится к малоактивным металлам (расположена в ряду активности правее водорода). В связи с этим не реагирует с растворами кислот-неокислителей. По этой причине не подходит вариант ответа 1 и 3. Азотная кислота в независимости от концентрации относится к кислотам окислителям, т.е. окисляет не водородом в степени окисления +1, а кислотообразующим элементом (азотом) в степени окисления +5. Это означает, что список металлов, с которыми может реагировать азотная кислота, распространяется не только на металлы, находящимися в ряду активности до водорода, но и на все металлы после (кроме платины и золота):
Металл с солью может реагировать в том случае, если исходный свободный металл более активен, чем тот который содержится в исходной соли. Поскольку медь более активна, чем серебро, то ее реакция с нитратом серебра возможна и протекает в соответствии с уравнением:
Поскольку медь менее активна, чем железо, то ее реакция с солями железа (II) невозможна.
Соли железа (III) в отличие от солей железа (II) являются более сильными окислителями. По этой причине соли железа (III) могут реагировать не только с металлами левее Fe в ряду активности, но также и с некоторыми металлами после. Формально это противоречит правилу, однако, это не так, поскольку вытеснение свободного железа медью не происходит. Наблюдается лишь частичное восстановление железа (III) до меньшей степени окисления. Например:
Из предложенного перечня веществ выберите два вещества, с каждым из которых хром реагирует при комнатной температуре.
- 1. HCl (разб.)
- 2. H2O
- 3. H2SO4 (разб.)
- 4. N2
- 5. H2
Запишите в поле ответа номера выбранных веществ.
Ответ: 13
Хром - металл, расположенный в ряду активности до водорода. По этой причине реагирует практически со всем кислотами, включая кислоты-неокислители. Среди представленного списка кислотами-неокислителями являются разбавленные растворы серной и соляной кислот. Обе реакции протекают по типу замещения с выделением водорода:чно Fe, Al). Реакция между пассивирующимися металлами и концентрированной серной или концентрированной азотной кислотами возможна лишь при сильном нагревании.
С водой из металлов реагируют при комнатной температуре только щелочные и щелочно-земельные металлы. Хром, будучи металлом средней активности (расположен между Al и H), реагирует с перегретым водяным паром в раскаленном состоянии, образуя оксид металла и водород.
Азот при комнатной температуре реагирует лишь с единственным металлом - литием.
Водород при комнатной температуре с металлами не реагирует. При нагревании водород способен реагировать с щелочными и щелочноземельными металлами.
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует при обычных условиях.
2) серная кислота (конц., хол.)
3) нитрат цинка (р-р)
4) нитрат меди (II) (р-р)
5) серная кислота (конц., гор.)
Запишите в поле ответа номера выбранных веществ.
Ответ: 45
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует бром.
4) гидроксид меди (II)
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Ответ: 25
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует кальций.
- 1. K2O
- 2. H2
- 3. BaCl2
- 4. H2O
- 5. Mg
Запишите в поле ответа номера выбранных веществ.
Ответ: 24
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует фосфор.
1) концентрированная соляная кислота
2) разбавленная серная кислота
3) концентрированная азотная кислота
4) гидроксид меди (II)
5) гидроксид калия
Запишите в поле ответа номера выбранных веществ.
Ответ: 35
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует хлор.
1) хлорид железа (II)
2) хлорид железа (III)
3) фторид железа (III)
4) фторид натрия
5) бромид натрия
Запишите в поле ответа номера выбранных веществ.
Ответ: 15
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует сера.
- 1. Cl2
- 2. NaCl
- 3. HCl
- 4. H2
- 5. N2
Запишите в поле ответа номера выбранных веществ.
Ответ: 14
Из предложенного перечня веществ выберите два вещества, с каждым из которых цинк реагирует без нагревания.
- 1. CuSO4
- 2. MgCl2
- 3. Na2SO4
- 4. AgCl
- 5. AgNO3
Запишите в поле ответа номера выбранных веществ.
Ответ: 15
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует кремний.
4) гидроксид натрия
5) гидроксид алюминия
Запишите в поле ответа номера выбранных веществ.
Ответ: 34
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует водород.
- 1. Na
- 2. Cl2
- 3. NaOH
- 4. HCl
- 5. NaCl
Запишите в поле ответа номера выбранных веществ.
Ответ: 12
Из предложенного перечня веществ выберите два вещества, с каждым из которых хром реагирует без нагревания.
1) хлорид железа (III)
2) концентрированная серная кислота
3) разбавленная серная кислота
4) гидроксид цинка
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Ответ: 13
Из предложенного перечня веществ выберите два вещества, с каждым из которых азот может реагировать при нагревании.
4) концентрированная серная кислота
5) концентрированная азотная кислота
Запишите в поле ответа номера выбранных веществ.
Ответ: 12
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагируют и водород, и хлор.
3) гидроксид кальция
4) металлический кальций
Запишите в поле ответа номера выбранных веществ.
Ответ: 45
Из предложенного перечня веществ выберите два вещества, в каждом из которых растворяются и железо, и медь.
1) серная кислота (разб., гор.)
2) серная кислота (конц., гор.)
3) серная кислота (конц., хол.)
4) серная кислота (разб., хол.)
5) азотная кислота (конц., гор.)
Запишите в поле ответа номера выбранных веществ.
Ответ: 25
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагируют и сера, и хлор.
5) оксид углерода (IV)
Запишите в поле ответа номера выбранных веществ.
Ответ: 13
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагируют и алюминий, и фосфор.
4) раствор хлорида железа (II)
5) раствор нитрата цинка
Запишите в поле ответа номера выбранных веществ.
Ответ: 12
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует барий.
2) гидроксид натрия
3) сульфат калия
4) хлорид кальция
Запишите в поле ответа номера выбранных веществ.
Ответ: 15
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует азот.
4) соляная кислота
Запишите в поле ответа номера выбранных веществ.
Ответ: 12
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует бром.
2) соляная кислота
3) карбонат калия
4) азотная кислота (р-р)
Запишите в поле ответа номера выбранных веществ.
Ответ: 15
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует сера.
1) серная кислота (конц.)
2) гидроксид хрома(III)
3) карбонат натрия (р-р)
4) хлорид меди(II)
Запишите в поле ответа номера выбранных веществ.
Ответ: 15
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует хром.
1) гидроксид цинка
3) сульфат кальция (р-р)
4) соляная кислота
5) хлорид бария (р-р)
Запишите в поле ответа номера выбранных веществ.
Ответ: 24
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует хлор.
1) азотная кислота (конц.)
2) оксид кремния
3) гидроксид калия (р-р)
4) фосфат кальция
5) бромид натрия (р-р)
Запишите в поле ответа номера выбранных веществ.
Ответ: 35
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует водород.
2) серная кислота (конц.)
3) хлорид кальция (р-р)
4) оксид меди (II)
5) гидроксид натрия (р-р)
Запишите в поле ответа номера выбранных веществ.
Ответ: 14
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует цинк.
1) сульфат магния (р-р)
2) хлорид алюминия (р-р)
3) гидроксид натрия (р-р)
4) азотная кислота (р-р)
5) гидроксид железа(II)
Запишите в поле ответа номера выбранных веществ.
Читайте также:

