Литература по предраковых заболеваниях
У большинства больных фиброаденоматозом установлены нарушения менструальной функции, доказывающие изменения в балансе гормонов. Эти нарушения менструального цикла могут быть легко замечены женщинами, если они регулярно регистрируют соответствующие дни в табель-календаре.
Различают ограниченные формы фиброаденоматоза, поражающие лишь небольшой участок железы, и распространенные (диффузные) формы, захватывающие почти всю железу и часто даже обе железы, хотя и в разной степени. Боли и ощущение набухания желез перед наступлением менструаций являются типичными для дисгормональных гиперплазии у молодых женщин в возрасте 25—39 лет. Эти признаки помогают правильному распознаванию характера изменений в молочной железе. Предраковые состояния способны подвергаться обратным изменениям, и далеко не во всех случаях они превращаются в злокачественные опухоли.
Женщинам с предопухолевыми заболеваниями следует прежде всего посоветоваться с врачами-специалистами и попытаться устранить существующие у них нарушения в половой жизни. Иногда им даже рекомендуют деторождение с последующей лактацией. Нам известно немало наблюдений, когда у молодых женщин после нормальных родов и длительного правильного кормления ребенка грудью молочная железа приобрела нормальную консистенцию и от бывшего в ней кистозного фиброаденоматоза не оставалось и следа.
Если принятые меры будут недостаточными, то можно использовать гормонотерапию. Конечно, выбор отдельных гормональных препаратов, их дозировку, порядок и длительность применения устанавливает горько врач-специалист, систематически наблюдающий больную женщину. Всякая самостоятельность женщин в принятии гормонов и лечении предраковых заболеваний вредна и опасна.
В некоторых случаях применяют хирургическое удаление резко измененных участков железы или опухолевых узлов с последующим тщательным микроскопическим исследованием удаленных участков. Поэтому такие операции производят в онкологических учреждениях или больницах, имеющих специальные патологоанатом ические лаборатории.
Каким должно быть питание при онкологических заболеваниях? Какие продукты абсолютно противопоказаны при той или иной форме рака?
Фитотерапия способна оказать существенную помощь не только в лечении онкологических заболеваний, но также и в их профилактике.
Многих людей, имеющих у себя или у родственников онкологическое заболевание, интересует вопрос: передается ли рак по наследству?
Лечение рака во время беременности является довольно сложным, ведь большинство лекарственных средств обладает токсичностью.
Какие перспективы у беременности после перенесенного онкологического заболевания? Следует ли выдерживать срок после лечения рака?
Профилактика является важной частью общей борьбы с онкологическими заболеваниями. Как же уменьшить вероятность возникновения рака?
Что представляет из себя паллиативное лечение рака? Как оно может повлиять на качество жизни онкологического больного и изменить ее к лучшему?
Учеными разработано достаточно много перспективных методов лечения рака, пока еще не признанных официальной медициной. Но все может измениться!
Как найти силы для борьбы с раком? Как не впасть в отчаяние от возможной инвалидности? Что может послужить надеждой и смыслом жизни?
Бытует такое мнение, что постоянные стрессовые ситуации способны привести к развитию онкологических заболеваний. Так ли это?
Многие онкологические больные часто страдают от резкой потери веса. Чем это вызвано и можно ли как-то справиться с этой проблемой?
Правила ухода за больными, вынужденными постоянно находиться в кровати, имеют свои особенности и их нужно обязательно знать.
- Список членов редколлегии
Федеральное государственное бюджетное учреждение науки
"Институт токсикологии Федерального медико-биологического агентства"
(ФГБУН ИТ ФМБА России)
Институт теоретической и экспериментальной биофизики Российской академии наук.
199406, Санкт-Петербург, ул.Гаванская, д. 49, корп.2
Евтина И.П.1, Сидорова И.С.1, Унанян А.Л.1, Власов Р.С.1, Кадырова А.Э.1, Карпов Д.В.1
1 - кафедра акушерства и гинекологии №1 ЛФ (зав. кафедрой – член-корр. РАМН, проф. И.С.Сидорова), Первого МГМУ им. И.М.Сеченова
Патологические процессы шейки матки относятся к актуальным вопросам современной гинекологии в связи с тем, что они часто трансформируются в злокачественные заболевания и нередко отмечаются в репродуктивном возрасте. Доброкачественные заболевания не являются причиной развития опухоли, однако часто предшествуют предраковым процессам. Одним из важных событий необходимых для развития опухолевого роста играют эпигенетические нарушения, к которым относят метилирование генов-супрессоров опухолевого роста. Комплексная оценка клинических особенностей доброкачественных и предраковых процессов шейки матки в совокупности с результатами исследования метилирования генов позволит разработать принципы прогнозирования риска по возникновению онкопатологии шейки матки.
Ключевые слова
шейка матки, доброкачественные и предраковые процессы, вирус папилломы человека, метилирование генов.
(статья в формате PDF. Для просмотра необходим Adobe Acrobat Reader)
Список литературы
2. Ашрафян Л.А., Киселев В.И. Опухоли репродуктивных органов (этиология и патогенез). М.: Димитрейд График Групп, 2008. С.216.
3. Залетаев Д.В., Немцова М.В., Бочков Н.П. Метилирование ДНК как этиологический фактор канцерогенеза. Вестник РАМН. М., 2002. №4. С. 6-11.
4. Залетаев Д.В., Немцова М.В., Стрельников В. 2004 Диагностика эпигенетической патологии при наследственных и онкологических заболеваниях. Молекулярная биология. 38, 213-223.
10. Лихтенштейн А.В., Киселева Н.П. Биохимия. М. , 2001. 66 (3). С. 657-69.
14. Прилепская В.Н., Голубенко А.Е. Эпидемиология, этиология и факторы риска заболеваний рака шейки матки. Поликлиническая гинекология под ред. проф. В.Н. Прилепской. М.,2005. С.9-20.
15. Подистов Ю.И., Лактионов К.П., Петровичев Н.И., Брюзгин В.В. Эпителиальные дисплазии шейки матки (диагностика и лечение). М.: ГЭОТАР-Медиа, 2006.
18. Ходырев Д.С. Изменение метилирования промоторных областей семи генов хромосомы 3 человека в эпителиальных опухолях. Автореф. дис. на соиск. уч. ст. канд. биол. наук. М.,2009.
19. Chan A.O., Kim S.G., Bedeir A. CpG Island methylation in carcinoid and pancreatic endocrine tumors. Oncogen 2003. Feb13; 22(6):924-934.
20. Cheung T.H ., Lo K.W., Yim S.F. Epigenetic and genetic alternation of PTEN in cervical neoplasm. Gynecol Oncol, 2004. Jun; 93(3):621-627.
21. Choy K.W., Chi Pui Pang, Ka Fai To, Christofer B.O. Yu, Joan S.K. Ng, Dennis S.G.Lam et al. Impaired Expression and Promotor hypermethylation of O6-methylguanine-DNA methyltransferase in Retinoblastoma tissues. Investigative Ophthalmology and Visual Science. 2002: 43: 1344-1349.
22. Duffy M., Napieralski R., Martens J., Span P., Spyratos F., Sweep F., Brunner N., Foekens J., Schmitt M. Methylated genes as new cancer biomarkers. European Journal of Cancer. 2008. Vol. 45. Issue 3. P. 335-346.
23. Esteller M., Corn P.G., Baylin S.B., Herman J.G. A Gene hypermethylation profile of human cancer. Cancer Research 2001. Vol.61. P.3225-3229.
24. Fenton S.L., Dallol A., Agathanggelou A., Hesson L., Ahmed-Choudhury J., Baksh S., Sardet C., Dammann R., Minna J.D., Downward J., Maher E.R., Latif F. Identification of the E1A-regulated transcription factor p120 E4F as an interacting partner of the RASSF1A candidate tumor suppressor gene. Cancer Res. 2004 Jan 1:(64):102-7.
25. Ferlay J., Bray F., Pisani P., Parkin D.M. Cancer incidence, mortality and prevalence worldwide. GLOBOCAN 2002: Version 1.0/ IARC Cancer Base NS №5. Lyon: IARCPress (www-dep.iarc.fr).
26. Fiedler M., Muller-Holzner E., Viertler H.P. et al. (2004) High level HPV-16 E7 oncoprotein expression correlates with reduced pRb-levels in cervical biopsies. FASEB J, 18(10), 1120-1122.
27. Focchi G.R., Silva I.D., Nogueira-de-Souza N.C., Dombo C., Oshima C.T., Stavale J.N. Immunohistochemical expression of p16 (INK4A) in normal uterine cervix, nonneoplastic epithelial lesions, and low-grade squamous intraepithelial lesions. J Low Genit Tract Dis. 2007 Apr. 11(2):98-104.
28. Gonkong C.S., Balcer B.L., Troxe M.L., Patterson K., Longacre T.P. Immunohistochemical superior HPV on the site of hybridization for the detection of high risk HPV in atypical squamous cell metaplasia. Am J Surg Pathol. 2007. Jan; 31 (1): 33-43.
29. House M., Guo M., Iacobuzio-Donahue C., Herman J. Molecular progression of promoter of promoter methylation in intraductal papillary mucinous neoplasms of the pancreas. Carcinogenesis. 2003. Feb 24(2): 193-198.
30. Hitchins M.P., Wong J.J., Suthers G., Suter C.M., Martin D.I., Hawkins N.J., Ward R.L. Inheritance of a cancer-associated MLH1 germ-line epimutation. N Engl J Med. 2007 Feb 15; 356(7):697-705.
31. Jeon J.H., Shin D.M., Cho S.Y., Song K.Y., Parc N.H., Kang H.S., Kim Y.D., Kim I.G. Immunocytochemical detection of HPV 16 E7 in cervical smear. Exp Mol Med. 2007. Oct 31; 39 (5):621-8.
32. Kausar M. Neyaz, R. Suresh Kumar, Showket Hussain et al. Effect of aberrant promoter methylation of FHIT and RASSF1A genes on susceptibility to cervical cancer in a North Indian population. 2008. Vol. 13. №6. Pages 597- 606.
33. Kim M., Kang H.G., Lee S.Y., Lee H.C., Choi Y.Y., Lee W.K., Cho S., Jin G., Jheon H.S., Son J.W., Lee M.H., Jung D.K., Cha S.I., Kim C.H., Kang Y.M., Kam S., Jung T.H., Jheon S., Park J.Y. Comprehensive analysis of DNA repair gene polymorphisms and survival in patients with early stage non-small-cell lung cancer. Cancer Sci. 2010 Nov. 101(11):2436-42.
34. Kondo Y., Shen L., Issa J. Critical role of histone methylation in tumor suppressor gene silencing in colorectal cancer. Molecular and cellular biology. 2003. Jan 23(1):206-215.
35. Lee S., Lee H., Kim J. Abberant CpG island hypermethylation along multistep hepatocarcinogenesis. American journal of pathology. 2003. Oct 163(4): 1371-1378.
36. Lin Z., Gao M., Zhang X., Kim Y.S., Lee E.S., Kim H.K., Kim I. The hypermethylation and protein expression of p16 INK4A and DNA repair gene O6- methylguanine-DNA methyltransferase in various uterine cervical lesions. J.Cancer Res Clin Oncol. 2005. Jun; 131(6):364-70.
37. Matallanas D., Romano D., Yee K., Kucerova L., Piazzolla D., Baccarini M., Vass J.K., Kolch W., O’neill E. RassF1A elicits apoptosis through an MST2 pathway directing proapoptotic transcription by the p73 tumor suppressor protein. Mol. Cell. 2007. Sep 21; 27(6):962-75.
38. Maruyama R., Toyooka S., Toyooka K. Abberant promoter methylation profile of prostate cancers and its relationship to clinicopathological features. Clinical cancer research. 2002. Feb 8(2):514-519.
39. Moscicki A. CIN management guidelines in adolescents and young women. Abstracts the International papillomavirus society symposium. April 13-14. 2007. Warsaw. P.17.
40. Muller H., Fiegl H., Widschwendter A., Widschwendter M. Prognostic DNA methylation marker in serum of cancer patients. Ann. N.Y. Acad. Sci. 2004. Jun;1022:44-49.
41. Narayan G., Arias-Pulido H., Koul S. Frequent promoter methylation of CDH1, DAPK, RARB and HIC1 genes in carcinoma of cervix uteri: its relationship to clinical outcome. Molecular cancer. 2003. May13;2:24.
42. Nicol G., Crichton D.N., McDowell H.E. et al. Expression of the Hypermethylated in cancer gene (HIG-1). Is associated with good outcome in breast cancer. Br. J. Cancer. 2001. 14. P. 1878-1882.
43. Ouade B.J., Yang A., Wang Y. et al. Expression of the p53 homologue p63 in early cervical neoplasia. Gynecol. Oncol. 2001.Vol. 80 P. 24-29.
44. Rathi A., Virmani A., Harada K. Aberrant methylation of the HIC1 promoter is a frequent event in specific pediatric neoplasms. Clinical cancer research 2003. Sep1; 9(10 Pt 1): 3674-3678.
45. Reesink-Peters N., Wisman G., Jeronimo C. , Tokumaru C.Y., Cohen Y., Dong S.M., Klip H.G., Buikema H.J., Suurmeijer A.J., Hollema H., Boezen H.M., Sidransky D., van der Zee A.G. Detecting cervical cancer by quantitative promoter hypermethylation assay on cervical scrapings: a feasibility study. 2004. Mol Cancer Res. May; 2(5): 289-95 .
46. Ressler S, Scheiden R, Dreier K et al. High-risk human papillomavirus E7 oncoprotein detection in cervical squamous cell carcinoma. Clin Cancer Res. 2007. Dec 1; 13(23): 7067-7072.
47. Schwartz S.M., Carter J.J., Madelaine M.M. et al. Human papillomavirus 16 and 18 L1 serology compared across anogenital cancer cites. Cancer Research. 2001. Mar 1; 61 (5): 1934-40.
48. Sedjo R.L., Fowler B.M., Sneider A. et al.Folate, vitamin B12, and homocysteine status. Findings of no relation between human papillomavirus persistence and cervical dysplasia. Nutrition. 2003. Jun; 19(6): 497-502.
49. Shivakumar L., Minna J., Sakamaci T. et al. The RASSF1A Tumor Supression Blocks Cell Cycle Progression and Inhibits Cyclin D1 Accumulation. Molecular and Cellular Biology. June 2002. Vol.22. №12. P.4309-4318.
50. Song M.S., Song S.J., Ayad N.G., Chang J.S., Lee J.H., Hong H.K., Lee H., Choi N., Kim J., Kim H., Kim J.W., Choi E.J., Kirchner M.W., Lim D.S. The tumour suppressor RASSF1A regulates mitosis by inhibiting the APC-Cdc20 complex. Nature Cell Biol. 2004. Feb 6(2): 129-137.
51. Vos M.D., Ellis C.A., Elam C., Ulku A.S., Taylor B.J., Clark G.J. RASSF2 is a novel K-Ras-specific effector and potential tumor suppressor. The Journal of Biological Chemistry. 2003. Jul 25; 278(30): 28045-51.
52. Zochbauer-Muller S., Fong K., Virmani A. Abberant promoter methylation of multiple genes in non-small cell lung cancers. Cancer Res. 2001. Jan 1;61(1): 249-255.
53. Yildiz I.Z., Usubutun A., Firat P., Ayhan A., Kucukali T. Efficiency of immunohistochemical p16 expression and HPV typing in cervical squamous intraepithelial lesions grading and review of the p16 literature. Pathol Res Pract. 2007; 203 (6):445-9.
54. Young-Sik Cho, Jeong-Woo Kang, MinChul Cbo et al. Down modulation of IL18 expression by human papillomavirus type 16 E6 oncogene via binding to IL-18. FEBS Letters 2001; 501: 139-45.
2. Ашрафян, Л.А, Опухоли репродуктивных органов (этиология и патогенез) [текст] / Л.А. Ашрафян, В.И. Киселев – Москва, 2007. – 208с.
5. Биссет, Р, Дифференциальный диагноз при абдоминальном ультразвуковом исследовании [текст] / Р. Биссет, А. Хан– М., 1996
6. Бохман, Я.В. Руководство по онкогинекологии [текст] / Я.В. Бохман– Л.: Медицина, 1989
7. Бохман ,Я.В , Полинеоплазии органов репродуктивной системы [текст] / Я.В.Бохман, Е.П. Рыбин – Санкт-Петербург, 2001. –239с.
8. Вишневская, Е.Е, Ошибки в онкогинекологической практике: Справ. Пособие [текст] / Е.Е. Вишневская, Я.В. Бохман – Мн.: Выш. Шк., 1994. – 288 с.
12. Гершанович, М.Л. Введение в фармакотерапию злокачественных опухолей [текст] / М.Л. Гершанович, В.А. Филов, М.А. Акимов, А.А. Акимов – СПб.: Сотис, 1999. – 152 с.
16. Белогурова, М.Б.Детская онкология. Руководство для врачей [текст] / Под редакцией М.Б.Белогуровой. – Санкт-Петербург, 2002. – 351с.
17. Блинов, Н.Н. Диагностика злокачественных опухолей при диспансеризации населения [текст] / Под редакцией Н.Н. Блинова, А.Г.Веснина, Ю.Г.Пучкова. – Санкт-Петербург, 1994. – 223с.
19. Иконописов, Р. Пигментные опухоли [текст] / Р. Иконописов, Р. Райчев - София, 19976.
20. Имянитов, Е.Н, Молекулярная онкология: клинические аспекты [текст] / Е.Н. Имянитов, К.П. Хансон – Санкт – Петербург, 2007. – 211с.
21. Чиссов, В.И, Избранные лекции по клинической онкологии [текст] / Под редакцией академика РАМН В.И.Чиссова, профессора С.Л.Дарьяловой. – Моска, 2000, 734с.
22. Искендеров, Ф. Злокачественные опухоли надпочечников: дисс. д-ра.мед.наук, / Ф. Искендеров, -ВОНЦ, 1995
23. Киселев, В.И. Вирусы папилломы человека в развитии рака шейки матки [текст] / В.И. Киселев – Москва, 2004. – 179с.
25. Моисеенко, В.М, Клиническая онкология (избранные лекции) I Том [текст] / Под редакцией В.М. Моисеенко, А.Ф. Урманчеевой – Санкт – Петербург, 2006. – 175с.
26. Моисеенко, В.М, Клиническая онкология(избранные лекции) II Том [текст] / Под редакцией В.М. Моисеенко, А.Ф. Урманчеевой - Санкт – Петербург, 2006. – 255с.
27. Митьков, М.Д. Клиническое руководство по ультразвуковой диагностике [текст] / Под ред. М.Д. Митькова в 5-ти томах. – М., 1997
28. Колосов, А.Е, Рецидивы злокачественных опухолей и прогноз для больных [текст] / А.Е. Колосов, А.Г. Захарьян – Киров, 1995. – 447с.
29. Мерабишвили, В.М, Контроль качества онкологической помощи населению с использованием современных информационных систем. Пособие для врачей [текст] / Под редакцией проф. В.М.Мерабишвили. проф. В.В.Старинского. – Санкт-Петербург, 2005. – 61с.
30. Колосов, А.Е. Опухоли яичников и прогноз для больных: Руководство для врачей [текст] / А.Е. Колосов – Киров, 1996. – 240 с.
31. Моисеенко, В.М. Лекции по фундаментальной и клинической онкологии [текст / Под редакцией В.М.Моисеенко, А.Ф.Урманчеевой, К.П.Хансона. - Издательство Н-Л, 2004.- 703с.
32. Лелюк, С.Е, Комплексное ультразвуковое исследование сосудов [текст] / С.Е. Лелюк, В.Г. Лелюк - М, 1998
33. Летягин, В.П. Рак молочной железы (эпидемиология, классификация, диагностика, лечение, прогноз) [текст] / В.П. Летягин, К.П. Лактионова, И.В. Высоцкая, В.А. Котов - М., " Медицина ", 1996
34. Летягин, В.П, Первичный рак молочной железы (диагностика, лечение, прогноз) [текст] / В.П. Летягин, И.В.Высоцкая - М., 1996
35. Летягин, В.П. Редкие формы рака молочной железы [текст] / В.П. Летягин, К.П. Лактионов, В.Д. Ермилова и др. - М." Медицина ",1995
36. Мартов, А.Г. Рентген - эндоскопические методы диагностики и лечения заболеваний почек и верхних мочевых путей: дисс. д-ра.мед.наук,/ А.Г. Мартов, -НИИ урологии, 1993
37. Матвеев, Б.П. Рак предстательной железы [текст] / Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев - М, 1999
38. Материалы Российских онкологических конгрессов 2000-2008 гг.
39. Михайлов, А.Н. Лучевая диагностика в гастроэнтерологии [текст] / АН. Михайлов – М., 1994
41. Чиссов ,В.И, Ошибки в клинической онкологии: Руководство для врачей [текст] / Под ред. В.И. Чиссова, А.Х. Трахтенберга. – М.: Медицина, 1993. – 539с.
44. Пачес, А.И. Опухоли головы и шеи [текст] / А.И. Пачес - М., " Медицина ", 1997
45. Пачес, А.И, Рак щитовидной железы [текст] / А.И. Пачес, P.M. Пропп – Москва, 1995
47. Трахтенберг, А.Х. Рак легкого [текст] / Под ред. А.Х. Трахтенберга. – М., 1992
48. Анисимов, В.Н. Рак у пожилых [текст] / Под редакцией В.Н. Анисимова, В.М. Моисеенко, К.П. Хансона - Издательство Н-Л, 2004. -333с.
49. Романчишен, А.Ф, Курс онкологии [текст] / А.Ф. Романчишен, Г.М. Жаринов – Санкт-Петербург, 1999. – 251с.
50. Петров, С.В, Руководство по иммуногистохимической диагностике опухолей человека [текст] / Под редакцией С.В.Петрова, Н.Т.Райхлина. – Казань, 2000. – 287с.
51.Саймонтон, К, Психотерапия рака [текст] / К. Саймонтон, С. Саймонтон – Санкт-Петербург. – 2001.- 285 с.
52. Серов, В.Н, Доброкачественные опухоли и опухолевидные образования яичников [текст] / В.Н. Серов, Л.И. Кудрявцева – Москва: Триада – Х, 1999.– 152 с.
53. Трапезников, Н.Н, Справочник по онкологии [текст] / Акад. РАМН Н.Н. Трапезников и проф. И.В. Поддубная /Онкоцентр РАМН/. Справочная библиотека врача. Выпуск 4.- М., КАППА, 1996.
54. Чиссов, В.И, Торакальная онкохирургия [текст] / Под ред. В.И. Чиссова, А.Х. Трахтенберга. - М., 1992
55. Трапезников, Н.Н, Статистика злокачественных новообразований в России и странах СНГ (состояние онкологической помощи, заболеваемость и смертность) [текст] / Н.Н. Трапезников, Е.М. Аксель – Москва, 2001. – 295с.
56. Тюляндин, С.А. Лечение диссеминированных герминогенных опухолей у мужчин. Дисс. д.м.н., ВОНЦ, 1993
57. Харченко, В.П, Рак легкого. Фундаментальные проблемы и клинические перспективы. Руководство для врачей [текст] / В.П. Харченко, И.В. Кузьмин – М., 1994. – 479с.
58. Палеев, Р.Х.
Цистэктомия и илеоцистопластика у больных раком мочевого пузыря : дисс. д-ра.мед.наук,/ Палеев Р.Х. - ВОНЦ, 1993
59. Цыб, А.Ф. Ультразвуковая томография и прицельная биопсия в диагностике опухолей малого таза [текст] / А.Ф. Цыб, Г.Н. Гришин, Г.В. Нестайко – М., 1994
60. Капустин, С.В, Ультразвуковое исследование мочевого пузыря, мочеточников и почек [текст] /С.В.Капустин, С.Н.Пиманов, -1997
61. Черенков, В.Г. Клиническая онкология: Руководство для студентов и врачей [текст] / В.Г. Черенков – М.: ВУНМЦ МЗ РФ, 1999
62. Чиссов, В.И, Избранные лекции по клинической онкологии [текст] / В.И. Чиссов, С.Л. Дарьялова – Москва, 2000. – 735с.
65. Пользование онкоресурсами ИНТЕРНЕТа.
Дополнительно к литературе:
2. Петров, С.В, Руководство по иммуногистохимической диагностике опухолей человека [текст] / Под редакцией С.В.Петрова, Н.Т.Райхлина. – Казань, 2000. – 287с. (кафедра онкологии)
3. Петров, С.В. Диагностические возможности и ограничения иммуногистохимического анализа в клинической онкологии. – XII Российский онкологический конгресс [текст] / Петров С.В., Балатенко Н.В., Мухаметшина Г.З. и др. – Москва, 2008 (кафедра онкологии)
4. Напольских, В.М. Рак легкого: учебное пособие [текст] / сост. В.М. Напольских и др. – Ижевск, 2005.-52с.
6. Дурнов, Л.А. Руководство по детской онкологии [текст] / Л.А. Дурнов и др.; под ред. Л.А. Дурнова - М.: Миклош, 2003. - 503 с.
7. Бушмелев, В.А. Диагностика и лечение гемангиом у детей: учебное пособие [текст] / В.А.Бушмелев - Ижевск, 2007
8. Румянцева А.Г. Гематология [текст] /онкология детского возраста: практическое руководство по детским болезням /под ред. А.Г. Румянцева – М.: ИД Медпрактика, - Т4 - 792с.
9. Дурнов, Л.А Клинические лекции по детской онкологии. В 2-х ч [текст] / Л.А Дурнов. - М.: МИА, 2004. - 271 с.
10. Ганцев, Ш.Х. Онкология [текст] / Ш.Х Ганцев / Учебник студентов медицинских вузов.- М.: ООО МИА, 2006.- 488с
11. Чиссов, В.И. Онкология: учеб. Для студентов мед. вузов с компакт диском [текст] / под ред. В.И. Чиссова.-М.,2007
12. Ганцев, Ш.Х. Руководство к практическим занятиям по онкологии для студентов мед. Вузов [текст]/ Ш.Х Ганцев - М., 2007.
13. Трапезников, Н.Н, Онкология [текст] / Н.Н. Трапезников, А.А. Шайн // Учебник. – М.: Медицина, 1992.- с.
14. Бондарь, Г.В. Справочник онколога: Учеб. Пособие для студентов вузов [текст] / Г.В. Бондарь [и др.;] под ред. Г.В. Бондарь - М.: МЕДпресс-информ, 2003. - 400 с.
15. Чиссов, В.И. Клинические рекомендации. Онкология [текст] /гл. ред. В.И. Чиссов.- М. ГЭОТАР-Медиа, 2006 -720с
16. Пальцев, М.А. Атлас патологии опухолей человека: учебное пособие для системы послевузовского профессинального образования врачей [текст]/ М.А. Пальцев - М., 2004
17. Давыдов, М.И. Энциклопедия клинической онкологии: Руководство для практикующих врачей [текст] / М.И. Давыдов [и др.;] под ред. М.И Давыдова.- М.: РЛС-2005, 2004.- 1536с.
Законодательные и нормативно-правовые документы.
Онкологическому заболеванию могут предшествовать хронические состояния. В совокупности с генетическими особенностями организма болезни способны перейти в злокачественные опухоли. Причиной развития является ослабленный иммунитет человека. Патологические процессы, предшествующие развитию раковых новообразований, называются предраковыми заболеваниями.
Научное понятие
Патофизиология – так называется наука о больном организме, она изучает причины появления, этапы развития, протекания, исход заболеваний. Термин впервые упоминается во второй половине 19 века. Направлениями новой науки стали морфогенез и гистогенез опухолей. Морфогенез рассматривает процессы образования, статистику развития новообразований в целом. Гистогенез изучает тканевую структуру опухоли.
В работах учёных выделена классификация процессов развития опухолей, но все они протекают в одном направлении: есть начало, продолжение, но нет конца. Первая стадия определяется изменениями на клеточном уровне до доброкачественной опухоли, вторая – перерастание в онкологическое новообразование.
Доброкачественные формы подразделяются на две группы: с минимальным риском, с высоким риском малигнизации.
Не всегда предопухолевое состояние перерастает в рак. Доброкачественные новообразования подвергаются трансформации только при возникновении благоприятных условий. Это значит, что ранняя диагностика, своевременное лечение предупреждают необратимые процессы.
В медицине принято подразделять предрак на виды: облигатный и факультативный. Отдельно выделяются фоновые состояния.
Это нарушение работы органов либо процессов, которые являются причиной возникновения болезни. У фоновых заболеваний нет внешних проявлений, поэтому они трудно выявляются, организм при этом уже подвержен предраковой опасности. Для определения проводятся гистологические или цитологические исследования.
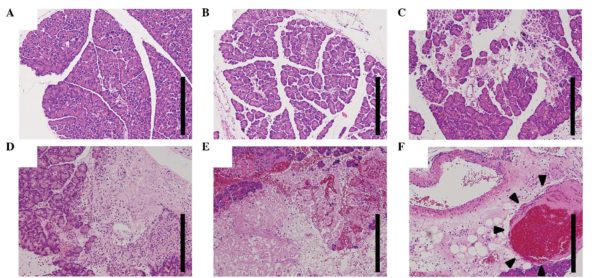
Для такого анализа необходим биологический материал – кусочек ткани. Больной орган при этом не страдает. При анализе выявляются атипичные клетки или ороговение, что считается тревожным показателем.
Не всегда происходит процесс перехода болезни в стадию онкологии. Такое состояние происходит на фоне особенностей развития тканей, органов переданных по наследству, приобретённых при рождении. Это долго незаживающие дефекты тканей.
Процессы требуют обнаружения, а затем лечения на ранних стадиях. Длительность пребывания без лечебного воздействия увеличивает шанс озлокачествления. Больные наблюдаются у специалистов (гинекологического, терапевтического профиля и других).
К факультативному виду предрака относятся хронические состояния с дистрофическими признаками тканей, дисрегенераторными процессами, где может возникнуть рост опухоли.
Патологический процесс, в результате которого происходит перерождение клеток в злокачественные новообразования. Вид предрака обусловлен наследственными заболеваниями, генетической предрасположенностью. Показателем является дисплазия участков тканей, органов.
При таком фоне человеку грозит раковая патология. Необходимо проведение лечения, постановка больного на учёт онколога. К облигатному виду относятся процессы с сопровождением нарушений стволовых элементов, созревания клеток.
Диагностика
Для предотвращения онкологических заболеваний необходима ранняя диагностика. Проведение скрининга, детального обследования позволяют выявить предраковые болезни, установить, возможен ли переход в рак, определить методы, формы лечения.
По месту локализаций опухоли разделяют по типам поражённых органов. Каждая группа заболеваний диагностируется по собственной методике.

Проблемами здоровья женщин занимается отрасль медицины – гинекология. Заболевания, которые по своей этиологии способны стать онкологическими:
- Дисплазия эпителия, эрозия, полипы шейки матки;
- Атипичная гиперплазия эндометрия тела матки;
- Доброкачественные опухоли, кисты яичников;
- Дисплазия эпителия влагалища и вульвы;
- Дисгормональная гиперплазия молочной железы.
- К лейкоплакии относятся предраки шейки матки и слизистых оболочек органов.
Предраки молочной железы:
- Мастопатия и фиброаденома молочной железы;
- Узловатая и диффузная дисгормональная гиперплазия.
Для выявления патологических процессов женских органов проводится ряд специфических исследований. Одни назначаются уже при установленных поражениях с целью уточнения диагноза, другие в профилактических целях для выявления патологии без внешних признаков. Исследования содержат перечисленные процедуры:
- Маммография – рентгенограмма грудных желёз;
- Ультразвуковое исследование молочной железы, органов малого таза, регионарных лимфатических узлов на предмет наличия метастазов;
- Генетическое тестирование;
- Цитологическое исследование шейки матки, выделений из сосков груди, половых органов;
- Кольпоскопия – инструментальное исследование эндометрия;
- Определение онкомаркеров – анализ крови;
- Гистологическое исследование – проводится анализ биологического материала;
- Онкоцитологическое исследование клеток в мазке.
Дерматологические состояния предракового генезиса характеризуются разрастанием узелков на кожном покрове, наличием пигментных пятен, папулы, зон гиперкератоза. Видимые очаги могут быть проявлением указанных заболеваний:
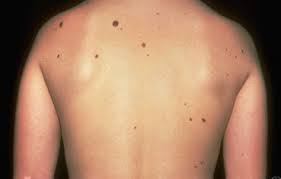
- Болезнь Боуэна;
- Бородавчатый предрак;
- Абразивный преканцерозный хейлит Манганотти;
- Ограниченный предраковый гиперкератоз слизистой оболочки полости рта и красной каймы губ;
- Кожный рог;
- Кератоз.
Предрак кожи можно увидеть, диагноз подтверждается гистологическим анализом. Для исследования берётся биологический материал – биопсия, который подвергается анализу. Отклонения, свойственные присутствию злокачественных новообразований, подтверждают наличие болезни.
Органы пищеварения имеют несколько отделов. Слизистые оболочки выстилают изнутри ЖКТ. Оболочки способны разрастаться и перерождаться в новообразования. К предраковым относятся:
- Послеожоговые рубцы, лейкоплакия пищевода;
- Гастрит, язва желудка;
- Аденоматозные полипы пищевода, желудка и кишечника;
- Язвенные колиты;
- Свищи и трещины заднего прохода;
- Рубцы различной локализации;
- Цирроз печени, желчнокаменная болезнь, гепатома;
- Диабет;
- Хронический панкреатит;
- Пролиферация покровно- ямочного эпителия;
- Рефлюкс;
- Аденома ободочной кишки;
- Семейный полипоз толстой кишки;
- Эзофагит;
- Воспаление поджелудочной железы.
Своевременная и точная диагностика, наблюдение врачей помогают избежать развития опасных форм новообразований. Рекомендованный перечень обследований:
- Эзофагогастродуоденоскопия – эндоскопия оболочек желудка; кишечника. Обнаруживает патологические опухолевые изменения.
- Двухбаллонная энтероскопия – обследование визуально обозримых отделов кишечника.
- Колоноскопия – обнаруживает полип.
- Ректороманоскопия оболочки прямой кишки.
- Анализ кала.
- Биопсия – забор материала, после исследования которого определяются формы заболевания.
- УЗИ, КТ, МРТ.
К предраку мочеполовой системы относятся болезни:
- Лейкоплакия слизистой мочевого пузыря;
- Поликистоз почек;
- Папилломы;
- Аденомы;
- Крипторхизм;
- Гиперплазия предстательной железы;
- Тератоидные опухоли яичка;
- Специфические поражения придатка яичка при гонорее и туберкулёзе.
Для установления диагноза проводятся современные методы исследования:
- ТРУЗИ;
- Биопсия;
- УЗИ;
- Рентгеновские методы;
- Компьютерная томография.
Для челюстно-лицевой области характерна очаговая структура. Опухоли лица располагаются в области губ, ротовой полости, гортани и горла. Сюда относятся образования:
- Красной каймы губ: дискератоз, папилломы;
- Слизистой ротовой полости: трещины, язвы, лейкокератоз;
- Папилломы, дискератозы, базальный фиброид, хондрома, аденома, контактная фиброма носоглотки, гортани, горла.
Исследованием с установлением диагноза является морфологический анализ. Диагностируются предраки и иными способами. Проводятся:
- Внешний осмотр полости рта;
- Мануальное обследование;
- Цитоморфологический анализ;
- Рентгенодиагностика;
- Радионуклидное обследование;
- УЗИ;
- Термография;
- Иммунодиагностика;
- Люминесцентный и флуоресцентный анализ.
Болезни респираторной системы опасны развитием онкологии лёгких:
- Бронхоэктазы – разрастание эпителия бронхов и образование складок. Клетки принимают атипичную форму и разрастаются.
- Хронические пневмонии – частые и долго длящиеся воспаления становятся факультативной формой предрака.
Обязательной к применению формой диагностики является флюорография. Профилактическая задача: определить признаки наличия патологических изменений.
Гормоны щитовидной железы необходимы для человеческого организма. Этот орган первым реагирует на отрицательные экологические изменения окружающей среды, что способствует развитию опухолей:
- Узловой зоб;
- Тиреоидит.
Достоверная диагностика проводится при проведении УЗИ, гистологическом исследовании.
Симптомы
Клиника предрака разнообразна. При одних видах она протекает без проявлений, при других выдаёт симптомы обычных болезней.
При предраковых состояниях женских репродуктивных органов клиника выявляется случайно при плановых гинекологических обследованиях.
Проявления признаков заболевания груди у женщин также неярко выражены. Невнимательное отношение к тревожным сигналам организма приводит к переходу предрака в раковые образования. Своевременное обследование поможет исключить точку невозврата.
Клинические проявления предрака ЖКТ схожи с симптомами заболеваний этих органов. Также больные испытывают боли в эпигастральной области, теряют вес. Возникает рвота с кровью, понос меняет запор, повышается температура, появляется желтизна кожи и склер глаз.
Дерматовенерология видит проблемы наружных покровов кожи, но это не всегда приводит к ранней диагностике. Симптоматика предрака кожи соответствует клинике заболеваний. Результаты проведенных анализов помогут понять и диагностировать опухоль либо не предрак.
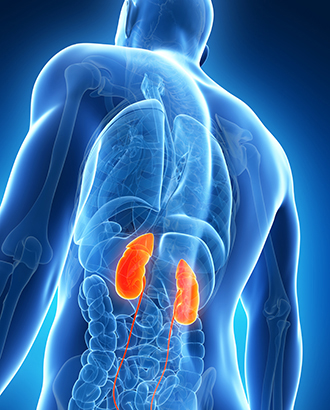
Органы мочевыводящей системы никак не проявляются при наличии предракового состояния. И только в момент активно роста проявляются специфические симптомы: болевой синдром в области почек, кровь в моче. При разрастании аденомы затруднён отток мочи. Сберечь здоровье поможет внимательное отношение к работе органов.
Предраковые состояния лёгких протекают либо бессимптомно, либо проявляется симптом воспалительного характера. Онкологическая настороженность возникает при затяжном характере хронического заболевания.
Челюстно-лицевые заболевания на начальных стадиях протекают бессимптомно, но визуально определяемы. Санация у стоматолога выявляет патологический очаг опухолевого характера.
Признаками соответствующих заболеваний проявляется предрак щитовидной железы. Наблюдается повышенная раздражительность, похудение, потоотделение, быстрая утомляемость.
Лечение
Лечение предраковых заболеваний состоит из двух направлений: удаление или разрушение очага болезни и предотвращение роста опухолевой ткани.
При факультативном проявлении и низкой степени вероятности перехода в рак проводится отслеживание болезни в динамике. Очаг не удаляется, а лечение нацелено на обратное развитие болезни.
Такая направленность означает:
- Правильное питание пациента;
- Профилактика воспалительных заболеваний;
- Отказ от вредных привычек.
Облигатные проявления предрака подвергаются удалению. Основной причиной является возможность болезни развиваться в онкологическую опухоль. В медицине разработаны технологии удаления патологических новообразований: лазеротерапия, криотерапия, электрохирургия. Если лечение не привело к желаемым результатам, опухолевая ткань удаляется, применяется облучение.
При всех видах предрака рекомендации врачей направлены на проведение иммунотерапии. Профилактика играет важную роль в предотвращении болезни. Медицина отслеживает примеры успешного лечения предраковых заболеваний. Статистика выздоровления составляет от 85 до 97%.
Читайте также:

