Лекарство от рака палладия


- Описание
- Характеристики
- Отзывы
Противоопухолевый препарат, ингибитор протеинкиназы. Действующее вещество: тоцераниб.
I. Общие сведения
Торговое наименование лекарственного препарата: Палладия (Palladia).
Международное непатентованное наименование: тоцераниб.
Лекарственная форма: таблетки для перорального применения.
Палладию выпускают в трех дозировках: по 10 мг, 15 мг и 50 мг в таблетке, которые содержат в качестве действующего вещества тоцераниб (в форме тоцераниба фосфата) - 10 мг, 15 мг и 50 мг соответственно, а в качестве вспомогательных веществ лактозы моногидрат, микрокристаллическую целлюлозу, диоксид кремния коллоидный, кросповидон, магния стеарат, краситель Опадрай II голубой.
По внешнему виду Палладия представляет таблетки круглой формы, покрытые цветной пленочной оболочкой: Палладия 10 мг - голубого цвета, Палладия 15 мг - оранжевого цвета, Палладия 50 мг - красного цвета. С одной стороны каждой таблетки вытиснено содержание тоцераниба в мг в таблетке.
Срок годности лекарственного препарата при соблюдении условий хранения - 24 месяца с даты производства. Запрещается применять Палладию по истечении срока годности.
Палладию выпускают в алюминиевых блистерах по 5 таблеток. Алюминиевые блистеры помещают в картонные коробки по 4 штуки и снабжают инструкцией по применению. Также Палладию таблетки 10 мг, 15 мг и 50 мг выпускают расфасованными по 30 штук во флаконы квадратной формы из полиэтилена высокой плотности белого цвета с полипропиленовой крышкой, недоступной для открывания детьми. Каждую потребительскую упаковку снабжают инструкцией по применению.
Хранят Палладию в закрытой упаковке производителя, в сухом, защищённом от света месте, отдельно от продуктов питания и кормов при температуре от 0°С до 30°С в местах, недоступных для детей.
Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями законодательства.
Лекарственный препарат отпускается без рецепта ветеринарного врача.
Инструкция по применению препарата Палладия в качестве противоопухолевого средства
для лечения онкологических заболеваний у собак
I. Общие сведения
Торговое наименование лекарственного препарата: Палладия (Palladia).
Международное непатентованное наименование: тоцераниб.
Лекарственная форма: таблетки для перорального применения.
Палладию выпускают в трех дозировках: по 10 мг, 15 мг и 50 мг в таблетке, которые содержат в качестве действующего вещества тоцераниб (в форме тоцераниба фосфата) - 10 мг, 15 мг и 50 мг соответственно, а в качестве вспомогательных веществ лактозы моногидрат, микрокристаллическую целлюлозу, диоксид кремния коллоидный, кросповидон, магния стеарат, краситель Опадрай II голубой.
По внешнему виду Палладия представляет таблетки круглой формы, покрытые цветной пленочной оболочкой: Палладия 10 мг - голубого цвета, Палладия 15 мг - оранжевого цвета, Палладия 50 мг - красного цвета. С одной стороны каждой таблетки вытиснено содержание тоцераниба в мг в таблетке.
Срок годности лекарственного препарата при соблюдении условий хранения - 24 месяца с даты производства. Запрещается применять Палладию по истечении срока годности.
Палладию выпускают в алюминиевых блистерах по 5 таблеток. Алюминиевые блистеры помещают в картонные коробки по 4 штуки и снабжают инструкцией по применению. Также Палладию таблетки 10 мг, 15 мг и 50 мг выпускают расфасованными по 30 штук во флаконы квадратной формы из полиэтилена высокой плотности белого цвета с полипропиленовой крышкой, недоступной для открывания детьми. Каждую потребительскую упаковку снабжают инструкцией по применению.
Хранят Палладию в закрытой упаковке производителя, в сухом, защищённом от света месте, отдельно от продуктов питания и кормов при температуре от 0°С до 30°С в местах, недоступных для детей.
Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями законодательства.
Лекарственный препарат отпускается без рецепта ветеринарного врача.
II. Фармакологические свойства
Палладия относится к группе противоопухолевых средств - ингибиторов протеинкиназы.
Тоцераниб - действующее вещество Палладии - является ингибитором протеинкиназ, обладает как прямой противоопухолевой, так и антиангиогенной активностью.
Тоцераниб избирательно ингибирует активность рецепторных тирозинкиназ (РТК), часть из которых вовлечена в рост опухолей, патологический ангиогенез и метастатизирование. В биохимических и клеточных исследованиях показано, что тоцераниб подавляет активность тирозинкиназы Flk-1/KDR (рецептора фактора роста сосудистого эндотелия, VEGFR2), рецептора фактора роста, выделенного из тромбоцитов (PDGFR) и стволовой фактор роста мастоцитов (C-kit). Тоцераниб показал антипролиферативное воздействие на эндотелиальные клетки в исследованиях in vitro. Тоцераниб оказывает влияние на клеточный цикл и вызывает апоптоз опухолевых клеток, в которых произошла мутация в гене Okit, которая и обуславливает развитие мастоцитомы у собак.
Тоцераниб достигает максимальной концентрации в плазме через 6,2 ± 2,6 часов после введения, при биодоступности около 86%. Период полувыведения у собак составляет 17,2 ± 3,9 часов. Тоцераниб на 91-93% связывается с белками плазмы. Около 93% тоцераниба фосфата выводится с фекалиями, остальные 7% выводятся с мочой.
Палладия по степени воздействия на организм относится к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007).
III. Порядок применения
Палладию применяют для лечения неоперабельных рецидивирующих опухолей тучных клеток у собак (мастоцитом) II или III степени дифференциации по гистологической классификации Патнайка.
Противопоказаниями к применению Палладии являются: возраст животного до 2 лет и/или масса тела менее 3 кг; гиперчувствительность животного к компонентам лекарственного препарата; желудочно-кишечные кровотечения; беременные и лактирующие животные, либо собаки, предназначенные для селекционного разведения.
В виду отсутствия исследований приема Тоцераниба у животных, страдающих заболеваниями печени, препарат следует применять с особой осторожностью у таких животных.
Палладию применяют собакам, начиная с 2-х летнего возраста, перорально в дозе 3,25 мг тоцераниба на 1 кг массы животного независимо от приема пищи через день (каждые 48 часов). Таблетки следует давать целиком, их нельзя разделять, разламывать или измельчать. При применении лекарственного препарата необходим тщательный контроль ветеринарного врача за состоянием животного. Продолжительность лечения зависит от эффективности проводимой терапии. Лечение следует продолжать в случаях стабилизации опухолевого процесса, либо частичной или полной реакции, при условии, что препарат достаточно хорошо переносится. В случае если наблюдается прогресс опухолевого процесса, необходимо пересмотреть целесообразность проводимой терапии.
Количество таблеток Палладии в зависимости от массы животного указано в таблице:
Масса тела собаки (кг) Количество таблеток
10 мг (голубые) 15 мг (оранжевые) 50 мг (красные)
7,0 - 8,4 1 плюс 1
10,1 - 11,5 2 плюс 1
11,6 - 13,0 1 плюс 2
16,2 - 17,6 1 плюс 3
17,7 - 19,2 1 плюс 1
19,3 - 20,7 1 плюс 1
20,8 - 23,0 2 плюс 1
23,1 - 26,9 2 плюс 1
27,0 - 29,9 3 плюс 1
32,4 - 34,6 1 плюс 2
34,7 - 36,1 1 плюс 2
36,2 - 38,4 2 плюс 2
38,5 - 43,0 2 плюс 2
47,7 - 49,9 1 плюс 3
50,0 - 51,5 1 плюс 3
51,6 - 53,8 2 плюс 3
53,9 - 58,4 2 плюс 3
* - Количество таблеток, необходимое для собак с массой тела менее 5,0 кг или более 63 кг следует рассчитывать исходя из режима дозирования 3,25 мг/кг. Собаке массой 3 - 3,5 кг следует назначать 1 таблетку 10 мг, при массе 4 - 4,5 кг - 1 таблетку 15 мг. Для минимизации нежелательных реакций доза может быть уменьшена до 2,75 мг на кг массы животного или даже до 2,25 мг на кг массы тела и вводиться через день, либо лечение может быть прервано на срок до двух недель.
При применений Палладии необходимо тщательно контролировать состояние животного. Для минимизации нежелательных явлений может понадобиться снижение дозы и/или перерыв в лечении. Необходимо анализировать ход лечения еженедельно в течение первых шести недель, а затем через каждые шесть недель, либо с периодичностью, установленной лечащим ветеринарным врачом.
Для корректного подбора дозы препарата рекомендуется провести биохимический и клинический анализы крови и анализ мочи до начала лечения и через один месяц после начала лечения, а затем через каждые шесть недель, либо с периодичностью, установленной лечащим ветеринарным врачом.
Периодический мониторинг лабораторных показателей должен проводиться с учетом клинических признаков и состояния животного.
Лечение следует полностью прекратить при повторении или сохранении тяжелых нежелательных явлений, несмотря на проводимую поддерживающую терапию и снижение дозы, как описано в таблице:
Таблица №2. Рекомендации по снижению дозы или отмене Тоцераниба при развитии побочных эффектов:
Клинические признаки / лабораторные показатели Корректировка дозы*
Менее 50% обычного объема принимаемой пищи более 2 дней Прекратить лечение и изменить схему кормления ± поддерживающая терапия до улучшения приема пищи, а затем снизить дозу на 0,5 мг/кг.
4 жидких стула в день или >2 дней Прекратить лечение до нормализации стула и ввести поддерживающую терапию, а затем снизить дозу на 0,5 мг/кг.
Свежая кровь в стуле или смолисто-черный стул более 2 дней или открытое кровотечение, либо сгустки крови в стуле Прекратить лечение и ввести поддерживающую терапию до исчезновения всех клинических признаков крови в стуле, а затем снизить дозу на 0,5 мг/кг.
Альбумин 1,5 г/дл и нормализации клинических признаков, а затем снизить дозу на 0,5 мг/кг.
Нейтропения (содержание нейтрофилов)
> 1000/мкл Сохранить уровень дозы.
1000/мкл и нормализации клинических признаков, а затем снизить дозу на 0,5 мг/кг.
> 26% Сохранить уровень дозы.
26 %, а затем снизить дозу на 0,5 мг/кг.
Гепатотоксикоз (АЛТ, ACT)
> 1 - 3-х верхних пределов нормы Сохранить уровень дозы; прекратить применение гепатотоксических средств, если таковые используются.
> 3-х верхних пределов нормы Прекратить лечение до достижения уровня 1,25 верхних пределов нормы Прекратить лечение до достижения уровня 2,5 r/дл, а затем снизить дозу на 0,5 мг/кг.
* - Снижение дозы на 0,5 мг/кг означает ее снижение с 3,25 мг/кг до 2,75 мг/кг или с 2,75 мг/кг до 2,25 мг/кг. Доза не должна быть 1/10, часто: от >1/100 до 1/1000 до

ТАСС, 7 июля. Молекулярные биологи приспособили молекулы яда пестрых скорпионов для лечения аутоиммунных болезней и определенных типов рака. Для этого ученые поменяли то, с какими ионными каналами эти молекулы взаимодействуют, пишет пресс-служба Российского научного фонда (РНФ) со ссылкой научный журнал Frontiers in Pharmacology.
"Наша глобальная цель – понять, как устроены участки взаимодействия подобных белков и калиевых каналов. Это поможет найти ключ к созданию препаратов нового поколения для персонализированной медицины", – рассказал один из авторов работы, научный сотрудник Института биоорганической химии РАН Алексей Кузьменков.
За последние десять лет биохимики и биологи создали множество новых лекарств на основе различных ядов и других веществ, которые были извлечены из тела самых разных морских и сухопутных животных. К примеру, в начале прошлого десятилетия биохимики из Франции создали мощный и не вызывающий привыкания анальгетик мамбалгин на основе яда африканской змеи черной мамбы (Dendroaspis polylepis).
Как правило, в яде змей, скорпионов, пауков и других ядовитых животных содержится множество белков и сигнальных молекул, которые могут проникать в рецепторы или ионные каналы на поверхности нервных клеток и мешать им работать. В нормальной ситуации блокировка их работы приводит к параличу или конвульсиям. Однако при развитии некоторых нейродегенеративных болезней это может пойти на пользу пациенту. Для этого нужно создать такую версию яда, которая действовала бы только на конкретные нейроны или же обладала пониженной или повышенной активностью.
Кузьменков и его коллеги решили эту задачу, используя яд пестрых скорпионов (Mesobuthus eupeus). Эти паукообразные широко распространены в Сирии, Турции, на юге России, а также в странах Центральной Азии. Вещества из их яда вызывают у человека зуд, отек и боль, но в большинстве случаев он не смертелен для человека.
"Приручение" яда
Ученые уже давно пытаются приспособить некоторые компоненты яда пестрых скорпионов для создания лекарств от малярии и некоторых инфекций, а также лечения артрита и воспалений. Российских исследователей интересовал другой компонент их яда – белок MeKTx13-3.
Он представляет собой короткую цепочку аминокислот, которая блокирует работу нескольких типов ионных каналов, управляющих круговоротом ионов калия внутри клетки. Сильнее всего этот белок затрагивает каналы типа Kv1.1, но при этом действует и на некоторые другие схожие структуры, такие как Kv1.3, хотя и с меньшей силой.
Российские ученые попытались модифицировать белок MeKTx13-3 таким образом, чтобы заставить его действовать преимущественно на каналы типа Kv1.3, нарушения в работе которых связаны с развитием рассеянного склероза, диабета и болезни Альцгеймера. Для этого ученые выяснили, как MeKTx13-3 взаимодействует со всеми типами калиевых ионных каналов.
Результаты показали, что структуру этой молекулы можно изменить таким образом, что она почти не потеряет своей способности связываться с каналами типа Kv1.3, но при этом будет значительно меньше действовать на Kv1.1 и другие варианты этих клеточных структур. Как оказалось, для этого достаточно было заменить в белковой цепочке MeKTx13-3 всего четыре звена.
Как показали опыты на зародышах лягушек, благодаря этому ученые примерно в сто раз повысили избирательность действия новой молекулы, которую назвали MeKTx13-3_AAAR. Это позволяет использовать "перепрофилированный" яд скорпиона для борьбы с различными нейродегенеративными расстройствами, раком и аутоиммунными болезнями.
Как предполагают ученые, нечто похожее можно сделать и с другими токсинами, которые воздействуют на калиевые каналы. Последующие опыты и расчеты покажут, насколько это реально осуществить на практике, подытожили исследователи.
Как они побеждают онкологию и сколько стоят?
25.10.2018 в 13:19, просмотров: 11797
Каждый год почти 10 миллионов человек в мире получают онкодиагноз. В России рак обнаруживают ежегодно у 27 тысяч пациентов. Смертность от него находится на втором месте, уступая лишь сердечно-сосудистым заболеваниям. Победить болезнь сейчас пытаются ученые всего мира. И у них это постепенно получается. В октябре 2018 года Нобелевскую премию по медицине дали Джеймсу Эллисону из США и Тасуку Хондзё из Японии за новый метод лечения рака.

Заведующий научным отделом онкоиммунологии Национального медицинского исследовательского центра онкологии им. Н. Н. Петрова Ирина БАЛДУЕВА рассказала, как работает новое лечение и когда нам удастся вылечить рак.
В норме наша иммунная система постоянно отслеживает, вовремя отлавливает и уничтожает раковые клетки. Но бывает, что иммунитет перестает видеть, распознавать их и, соответственно, бороться с ними. В итоге развивается болезнь. Один из способов лечения — химиотерапия — может убить далеко не все опухолевые клетки. Некоторые выживают и дают рост новой опухоли. Иммуноонкологические препараты (за их изобретение в этом году и дали Нобелевскую премию. — Ред.) способны заставить иммунные клетки организма увидеть опухоль и убить ее. Эти препараты связываются со специальными белками (CTLA-4 и PD-1. — Ред.) на поверхности клеток иммунной системы (Т-лимфоцитов. — Ред.), на раковой клетке и растормаживают противоопухолевый иммунный ответ. Он запускается, лимфоциты замечают раковые клетки и разрушают их.
Это настоящий прорыв в онкологии и иммунологии, это будущее. Какие виды рака можно лечить с помощью новой терапии? Если в опухоли есть определенные маркеры, то эти препараты можно назначать вне зависимости от расположения рака. Но если этих маркеров нет, то иммунная терапия не поможет. Представьте, что рак — это кубик Рубика. Так вот, новые препараты умеют блокировать, предположим, только синие квадратики. Если они в кубике Рубика есть, то опухоль можно победить. Но сейчас разрабатываются препараты, которые направлены и на другие квадратики — красные, желтые, зеленые. Как только мы научимся блокировать все части нашего воображаемого кубика Рубика, то научимся лечить и все виды рака.
СЛУЧАЙНОЕ ОТКРЫТИЕ
Открытие было сделано больше 20 лет назад. В медицине, биологии не бывает такого: сегодня открыл, а завтра уже получил Нобелевскую премию. Все лауреаты работают много лет, это длинный путь.
Что касается данного открытия, то оно было сделано очень интересным образом. [Ученые] изучали препарат для лечения аутоиммунных заболеваний — то есть агрессии иммунитета на ткани и клетки собственного организма. Все новые лекарства в обязательном порядке тестируют на аутогенность; должно быть доказано, что они не вызывают опухолевый рост. Так вот, препарат, о котором я вам рассказываю, подвергли такому же испытанию. Его давали лабораторным животным с различными видами опухоли. И оказалось, что лекарство разрушало их! Это был невероятный удивительный побочный эффект! Как получилось, что препарат, направленный на то, чтобы затормозить аутоиммунные реакции, убил опухоль? Ученые стали выяснять это и в процессе сделали открытие белков CTLA-4 и PD-1. На основании этого появились и иммуноонкологические препараты.

ЧУДО-ТАБЛЕТКИ НЕТ
Сейчас врачи-онкологи получили целый арсенал лекарственных средств. Они позволяют контролировать опухолевый рост и излечивать пациентов, которые до недавнего времени считались безнадежными. При этом надо понимать, что одной чудо-таблетки, которая раз и навсегда победит любой рак, нет. Ведь опухоль очень многолика, ее клетки находятся в разных фазах цикла: одни отдыхают, другие делятся, в-третьих происходят какие-то мутации.
Поэтому необходимо выстраивать индивидуальный подход к каждому пациенту. Если опухоль быстро растет, нужны химиопрепараты, которые будут ее разрушать. Таргетная терапия направлена на определенные белки, влияющие на рост и распространение опухоли.
Контроль за раковыми клетками, которые остались после применения химиопрепаратов — это, конечно, иммунная терапия.
Сейчас идут исследования в области генной терапии. Ее суть заключается в том, что у пациента забирают его собственные Т-клетки (они составляют часть иммунной системы. — Ред.), помещают в них гены, которые способны распознать злокачественные клетки и разрушить их, и вводят их обратно пациенту. Такое лечение может помочь больным лейкозом, которые нечувствительны к трансплантации костного мозга, к химиопрепратам и иммунной терапии. Такие лекарства уже есть за рубежом, они используются (предполагается, что в США курс генной терапии будет стоит около 300 тысяч долларов. Это примерно 19,7 миллионов рублей. — Ред.). Мы тоже разрабатываем похожий препарат. Одно его введение может излечить пациента! Я уверена, за это (исследования в области генной терапии при лечении рака. — Ред.) тоже непременно будет вручена Нобелевская премия.
ПОБОЧНЫЕ ЭФФЕКТЫ
У химиотерапии есть побочные эффекты. Например, тошнота, рвота, проблемы с пищеварением и так далее. Они могут длиться около 10 дней, а потом — пройти. К сожалению, побочные эффекты при применении иммуноонкологических препаратов более длительные. И мы их только учимся лечить. Иммунная система начинает возмущаться и атаковать собственные клетки. В результате возникают очень серьезные аутоиммунные болезни. Например, воспалительные заболевания кишечника, надпочечников, воспаление щитовидной железы. Не исключено, что в результате такого лечения рак не пройдет, но к нему добавится, например, язвенный колит или болезнь Крона. Вот такая непростая история. Иммунная терапия — это не волшебная таблетка, которую выпил и ты здоров. Но онкологи сейчас учатся обращаться с этими препаратами и справляться с побочными эффектами.
МИЛЛИОНЫ НА ЛЕЧЕНИЕ
Многие иммуноонкологические препараты уже зарегистрированы в России. Например, ипилимумаб, ниволумаб. Последний используется для профилактики прогрессирования рака. Например, пациента прооперировали, но есть высокий риск дальнейшего распространения заболевания.
К сожалению, все эти препараты пока очень дорогие. Например, некоторое время назад стоимость ипилимумаба — для лечения необходимо четыре введения этого препарата — достигала четырех миллионов рублей. Но сейчас ипилимумаб стоит значительно меньше. Здесь работает простое правило: чем больше препарат используется пациентами, тем он становится дешевле. Кроме того, Министерство здравоохранения Российской Федерации закупает некоторые препараты, и пациенты получают их.
На первой-второй стадии рака можно обойтись более дешевыми способами лечения, но, например, на третьей (стадия, при которой опухоль уже появилась в близлежащих тканях, но ее нет в других частях тела. — Ред.) или четвертой стадии (опухоль распространилась в отдаленные от места первичного поражения органы тела. — Ред.) — финансовые затраты уже очень серьезные, а лечение болезни требует очень больших усилий. Поэтому мы сейчас постепенно возвращается к тому, что надо проводить регулярные профосмотры и выявлять заболевание на ранних стадиях. К сожалению, рак сейчас очень помолодел, например, к нам приходят молодые 23-летние девушки с раком молочной железы. Но и лечение прогрессирует. Рак сейчас — это хроническое заболевание, которое требует постоянного контроля. Но не надо к нему относиться как к приговору. Я уверена, мы уже на пути к его излечению.
Новые прорывы обязательно будут, долго ждать не придется. Речь идет не о 20–30 годах, а о гораздо меньшем времени.
Исследователи из онкологического центра Рогеля Университета Мичигана провели клинические испытания нового препарата, предназначенного для лечения рака поджелудочной железы, и первые результаты являются многообещающими.
Рак поджелудочной железы является одним из смертельных видов рака
При этом средняя пятилетняя выживаемость составляет мрачные 9%. Общеизвестно, что он распространяется на отдаленные области организма и обычно устойчив к химио- и лучевой терапии.
В течение последних двух десятилетий исследователи этого института изучали различные способы борьбы с раком поджелудочной железы.
По данным Центра профилактики и контроля заболеваний (CDC), люди старше 65 лет более подвержены риску рака поджелудочной железы. CDC говорит, что мужчины:
- потребители табака,
- люди, страдающие ожирением и избыточным весом,
- диабетики,
- люди с хроническим панкреатитом,
- имеющие семейный анамнез рака поджелудочной железы, подвергаются наибольшему риску возникновения этого вида онкологии.
Фаза 1-го клинического испытания проводилась с использованием молекулы, названной AZD1775. Препарат работает путем ингибирования фермента киназы Wee1. Было показано, что киназа Wee1 играет значительную роль в восстановлении поврежденной ДНК. Раковые клетки особенно чувствительны к фатальному повреждению ДНК, поскольку их геномы нестабильны по сравнению со здоровыми клетками.
Исследователи объяснили, что химиотерапия с использованием гемцитабина, стандартного химиотерапевтического препарата, и лучевая терапия, применяемая при раке поджелудочной железы, может привести к повреждению ДНК. Раковые клетки поджелудочной железы могут восстанавливать поврежденную ДНК и, таким образом, снижать эффективность лечения.
Руководитель исследования Мередит Морган, доктор философии, объяснила, что новая молекула была в состоянии предотвратить раковые клетки поджелудочной железы от защиты от повреждения ДНК, вызванного химиотерапией. Это повысило эффективность гемцитабина и лучевой терапии. Доктор объяснила, что лечение оказало минимальное влияние на нормальные клетки.

В исследовании приняли участие 34 пациента с местнораспространенным раком поджелудочной железы.
Пациенты получали:
- радиацию,
- гемцитабин,
- AZD1775.
Доза AZD 1775 была повышена с использованием "метода непрерывной переоценки по времени". Это означало, что доза была увеличена на основании токсичности, наблюдаемой в течение первых 15 недель лечения.
Общая выживаемость улучшилась у пациентов после этого режима лечения, по сравнению с теми, кто получал химиотерапию и только радиацию. Средняя продолжительность жизни без нового препарата составляла от 12 до 14 месяцев. С добавлением нового лекарственного средства выживаемость увеличилась в среднем до 22 месяцев, и безболезненное состояние наблюдалось в течение 9 месяцев с новым лекарственным средством.
Кунео сказал: "Добавление AZD 1775 к радиации и гемцитабину относительно хорошо переносилось, что дало хорошие результаты выживания. Необходимы дальнейшие исследования с этой многообещающей комбинацией".
Эксперты добавили, что этот новый препарат также тестируется на другие виды онкозаболеваний, такие как рак молочной железы и яичников, в качестве дополнения к стандартной химиотерапии и лучевой терапии.
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.

Причиной смерти пациента-испытателя назвали неожиданную реакцию организма на экспериментальный препарат производства "Биокад". Ранее фармзавод удостоился похвалы Минздрава за "фантастические результаты" в лечении опухолей. Лекарство должно было появиться на рынке ещё год назад. Не остановит ли смерть добровольца исследования и когда ждать отечественное лекарство от рака — в расследовании Лайфа.
Одна из самых секретных разработок российской медицины попала в неприятную историю, которая могла бы так и остаться в стенах петербургской лаборатории. Рассказываем, как российские учёные изобретали молекулу для лечения меланомы и рака лёгких и с какими трудностями столкнулись.
1. Экспериментальный препарат стал главной темой онкологического конгресса
В ноябре 2018 года состоялся XXII Российский онкологический конгресс. Представители фармзавода "Биокад" и врачи рассказали об успешных испытаниях на людях новейшего отечественного лекарства от рака. Он заставляет иммунные клетки атаковать опухоль.
Речь о препарате под кодовым названием BCD-100. Это одна из самых засекреченных разработок отечественной фармацевтики — не разглашают даже имена учёных, разработавших молекулу (основное действующее вещество).
Препарат показал ошеломляющие результаты в лечении неоперабельной меланомы. Когда опухоль даёт метастазы, зловредные клетки проникают в окружающие органы и там формируют вторичные очаги болезни. Справиться с метастазирующей меланомой гораздо труднее. Однако BCD-100 сумел полностью убрать подобные опухоли у 7% пациентов. Ещё у 29% пациентов размер опухоли уменьшился не меньше чем на треть. В исследовании участвовало 126 онкобольных с неоперабельной меланомой. Испытания финансировал сам "Биокад".
Меланома (рак кожи)
Не самый частый, но один из самых агрессивных видов рака (≈74 тысяч больных в РФ). С 1950-х мировая заболеваемость выросла на 600%
Однако пациентов ждут серьёзные побочные эффекты, которые стали сюрпризом и для врачей — препарат-то новый.
"Внедрение [иммунотерапии], по-русски сказать, взорвало химиотерапевтам мозг. Мы столкнулись со спектром сложных и не понятных для нас [побочных] реакций. Может поражаться любой орган: начиная от щитовидной железы и заканчивая воспалением сосудов".
онколог центра им. Блохина Михаил Федянин
Но в декабре 2018 года НИИ онкологии им. Н.Н.Петрова (Санкт-Петербург) презентовал новые данные о результатах того же исследования.
У пациентов, принимавших BCD-100, чаще воспалялась щитовидная железа, чем у пациентов, принимающих аналогичные зарубежные препараты. Об этом заявил на конференции Федянин, то же впоследствии подтвердил и химиотерапевт из НИИ онкологии им. Н.Н. Петрова Алексей Новик. Его выступление находится в открытом доступе. Однако другие показатели побочных явлений не сильно отличались от уже выпущенных на рынок аналогов, так что Новик осторожно назвал BCD-100 "не менее безопасным", чем ему подобные.
2. Летальный исход, о котором умолчали
В ноябрьском выступлении доктор Федянин коротко обмолвился: были описаны смертельные случаи после приёма подобных препаратов. Одна из причин летальности — воспаление сердечной мышцы (миокардит).
Ни Федянин, ни Новик подолгу не останавливались на опасностях подобного рода препаратов. Врачи не упомянули и о смертельном случае с одним из пациентов-добровольцев. А самое главное, этого не сделала медицинский директор фармзавода "Биокад" Юлия Линькова.
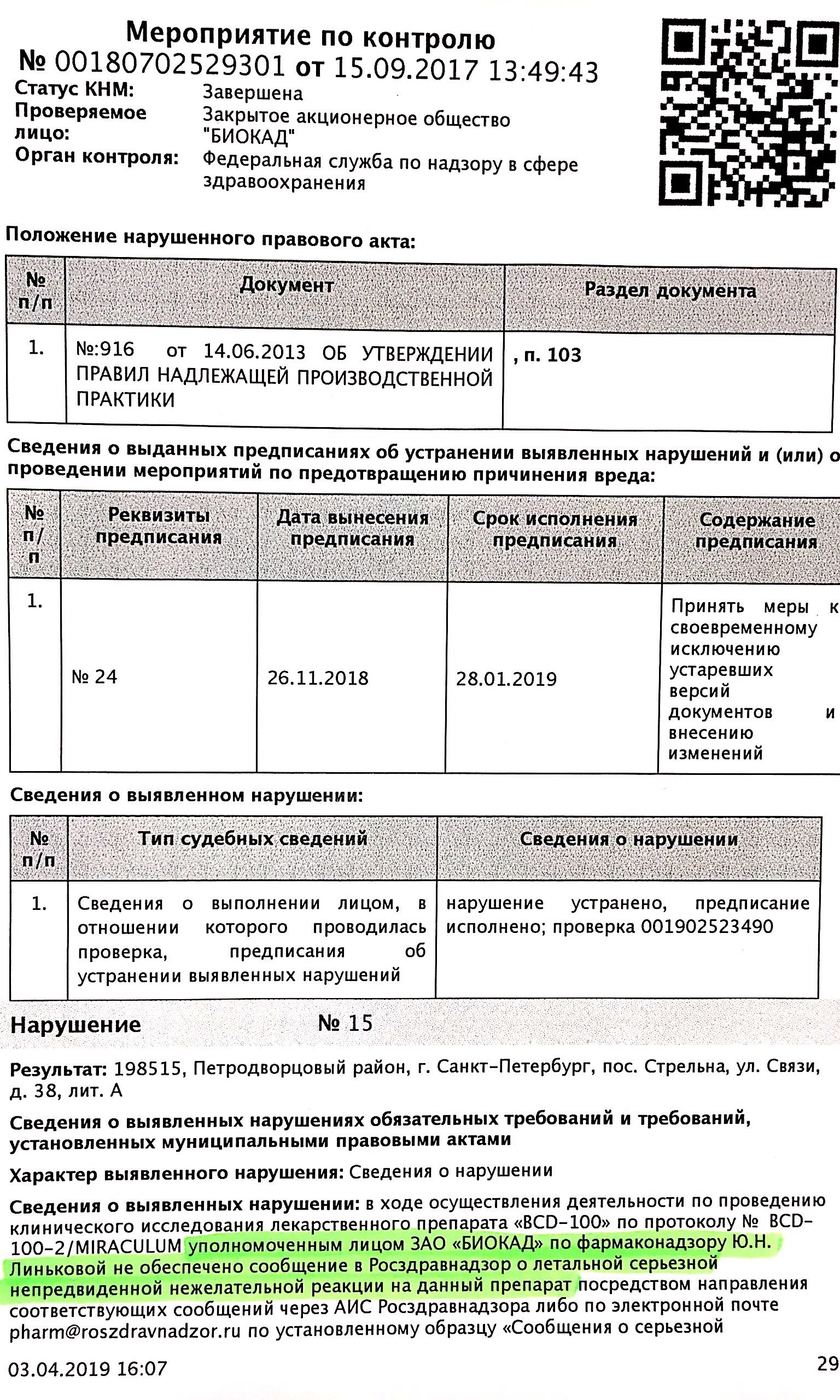
Представители завода "Биокад" вовремя не проинформировали государственные службы о смерти пациента из-за приёма BCD-100. Об этом говорится в материалах проверки Росздравнадзора, которые попали в Лайф из прокуратуры.
"В ходе клинического исследования препарата BCD-100 по протоколу Miraculum уполномоченное лицо ЗАО "Биокад" Юлия Линькова [не сообщила] в Росздравнадзор о летальной непредвиденной нежелательной реакции на данный препарат".
Материалы проверки Росздравнадзора от 26.11.18
Линькова обязана была уведомить о произошедшем либо через защищённую информационную систему Росздравнадзора, либо просто по электронной почте.
В том же предписании Росздравнадзор отмечает, что ни в 2017-м, ни в 2018-м в адрес ведомства вообще не поступало данных о безопасности трёх других препаратов, которые разрабатывает "Биокад".
Недавние исследования показали — больше половины российских медиков не сообщают в Росздравнадзор о побочных эффектах на препараты, с которыми столкнулись их пациенты. Ещё 8% вообще считают, что рассказывать о нежелательных реакциях нецелесообразно.
3. В надежде на "чудо"
Ещё в 2016 году министр здравоохранения Вероника Скворцова назвала результаты использования BCD-100 фантастическими. Протоколу, по которому исследовали лекарство, даже придумали соответствующее метафорическое название. С латыни "miraculum" переводится как " чудо". И действительно, с некоторыми пациентами BCD-100 сотворил чудо.
У 64-летней пациентки из Питера был опухолевый очаг в лёгком
Через несколько месяцев после приёма BCD-100 опухоль заметно уменьшилась в объемах. Это видно на снимках НМИЦ им. Н.Н.Петрова.
Но для других пациентов чудо обернулось проблемами или трагедией. Побочные эффекты от BCD-100 испытывали 80% пациентов, заявил на ноябрьской конференции доктор Федянин.
Чтобы разобраться, как работает BCD-100, важно понимать принцип работы иммунной системы человека.
Очень упрощённо иммунитет можно описать как систему "свой-чужой". Некоторые клетки крови умеют распознавать чужеродные бактерии и опасные тела и уничтожать их. Такой тип иммунных клеток называют Т-лимфоцитами. Получается эдакий "иммунный спецназ", который способен проникать через стенки сосудов в окружающие ткани и проводить там боевые действия против чужаков.
На поверхности Т-лимфоцита живёт белок PD-1, который отвечает за восприятие чужеродных клеток. Раковые же клетки "прячутся" от лимфоцитов, обманывая белок PD-1. Лимфоциты начинают думать, что раковая клетка — "своя", и не трогают смертельную опухоль.
Учёные по всему миру ломают головы над тем, как взломать маскировку и обучить лимфоциты распознавать в раковой клетке врага. Как уверяют создатели Miraculum, именно это им и удалось.

Создатели препарата рассчитывают, что его можно будет использовать не только для лечения меланомы и рака лёгких, но и других видов онкологии.
Поначалу на заводе "Биокад" рассчитывали выпустить лекарство на рынок в 2018 году. Сейчас сроки отодвинулись до 2022 года. Причин может быть множество: от недостаточного финансирования до неожиданно вскрывшихся проблем при использовании препарата.
В одном из интервью представители завода сравнивали цены на зарубежные аналогичные препараты. Выходило, что лечиться израильскими либо японскими средствами стоит примерно 9 миллионов рублей за курс. Отечественные разработчики обещали существенно меньшую цену за курс BCD-100. Возможно, в разы.
Хронология разработки препарата
4. Человечество писало кровью правила исследований препаратов
Лайф попросил эксперта, который много лет занимается клиническими исследованиями, рассказать о морально-этической стороне испытаний препаратов на людях. Вот что рассказала исполнительный директор Ассоциации организаций по клиническим исследованиям Светлана Завидова.
"Человечество двигалось к системе регулирования через лекарственные трагедии. Где-то, конечно, своим умом доходили, но в основном двигателем послужил негативный опыт, который и приводил к разработке тех или иных правил. Правила писали "на крови".
Светлана Завидова, Ассоциация по клиническим исследованиям
Один из первых мировых законодательных актов на тему регулирования исследований препаратов появился в США в 1938 году. Взяться за его разработку пришлось после того, как из-за неподтверждённого по критериям безопасности препарата сульфаниламида погибло 107 человек, большинство из которых — дети. Именно после этой трагедии фармпроизводителей обязали подтверждать безопасность лекарств. В том числе и на пациентах.
Исследования на людях идут в три фазы и длятся годами. В первую, как правило, включают только здоровых добровольцев. Вторая фаза — это испытания на пациентах, страдающих от конкретного заболевания. Обычно в них участвует несколько сотен человек. Третья фаза — самая масштабная: здесь в выборку могут включить несколько тысяч больных. Именно на третьей фазе появляется большинство данных о побочных реакциях и их частоте. Все добровольцы подписывают информированное согласие, соглашаясь на все риски (вплоть до летального исхода). Для многих пациентов участие в испытаниях — последний шанс.
Только при успешном завершении третьей стадии препарат регистрируют в госорганах и завозят в аптеки.
Второй случай изучают в медвузах как пример халатного отношения к безопасности препарата в угоду его продаваемости. Препарат талидомид в середине ХХ века был одним из самых продаваемых успокоительных и снотворных. Особенно его рекомендовали беременным и кормящим матерям, чтобы справляться с ночной бессонницей, утренней тошнотой и беспокойством. При этом никакие тесты влияния таблеток на плод не проводились. Препарат активно продавался в Европе. Через несколько лет стали чаще рождаться дети с патологиями: у новорожденных не было рук, ног либо ушей.
Ещё год потребовался властям нескольких стран, чтобы увязать страшную статистику с популярностью талидомида. Всё это время компания-производитель не признавала связи между этими событиями и продолжала рекламировать лекарство как безопасное.
5. Биокад: мы ничего не пытались скрыть!
Действия петербургской фармацевтической компании, которая не сообщила в Росздравнадзор о смерти пациента, на первый взгляд выглядят попыткой скрыть негатив во избежание репутационных и иных потерь. Однако в "Биокаде" заявляют, что специально ничего не утаивали.
"Первично полученные данные не соответствовали определению "Серьёзная непредвиденная нежелательная реакция". После получения дополнительных сведений информация была передана в Росздравнадзор".
Юридический департамент ЗАО "Биокад"
— Предположение о том, что ЗАО "Биокад" пыталось скрыть летальный случай, не соответствует действительности, поскольку данная информация сообщалась в ряд компетентных органов и учреждений, — добавили представители фармзавода. — Компания провела внутреннюю проверку, по результатам которой были детализированы внутренние процедуры.
Один из корпусов завода "Биокад" в Петербурге.
Компания "Биокад" создана в 2001 году. Это одна из крупнейших биотехнологических компаний России, где разрабатывают, изучают и производят новые типы лекарств. В штате трудятся более 1800 человек. Компания фокусируется на препаратах для терапии онкологических и аутоиммунных заболеваний, также ведёт разработки в области терапии других социально значимых заболеваний.
19 апреля 2019 года Национальный медицинский исследовательский центр радиологии Минздрава сообщил об увеличении числа онкобольных в стране. На первом месте в России рак лёгких. Каждый год онкологией заболевают около 600 тысяч человек. Всего в России на онкологическом учёте стоят 3,6 миллиона человек.
Читайте также:

