Лейкоз экспрессия что такое
Научно-исследовательский институт гематологии и трансфузиологии имени Б. Ейвазова, г. Баку, Азербайджан
Острые лейкозы (ОЛ) представляют собой гетерогенную группу опухолевых новообразований системы крови - гемобластозов, характеризующихся первичным поражением костного мозга морфологически незрелыми кроветворными (бластными) клетками с вытеснением ими нормальных элементов гемопоэза. Все острые лейкозы клональны, т.е. возникают из одной мутировавшей кроветворной клетки. [1]. Алгоритм диагностики острых лейкозов в современной клинике основан на пяти базовых компонентах: получение клинических данных, морфологический анализ бластов, цитохимический анализ бластов, иммунофенотипирование бластов, цитогенетическое исследование. В генезе лейкоза лежит нарушение созревания и пролиферации гемопоэтической стволовой клетки, вызывающее блок клеточной дифференцировки и запускающее экспрессию антигенов, которые в норме отсутствуют. Использование метода проточной цитометрии основывается на четком представлении об иммунофенотипических особенностях лейкемических клеток. Определение с помощью линейно-специфичных антигенов иммунологического фенотипа бластных клеток позволяет дифференцировать острые миелобластные лейкозы (ОМЛ), острые лимфобластные лейкозы (ОЛЛ) и смешанно-клеточные лейкозы [2].
Иммунофенотипическая диагностика ОЛ основывается на выявлении фенотипического профиля, практически не встречающегося в норме:
- лейкозов с гетерогенными популяциями бластов;
- лейкозов с аберрантными фенотипами (характеризующиеся отсутствием одного или нескольких линейно-специфичных маркеров);
- лейкозов с асинхронной экспрессией антигенов (характеризующиеся одновременной экспрессией маркеров различных этапов дифференцировки).
Целью нашего исследования явилась оценка экспрессии лимфоидных антигенов на бластных клетках при различных вариантах острых миелоидных лейкозов в республике Азербайджан.
Материалы и методы. Нами было проанализировано 160 больных c диагнозом ОЛ. Среди больных было 55% мужчин и 45% женщин. Медиана возраста составила 55 лет (диапазон 18-75 лет). Разделение на исследуемые группы проводили в соответствии с вариантами лейкоза по ФАБ (франко-американо-британской) классификации. Всего исследовано 7 групп ОМЛ: М0, М1,М2, М3, М4, М5, М6.
Исследование проводилось на 3-х лазерном проточном цитометре FACS CANTO II (Beckton Discinson, USA), с использованием моноклональных антител меченых флюорохромами (FITC, PE, Pecy7, APC, APCcy7, PerCP, Violet) к поверхностным и внутриклеточным дифференцировочным антигенам лимфоидного и миелоидного рядов.
Миелоидные и моноцитарные: CD117, CD13, CD33, CD15, MPO, CD14, CD64, CD11B, CD11C;
Лимфоидный. В-клеточные: CD19, CD22, CD79a, CD10;
Т-клеточные: CD2, CD3, CD5, CD7, CD9, CD4, CD8, CD1a;
Подготовка проб. Материалом служили образцы костного мозга и периферической крови больных, стандартно стабилизированные К2 EDTA. Окраску клеток моноклональными антителами, производили с использованием лизирования с последующей отмывкой клеток.Анализ образцов проводили в программе Facs Diva. Положительной считали экспрессию маркера более чем на 20% клеток. В данном исследовании рассмотрен вариант острого лейкоза с экспрессией маркеров чужих линий, примером которой может быть коэкспрессия лимфоидных антигенов на поверхности бластных клеток у больных острыми миелоидными лейкозами. Выбор аномальных комбинаций антигенов опирался на фундаментальные исследования немецких авторов [3].
Результаты и их обсуждение. Аберрантная экспрессия антигенов дифференцировки чужих линий выявляется в большинстве случаев ОМЛ. При выявлении коэкспрессии маркеров разной линейной принадлежности, является необходимым определение суммарного фенотипа бластов для установления окончательного иммунофенотипического диагноза. Нами было проанализировано 160 случаев острого лейкоза в Азербайджане (рис. 1).
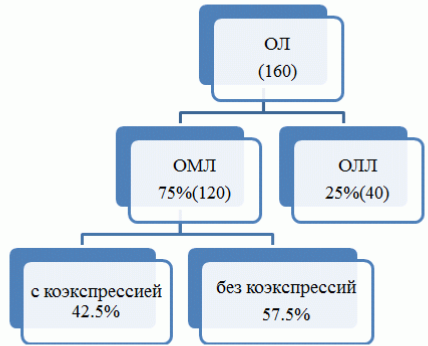
Рис. 1. Структура острых лейкозов в 2014-2015 г. в Азербайджане.
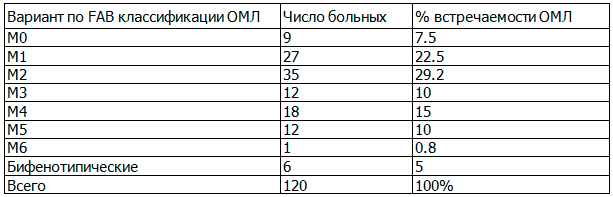
Варианты ОМЛ распределились следующим образом (табл. 1).
Таблица 1. Распределение вариантов ОМЛ в 2014-2015 г. в Азербайджане
Следующим этапом исследования явилось изучение коэкспрессии иммунофенотипических маркеров при остром миелоидном лейкозе. К наиболее частым вариантам аберрантного иммунофенотипа относится коэкспрессия Т-клеточного антигена CD7 у больных ОМ Л. Случаи с экспрессией CD7 на миелобластах характеризуются низкой частотой полных ремиссий и короткой продолжительностью жизни [4].
Объяснением данного клинического феномена может быть связь аберрантного иммунофенотипа с экспрессией гена множественной лекарственной устойчивости MDR1 [5] возможно, что агрессивное течение обусловлено возникновением лейкозного клона из ранних гемопоэтических предшественников. Вместе с тем негативное влияние аберрантной экспрессии CD7 на течение ОМЛ подтверждено не всеми исследователями. Предполагается, что более значимыми для прогноза могут быть другие клинико-лабораторные параметры, нежели иммунофенотипическая характеристика бластных клеток, и прежде всего молекулярно-генетические повреждения [6].
Подтверждением данного предположения может быть связь между кариотипом и иммунофенотипом. Так, у больных с транслокацией t(8;21) на поверхности миелобластов достаточно часто обнаруживается экспрессия антигенов CD34, CD56 и CD7, в случаях с трисомией хромосомы 8 - CD56, а при инверсии inv(16) - CD34 [7]. Аберрантная экспрессия CD7 встречается чаще у больных ОМЛ с промежуточными и неблагоприятными прогностическими вариантами нарушений кариотипа [8]. Анализ протоколов наших исследований выявил СD7 у 30 (25%) пациентов, при этом наиболее часто он встречался при ОМЛ М1-М2 вариантах (рис. 2).
Рис. 2. Проточно-цитометрический анализ образца костного мозга больного ОМЛ М2 с коэкрессией СD7. На I-м дотблоте бокового светорассеяния и CD45 гейтирована бластная популяция. На II-м дотблоте в квадранте Q2 показаны клетки одновременно позитивные по двум антигенам CD7 и CD33.
Антиген CD2 чаще встречается при ОМЛ М3 и М4эоз. Одновременная коэкспрессия антигенов CD2 и CD19 коррелирует с более высокой частотой достижения ремиссий и более длительной 2х летней выживаемостью по сравнению с [CD2;CD19] негативными больными [9]. В нашем исследовании CD2 был выявлен у 12 пациентов (10%) и наиболее часто при ОМЛ М4 варианте. Антиген CD4 встречается на очень ранних стадиях развития клеток-предшественников, коммитированных в грануломоноцитарном и эритроидном направлении, а также на мембране моноцитов и макрофагов. Наличие антигена CD4 чаще обнаруживается у больных ОМЛ с аберрацией [11q23] и коррелирует с низкой выживаемостью [10]. В данном исследовании CD4 был выявлен у 6 пациентов (5%) с диагнозом ОМЛ М5. Ранее экспрессия антигена клеточной поверхности CD9 описана на стволовых кроветворных клетках, эозинофилах, базофилах [11]. Наличие СD9 встречается при всех вариантах ОМЛ, но чаще экспрессия CD9 отмечается при промиелоцитарном лейкозе (рис. 3). В результате наших наблюдений CD9 был выявлен у 12 пациентов (10%), причем почти все случаи ОМЛ М3 были позитивны по CD9.
Рис. 3. Проточно-цитометрический анализ образца костного мозга больного ОМЛ М3v с коэкрессией СD9. На I-м дотблоте бокового светорассеяния и CD45 гейтирована бластная популяция. На II-м дотблоте в квадранте Q2-1 показаны клетки одновременно позитивные по двум антигенам.
Наличие антигена CD10 ассоциируется с более высокой частотой полных ремиссий и большой общей выживаемостью больных. В нашей практике СD10 был выявлен в 6 случаях (5%).
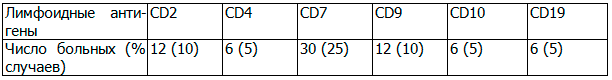
Обобщая данные протоколов наших исследований по экспрессии неродственных антигенов при миелоидных лейкозах, в 42.5% случаев ОМЛ была выявлена лимфоидная позитивность. Частота встречаемости антигенов, ассоциированных с В-линией была значительно меньше, чем антигенов специфичных для Т-линии (таблица 2).
Наиболее часто встречаемый неродственный маркер при ОМЛ М1-М2 вариантах был CD7, при ОМЛ М3 - CD9, при ОМЛ М4 - СD2 и CD4.
Самый высокий процент встречаемости среди лимфоидных маркёров, экспрессируемых одновременно с миелоидными, подтверждён для CD7. Экспрессия CD9 встречалась почти во всех случаях ОМЛ М3. В результате исследования была выявлена высокая частота экспрессии на миелоидных бластных клетках лимфоидных антигенов, из которых преобладающее значение имеют антигены асоциированные с Т-клеточной линией дифференцировки. Аберрантная коэкспрессия В-лимфоидных и миелоидных маркеров встречается в 5.5 раза реже, чем коэкспрессия Т-лимфоидных и миелоидных антигенов.
Таблица 2. Общая частота экспрессии Т-или В-клеточных антигенов у больных ОМЛ
По рекомендациям ВОЗ (2008), в диагностике гемобластозов методом проточной цитофлоуриметрии должны предусматриваться не только возможности диагностики первичного варианта опухоли, но и минимальной остаточной болезни (МОБ) [12].
Выявление у больных аберрантной экспрессии, позволяющей отличать бластные клетки от нормальных гемопоэтических клеток, дает возможность определения резидуальных лейкемическик клеток.
Исходя из вышеизложенного, необходимо отметить значимость выявления такого рода аномальных экспрессий для определения суммарного фенотипа бластов с целью улучшения иммунофенотипической диагностики острых лейкозов, более полной оценки ремиссии и риска развития раннего рецидива заболевания.
Единой, общепринятой иммуноклассификации острых миелоидных лейкозов не существует, однако многочисленные группы исследователей оценили значение мембранных антигенов миелобластов в прогнозе заболевания и пришли к выводу о существовании связи экспрессии ряда маркеров с частотой достижения полных ремиссий, их продолжительностью, а также с общей продолжительностью заболевания (выживаемость) больных.
Интересные и обнадеживающие результаты получены относительно данных иммунофенотипирования в прогнозе и выборе тактики лечения острых миелоидных лейкозов у взрослых.
Сведения о частоте экспрессии различных лимфоидных, миелоидных и линейно не рестриктированных антигенов, а также о прогностической роли иммунологических маркеров весьма противоречивы. Это, вероятно, связано с техническими особенностями определения антигенов, использованием различных антител и разной интерпретацией полученных результатов. Большинство авторов сходятся в том, что экспрессия CD7 при остром миелоидном лейкозе взрослых является фактором неблагоприятного прогноза, однако и в этом вопросе нет полного единства мнений.
Из числа перечисленных маркеров только экспрессия эритроидных антигенов была связана с большей частотой полных ремиссий: 77,8 и 40 % (р = 0,047). Короткая безрецидивная выживаемость установлена при наличии любого из трех маркеров (HLA-DR, Т-клеточные антигены, эритроидные антигены) на бластных клетках острых миелоидных лейкозов взрослых.
Иммунофенотип бластных клеток наряду с FAB-вариантом заболевания впервые был положен в основу разработанной в отделении химиотерапии гемобластозов программы дифференцированной терапии острых миелоидных лейкозов взрослых, которая была использована в отделении с июня 1996 г.
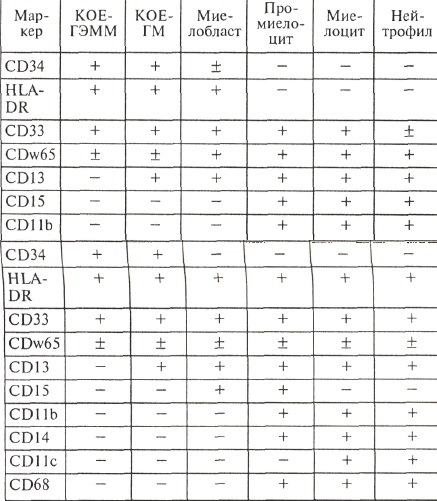
Основным принципом дифференцированной терапии явилось различное по интенсивности лечение для различных в прогностическом отношении групп больных — сохранение комбинации двух препаратов (цитозин-арабинозид и идарубицин) для группы благоприятного прогноза и усиление интенсивности терапии для группы неблагоприятного прогноза.
В группу благоприятного прогноза были отнесены больные с благоприятными FAB-вариантами Ml, M2, МЗ, М4 эозинофильный при отсутствии на бластных клетках экспрессии прогностически неблагоприятных антигенов (CD7, HLA-DR, CD34, эритроидные маркеры) или экспрессии не более одного из них.
Группу неблагоприятного прогноза составили больные с неблагоприятными FAB-вариантами: М4, М5, М6, М7 и больные с благоприятными FAB-вариантами, но с экспрессией двух или более неблагоприятных в прогностическом плане иммунологических маркеров на бластных клетках.
Трехлетняя общая и безрецидивная выживаемость при дифференцированной программе более чем в 2 раза превышает эти показатели при использовании цитозаррубомициновой программы.
Использование дифференцированной программы позволило выделить особую группу больных, которые оказались резистентными к данной программе.
Полученные результаты показали, что использование иммунофенотипа бластных клеток в качестве прогностического маркера при остром миелоидном лейкозе оказалось плодотворным: оно позволило не только создать дифференцированную программу лечения больных острым миелоидном лейкозе, но и явилось основой для дальнейших исследований особенностей патогенеза отдельных форм острого миелоидного лейкоза.
В последнее время в клинике гематологии лечение больных острыми миелоидными лейкозами детей осуществлялось по протоколу BFM-87 (в модификации). За период 1991 — 1995 гг. лечение по этой программе получили 32 ребенка. В целом результаты полихимиотерапии существенно улучшились: частота полных ремиссий возросла до 90,6 %, трехлетняя бессобытийная выживаемость составила 54 %. В условиях применения протокола BFM-87 изменилось значение иммунологических факторов прогноза.
Сохранилась благоприятная роль Т-клеточных антигенов и неблагоприятное прогностическое значение экспрессии CD11b, однако различия с группами сравнения были менее выраженными. Определенную связь с результатами лечения имели В-клеточные и стволово-клеточные (CD34) антигены. Судить с полной достоверностью о значении экспрессии эритроидных маркеров сложно, так как эта группа больных (эритроидно-позитивных острых миелоидных лейкозов) немногочисленна. Однако создается впечатление, что при наличии эритроанти генов на бластных клетках прогноз у больных был менее благоприятный.
В последние годы, помимо изучения прогностической значимости иммунофенотипических маркеров острых миелоидных лейкозов, большое внимание уделяется поиску устойчивых иммуноцитогенетических и морфоцитохимических ассоциаций. Установлено, что для варианта М2 с транслокацией (8;21) характерно отсутствие CD13. При промиелоцитарном лейкозе M3/t(15;17) типичным является фенотип HLADRCD15-. При этих вариантах, а также при М4 с эозинофилией/inv(16) прогноз у взрослых больных ОМЛ существенно лучше, чем при других вариантах.

Лейкемия – это заболевание, относящееся к гемабластозу, в результате которого клетки костного мозга повсюду замещаются на злокачественные.
В крови при лейкемии появляются не только опухолевые лейкоциты, но и эритрокариоциты, и мегакариоциты. Кроме того, образование в крови избыточного числа лейкоцитов при такой патологии необязательно. Злокачественная опухоль активно разрастается и практически не контролируется организмом.
В основном лейкемия потенциально излечима, но при хронической форме в пожилом возрасте прогнозы не очень благоприятные. Однако патологическое течение заболевания можно контролировать в течение длительного периода.
Что это такое?
Лейкемия (лейкоз, рак крови, белокровие) – опухолевое заболевание кроветворной системы (гемобластоз), связанное с заменой здоровых специализированных клеток лейкоцитарного ряда на аномально измененные лейкозные клетки. Лейкемия характеризуется быстрой экспансией и системным поражением организма — кроветворной и кровеносной систем, лимфоузлов и лимфоидных образований, селезенки, печени, ЦНС и др. Лейкемия поражает и взрослых и детей, является наиболее часто встречающимся онкозаболеванием детского возраста.
При нормальном функционировании костного мозга и хорошем здоровье человека он вырабатывает:
- Эритроциты (кровяные тельца красного цвета) – выполняют транспортную функцию, доставляя к внутренним органам кислород и питательные вещества.
- Лейкоциты (белые клетки) – защищают организм от инфекционных болезней, вирусов и прочих чужеродных тел.
- Тромбоциты – обеспечивают свертываемость крови, что дает возможность избежать большой кровопотери при травмах.
В результате мутации клетки перерождаются в раковые и уже неспособны выполнять свои функции, что провоцирует развитие заболевания и вызывает ряд осложнений. Главной опасностью является то, что попадая в кровеносную систему, они начинают быстро и бесконтрольно делиться, вытесняя и заменяя здоровые.
Измененные кровяные клетки могут попадать во внутренние органы и вызывать в них патологические изменения. Часто это приводит к таким заболеваниям, как анемия, мигрень, артрит и др. Для развития лейкемии достаточно патологического изменения строения и структуры одной клетки и попадания ее в кровеносную систему. Вылечить болезнь и остановить распространение раковых кровяных крайне сложно и часто исход весьма печальный.
Причины
Что в действительности вызывает лейкемию, на данный момент достоверно неизвестно. Между тем, имеются определенные представления на этот счет, которые вполне могут поспособствовать развитию этого заболевания.
В частности это:
- Синдром Дауна, а также ряд других заболеваний с сопутствующими хромосомными нарушениями – все это также может спровоцировать острый лейкоз.
- Химиотерапия в адрес тех или иных видов рака также может стать причиной развития в будущем лейкоза.
- Наследственность, на этот раз, значительной роли в предрасположенности к развитию лейкемии не играет. Исключительно редко на практике встречаются случаи, при которых несколько членов семьи заболевают раком в порядке, характерном для выделения наследственности как фактора, его спровоцировавшего. И если случается, что такой вариант действительно становится возможным, то преимущественно он подразумевает под собой хронический лимфоцитарный лейкоз.
- Радиоактивное воздействие: отмечается, что те люди, которые подверглись такому воздействию в значительных объемах облучения, в большей мере рискуют приобрести острый миелобластный лейкоз, острый лимфобластный лейкоз или лейкоз миелоцитарный хронический.
- .Длительный контакт с широко используемыми в области химической промышленности бензенами, в результате воздействия которых, соответственно, повышается риск развития лейкозов определенных их типов. Кстати, бензены содержатся также в бензине и в сигаретном дыме.
Важно также отметить и то, что если вы определили по перечисленным факторам подверженность риску развития лейкемии, это вовсе не является достоверным фактом для обязательного ее развития у вас. Многие люди, отмечая для себя даже одновременно несколько актуальных из перечисленных факторов, с заболеванием, между тем, не сталкиваются.
Классификация
В зависимости от количества лейкоцитов в периферической крови выделяют несколько типов болезни. Это лейкемический, сублейкемический, лейкопенический и алейкемический лейкоз. По особенностям развития выделяют острую и хроническую патологии. На первую приходится до 60% случаев, при ней наблюдается быстрый рост популяции бластных клеток, которые не созревают.
Острый тип заболевания подразделяется на виды:
- лимфобластный – диагностирован в 85% случаев у заболевших детей 2–5 лет. Опухоль формируется по лимфоидной линии, состоит из лимфобластов;
- миелобластный – поражение миелоидной линии кроветворения, отмечен в 15% случаев у детей, больных лейкозом. При нем разрастаются миелобласты. Лейкоз этого вида делится на миеломонобластный, промиелоцитарный, монобластный, мегакариоцитарный, эритроидный;
- недифференцированный – характеризуется ростом клеток без признаков отличий, представлен однородными мелкими стволовыми бластами.
Болезнь развивается медленно, характеризуется избыточным ростом зрелых неактивных лейкоцитов. При лимфоцитарной форме заболевания развиваются В- и Т-клетки (лимфоциты, отвечающие за поглощение чужеродных агентов), при миелоцитарной – гранулоциты.
При классификации хронического лейкоза выделяют ювенильный, детский, взрослый типы, миеломную болезнь, эритремию. Последняя характеризуется лейкоцитозом и тромбоцитозом. При миеломном типе растут плазмоциты, нарушается обмен иммуноглобулинов.

Стадии лейкемии
При дифференцированных лейкемиях острого типа процесс протекает поэтапно и проходит три стадии.
- Начальная – симптомы выражены в незначительной степени, часто начальная стадия проходит мимо внимания больного. Иногда лейкемия выявляется при случайном исследовании крови.
- Стадия развернутых проявлений, с четкими клиническими и гематологическими признаками болезни.
- Терминальная – отсутствие эффекта от цитостатической терапии, выраженное угнетение нормального кроветворения, язвенно-некротические процессы.
Ремиссия при острой лейкемии может быть полной или неполной. Возможны рецидивы, каждый последующий рецидив прогностически более опасен, чем предыдущий.
Хронические лейкемии характеризуются более доброкачественным и длительным течением, периодами ремиссий и обострений. Различают три стадии хронической лейкемии.
- Хроническая стадия – характеризуется постепенно нарастающим лейкоцитозом, увеличением перепроизводства гранулоцитов, склонностью к тромбоцитозу. Болезнь на этой стадии, как правило, протекает бессимптомно или проявляет себя незначительно выраженными признаками гиперметаболизма, анемическим синдромом.
- Стадия акселерации – изменение картины крови, отражающее снижение чувствительности к проводимой и ранее эффективной терапии. У большинства больных нет новых характерных клинических симптомов или они выражены неотчетливо.
- Стадия бластного криза (острая стадия) – резкое снижение уровня эритроцитов, тромбоцитов и гранулоцитов, что приводит к появлению внутренних кровотечений, язвенно-некротических осложнений, развитию сепсиса.
Разрастание лейкозных клеток в органах и тканях приводит к серьезной анемии, тяжелым дистрофическим изменениям паренхиматозных органов, инфекционным осложнениям, геморрагическому синдрому.
При недиффиренцируемых и малодифференцированных формах лейкемии стадийность патологического процесса отсутствует.
Признаки лейкемии
При лейкемии можно выделить характерные признаки данного онкологического заболевания общего и местного проявления.
К этим симптомам лейкемии у взрослых можно отнести: быструю утомляемость и слабость; бессонницу либо постоянное желание спать; ухудшение концентрации внимания и памяти; бледность кожных покровов и тёмные круги под глазами; незаживающие раны; образование на теле различных гематом без видимых на то причин; кровотечения из носа; часто возникающие ОРВИ и инфекции; спленомегалию и увеличение лимфоузлов, а также печени, подъём температуры.
В лабораторных анализах крови выявляют понижение или повышение СОЭ, различного вида лейкоцитозы, тромбоцитопения и анемии.
Имеющийся один или несколько вышеперечисленных признаков ещё не говорят о лейкемии. А в целях исключения или подтверждения диагноза целесообразно обследоваться в специализированной клинике и проконсультироваться у профессионалов.
Острая форма
Наиболее распространенной формой острой лейкемии у взрослых является острый миелоидный лейкоз (AML). Распространенность этой болезни составляет 1 на 100 000 человек в возрасте от 30 лет и 1 на 10 000 человек в возрасте старше 65 лет. Причины возникновения острой миелоидной лейкемией у взрослых не до конца изучены.
Симптомы острых лейкемий у взрослых:
В ходе острой лейкемии очень важно быстрая ее диагностика и принятие немедленного лечения. Острая лейкемия, если ее не лечить, приводит, как правило, к смерти в течении нескольких недель.
Хроническая форма
Этот тип заболевания характеризуется медленным или умеренным течением (от 4 до 12 лет). Проявления болезни наблюдаются в терминальной стадии после метастазирования бластных клеток за пределы костного мозга. Человек резко худеет, у него увеличивается селезенка, развиваются гнойничковые поражения кожи, пневмония.
Симптомы в зависимости от вида хронического лейкоза:
- Миелобластный – учащенное или замедленное биение сердца, стоматит, ангина, почечная недостаточность.
- Лимфобластный – нарушение иммунитета, цистит, уретрит, склонность к гнойникам, легочные поражения, опоясывающий лишай.
Общими симптомами хронической лейкемии у взрослых являются специфические признаки:
- кровотечения – носовые, кожные, обильные менструации у женщин;
- кровоподтеки, которые появляются внезапно, без механических травм;
- суставные боли в зоне грудины, тазовой кости;
- хроническая лихорадка – появляется из-за того, что внутренние воспалительные процессы активизируют работу гипоталамуса, который ответственен за повышение температуры;
- кашель, заложенность носа, частые инфекции, вызванные снижением иммунитета;
- постоянная усталость, слабость, депрессия, которые возникают из-за падения уровня эритроцитов.
Осложнения
Многие из осложнений лейкоза зависят от уменьшения количества нормальных клеток крови, а также от побочных эффектов проводимого лечения.
К ним принадлежат частые инфекционные заболевания, кровотечения, снижение веса и анемия. Другие осложнения лейкемии связаны с ее специфическим типом. Например, в 3 – 5% случаев хронической лимфоцитарной лейкемии клетки трансформируются в агрессивную форму лимфомы. Еще одним потенциальным осложнением этого типа лейкоза является аутоиммунная гемолитическая анемия, при которой организм разрушает собственные эритроциты.
Синдром лизиса опухолей – это состояние, вызванное быстрой гибелью раковых клеток при проведении лечения. Он может развиваться при любом раке, включая и лейкоз с большим количеством патологических клеток (например, при острой лейкемии). Быстрое разрушение этих клеток приводит к высвобождению большого количества фосфатов, что может стать причиной метаболических нарушений и почечной недостаточности. У детей, которым проводят лечение острой лимфобластной лейкемии, могут развиваться отдаленные неблагоприятные эффекты, включая нарушения центральной нервной системы, замедление роста, бесплодие, катаракту, увеличение риска развития других видов рака.
Частота этих отдаленных осложнений изменяется в зависимости от возраста на момент лечения, типа и силы проводимой терапии.

Диагностика
В случае, когда есть подозрение на лейкоз, человека обязательно направляют в онкогематологический стационар. Пребывание дома при подобном заболевании или подозрении – строго противопоказано! В течении нескольких дней специалисты возьмут все необходимые анализы и выполнят все инструментальные исследования.
- Первым делом берут общий и биохимический анализ крови. В общем анализе при лейкозах часто отмечается анемия (сниженное количество эритроцитов и гемоглобина), тромбоцитопения (снижение количества тромбоцитов), количество лейкоцитов может быть как снижено, так и повышено. Иногда в крови можно обнаружить бластные клетки.
- Обязательно берут костный мозг и спинно-мозговую жидкость. Анализ костного мозга является самым важным, именно на его основании устанавливают или снимают диагноз лейкоза. Спинно-мозговая жидкость является зеркалом состояния центральной нервной системы. При обнаружении в ней бластных клеток применяются более интенсивные схемы лечения.
Все остальные исследования, такие как УЗИ, компьютерная томография, рентгенография являются дополнительными и необходимы для оценки распространенности процесса.
Лечение
Терапия лейкемии дифференцирована, выбор методов лечения зависит от морфологического и цитохимического типа заболевания. Основная задача комплексной терапии – избавление организма от лейкемических клеток.
Основные методы лечения лейкемии:
- химиотерапия – лечение различными комбинациями цитостатиков в высокой дозировке (полихимиотерапия);
- лучевая терапия;
- трансплантация костного мозга – пересадка донорских стволовых клеток (аллогенная трансплантация).
Существует 5 этапов проведения химиотерапии:
- Циторедуктивный предварительный этап лечения – проводят при первой атаке острой лейкемии.
- Индукционная терапия.
- Консолидация ремиссии (2–3 курса).
- Реиндукционная терапия (повторение этапа индукции).
- Поддерживающая терапия.
Для всех форм лейкемии характерно замещение нормальной ткани патологической тканью опухоли, форма лейкемии зависит от того, какая клетка составляет морфологический субстрат опухоли.
При хронической лейкемии в доклинической стадии достаточно общеукрепляющего лечения и постоянного наблюдения врача. При отчетливых признаках перехода заболевания в фазу акселерации и бластного криза проводят цитостатическую терапию. По особым показаниям применяют облучение лимфоузлов, кожи, селезенки, проводят спленэктомию. Хорошие результаты может давать аллогенная трансплантация костного мозга.
Профилактика
Специфической первичной профилактики лейкемии не существует, неспецифическая заключается в исключении воздействия на организм потенциальных мутагенных факторов (канцерогенов) – ионизирующей радиации, токсичных химических веществ и т. д.
Вторичная профилактика сводится к тщательному контролю состояния больного и проведению противорецидивного лечения.
Прогноз
Прогноз для жизни при лейкемии зависит формы заболевания, распространенности поражения, группы риска больного, сроков постановки диагноза, ответа на лечение и др.
Более плохой прогноз лейкемия имеет у пациентов мужского пола, у детей в возрасте старше 10 лет и взрослых старше 60 лет; при высоком уровне лейкоцитов, наличии филадельфийской хромосомы, нейролейкемии; в случаях запоздалой диагностики. Острые лейкемии имеют гораздо худший прогноз из-за стремительного течения и при отсутствии лечения быстро приводят к смерти. У детей при своевременном и рациональном лечении прогноз острой лейкемии более благоприятен, чем у взрослых. Хорошим прогнозом лейкемии считается вероятность 5-ти летней выживаемости 70% и более; риск рецидивов — менее 25% .
Хроническая лейкемия при достижении бластного криза приобретает агрессивное течение с риском летального исхода из-за развития осложнений. При правильном лечении хронической формы можно добиться ремиссии лейкемии на долгие годы.
Читайте также:

