Чувствительность опухоли к рецепторам
Радиочувствительность — это ответ опухоли на облучение, который измеряется степенью регрессии, скоростью ее наступления и длительностью. Радиочувствительность зависит от ряда факторов: способности клеток устранять повреждение, гипоксии, периода клеточного цикла и доли растущих клеток. Кроме того, возможность ликвидации опухоли определяется ее начальным объемом.
Прекрасный пример относительно радиорезистентного новообразования — плоскоклеточный рак шейки матки (РШМ). Эта опухоль остается одной из самых излечиваемых, что объясняется возможностью подведения к ней высоких доз излучения и ее происхождением из тканей, которые также относительно радиорезистентны. Ключ к успешному лечению — хорошие условия для расположения радия или цезия в непосредственной близости к опухоли без превышения дозы на окружающие нормальные ткани выше переносимой.
Множество попыток было предпринято, чтобы найти способ определения радиочувствительности опухоли. Однако в настоящее время не существует надежного метода прогнозирования результата лечения данной конкретной опухоли. Не исключено, что опухоли состоят из нескольких популяций клеток с различной чувствительностью к XT и ЛТ. Чувствительные клетки погибают, а резистентные — продолжают расти. Это объясняет, почему вначале ответившие на лечение опухоли в конечном счете не излечиваются.
Для прогнозирования и изучения радиочувствительности опухолевых клеток разработаны модели in vitro. Клеточная радиочувствительность определяется в основном потерей репродуктивной способности, которую показывает кривая выживаемости, характеризующаяся начальным наклоном а и конечным b, причем а отражает невосстановимые повреждения клетки, а b — восстановимые. Отношение а/b — доза, при которой вклад от а эквивалентен вкладу от и, и есть показатель радиочувствительности.
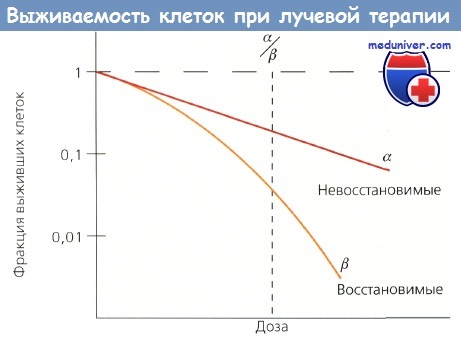
Кривая выживаемости клеток.
Начальный наклон (а) отражает невосстановимые повреждения, а конечный наклон (b) - восстановимые.
Отношение а/b — это точка на кривой, где два значения равны
Большие значения отношения характерны для быстроделящихся клеток, они помогают предсказать ответ опухолей и оценить раннюю эффективность облучения. Низкие значения характеризуют поздно реагирующие ткани.
Размер плеча кривой выживаемости дает важную информацию, т. к. отражает величину репарации сублетальных повреждений. Широкие плечи имеют низкие отношения а/b и хорошую репарацию сублетальных повреждений, которая занимает 2—6 ч. Способность клеток восстанавливать сублетальные повреждения служит основанием для фракционирования дозы ЛТ, при котором используются различия между способностью нормальных и опухолевых тканей к репарации.
Различная способность к репарации также служит основой для ускоренного фракционирования и гиперфракционирования, при которых доза подводится 2 раза в день. Такой подход дает хорошие результаты при быстро растущих опухолях. Лечение 2 раза в сутки оставляет достаточный срок нормальным тканям для репарации, тогда как опухолевые, менее организованные ткани погибают в силу нехватки времени для восстановления.
Некоторые клетки почти не имеют плеча на графике, что говорит об их ограниченной способности к репарации сублетальных повреждений; эти клетки погибают от относительно небольших доз радиации. Например, дисгерминомы излечиваются сравнительно невысокими дозами облучения (20—30 Гр) по сравнению с опухолями шейки матки, к которым необходимо подвести более 70 Гр для получения полного эффекта.
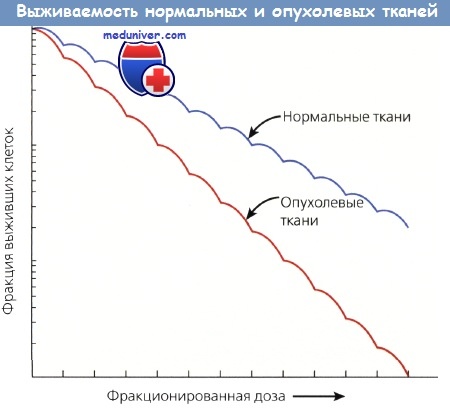
Различная выживаемость нормальных и опухолевых тканей зависит от разной их способности накапливать и репа-рировать сублетальные повреждения, полученные от фракционированных доз.
Нормальные ткани восстанавливаются быстрее и эффективнее
Способность кислорода усиливать излучение, или коэффициент кислородного усиления, вычисляется как отношение дозы излучения, производящей определенный эффект без кислорода, к дозе, дающей тот же эффект, но в присутствии кислорода. Для наблюдения полного кислородного эффекта необходимо наличие по крайней мере 2 % (17 мм рт. ст.) тканевого кислорода.
Способность опухолевых клеток к росту потенциально не ограничена, но практически зависит от поступающих с кровью питательных веществ. Известно, что любая опухоль размером более 200 мкм имеет некроз в центре вследствие ограниченной способности кислорода диффундировать на большие расстояния. Кислород легко проникает на 70 мкм от кровеносного сосуда.
Клетки, располагающиеся дальше этого расстояния, страдают от нехватки кислорода и переходят в фазу покоя. В них может развиться гипоксия и даже аноксия и некроз. Это важно с точки зрения радиобиологии, т. к. покоящиеся клетки проявляют более выраженную способность к восстановлению радиационных повреждений. Клетки в состоянии гипоксии более резистентны к облучению, чем нормально оксигенированные. Таким образом, большие опухоли труднее излечить с помощью ЛТ не только из-за большего числа составляющих их клеток, но и вследствие нахождения в них гипоксических, покоящихся и радиорезистентных клеток.
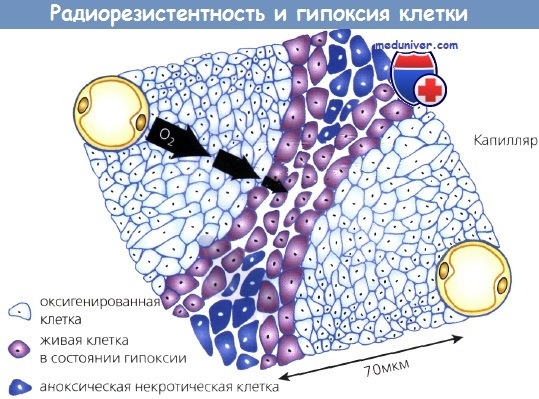
С увеличением расстояния от кровеносных сосудов клетки находятся в состоянии гипоксии и даже аноксии.
Гипоксические клетки более радиорезистентны и поэтому труднее поддаются лечению.
Кислород диффундирует примерно на 70 мкм от капилляров.
Клинический пример: замечено, что экзофитные рыхлые опухоли шейки матки, легко кровоточащие при контакте, лучше и быстрее отвечают на облучение, чем инфильтративные формы. Кровоснабжение и оксигенация этих двух видов новообразований значительно отличаются: рыхлая опухоль лучше васкуляризована и, следовательно, оксигенирована, поэтому ее радиочувствительность выше. К сожалению, к настоящему времени попытки преодолеть такое существенное различие в чувствительности к облучению с помощью гипербарической оксигенации и радиосенсибилизации не дали ожидаемых результатов.
Другим важным фактором, влияющим на радиочувствительность, служит содержание в опухоли митотических, или клоногенных, клеток. Размножающиеся клетки более чувствительны к облучению. Число митозов коррелирует с прогнозом лечения при многих опухолях. Фаза клеточного цикла тоже имеет большое значение. Клетки в поздней G2 и митотической (М) фазах наиболее чувствительны к облучению, а в поздней синтетической фазе (S) — наиболее резистентны. Это учитывается при совместном применении ЛТ и XT. Так, например, паклитаксел задерживает клетки в фазе митоза и, следовательно, выступает в роли чрезвычайно сильного радиосенсибилизатора.
От первоначального объема опухоли в значительной степени зависит возможность излечения: чем меньше объем, тем меньшая доза облучения требуется для уничтожения всехзлокачественных клеток и наоборот, при большем объеме доза, необходимая для исчезновения опухоли, возрастает. Принцип лечения сокращающимися полями заключается в последовательном уменьшении размера полей облучения с тем, чтобы подвести наибольшую дозу на центральную часть опухоли, где предположительно находятся наиболее радиорезистентные клетки в состоянии гипоксии.
В течение длительного времени клиницисты предпринимали попытки установить взаимосвязь между ответом опухоли на облучение и частотой местного рецидивировапия. В целом, чем полнее ответ опухоли к окончанию лечения и чем скорее он наступает, тем дольше период ремиссии, т. к. можно предположить, что отдаленные метастазы не появятся. Хотя эта зависимость не универсальна, при РШМ показана устойчивая корреляция между длительностью ремиссии и степенью резорбции опухоли к концу курса облучения — частичной или полной регрессией.

Grigsby установил взаимосвязь между выживаемостью и ответом опухоли к окончанию лечения, который он определял с помощью ПЭТ, основанной на измерении метаболизма глюкозы.
Другой фактор, ограничивающий излечиваемость с помощью лучевой терапии (ЛТ), — увеличение побочных эффектов со стороны нормальных тканей, связанное с повышением дозы. Появление этих осложнений зависит от суммарной дозы и дозы за фракцию, объема облученных тканей и их радиочувствительности. Цель любой терапии — достижение излечения с минимальным количеством побочных эффектов. Комбинирование ЛТ с хирургическим лечением или XT снижает толерантность нормальных тканей к облучению.
Установлены и хорошо обоснованы размеры полей, суммарные дозы и схемы фракционирования, но они не могут оставаться неизменными. Продолжают исследовать различные методы повышения процента выздоровления и снижения осложнений; для этого используют новые химиотерапевтические радиосенсибилизаторы, а также технические достижения в подведении излучения, такие как ЛТМИ и радиопротекторы, подобные этиолу.
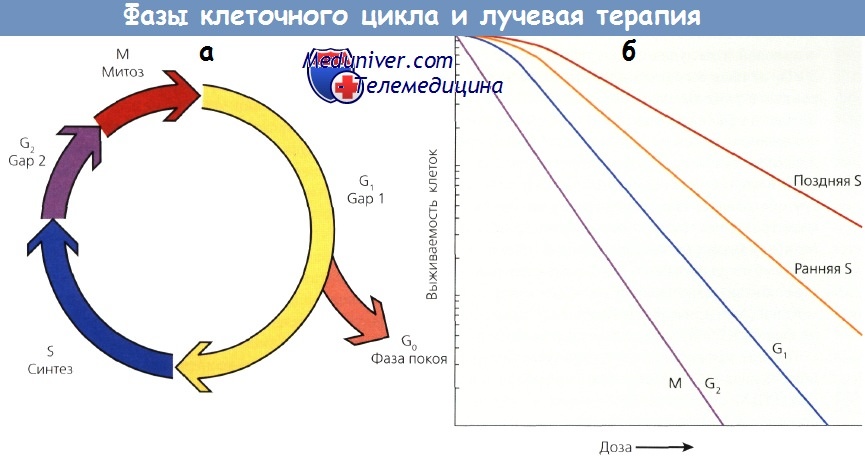
а - клеточный цикл
б - кривая выживаемости клеток в митозе и фазе G2 более крутая и не имеет плеча.
Кривая для клеток в поздней S-фазе более пологая и имеет большое плечо.
Фазы G1 и ранняя S характеризуются промежуточной чувствительностью.
- Как проводится исследование опухоли на чувствительность к химиопрепаратам?
- Какие преимущества предоставляет этот анализ?
- Как я узнаю, что это подходит мне?
- Какие методы используются для проведения анализа?
- Что входит в отчёт по данным анализа?
- Какой образец нужен, чтобы провести это исследование?
- Где проводится это исследование?
- Когда я смогу получить результаты исследования?
Научные открытия и технологические достижения сделали возможным исследовать опухоль на молекулярном уровне. С помощью тщательного анализа генетической информации и белков конкретной опухоли может быть сформирован так называемый молекулярный отпечаток вашей опухоли.
Узнайте, как последние революционные открытия в генетике и молекулярной биологии позволяют врачам получить данные для персонализированного подхода к лечению именно вашего рака. В результате исследования опухоли мы узнаем о наиболее эффективных лекарствах в каждом конкретном случае.
Как проводится исследование опухоли на чувствительность к химиопрепаратам?
Проводимое исследование различает клеточные компоненты, играющие наиболее важную роль в распространении рака. Их иногда еще называют биомаркеры. Биомаркеры составляют тот самый молекулярный отпечаток, специфический для данного пациента. Этот отпечаток в последующем сравнивается с данными доказательной медицины из современной медицинской литературы.
Данные предоставляются в виде отчета. Этот отчет поможет вашему врачу найти ту самую терапию, дающую максимальный шанс благоприятного исхода заболевания и максимально эффективную программу борьбы против опухоли.
Отчет также содержит информацию о препаратах, которых следует избегать. С помощью этой информации ваш врач примет решение о том протоколе лечения, который подходит именно вам, исходя из данных о вашей опухоли и общего состояния вашего здоровья.
Вы можете получить наиболее эффективную терапию, чтобы атаковать рак и минимизировать воздействие на здоровые клетки.
Для согласования порядка проведения анализа на чувствительность опухолей к химиопрепаратам звоните по телефону +7 (495) 151-14-53+7 (861) 200-29-568 800 100 14 98 или направьте запрос по электронной почте hospital@euroonco.ru

Какие преимущества предоставляет этот анализ?
Данные анализа на чувствительность к химиопрепаратам помогут вашему врачу сделать выбор между уже существующими протоколами лечения заболевания. Более того, они могут помочь выбрать ту терапию, которая обычно не применяется при данном виде заболевания, но может иметь положительный эффект, исходя из конкретного уникального отпечатка вашей опухоли. Этот отпечаток сопоставляется с самыми последними и лучшими данными современной медицинской литературы, чтобы определить все возможные варианты лечения, которые потенциально могут помочь.
Некоторая информация в данных вашего профиля может указать на ваше возможное участие в клиническом исследовании новых препаратов лечения того или иного заболевания.
Как я узнаю, что это подходит мне?
Проведение анализа возможно для любой плотной опухоли, например:
Чаще всего этот анализ используется у пациентов, которым стандартная терапия уже проводилась, но без должной эффективности. Также это подходит людям с метастатическим раком или пациентам с редкими или агрессивными опухолями.
Даже если вы уже проходите терапию, вам все равно может помочь этот анализ. Ваш онколог способен оценить предоставленную в отчете информацию, чтобы выбрать максимально подходящую вам терапию.
Какие методы используются для проведения анализа?
Анализ опухоли включает в себя разные техники определения биомаркеров вашей опухоли. Команда ученых использует те же самые технологии, которыми пользуются ученые с мировыми именами, публикующиеся в научных изданиях. Все данные, предоставляемые отчетом, основаны на принципах доказательной медицины. Технологии, которые мы используем, включают в себя
- иммуногистохимию,
- флуоресцентную гибридизацию in situ,
- хромогенную гибридизацию in situ
- секвенирование (анализ последовательности ДНК) последнего поколения.

Что входит в отчёт по данным анализа?
В отчёт включены результаты вашего анализа, описания препаратов, которые могут или не могут потенциально вам помочь. Помимо этого, отчет содержит сопроводительные данные из клинических исследований, на основе которых он составлялся. В приложении к отчету предоставляется краткое изложение в понятной для пациента форме. Отчёт направляется непосредственно вашему врачу.
Какой образец нужен, чтобы провести это исследование?
Исследование проводится на ткани, которую получают в результате хирургического удаления опухоли или из образца, взятого во время биопсии. Так как биомаркеры вашей опухоли могут изменяться с течением времени, лучше предоставить самый последний образец для анализа. Если же недавнего образца нет, мы все равно можем провести это исследование. Если у вас нет на руках такого образца, то скорее всего там, где вы проходили лечение, образцы сохранены в архиве. Ваш врач может их запросить.
Где проводится это исследование?
Все исследования проводятся в лаборатории Caris, которая находится в Фениксе, Аризона, США. Все лаборатории сертифицированы, работают только лицензированные техники, ученые, патологи и врачи.
Когда я смогу получить результаты исследования?
В среднем от момента получения образца до подготовки отчета по результатам проходит 10–15 дней. Результаты тут же отправляются вашему врачу для обсуждения дальнейшей стратегии.
ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ (ER, PR, HER2NEU, KI67, P53 И ДР)
Что такое иммуногистохимическое исследование?
Иммуногистохимическое исследование - особый вид исследования ткани, который предполагает использование специальных реактивов. При гистологическом исследовании материал, полученный при биопсии или после операции, окрашивают с помощью красителей. При иммуногистохимическом исследовании используют специальные реактивы, содержащие антитела, меченные специальными веществами. Антитело - белковое вещество, которое связывается в тканях с определенными участками (если они есть) - антигенами, после чего возникает реакция, по которой и можно судить, присутствует в ткани то или иное вещество или нет.
На чем основано иммуногистохимическое исследование?
Иммуногистохимическое исследование основано на реакции антиген-антитело. Такие реакции каждый день происходят в организме. Например, при попадании чужеродного вещества в организм человека у него образуется в крови антитела, которые связывают чужеродный агент. На основе этой реакции работает вакцинация (сначала в организм вводят антигены - очищенные частицы микробов и организм вырабатывает антитела, а при попадании инфекции эти антитела связывают чужеродные микроорганизмы).
При иммуногистохимическом исследовании используются сыворотки, содержащие антитела, которые связываются с этими факторами, после чего возникает реакция, по которой и можно судить о наличии их в опухоли. Можно привести "бытовой пример" на бумагу нанесен прозрачный клей. При обычном рассмотрении листа он малозаметен, но стоит только присыпать его мелким песком, как становится виден рисунок, за счет прилипающих частиц песка.
Зачем нужно иммуногистохимическое исследование?
В результаты многочисленных исследований ученые обнаружили в опухолях ряд факторов, которые связаны с прогнозом заболевания и ответом на лечение. К таким факторам относятся рецепторы к эстрогенам ( ER ) , рецепторы к прогестерону ( PR ) , ki -67 (маркер активности опухоли), her 2 neu ( определяет чувствительность опухоли к трастузумабу/герцептину), VEGF (сосудистый фактор роста), Bcl -2, р53 и др.
Все эти факторы могут содержаться в опухоли. Однако при обычном гистологическом исследовании их невозможно определить.
Как проводится иммуногистохимическое исследование?
Иммуногистохимическое исследование проводится в лаборатории. Для его проведения необходима опухолевая ткань, которую обычно получают при биопсии или после операции. Выполняется тонкий срез ткани (обычно она залита в парафин) после чего производится окрашивание с помощью специальных реактивов.
Какой материал используется для иммуногистохимического исследования?
Для иммуногистохимического исследования используется ткань, полученная при биопсии или после операции. При раке молочной железы наиболее часто используется материал биопсии. Очень важно, чтобы материал был получен до начала лечения, в противном случае результаты могут быть искажены.
Какое значение иммуногистохимическое исследование имеет при раке молочной железы?
Иммуногистохимическое исследование в настоящее время имеет одно из кардинальных значений в выборе тактики лечения, выборе самого лечения. Данные исследования помогают врачу подобрать наиболее эффективное лечение и позволяют оценить прогноз заболевания.
Что такое рецепторы к эстрогену и прогестерону?
Рецепторы к эстрогену и прогестерону - это белковые вещества, которые располагаются на поверхности опухолевой клетки. При воздействии на них женских половых гормонов образуется комплекс, который стимулирует опухоль к размножению. Несмотря на то, что гормонотерапия рака молочной железы была открыта задолго до обнаружения этих рецепторов, после их открытия показания к использованию этого метода лечения были существенно уточнены, в связи, с чем эффективность его существенно возросла. А такие препараты как тамоксифен и фарестон (группа антиэстрогенов) воздействует именно на эти рецепторы, блокируя их, не давая опухолевой клетке размножаться. Наличие в опухоли рецепторов к эстрогенам и прогестерону связано с лучшим прогнозом по отношению к опухолям, которые не содержат данные рецепторы.
Что такое her2neu?
Her 2 neu ( протоонкоген, кодирующий рецептор 2 человеческого эпидермального фактора роста c - erb В- 2) . Гиперэкспрессия (увеличенное содержание) этого фактора отмечается в 25-30% случаев рака молочной железы и ассоциируется с плохим прогнозом при наличии метастазов опухоли в регионарных лимфоузлах. Данный фактор определяет чувствительность опухоли к трастузумабу (герцептину) - одному из современных и эффективных препаратов в лечении рака молочной железы.
Что такое ki67?
Ki 67 является маркером пролиферации, то есть "определителем скорости деления опухолевой клетки". Данный параметр оценивается в процентах. При ki 67 менее 15% опухоль считается менее агрессивной, при показателе более 30% опухоль считается высоко агрессивной. ki 67 является предсказывающим фактором. Так при высоком уровне данного фактора опухоль с более высокой вероятностью ответит на химиотерапевтическое лечение. При низком уровне данного показателя опухоль в большей мере отреагирует (при наличии позитивных рецепторов к эстрогенам и прогестерону) на гормонотерапию.
Какие другие маркеры используются в диагностике рака молочной железы?
В настоящее время в рутинной практике широко используются определение рецепторов к эстрогенам и прогестерону ( ER PR ), her 2 neu , ki 67 .
Как разделяют опухоли по подтипам?

Более ста лет назад было показано, что удаление яичников, являющихся основным источником эстрогенов у женщин в пременопаузе, оказывает противоопухолевый эффект у больных с распространенным РМЖ.
Как остановить выработку гормонов?
Остановка функции яичников у женщины (хирургическая, лучевая, гормональная) приводит к снижению уровня эстрогенов крови с 1000-100 до 100-10 ммоль/л, т. е. в 10 раз. Остаточный уровень эстрогенов обеспечивается превращением андростендиона, вырабатываемого корой надпочечников, в эстрогены за счет реакции ароматизации, протекающей в жировой и некоторых других тканях.
В постменопаузе главным путем образования эстрогенов является ароматизация андрогенов, продуцируемых надпочечниками. Таким образом, блокада яичников не обеспечивает полной остановки образования этих гормонов, и требуется дополнительное воздействие, чтобы прервать стимуляцию опухоли.
Спросите вашего врача: Какое значение имеет определение рецепторов к эстрогенам и прогестерону в лечении рака молочной железы?
Определение рецепторов к эстрогену и прогестерону в опухоли молочной железы является на сегодняшний день стандартным мероприятием, позволяющим планировать объем лечение, определять в нем роль гормонотерапии, а также определять риск возникновения рецидива заболевания.
Определение рецепторов к эстрогенам и прогестерону проводится с помощью иммуногистохимического исследования. Материалом для исследования обычно являются блоки препарата (кусочек опухоли, специально обработанный и залитый в парафин). Исследование проводится в специальных лабораториях.
Значительный прогресс в лечении рака молочной железы внесли исследования по выявлению и количественному определению в опухолевых клетках стероидных рецепторов к эстрагену и прогестерону. Пациентки, опухоли которых содержали рецепторы к эстрогену и прогестерону, в 50-65% случаев оказались чувствительными к гормональной терапии. В то же время, если опухоль содержала один тип рецептора, чувствительность к гормональной терапии значительно снижалась. В случае если опухолевые клетки не содержали рецепторов, то эффективность гормонотерапии не превышала 10%.
В настоящее время общепринято, что если более 10% опухолевых клеток содержат рецепторы к эстрогену или прогестерону, то опухоль следует считать гормоночувствительной. В Израиле гормональные препараты применяются на различных этапах комбинированного и комплексного методов лечения операбельных форм рака молочной железы, а также в случаях генерализации опухолевого процесса.
Следует признать, что первичная опухоль молочной железы состоит из биологически различных популяций клеток. Они различаются по многим параметрам, в частности по скорости роста, кариотипу, наличию или отсутствию гормональных рецепторов, продукции опухоль-ассоциированных белков, иммуногенности, чувствительности к гормоно- и химиотерапии.
Эффективной последующей антиэстрогенной стратегией явилась блокада рецепторов этих гормонов. С этой целью были синтезированы селективные модуляторы рецепторов к эстрогенам (SERM) тамоксифен и торимефен. Назначение тамоксифена в течение пяти лет у пациенток с рецептор-позитивными опухолями в менопаузе позволило сократить частоту рецидивов и возникновения рака контралатеральной молочной железы на 50%, уменьшить смертность на 28%.
Помимо этих препаратов есть и новые, не упомянутые в статье, созданные по тому же принципу - блокировке рецепторов опухоли к гормонам женщины или же подавлению функции яичников. Спросите у нашего консультирующего врача о новых направлениях лечения гормоно-зависимых опухолей груди и какие успехт уже достигнуты в лечении не чувствительных к гормонам опухолей. Мы можем помочь вам - не тяните время, оно не ждет.

Клинические рекомендации Европейского Общества Медицинской Онкологии (ESMO) по диагностике и лечению первичного рака молочной железы, а также диспансерному наблюдению пациенток:
Обязательным является определение статуса эстрогеновых и прогестероновых рецепторов, оптимальным является метод иммуногистохимии.
Одновременно проводится иммуногистохимическое определение экспрессии HER2-рецепторов для выбора дальнейшего лечения.
Данное исследование поддержано Представительством фармацевтической компании "Hoffman-La Roche" в Армении.

В случае, если это исследование дает результат (++), необходимо провести определение амплификации HER2 гена методами флюоресцентной (FISH) или хромогенной гибридизации in situ (CISH).
Что такое рецепторы к эстрогенам и прогестерону?
Рецепторы к эстрогенам и прогестерону являются белковыми молекула¬ми, которые располагаются на поверхности опухоли. Эстрогены и прогестерон, которые вырабатываются в организме человека, соединяются с этими рецепторами. В результате происходит стимуляция роста опухоли.
Как определить наличие рецепторов к эстрогенам и прогестерону?
Материалом для исследования является опухоль (полученная после операции) или ее часть (после биопсии).
Метод: иммуногистохимическое окрашивание (ИГХ).
Зачем определять ЭР и ПР?
Определение рецепторов к эстрогенам и прогестерону является одной из важнейших диагностических мер, позволяющих определять чувствительность опухоли к гормоноте¬рапии. Рецепторный статус является важнейшим фактором в определении риска развития рецидива рака молочной железы.

Где можно определить ЭР и ПР?
В Центре Медицинской генетики и первичной охраны здоровья проводится определение рецепторного статуса. В настоящее время в Ереване существует только одна лаборатория, в которой проводится исследование на содержание эстрогеновых и прогестероновых рецепторов. Если вам необходимо определение рецепторов вы можете обратиться к нам.
При проведении иммуногистохимического окрашивания нами используются реактивы фирмы ДАКО (Дания), являющейся признанным лидером в данной области во всем мире.
Как часто встречаются гормональные рецепторы на поверхности клеток РМЖ?
- Около 75% всех раковых опухолей молочной железы являются гормонально-позитивными в плане эстрогеновых рецепторов (Эр-положительные).
- Около 65% из этих гормонально-позитивных опухолей имеют на поверхности и прогестероновые рецепторы (Пр-положительные).
- Около 25% всех раковых опухолей молочной железы являются гормонально-негативными как в плане эстрогена, так и прогестерона.
- Около 10% всех раковых опухолей молочной железы являются гормонально-позитивными в плане эстрогеновых рецепторов и негативными в плане прогестероновых рецепторов.
- Около 5% всех раковых опухолей молочной железы являются гормонально-негативными в плане эстрогеновых рецепторов и позитивными в плане прогестероновых рецепторов.
Если запланировано исследование амплификации гена (FISH или CISH), то определение статуса HER2-рецепторов методом иммуногистохимии не обязательно.

Рецепторный статус опухоли является значимым фактором для выбора оптимального лечения.
Пациентки с гормоночувствительными опухолями, могут получать только гормональную терапию или комбинацию гормональной и химиотерапии. Для лечения женщин с нечувствительными к гормонотерапии опухолями целесообразно применять химиотерапию, гормональная терапия не показана.
Кроме гормональной и химиотерапии, пациентки с гиперэкспрессией или амплификацией HER2 в качестве адъювантной терапии должны получать также препарат Герцептин (трастузумаб).
Контактное лицо: зав. группой биохимии и цитологии Аракелян Армине Вруйровна
Тел.: (37410) 54 43 65;
Факс: (37410) 54 43 66.
Центр медицинской генетики и первичной охраны здоровья
Наши координаты:
ул. Абовян 34/3,
Ереван 0001, АРМЕНИЯ
Тел: (+ 374 10) 54 43 67
Факс: (+ 374 10) 54 43 66
You are using an outdated browser. Please upgrade your browser or ">activate Google Chrome Frame to improve your experience.
mun.Chişinău, bd. Traian, 7/1 карта
(+373) 22 944 944 (+373) 69 944 944
Blvd. Traian 7/1, Chisinau
- Размер опухоли;
- Наличие метастазов в регионарных лимфатических узлах;
- Гистологическая степень злокачественности;
- Уровень рецепторов эстрогенов и прогестерона;
- Маркеры активности синтеза ДНК:
- индекс метки;
- фракция S-фазы;
- активность тимидин-киназы;
- Ki-67.
- Плоидность или индекс ДНК;
- Рецепторы факторов роста, включая онкогены:
- EGR-R (рецепторы эпидермального фактора роста);
- HER2/neu ;
- IGF-R(рецепторы инсулиноподобного фактора роста).
- Рецепторы к соматостатину;
- Онкосупрессорные гены;
- p53;
- Nm23;
- другие:
- уровень СА 15-3;
- Heat-shock protein (hps 27);
- pS2;
- протеин, связанный с гаптоглобином (TGF-альфа);
- катепсин D;
- активаторы урокиназы-плазминогена;
- способность к колонеобразованию in vitro;
- концентрация в тканях ферритина;
- экспрессия рецепторов ламинина;
- белок, связывающий циклическую АМФ;
- NRCK 11.
С практической точки зрения есть смысл разделять представленные факторы по следующим признакам:
- прогнозирующие наличие микрометастазов;
- прогнозирующие чувствительность к проводимому лечению;
- прогнозирующие локализацию метастазов.
Параметры, прогнозирующие наличие микрометастазов
Параметры, прогнозирующие чувствительность к проводимому лечению
1. Рецепторы к стероидным гормононам
Рецепторы стероидных гормонов- специфические белки, избирательно связывающие соответствующие стероиды после их проникновения в клетку, и опосредующие таким образом их биологические эффекты. Принципиально важным для женского рака молочной железы является присутствие в опухолевой ткани рецепторов к эстрогенам и прогестерону, что с одной стороны, свидетельствует о чувствительности к гормональной терапии, а с другой, говорит о более высокой дифференцировке последней и, соответственно, о ее более низком потенциале метастазирования;
2. Эпидермальные факторы роста
Многочисленными исследованиями было показано, что наличие в опухолевой ткани данных факторов особенно в отсутствии рецепторов к стероидным гормонам, свидетельствует о неблагоприятном прогнозе и о резистентности к проводимой гормонотерапии;
3. HER2neu
Это – уникальный представитель семейства трансмембранных тирозинкиназ, являющийся ключевым звеном передачи митогенных сигналов всех подобных рецепторам эпидермального фактора роста пептидов, совершенно необходим для полноценного функционирования системы в целом. Блокирование его может существенно замедлить или остановить рост опухолей, зависимых от любых стимулов. Созданный недавно препарат Герцептин способен в значительной степени интенсифицировать комбинированное и комплексное лечение в целях увеличения безрецидивного периода. Гиперэкспрессия этого гена прогнозирует слабый ответ на эндокринную терапию, и, наоборот, говорит о чувствительности опухоли к химиотерапии.
Параметры, прогнозирующие прогресирование и локализацию метастазов
Способность к метастазированию и инвазии- одно из фундаментальных свойств злокачественных опухолей. Разработка этой проблемы только активно начинается. Интенсивные лабораторные исследования показали, что экспрессия специфических факторов роста опухолевых клеток, так называемых протеаз, занимает центральное место во всех этих процессах. Считается, что плазмин, способный уменьшить уровень внеклеточных матричных гликопротеидов, играет решающую роль, как в локальном распространении опухоли, так и в формировании метастазов в отдаленных органах и тканях. Важная роль в разрушении внеклеточного матрикса принадлежит также активатору плазминогена урокиназного типа (uPA). Соответственно подавление активатора плазминогена урокиназного типа на различных уровнях может стать перспективным направлением современной противоопухолевой терапии. Помимо этого, солидными исследованиями показано, что риск развития рецидива или метастазирования даже при ранних стадиях возрастает в 1,5-2 раза, если уровень этих белков превышает пороговый.
В последние годы большое внимание стало уделяться неоангиогенезу, т.е. формированию новых сосудов в злокачественных опухолях. Важнейшим регулятором ангиогенеза является фактор проницаемости сосудов (ФРЭС). Исследованиями последних десятилетий показано, что ФРЭС имеет, по-видимому, существенное значение для прогноза заболевания, а также влияет на чувствительность опухолей к химио-гормонотерапии. Его высокий уровень свидетельствует о неблагоприятном прогнозе, как при раннем, так и при распространенном раке молочной железы.
Из клинических данных известно, что у пременопаузальных больных с низким содержанием рецепторов эстрогенов в первичной опухоли чаще наблюдаются висцеральные метастазы, тогда как у постменопаузальных пациенток с высоким их содержанием чаще развивается поражение костей скелета. Поскольку ежегодно панель биологических маркеров рака молочной железы переоценивается и дополняется новыми данными, существующие сведения, несомненно, со временем будут унифицированы, а некоторые из них, возможно, утратят свое значение.
Читайте также:

