Ламберта итона рак легкого
Миастенический синдром Ламберт-Итона (LEMS) является паранеопластическим синдромом, и только 3% пациентов с мелкой клеточной карциномой легкого (SCLC) имеют LEMS. Более того, рецидив SCLC после безрецидивной выживаемости (DFS) более 10 лет редок. Сообщаем пациента, у которого была рецидив как SCLC, так и LEMS после 13-летнего периода DFS. 13 лет назад у 69-летнего мужчины был диагностирован LEMS и SCLC (cT0N2M0, этап IIIA). Проведена химиотерапия, и был достигнут полный ответ. С помощью противоопухолевого лечения симптомы ЛСМ были смягчены. В возрасте 82 лет наблюдалось нарушение походки, сопровождаемое левой надключичной лимфаденопатией, и дальнейшее обследование выявило рецидив SCLC. Тщательный скрининг на повторение SCLC может потребоваться, когда у пациента возникает рецидивный или вторичный паранеопластический неврологический синдром даже после длительного периода DFS.
Миастенический синдром Ламберт-Итона (LEMS) является паранеопластическим синдромом, и только 3% пациентов с мелкой клеточной карциномой легкого (SCLC) имеют LEMS [1]. Кроме того, рецидив SCLC после безрецидивной выживаемости (DFS) более 10 лет редок 4. Здесь мы сообщаем пациенту с повторением как SCLC, так и LEMS после 13-летнего периода DFS. Наш случай может указывать на важность повторного скрининга SCLC у пациентов с рецидивом или вторичным паранеопластическим неврологическим синдромом (PNS) даже после длительного периода DFS.
В декабре 2001 года 69-летний мужчина был направлен в нашу больницу на походку и дизартрию. Костная компьютерная томография (КТ) показала медиастинальную лимфаденопатию (рис.1а), а накопление 2-дезокси-2- [18F] фтор-d-глюкозы (ФДГ) было обнаружено позитронно-эмиссионной томографией (ПЭТ). Уровень сывороточного про-гастрин-высвобождающего пептида составлял 38,3 пг / мл. Образец, полученный биопсией лимфатических узлов с медиастиноскопией, выявил мелкоклеточный рак (рис.2), и ему был поставлен диагноз SCLC (cT0N2M0, этап IIIA). Уровень сыворотки антитела к кальциевому каналу (VGCC) типа P / Q-типа с высоким напряжением (VGCC) был чрезвычайно высоким (1476 пмоль / л, верхний предел нормали, 20 пмоль / л), а электромиография (ЭМГ) показала, что восковая форма при 50 Гц ( рис. 1b). Поэтому был поставлен диагноз LEMS с SCLC. Проводили плазмоферез, внутривенную иммуноглобулиновую терапию и 3,4-диаминопиридиновую терапию, но симптомы не улучшались, а уровень VGCC-антител P / Q-типа в сыворотке оставался высоким (1608 пмоль / л). 1Радиологические данные и электромиография у пациента с мелкой клеточной карциномой легкого (SCLC) с миастеническим синдромом Ламберт-Итона (LEMS). Сундер-компьютерная томография (КТ) выявила медиастинальную лимфаденопатию (стрелка) 7 февраля 2002 г. b Электромиография после стимуляции при 50 Гц показала вощение 13 марта 2002 г.
Патологические и цитологические данные у пациента SCLC с LEMS. Образцы были получены с помощью биопсии цервикального лимфатического узла 14 февраля 2002 г. Секции, вложенные парафином, окрашивали антителом с использованием полимерного метода (Dako Envision ™ FLEX, Dako Japan, Tokyo, Japan), и был разработан сигнал с диаминобензидином (DAB). Разделы контрастировали с гематоксилином. Положительное окрашивание маркеров в цитоплазме и на клеточной мембране было обозначено коричневым цветом. a Существуют плотные листы мелких клеток с ядерным формованием и некрозом (окрашивание гематоксилин-эозином). b CD56 был диффузно и сильно положителен на клеточной мембране. c Chromogranin A был диффузно и умеренно выражен в цитоплазме. d Synaptophysin был фокально и слабо экспрессирован в цитоплазме
Карбоплатин (площадь под кривой: 5 мг / мл, день 1) и этопозид (100 мг / м2, дни 1-3) вводили внутривенно каждые 4 недели (всего восемь циклов) и лучевую терапию средостения с общей дозой 45 Gy (1,5 Гр / фракция, два раза в день). Был достигнут полный ответ. Уровень сывороточного антитела VGCC P / Q-типа заметно снизился до 958 пмоль / л после первых трех циклов химиотерапии; после всех восьми циклов он уменьшился с 1608 до 40 пмоль / л. Нарушения походки и дизартрия были смягчены. SCLC не возобновлялся в течение 13 лет.
В январе 2015 года, в возрасте 82 лет, у пациента развилось нарушение походки, сопровождаемое левой надключичной лимфаденопатией. Было проведено дополнительное исследование левой надключичной лимфаденопатии. Физический осмотр выявил проксимальную мышечную слабость и уменьшил сухожильные рефлексы в нижних конечностях. Его рентгенограмма грудной клетки показала узел узкого сечения 3,5 × 2,5 см на аортальной арке левого верхнего легочного лезвия и узелок размером 4,4 × 2,3 см на легочном грудном лапах левой средней легочной доли. Контрастная КТ грудной клетки выявила надключичную, средостную и легочную внутригрудную лимфаденопатию (рис.3а) и ФДГ ПЭТ-КТ, показала накопление ФДГ (рис. 3b). Уровень сыворотки проаргарин-высвобождающего пептида составлял 442,3 пг / мл. Истрепительная биопсия иглы шейного лимфатического узла выявила мелкоклеточный рак в надключичном лимфатическом узле (рис.4), и пациенту был поставлен диагноз рецидива SCLC. Уровень сывороточного антитела VGCC P / Q-типа составлял 172,6 пмоль / л, а ЭМГ — воском при 20 Гц (фиг.3с). Поэтому у него были рецидивы как SCLC, так и LEMS. Карбоплатин (площадь под кривой: 5 мг / мл, день 1) и этопозид (100 мг / м2, дни 1-3) вводили внутривенно каждые 4 недели (всего шесть циклов и доза была снижена до 80% от четвертый цикл из-за нейтропении 4-го класса). Химиотерапия достигла частичного ответа и облегчения его симптомов. 3Радиологические данные и электромиография у пациента SCLC с LEMS в возрасте 85 лет. Контрастная КТ грудной клетки выявила медиастинальную и легочную внутригрудную лимфаденопатию (стрелка) 10 марта 2015 г. В позитронно-эмиссионной томографии (ПЭТ) -CT-2-дезокси-2- [18F] фтор-d-глюкозы (ФДГ) показано накопление ФДГ в средостения и легочные лимфатические узлы (стрелка) 24 марта 2015 года. c Электромиография после стимуляции при 20 Гц показала, что вощение 9 апреля 2015 г.
Цитологические данные у пациента SCLC с LEMS в возрасте 85 лет. Образцы были получены с помощью биопсии аспирационной иглы шейного лимфатического узла 3 марта 2015 года. Вложенные парафином участки окрашивали антителом с использованием полимерного метода, и сигнал был разработан с помощью DAB. Разделы контрастировали с гематоксилином. Положительное окрашивание маркеров в цитоплазме и на клеточной мембране было обозначено коричневым цветом. Цитологическое исследование выявило мелкоклеточный рак. b CD56 был диффузно и сильно положителен на клеточной мембране. c Chromogranin A был очаговым и умеренно выраженным в цитоплазме. d Синаптофизин не экспрессировался в цитоплазме
Когда рак легкого диагностируется после длительного периода DFS, трудно решить, связано ли это с рецидивом или вторичным первичным раком легкого. 5-летняя DFS является показателем лечения SCLC [5]. Однако в некоторых случаях SCLC сообщалось о повторении после периода DFS более 10 лет 4. Мы рассматривали данный случай как повторение SCLC по нескольким причинам. Во-первых, иммунологическая картина окрашивания образцов, полученных в 2015 году, была аналогична той, что была в 2001 году, хотя экспрессия синаптофизина не наблюдалась в 2015 году. Во-вторых, рецидив чаще встречается, чем второй первичный SCLC у пациентов с SCLC с длительным периодом выживания. У 60 пациентов с SCLC, которые выжили более 5 лет, у девяти был рецидив SCLC, и ни у кого не было второго первичного SCLC [6]. Johnson et al. [7] изучали 62 пациента с SCLC с периодом DFS более 2 лет и сообщили, что 18 имели рецидив, тогда как у двух было второе первичное SCLC. В-третьих, учитывая время удвоения, повторение после периода DFS более 13 лет вполне возможно [2]. Более того, в нашем случае SCLC появился на той же стороне средостенных лимфатических узлов. Поэтому мы рассматривали этот случай как повторение SCLC. Небольшое количество клеток SCLC росло в течение 13 лет. Однако остается возможность повторения.
При изучении вторичных PNS Ducray et al. [8], сообщалось, что у всех пациентов с рецидивом рака вторичный PNS предотвратил рецидив рака. В нашем случае нарушение походки было представлено перед диагностикой рецидива SCLC. Если у пациента есть рецидив или вторичный ПНС, необходим тщательный скрининг на рецидив рака.
Этиология рецидива ПНС может быть опосредована продуцированием онконуальных антител, стимулированных рецидивом SCLC. В этом случае уровень антител VGCC типа P / Q-типа повышался с повторением SCLC и LEMS. В предыдущем исследовании сообщалось, что среди пациентов с ПНС, положительным для онконуальных антител, было обнаружено то же антитело, когда появилось вторичное ПНС [8]. Nagashima et al. [9] сообщили пациента SCLC с антителом против Hu, у которого наблюдался рецидив SCLC со вторичным PNS. Однако, в отличие от наших случаев, у этих пациентов был вторичный PNS, отличный от первого [8, 9]. Антигуовое антитело связано с некоторыми типами ПНС, такими как сенсорная невропатия, мозжечковая атаксия и лимбический энцефалит [10]. С другой стороны, антитело VGCC типа P / Q было относительно специфичным для LEMS. Антитело было обнаружено у 85-90% пациентов с LEMS [11], а 10 из 12 пациентов с SCLC с антителом VGCC типа P / Q имели LEMS [1]. Это может быть связано с различием между нашим случаем и случаями, описанными в литературе. Неясно, как определяется тип ПНС, хотя обнаружено одно и то же антитело. Дальнейшее изучение необходимо для понимания этиологии ПНС.
Повторение как SCLC, так и LEMS после периода DFS более 10 лет редки. Тем не менее, тщательный скрининг на рецидивы рака необходим, если у пациента есть рецидив или вторичный PNS.
Письменное информированное согласие было получено от пациентов для публикации этого отчета о болезни и любого сопроводительного изображения.
ФА был студентом-медиком и подготовил рукопись. KW был лечащим врачом во время приема и составил рукопись. КМ был лечащим врачом в амбулаторной клинике и поставил диагноз. МТ сделал патологический диагноз и помог проекту. YT, IH, MS и TS провели экзамены и помогли проекту. MS, MK и TK рассмотрели и помогли проекту. Все авторы прочитали и утвердили окончательную рукопись.
Авторы заявляют, что у них нет конкурирующих интересов.
Синдром Ламберта-Итона — аутоиммунное заболевание, обусловленное поражением пресинаптической мембраны двигательных нервных окончаний и ассоциированное со злокачественными неоплазиями и аутоиммунной патологией. Главным проявлением синдрома является чрезмерная утомляемость и понижение силы мышц, выраженное преимущественно в верхних отделах ног. Диагноз базируется на неврологическом обследовании и данных электронейромиографии. Лечение состоит в удалении опухоли (при ее обнаружении), проведении иммунносупрессивной терапии и сеансов плазмафереза, назначении фармпрепаратов, облегчающих прохождение нервных импульсов по нервно-мышечному синапсу.
- Причины синдрома Ламберта-Итона
- Симптомы синдрома Ламберта-Итона
- Диагностика синдрома Ламберта-Итона
- Лечение синдрома Ламберта-Итона
- Цены на лечение
Общие сведения
Синдром Ламберта-Итона был детально изучен американскими исследователями Ламбертом и Итоном, в честь которых он получил эпонимическое название. Заболевание представляет собой миастенический синдром, ассоциированный с неопластическими и аутоиммунными процессами в организме. Возраст заболевших варьирует в пределах 20-70 лет, но наиболее часто поражаются лица старше 40-летнего возраста. Вначале синдром Ламберта-Итона диагностировался преимущественно у мужчин, и гендерное соотношение составляло 5 случаев заболевания у мужчин к 1 случаю у женщин. Однако современные наблюдения специалистов в области неврологии показали уменьшение этой разницы.
По различным данным, синдром Ламберта-Итона выступает как паранеопластический синдром у 50-75% заболевших; наиболее часто у мужчин (примерно в 70%) и достаточно редко у женщин (до 20%). 80% всех неоплазий, диагностируемых при данном синдроме, составляет мелкоклеточный рак легкого. Причем симптоматика миастенического синдрома может на несколько лет опережать выявление опухолевого процесса. В ряде случаев заболевание Ламберта-Итона сочетается с другими синдромами паранеопластического характера, например, с паранеопластической полиневропатией.

Причины синдрома Ламберта-Итона
Синдром развивается на фоне злокачественных неоплазий (рак бронха, рак желудка, рак яичников, ретикулосаркома, колоректальный рак, рак простаты и др.) и аутоиммунных процессов (ревматоидный артрит, болезнь Шегрена, СКВ, аутоиммунный тиреоидит и пр.). Патогенетическим субстратом заболевания являются аутоиммунные механизмы. У 90% пациентов были выявлены антитела к кальциевым каналам, входящим в структуру, как опухолевых клеток, так и окончаний двигательных нервных волокон. Предположительно мишенью аутоиммунной атаки является пресинаптическая мембрана нервно-мышечного синапса. Ее поражение приводит к уменьшению высвобождения ацетилхолина — медиатора нервно-мышечной передачи. Результатом является нарушение прохождения возбуждения от нервного волокна к мышечной ткани, что клинически проявляется утомляемостью и слабостью мышц.
Симптомы синдрома Ламберта-Итона
Отличительной особенностью синдрома является некоторое нарастание мышечной силы в ходе двигательной активности, в отличие от миастении, при которой движения приводят к усугублению мышечной слабости. У отдельных пациентов может возникать опущение верхнего века. Характерные для миастении глазодвигательные расстройства, диплопия и нарушения глотания наблюдаются редко.
Диагностика синдрома Ламберта-Итона
Диагноз устанавливается неврологом на основании жалоб, неврологического обследования и результатов электронейромиографии. В неврологическом статусе выявляется тетрапарез с акцентом в проксимальных отделах ног, гипорефлексия, легкая дисметрия при выполнении координаторных проб, незначительное снижение глоточного и небного рефлексов.
Поскольку высока вероятность, что заболевание развилось как паранеопластический синдром, рекомендовано широкое обследование пациента на предмет выявления неоплазии. Проводится анализ крови на онкомаркеры, КТ органов грудной клетки и средостения, МСКТ органов брюшной полости, МРТ головного мозга, КТ или МРТ позвоночника, УЗИ щитовидной железы и т. д. При отсутствии результатов (невыявлении неоплазии) показаны повторные обследования с интервалом в 6 мес. С целью подтверждения аутоиммунного характера патологии назначаются иммунологические исследования.
Лечение синдрома Ламберта-Итона
При паранеопластическом генезе синдрома лечение базируется на ликвидации опухолевого процесса. Если лечение опухоли проходит успешно, то обычно наблюдается регресс симптоматики. При аутоиммунном генезе заболевания проводится симптоматическая терапия фармпрепаратами, угнетающе воздействующими на иммунную систему. В основном используются глюкокортикостероиды. Хороший эффект оказывает плазмаферез, позволяющий отфильтровать из крови циркулирующие в ней аутоантитела.
С целью облегчения нервно-мышечного проведения в схему лечения включают ингибиторы ацетилхолинэстеразы — фармпрепараты, облегчающие нервно-мышечную передачу за счет накопления в синапсе ацетилхолина. К таким препаратам относятся пиридостигмин, ипидакрин. В ряде случаев отмечалось улучшение при применении гуанидина, облегчающего высвобождение ацетилхолина нервными окончаниями. Однако гуанидин не нашел широкого использования вследствие высокой токсичности с побочным воздействием на почки и костный мозг. Менее токсичным фармпрепаратом с аналогичным эффектом является 3,4-диаминопиридин. Его прием может сопровождаться возникновением парестезий, диареи, тахикардии, повышенной бронхиальной секреции. Хотя эффективность 3,4-диаминопиридина доказана клинически, в настоящее время он используется лишь в специализированных медицинских центрах.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Миастенический синдром Ламберта-Итона характеризуется слабостью и утомляемостью мышц при нагрузке, которые наиболее выражены в проксимальном отделе нижних конечностей и туловище и иногда сопровождаются миалгиями. Вовлечение верхних конечностей и наружных мышц глаз при миастеническом синдроме Ламберта-Итона наблюдается реже, чем при миастении.
Больным с миастеническим синдромом Ламберта-Итона бывает особенно трудно встать из положения сидя или лежа. Однако кратковременное максимально возможное произвольное напряжение мышц временно улучшает их функцию. Хотя выраженная слабость дыхательных мышц при миастеническом синдроме Ламберта-Итона наблюдается редко, распознавание этого осложнения, которое иногда бывает основным проявлением синдрома, может спасти больному жизнь. У большинства больных с миастеническим синдромом Ламберта-Итона развивается вегетативная дисфункция, которая проявляется уменьшением слюноотделения, потоотделения, утратой реакций зрачков на свет, ортостатической гипотензией и импотенцией. У большинства больных ослабляются или выпадают глубокие сухожильные рефлексы, однако они могут на короткое время нормализоваться после непродолжительного максимального напряжения мышц, по сухожилию которых наносят удар при вызывании рефлекса.

[1], [2], [3], [4], [5], [6], [7]
Что вызывает миастенический синдром Ламберта-Итона?
Миастенический синдром Ламберта-Итона чаще возникает у мужчин, чем у женщин. Примерно у двух третей больных, особенно у мужчин старше 40 лет, миастенический синдром Ламберта-Итона возникает на фоне злокачественного новообразования. Примерно у 80% из них обнаруживается мелкоклеточный рак легких, проявления которого могут быть явными к моменту диагностики миастенического синдрома Ламберта-Итона, но иногда становятся заметными лишь спустя несколько лет. Реже миастенический синдром Ламберта-Итона возникает вне связи со злокачественными новообразованиями.
Патогенез миастенического синдрома Ламберта-Итона
Экспериментальные данные указывают на то, что нарушение нервно-мышечной передачи и слабость мышц при миастеническом синдроме Ламберта-Итона связаны со снижением высвобождения ацетилхолина из окончаний двигательных волокон. Предполагают, что патологический процесс запускается аутоиммунными механизмами, прежде всего антителами против потенциал-зависимых кальциевых каналов или связанных с ними белков, которые изменяют морфологию мембраны, численность кальциевых каналов или ток кальция по этим каналам.
Предположение о роли иммунных механизмов в патогенезе миастенического синдрома Ламберта-Итона первоначально было сделано на основе клинических наблюдений. На это указывали нередкое сочетание миастенического синдрома Ламберта-Итона с аутоиммунными заболеваниями (у больных, не страдающих злокачественными новообразованиями) или важность иммунных механизмов в патогенезе паранеопластических синдромов (у больных со злокачественными новообразованиями). Первое прямое доказательство важности иммунных механизмов было получено при пассивном переносе физиологического дефицита, характерного для миастенического синдрома Ламберта-Итона, с помощью IgG. После инъекции мышам IgG, полученного от больного с миастеническим синдромом Ламберта-Итона, наблюдалось снижение высвобождения ацетилхолина из окончаний нервов, аналогичное тому, что выявлялось при исследовании биоптата межреберных мышц у больных с миастеническим синдромом Ламберта-Итона. Патофизиологический эффект пассивного переноса был отмечен и в том случае, когда высвобождение ацетилхолина вызывалось электрической стимуляцией и калий-индуцированной деполяризацией. Поскольку постсинаптических изменений выявлено не было, эффект отнесли за счет нарушения функционирования пресинаптических двигательных окончаний.
После пассивного переноса миастенического синдрома Ламберта-Итона с помощью IgG изменения внеклеточной концентрации кальция могут увеличить высвобождение ацетилхолина из окончаний двигательных волокон до нормального уровня. Это свидетельствует о том, что IgG нарушают прохождение кальция через специфические потенциал-зависимые кальциевые каналы в пресинаптической мембране. Поскольку эти каналы входят в состав частиц активной зоны, неудивительно, что при электронной микроскопии с замораживанием-скалыванием выявляются изменения морфологии частиц активной зоны в терминалях нервных волокон у больных миастеническим синдромом Ламберта-Итона, а также у мышей, которым пассивно переносят заболевание с помощью IgG. Это может служить доказательством того, что потенциал-зависимые кальциевые каналы служат мишенью иммунной атаки при миастеническом синдроме Ламберта-Итона. Дальнейшие исследования подтвердили, что IgG при миастеническом синдроме Ламберта-Итона уменьшают численность частиц активной зоны путем антигенной модуляции. Специфические для миастенического синдрома Ламберта-Итона IgG могут также нарушать высвобождение медиатора симпатическими или парасимпатическими окончаниями, влияя на функционирование одного или нескольких подтипов потенциал-зависимых кальциевых каналов.
In vitro показано, что специфические для миастенического синдрома Ламберта-Итона антитела нарушают функцию кальциевых каналов в клетках мелкоклеточного рака легкого, что подтверждает связь между наличием антител к кальциевым каналам и миастеническим синдромом Ламберта-Итона, индуцированным мелкоклеточным раком легкого. Потенциал-зависимые кальциевые каналы, влияющие на высвобождение ацетилхолина пресинаптическими терминалями млекопитающих, принадлежат преимущественно к Р- и Q-типам. Таким образом, хотя IgG при миастеническом синдроме Ламберта-Итона способны реагировать с различными типами кальциевых каналов в клетках мелкоклеточного рака легкого, нарушение высвобождение кальция пресинаптическими моторными окончаниями при миастеническом синдроме Ламберта-Итона, вероятнее всего, объясняется их взаимодействием с каналами Р-типа.
С помощью метода иммунопреципитации с экстрактом мозжечка человека и лигандом каналов Р- и Q-типов, меченым изотопом 1125 (омега-конотоксин MVIIC) в 66 из 72 образцах сыворотки, полученных от больных с миастеническим синдромом Ламберта-Итона, были выявлены антитела к потенциал-завивимым кальциевым каналам, в то же время антитела к каналам N-типа были обнаружены только в 24 из 72 случаев (33%). Таким образом, антитела к потенциал-зависимым кальциевым каналам Р- и Q-типов выявляются у значительного большинства больных с миастеническим синдромом Ламберта-Итона и, по-видимому, опосредуют нарушение нервно-мышечной передачи. Однако результаты, полученные с помощью иммунопреципитации с мечеными экстрактами, можно было интерпретировать и таким образом, что мишенью аутоиммунной реакции при миастеническом синдроме Ламберта-Итона служат плотно сцепленные белки, а не сами по себе кальциевые каналы. Чтобы отвергнуть это предположение, следовало бы продемонстрировать способность антител реагировать со специфическими белковыми компонентами кальциевых каналов, что и было сделано. Антитела к одному или обоим синтетическим пептидам альфа2-субъединицы кальциевых каналов Р- и Q-типов были выявлены у 13 из 30 больных с миастеническим синдромом Ламберта-Итона. При исследовании 30 проб сыворотки 9 реагировали с одним эпитопом, 6 - с другим, а 2 - с обоими эпитопами. Таким образом, накапливаются данные, что потенциал-зависимые кальциевые каналы Р- и Q-типов являются основной мишенью иммунной атаки. Однако необходимы дополнительные исследования, чтобы идентифицировать антитела и эпитопы, с которыми связаны патофизиологические изменения при миастеническом синдроме Ламберта-Итона.
Симптомы миастенического синдрома Ламберта-Итона
Идиопатический вариант миастенического синдрома Ламберта-Итона может возникать в любом возрасте, чаще у женщин, и сочетаться с другими аутоиммунными заболеваниями, в том числе патологией щитовидной железы, ювенильным сахарным диабетом и миастенией. Миастенический синдром Ламберта-Итона обычно легко отличить от миастении по распределению мышечной слабости. В то же время симптомы миастенического синдрома Ламберта-Итона способны имитировать моторную полиневропатию и даже болезнь двигательных нейронов. Для подтверждения диагноза и исключения других нервно-мышечных заболеваний часто необходимы дополнительные методы исследования.
Диагностика миастенического синдрома Ламберта-Итона
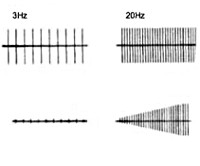
В диагностике миастенического синдрома Ламберта-Итона особенно полезна ЭМГ. Кратковременному увеличению силы мышц после их максимальной нагрузки при ЭМГ соответствует увеличение М-ответа при максимальном произвольном усилии. Амплитуда М-ответа при раздражении нерва одиночными супрамаксимальными стимулами обычно уменьшена, что соответствует сниженному высвобождению ацетилхолина, недостаточному для генерации потенциалов действия во многих нервно-мышечных синапсах. Однако после максимального произвольного напряжения мышц амплитуда М-ответа увеличивается на период 10-20 с, что отражает усиление высвобождения ацетилхолина. При стимуляции с частотой превышающей 10 Гц в течение 5-10 с происходит временное увеличение амплитуды М-ответа. Стимуляция с частотой 2-3 Гц может вызвать декремент со снижением амплитуды М-ответа, тогда как после нагрузки происходит восстановление и увеличение амплитуды М-ответа на 10-300%. При игольчатой ЭМГ регистрируются низкоамплитудные кратковременные потенциалы двигательных единиц и вариабельно увеличенные полифазные потенциалы. При ЭМГ отдельных волокон средний межпотенциальный интервал может быть увеличен даже в клинически интактных мышцах, что отражает нарушение нервно-мышечной передачи. Изменения ЭМГ после максимальной нагрузки и стимуляции помогают отличить миастенический синдром Ламберта-Итона от моторной полиневропатии, болезни двигательных нейронов и миастении.
Исследование биоптата мышц при миастеническом синдроме Ламберта-Итона обычно не выявляет патологии, но иногда обнаруживаются неспецифические изменения, например, атрофия волокон 2-го типа. Несмотря на то, что имеющиеся данные указывают на важную роль нарушения нервно-мышечной передачи, прежде всего на уровне пресинаптических окончаний, обычная электронная микроскопия обычно не выявляет изменений. Только усовершенный метод электронной микроскопии с замораживанием и скалыванием выявляет специфические изменения, но этот метод обычно не используется в клинических лабораториях.

[8], [9], [10], [11], [12]
Механизм возникновения эндокринных симптомов у больных раком легкого до сих пор не ясен. Они могут появляться при опухолях различного гистологического строения. Однако следует учесть, что в каждом из гистологических типов рака легкого могут встречаться клетки с нейросекреторными гранулами. Хорошо известны опухоли с двойной и даже тройной степенью их дифференцировки. Гормоны, секретируемые такими опухолями необычны, отличаются от продуцируемых эндокринными железами. Часто они гетерогенны, включают в свой состав формы-предшественники или фрагменты. Эндокринные симптомы характеризуются не только повышением концентрации тех или иных гормонов, но и нарушением контроля, регуляции их секреции.
Злокачественная опухоль в легком оказывает депрессивное влияние на функциональное состояние адаптационных механизмов организма, вызывает снижение функции симпатоадреналовой, гипофизарно-надпочечниковой систем и активности холинергических процессов.
Все это может объяснить появление некоторых паранеопластических синдромов у больных раком легкого. Наиболее часто встречается костно-суставной синдром, названный по имени описавших его исследователей — "Пьера Мари — Бамбергера"(Р.Маnе, Bamberger, 1890). Он проявляется болями в диафизах длинных трубчатых костей и явлениями периостоза, устанавливаемого при рентгенографии. Боли возникают также в суставах /голеностопных, лучезапястных. Их контуры сглаживаются за счет отека мягких тканей в области мыщелков. Появление синдрома Пьера-Мари-Бамбергера связывают с повышением концентрации в сыворотке соматотропного и гонадотропного гормонов.
Способность некоторых раков легкого, чаще мелкоклеточного строения, вырабатывать гормоноподобный полипептид, вызывающий выраженную мышечную слабость, гипокалиемический алкалоз, гемонатриемию с необычно высоким выделением натрия с мочой при стабильно нормально артериальном давлении крови, объединяются синдромом "Швартца-Бартера". W.B.Schwartz описал его в 1957 году, а виде нозологического синдрома он стал использоваться в клинической практике с 1967 года (Barter F.C., Schartz W.B.,1967). Синдром характеризуется задержкой вне- и внутриклеточной жидкости, возникновением психических расстройств в виде возбуждения или угнетения сознания, появлением различных неврологических симптомов.
К числу своеобразных паранеопластических синдромов у больных раком легкого относится описанный в 1957 году Ламбертом и Итоном. Синдром "Ламберта-Итона"характеризуется мышечной слабостью, развивающейся главным образом в проксимальных отделах и очень напоминающий миастеническую. Преобладают такие расстройства премущественно в ногах, встречаются также в области тазовых органов. Отличительной чертой является так называемый признак "врабатываемости". Если при миастении продолжающаяся мышечная деятельность приводит к полной утрате сил, то при синдроме Ламберта-Итона мышечная сила после нескольких повторных движений полностью восстанавливается и сохраняется в течении довольно продолжительного времени. Ввиду появления у таких больных избыточного количества холинэстеразы и подобных ей веществ они обладают повышенной чувствительностью к миорелаксантам, используемым во время наркоза. При этом возможно ранее и быстрое выключение дыхательной мускулатуры вплоть до полной остановки дыхания.
Повышенная секреция серотонина, адренокортикотропного и антидиуретического гормонов, кальциотонина и некоторых других у больных раком легкого могут формировать синдром Кушинга, тогда составляющий своеобразную "маску"этого заболевания. Следует отметить, что паранеопластические синдромы у больных раком легкого, особенно недифференцированного строения, могут возникать в ранние сроки — за несколько месяцев и даже за полгода до появления других клинических признаков заболевания. Правильная интерпретация различных проявлений паранеопластических процессов часто позволяет за этими своеобразными "масками"распознать злокачественную опухоль в легком.
Параканкрозные воспалительные изменения нередко значительно изменяют и даже затушевывают клинические проявления рака легкого. Они возникают в пораженном опухолью легком, плевральной полости и в региональных лимфатических узлах. Частота возникновения воспалительных параканкрозных процессов в легком возрастает по мере роста и развития раковой опухоли. Среди больных с далеко зашедшими стадиями развития рака легкого из числа обследованных и оперированных в нашей клинике параканкрозные изменения установлены в 59% наблюдений. При этом неблагоприятное сочетание воздействия на организм больных как продуктов опухолевого метаболизма, так и гнойной параканкрозной интоксикации, во многом определяет своеобразие вариантов клинического течения болезни. Разнообразные и многоплановые проявления таких вторично возникших изменений нередко занимают ведущее место, оттесняя на второй план, скрывая признаки собственно рака легкого.
Наиболее характерной чертой параканкрозных изменений в клинической картине центрального рака легкого являются различные проявления обтурационного пневмонита. Как правило, он связан с нарушением проходимости бронха, сопутствующими изменениями в системе мукоцилиарного клиренса, скоплением слизи и развитием инфекции дистальнее появившегося препятствия. Особенностью такого обтурационного пневмонита в начальном периоде рака легкого является быстротечность его возникновения и обратного развития под влиянием лечения, а также — рецидивирование. Позже, с прогрессированием бластоматозного поражения, в зоне ателектаза развиваются необратимые повреждения. Тогда возникает некроз, деструкция ткани с формированием полости абсцесса или гангрены легкого. Инфицирование нередко появляющегося при этом плеврального экссудата приводит к развитию тяжелой острой эмпиемы плевры. У части больных прогрессирующая деструкция в легком приводит к прорыву гнойника в плевральную полость, сопровождающемуся тогда тяжелыми клиническими проявлениями пиопнемоторакса.
Периферические формы рака легкого также могут видоизменять свое клиническое течение, приобретая "маску"гнойно-деструктивного процесса. Основу таких изменений составляют особенности патогенеза периферического рака.
Прогрессирующий рост шаровидной опухоли в легком закономерно вызывает деструкцию вовлекаемых в бластоматозный процесс кровеносных сосудов. В наибольшей степени это происходит в центральных ее отделах. Тогда здесь формируется зона колликвационного некроза, который при достижении опухолью одного из бронхов из среднего калибра инфицируется. В центре опухоли формируется гнойно-деструктивный очаг. Его клинические проявления вначале очень сходны с блокированным абсцессом легкого, а после расплавления и опорожнения через бронх — с неполностью дренированным гнойником или нагноившейся кистой. Все это сопровождается появлением у больных характерных для подобных состояний жалоб, повышением температуры тела, отделением с кашлем гнойной, нередко зловонной мокроты.
Клинические проявления паранкрозных гнойно-деструктивных изменений в легком и плевре как правило включают также выраженные общие расстройства. Отмечается высокая лихорадка, нередко с гектическими перепадами температуры тела, явления интоксикации, расстройство дыхания и деятельности сердечно-сосудистой системы.
Развиваются волемические и другие характерные для гнойно-деструктивных поражений легких расстройства. В это время жалобы и симптомы заболевания почти полностью утрачивают черты, патогномоничные для рака легкого. Такие больные нередко настойчиво связывают начало и первые признаки своего заболевания именно с этими, наиболее выраженными и особенно сильно беспокоящими их его проявлениями. При этом часто даже не упоминают о других, ранее имевшихся расстройствах здоровья, предшествоваших его столь заметному ухудшению. В связи с этим часть из них поступает для лечения в терапевтические, пульмонологические или хирургические стационары, предназанченные для оказания помощи больным с гнойными заболеваниями легких и плевры.
Первично-множественный рак легкого, отмечаемый у 3—% онкологических больных часто характеризуется своеобразными клиническими признаками, которые включают как все многообразие проявлений первичной злокачественной опухоли в легком так и могут дополнятся симптомами, возникающими в связи с развитием второй опухоли в одном из внутренних органов. С возрастом частота возникновения первично-множественных раков возрастает.
Это обстоятельство следует учитывать, так как оно дает некоторую ориентировку для целенаправленного поиска и анализа жалоб больных и клинических проявлений заболеваемости у лиц старшей возрастной группы, поступающих в специализированные клиники и стационары по поводу рака легкого. Под нашим наблюдением находилось 67 больных первично-множественным раком легкого.
Бисенков Л.Н., Гришаков С.В., Шалаев С.А.
Читайте также:

