Кумол с хлором на свету
Ароматические соединения
Ароматические соединения (арены) – циклические соединения содержащие, как правило 5- и 6-членные циклы, имеющие замкнутую систему сопряженных связей. Боковые цепи не обязаны содержать сопряженные связи.
Ароматичность молекулы характеризует ее повышенную устойчивость, которая обусловлена делокализацией π-электронов в циклической системе.
1. Атомы углерода в состоянии sp 2 -гибридизации создают замкнутую систему.
2. Атомы углерода образуют единую плоскость.
3. Цикл из сопряженных связей включает в себя 4n + 2 π-электронов (где n – целое число). Этот принцип называется правилом Хюккеля.
В зависимости от n можно выделить следующие простейшие ароматические системы:
• Системами с 2 π-электронам являются производные катиона циклопропенилия и дикатионциклобутадиена.
• Системы с 10 π-электронами – это в первую очередь нафталин. Кроме того, широко встречается в природе конденсированные бензольные кольца. Другой представитель – азулен. Это изомер нафталина, содержащий в себе 5- и 7-членные кольца. Азулен часто встречается в эфирных маслах, но распространенность гораздо меньше, чем у бензола и нафталина. 
Сюда же относятся индол, хинолин, изохинолин, хиназолин, хиноксалин, другие системы, основанные на бензольном кольце, конденсированном с другим кольцом, в котором находится гетероатом. Широко распространены в природе.
• Системы с 14 π-электронами: антрацен, фенантрен – конденсированные бензольные кольца обоих кольцах. Широко распространены в природе. 
Для ароматических соединений часто используют тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
| С6H5–CH3 | С6H5–C2H5 | С6H5–C3H7 |
| Метилбензол (толуол) | Этилбензол | Пропиленбензол |
Если радикалов более одного, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерация организовывается таким образом, чтобы заместители имели наименьшую сумму номеров положений. Например:
 |
| 1,2-Диметилбензол 1,3-Диметилбензол 1,4-Диметилбензол |
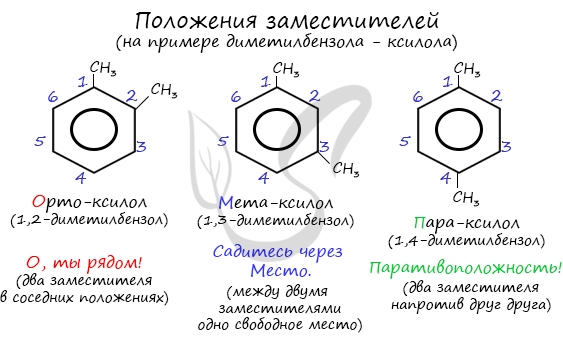
Для дизамещенных бензолов R–C6H4–R распространен способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
- орто- (о-) – заместители у соседних атомов углерода кольца, т.е. 1,2-положениях к опорному;
- мета- (м-) – заместители через один атом углерода (в 1,3-положениях к опорному);
- пара- (п-) – заместители на противоположных сторонах кольца (в 1,4-положениях к опорному).
| 1,2-Диметилбензол 1,3-Диметилбензол 1,4-Диметилбензол |
 |
- положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы);
- углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода:
![]()
н-Пропилбензол Изопропилбензол (кумол) - изомерия заместителей R, начиная с R=С2Н5. Например, молекулярной формуле С8Н10 соответствуют 4 изомера:
Химические свойства ароматических соединений сильно отличаются от свойств других классов соединений из-за делокализации шести π-электронов в циклической системе, которые понижают энергию молекулы. В результате в молекуле повышается устойчивость. Арены практически не вступают в реакции присоединения или окисления, приводящие к нарушению ароматичности. Для них наиболее распространены реакции с сохранением ароматической системы, т. е. замещения атомов водорода в составе цикла.
Так как в бензольном кольце за счет системы сопряженных связей с обеих сторон от плоскости кольца наблюдается повышенная электронная плотность, то бензольное кольцо является нуклеофилом и склонно взаимодействовать с электрофильным реагентом. Поэтому для ароматических соединений наиболее типичны реакции электрофильного замещения.
Замена атома водорода в бензольном кольце на какой-либо из галогенов наблюдается, как правило, в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса):
| C6H6 + Cl2 |  | C6H5Cl | + HCl. |
| Хлорбензол |
Бензол хорошо взаимодействует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
| C6H6 + HNO3 |  | C6H5NO2 | + H2O. |
| Нитробензол |
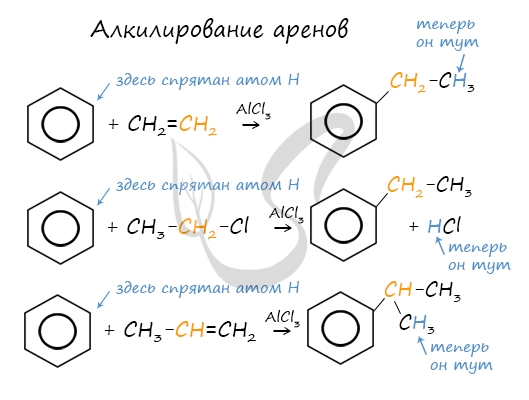
Алкильная группа замещает атом водорода в бензольном кольце при взаимодействии с алкилгалогенидами (реакция Фриделя–Крафтса) или алкенов с катализатором, например AlCl3 (кислота Льюиса):
| C6H6 + CH3Cl |  | C6H5CH3 | + HCl. |
| Толуол (метилбензол) |
Гомологи бензола, содержащие боковые цепи, активнее вступают в реакции замещения.
Например, при нитровании толуола С6Н5CH3 может происходить замещение не одного, а одновременно трех атомов водорода с образованием 2,4,6-тринитротолуола:
 | ||
| Толуол | 2,4,6-Тринитротолуол (тротил, тол) | |
В этом случае хорошо иллюстрируется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях.

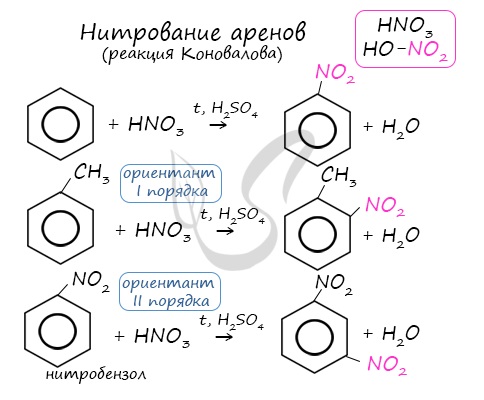
Причиной именно такой ориентации при электрофильном замещении является взаимное влияние атомов в молекуле. В незамещенном бензоле С6Н6 электроны в кольце распределены равномерно, а в замещенных ароматических соединениях под влиянием заместителя происходит перераспределение электронов и образуются области повышенной и пониженной электронной плотности, что оказывает влияние направления реакций электрофильного замещения. Таким образом, атака нового заместителя определяется природой уже имеющегося заместителя.
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т. е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Орто-пара-ориентанты направляют замещение преимущественно в орто- и пара-положения.
К ним относятся электроннодонорные группы (электронные эффекты групп указаны в скобках):
+M-эффект в этих группах сильнее, чем –I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
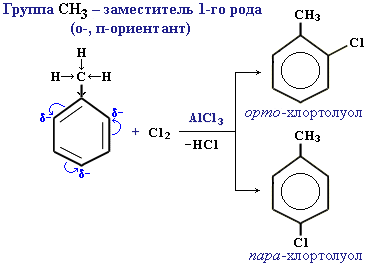
Ориентанты 1-го рода повышают в бензольном кольце электронную плотность, это приводит к повышению его активности в реакциях электрофильного замещения (по сравнению с бензолом).
Галогены занимают особое место среди ориентантов 1-го рода, проявляющие электронно-акцепторные свойства: –F (+M бензол > нитробензол.
Но нужно учитывать, что под влиянием бензольного кольца группа СH3 в толуоле становится активнее в реакциях окисления и радикального замещения по сравнению, например, с метаном СH4.
Поэтому толуол (в отличие от метана) окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):

В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.


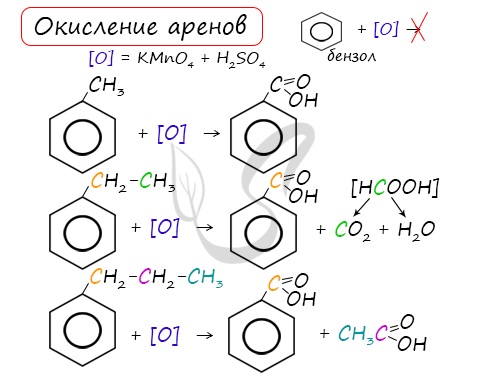
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т. п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений [5, 6].
Гомологи бензола, в отличие от самого бензола, окисляются легко. При обработке перманганатом калия будут окисляться только боковые цепи:
| C6H5–CH3 + 3[O] | → | C6H5–COOH | + H2O. |
| Толуол | Бензойная кислота |
Наращивание боковой насыщенной цепи (этилбензол, пропилбензол и т. д.) также дает на выходе бензойную кислоту, так как разрыв связи происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.

Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах:
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Уголь и нефть – основной источник ароматических углеводородов.
При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
а) дегидроциклизация (дегидрирование и циклизация) насыщенных УВ, состоящих, как минимум из 6 атомов углерода в основной цепи. Реакция проходит при нагревании в присутствии катализатора:

б) дегидрирование циклоалканов, состоящих из шести атомов:

Алкилирование бензола галогеналканами или алкенами в присутствии безводного хлорида алюминия:

Тримеризация алкинов над активированным углем (реакция Зелинского):

Бензол С6Н6 – основа для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т. д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5–СН3 используется для производства лекарственных и взрывчатых веществ (тротил, тол), а также красителей.
Ксилолы С6Н4(СН3)2 в виде смеси изомеров (орто-, мета- и пара-) применяется как растворитель.
Изопропилбензол (кумол) С6Н4–СН(СН3)2 – основа для получения фенола и ацетона.
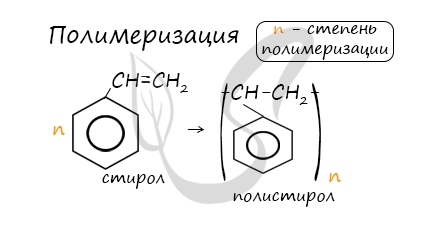
Винилбензол (стирол) C6H5–CН=СН2 используется для получения полистирола – важного для промышленности полимера.

Бензпире́н или бензапире́н – химическое соединение, относящееся к первому классу опасности. Источником его образования является сгорание углеводородного жидкого, твёрдого и (реже) газообразного топлива. Концентрируется преимущественно в почве, меньше – в воде. Из почвы мигрирует в ткани растений и продолжает своё движение дальше в пищевой цепочке.
942ACC
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пояснение:
1) Дегидрогалогенирование хлорбутана при действии спиртового раствора щелочи:
2) Окисление двойной связи бутена-1 подкисленным раствором перманганата калия (разрыв двойной связи):
3) Реакция этерификации – образование сложного эфира из спирта и карбоновой кислоты:
4) Щелочной гидролиз изопропилпропионата с образованием пропионата натрия и изопропилового спирта:
5) Сплавление соли пропионовой кислоты с щелочью с образованием этана и карбоната натрия:
372960
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Пояснение:
1) Из ацетата натрия метан получают по реакции декарбоксилирования, которая протекает при его сплавлении со щелочью, например, гидроксидом натрия:
2) При взаимодействии метана с хлором в мольном соотношении один к одному образуются преимущественно монохлорметан (Х1) и хлороводород:
3) При обработке монохлорметана водным раствором щелочи протекает нуклеофильное замещение атома хлора на гидроксильную группу с образованием метилового спирта (Х2):
4) Получить метаналь (формальдегид) из метилового спирта можно, действуя слабым окислителем – оксидом меди (II) при нагревании:
5) Перманганат калия, подкисленный серной кислотой, окисляет метаналь до углекислого газа и воды. При этом, так как среда раствора кислая, перманганат-ион восстанавливается до двухвалентного марганца:
D33737
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Пояснение:
1) При действии на пропанол-1 бромоводорода происходит реакция замещения гидроксильной группы в спирте на атом брома с образованием 1-бромпропана (Х1)
3) В кислой среде пропен может вступить в реакцию с водой в соответствии с правилом Марковникова – водород идет к наиболее гидрогенизированному атому, а гидроксильная группа к наименее гидрогенизированному. При этом образуется изопропиловый спирт:
Проблема в том, что по всей видимости, в этом задании банка ФИПИ, которое кстати попалось некоторым на досрочном экзамене ЕГЭ в апреле 2016-го, опечатка, и имелось ввиду 0 о С, а не нагрев.
995FCC
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) При действии на бромэтан водного раствора щелочи протекает нуклеофильное замещение атома брома на гидроксид-ион, при этом образуется этиловый спирт (Х1):
2) Этиловый спирт (Х1) можно превратить в уксусную кислоту, окислив его водным раствором перманганата калия в кислой среде при нагревании:
3) Уксусная кислота вступает в реакцию нейтрализации с щелочами, например, с гидроксидом натрия, при этом образуется ацетат натрия (Х2):
4) После выпаривания водного раствора ацетата натрия (Х2) и сплавления полученного твердого ацетата натрия с твердым гидроксидом натрия происходит реакция декарбоксилирования с образованием метана (X3) и карбоната натрия:
5) Пиролиз метана при 1500 о C приводит к образованию ацетилена (X4) и водорода:
1C6CBE
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) Пропилацетат, являясь сложным эфиром, подвергается щелочному гидролизу с образованием ацетата калия (X1) и пропанола:
2) Из ацетата калия по реакции декарбоксилирования, которая протекает при его сплавлении с щелочью, получают метан:
3) При температуре 1200 o C и быстром охлаждении (для предотвращения разложения ацетилена до простых веществ) метан разлагается на ацетилен (X2) и водород:
4) Димеризация ацетилена происходит в присутствии катализаторов – солянокислого раствора хлоридов меди (I) и аммония – с образованием винилацетилена:
5) При пропускании винилацетилена через бромную воду наблюдается обесцвечивание бромной воды за счет присоединения брома к кратным связям с образованием насыщенного бромпроизводного бутана – 1,1,2,2,3,4-гексабромбутана (X3):
26D1FD
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) В промышленности формальдегид получают окислением метана на катализаторе фосфате алюминия при температуре 450 o C и давлении 1-2 МПа:
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа формальдегида восстанавливается до гидроксильной, т.е. альдегид превращается в спирт – метанол (X1):
3) Металлический натрий взаимодействует с метанолом с образованием метилата натрия (X2) и выделением водорода:
4) Реагируя с соляной кислотой, метилат натрия обратно превращается в метанол (X1):
5) Перманганат калия в кислой среде при нагревании окисляет метиловый спирт до углекислого газа (X3) (Mn +7 → Mn +2 ; C -2 → C +4 ):
6C53D6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) В присутствии оксида алюминия при температуре 400 o C происходит дегидратация спирта с образованием этилена (X1) и воды:
2) Перманганат калия в нейтральной среде окисляет этилен до этиленгликоля (X2) (Mn +7 → Mn +4 ; 2C -2 → 2C -1 ):
3) При действии избытка бромоводорода на этиленгликоль происходит замещение гидроксильных групп на анионы брома, в результате чего образуется 1,2-дибромэтан (X3):
4) Этин (или ацетилен) можно получить действием на 1,2-дибромэтан спиртовым раствором щелочи:
5) По реакции М.Г. Кучерова в присутствии солей ртути в кислой среде (в водном или спиртовом растворе) ацетилен превращается в этаналь:
5B7666
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Получить ацетон (пропанон) можно по реакции М.Г. Кучерова, действуя на пропин (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе):
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа кетона восстанавливается до гидроксильной, т.е. кетон превращается во вторичный спирт – изопропанол (X2):
3) При действии бромоводорода на изопропанол происходит нуклеофильное замещение гидроксильной группы на анион брома, в результате чего образуется 2-бромпропан:
4) При действии спиртового раствора щелочи 2-бромпропан превращается в ненасыщенный углеводород – пропилен (X3):
5) Дегидрированием пропилена на катализаторе (Pt, Pd, Ni) можно получить пропин (X1):
EE403A
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Получить бромметан можно действием брома на метан (X1) на свету. Реакция замещения протекает по свободнорадикальному механизму:
2) При взаимодействии бромметана с аммиаком вначале образуется соль амина, которая при избытке аммиака превращается в свободный амин. В случае метиламина образуются метиламин (X2) и бромид аммония:
3) Азотистая кислота неустойчива, поэтому ее получают в ходе реакции, действуя на подкисленный раствор амина нитритом натрия. В случае первичного амина – метиламина - наблюдается выделение азота, а в растворе образуется метанол (X3):
4) Действием на метиловый спирт оксидом меди (II) при нагревании получим формальдегид, при этом Cu +2 восстановится до Cu 0 :
5) При окислении формальдегида перманганатом калия в кислой среде выделяется углекислый газ (X4) (Mn +7 → Mn +2 ; C 0 → C +4 ):
11E9DF
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Алканы с основной цепью 6 и более атомов углерода способны вступать в реакцию дегидроциклизации, при этом образующийся шестичленный цикл далее дегидрируется и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода. В данном случае образующийся циклогексан дегидрируется в бензол (X1):
2) Алкилирование ароматических углеводородов алкилгалогенидам и в присутствии безводного AlCl3является классическим примером реакции Фриделя-Крафтса. Реакция представляет собой электрофильное замещение в бензольном кольце. Алкилирование бензола метилхлоридом приводит к образованию толуола (X2):
3) При действии на толуол избытком хлора на свету все атомы водорода в метильном радикале толуола замещаются на хлор. Реакция замещения протекает по свободнорадикальному механизму:
4) При щелочном гидролизе тригалогенидов с атомами хлора при одном атоме углерода с высокими выходами образуются соли карбоновых кислот (в данном случае бензоат калия (X3)):
AC20AD
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) 1,2-дихлорэтан является геминальным дихлорпроизводным этана. В условиях водного раствора щелочи 1,2-дихлорэтан превращается в карбонильное соединение – ацетальдегид:
2) При восстановлении карбонильных соединений водородом образуются спирты. Так, пропуская смесь паров ацетальдегида и водорода над никелевым катализатором, можно получить этанол (X1):
3) Замещение гидроксильной группы спирта на аминогруппу происходит в жестких условиях. Пропуская пары этанола и аммиак над нагретым оксидом алюминия, получают этиламин:
4) При пропускании через водный раствор этиламина углекислого газа происходит образованием гидрокарбоната этиламмония (X2):
5) При нагревании гидрокарбонат этиламмония разлагается на углекислый газ, этиламин (X3) и воду:
Примечание: правильным может считаться вариант, в котором веществом Х2 является не гидрокарбонат, а карбонат этиламмония.
7EAE60
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Ацетилен (этин) вступает в реакцию гидратации в присутствии солей ртути в водном растворе с образованием ацетальдегида (реакция Кучерова) (Х1):
2) Ацетальдегид при действии на него подкисленного водного раствора перманганата калия превращается в уксусную кислоту:
3) Уксусная кислота вступает в реакцию нейтрализации с гидроксидом натрия, при этом образуется ацетат натрия (Х2) и вода:
4) Ацетат натрия взаимодействует с галогеналканами с образованием сложных эфиров, в данном случае образуется метиловый эфир уксусной кислоты (метилацетат)(Х3):
5) Сложные эфиры в присутствии кислот могут вступать в реакцию гидролиза. При гидролизе метилацетата в кислой среде образуется уксусная кислота и метанол:
7E4C51
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии спиртового раствора щелочи на любой из изомеров дибромэтана образуется ацетилен (X1):
2) Действуя на ацетилен (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетальдегид (X2) (реакция М.Г.Кучерова):
3) При окислении ацетальдегида перманганатом калия в кислой среде образуется уксусная кислота (Mn +7 → Mn +2 ; C +1 → C +3 ):
4) Получить хлоруксусную кислоту можно действием хлора на уксусную кислоту на свету. Реакция замещения протекает по свободнорадикальному механизму, в результате чего атом водорода при алкильном радикале замещается на хлор (X3):
5) При обработке хлоруксусной кислоты аммиаком образуется аминокислота – глицин:
39882С
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При температуре выше 140 0 C в присутствии концентрированной серной кислоты спирты подвергаются внутримолекулярной дегидратации с образованием алкена и воды. В данном случае при 180 0 C и действии конц. H2SO4 пропанол-1 превращается в пропилен (X1):
3) При действии спиртового раствора щелочи на 1,2-дибромпропан образуется пропин:
4) Действуя на пропин водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетон (X3) (реакция М.Г.Кучерова):
5) Пропуская смесь паров ацетона и водорода над палладиевым катализатором, получают пропанол-2 (или изопропанол) (X4):
A8F8C2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Циклопропан присоединяет бромоводород с раскрытием цикла, в результате чего образуется 1-бромпропан:
2) В лабораторных условиях алканы получают по реакции Вюрца из галогеналканов. Частичный положительный заряд на атоме углерода при галогене в галогенопроизводных делает возможной реакцию этих соединений с активными металлами. Моногалогеналканы уже при комнатной температуре взаимодействуют с натрием, превращаясь в алканы с удвоенным углеродным скелетом. Таким образом, из двух молекул 1-бромпропана получается н-гексан (X1):
3) Алканы, имеющие в молекуле шесть и более атомов углерода, могут вступать в более сложные реакции дегидрирования, в ходе которых отщепление водорода сопровождается замыканием цепи в цикл: реакции дегидрирования – циклизации. В данном случае гексан превращается в бензол (X2):
4) Толуол получают алкилированием бензола метилгалогенидом в присутствии катализатора AlCl3 (электрофильное замещение, механизм SE):
5) Метильная группа толуола окисляется перманганатом калия в кислой среде до карбоксильной группы, следовательно, толуол превращается в бензойную кислоту (X3) (Mn +7 → Mn +2 ; C -3 → C +3 ):
92C355
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) В лабораторных условиях пропан можно получить по реакции Вюрца из галогеналканов – хлорэтана и хлорметана, однако данная реакция сопряжена с образованием двух побочных продуктов – бутана и этана. Моногалогеналканы при комнатной температуре способны взаимодействовать с натрием:
2) Дегидрированием пропана на катализаторе (Pt, Pd, Ni) можно получить пропилен (X1):
3) При окислении алкена перманганатом в нейтральной среде на холоду образуется двухатомный спирт, щелочь и оксид марганца (IV). В данном случае из пропилена образуется пропандиол-1,2 (X2) (Mn +7 → Mn +4 ; C -2 → C -1 , C -1 → C 0 ):
4) Многоатомные спирты способны вступать в реакции нуклеофильного замещения с галогеноводородами. Действуя избытком бромоводорода на пропандиол-1,2 получается 1,2-дибромпропан (X3):
5) При действии спиртового раствора щелочи на дигалогеналкан – 1,2-дибромпропан – образуется пропин (X4):
Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C6H6. Общая формула их гомологического ряда - CnH2n-6.
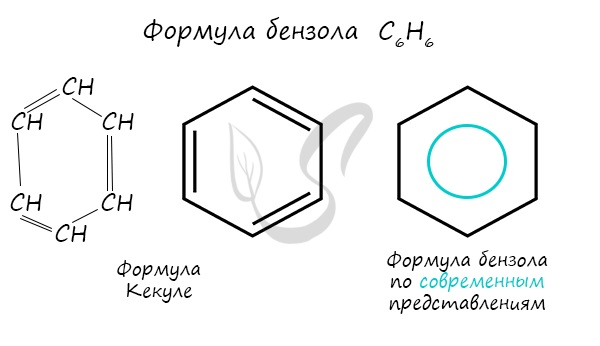
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям, двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол - 120°.
Названия аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
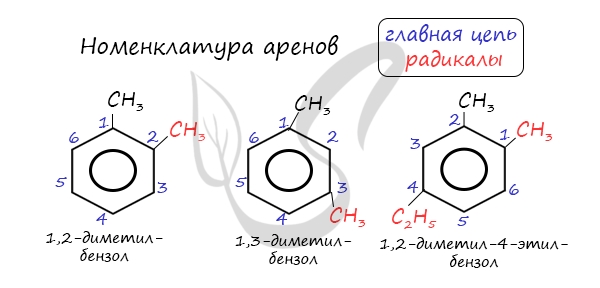
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
Арены получают несколькими способами:
-
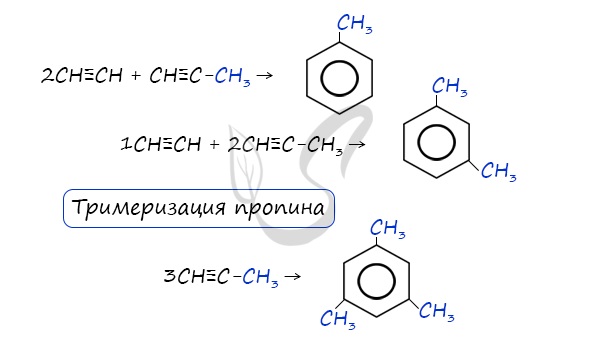
Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
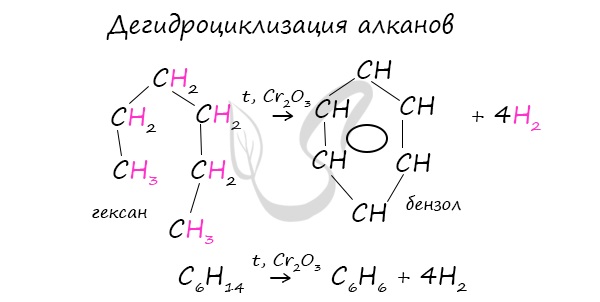
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора - Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
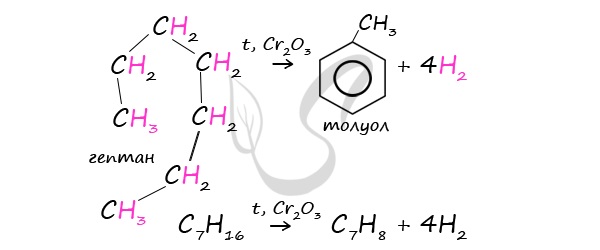
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже "готовых" циклов - циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.

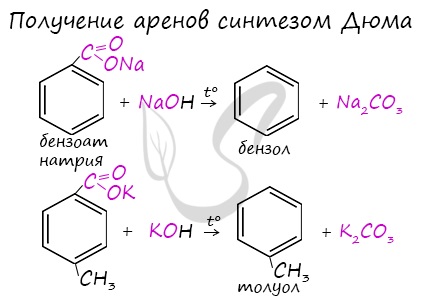
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Арены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.

Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
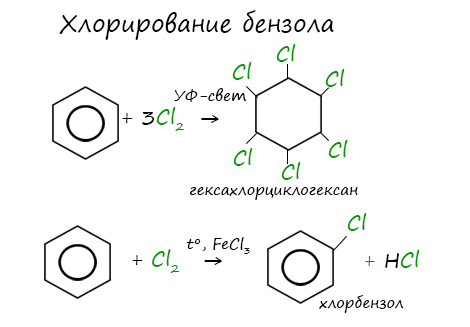
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
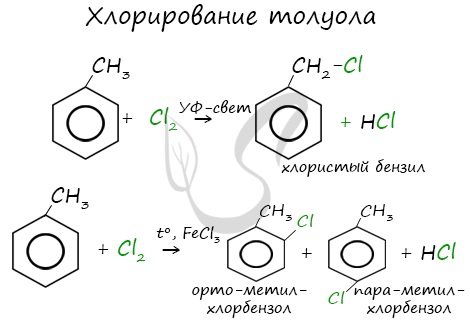
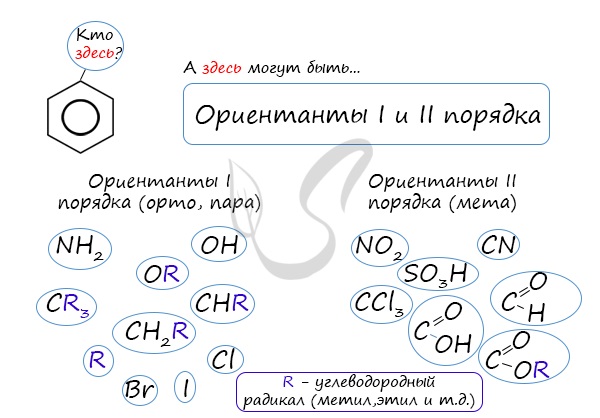
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
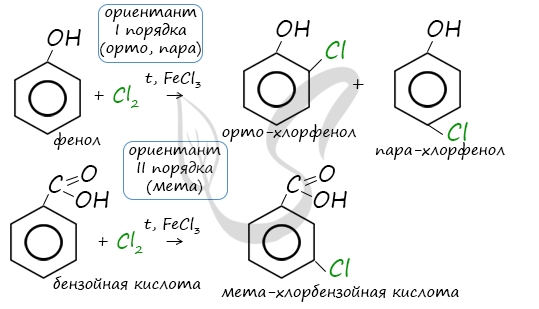
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH 2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:


