Криодеструкция при раке поджелудочной железы
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
1. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2009 г. Вестник ГУ РОНЦ им. Н.Н. Блохина РАМН. 2011; 22 (3): (85) (прил. 1): 172 с.
2. Напалков Н.П. Заболеваемость и смертность от рака основных локализаций (по материалам сборника ВОЗ “World Health 1995. Bridging the Gaps”). Диагностика и интервенционная радиология опухолей малого таза. Доклад на 23-м Европейском семинаре по диагностической и интервенционной радиологии. Обнинск, 1995 г. 8–9 октября. 35 с.
3. Чиссов В.И., Дарьялова С.Л. Онкология (клинические рекомендации). М.: ГЭОТАР-Медиа, 2006. 720 с.
4. Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М.: Медпрактика-М, 2003. 386 с.
5. Xu K.C., Korpan N.N., Niu L.Z. Modern cryosurgery for cancer. World Scientific. 2012. 903 p.
6. Warshaw A.L., Castilo C.F. Pancreatic carcinoma. N. Engl. J. Med. 1992; 326 (7): 455–465.
7. Korpan N.N. Basics of cryosurgery. Wien, New York: ShringerVerlag, 2001. 325 p.
8. Прохоров Г.Г. Основы криохирургии (Обзор истории и со временного состояния проблемы). Международный сборник научных трудов под ред. д.м.н. В.И. Коченова “Медицинская криология”. Н. Новгород, 2008. Вып. 5. 408 с.
9. Альперович Б.И., Мерзликин Н.В., Комкова Т.Б. Криохирургические операции при заболеваниях печени и поджелудочной железы. Под ред. Альперовича Б.И. М.: ГЭОТАР-Медиа, 2015. 240 с.
10. Xu K.C., Niu L.Z., Hu Y.Z. A pilot study on combination of cryosurgery and 125iodine seed implantation for treatment of locally advanced pancreatic cancer. World J. Gastroenterol. 2008; 14: 1603–1611.
11. Кубышкин В.А., Ионкин Д.А., Кунгурцев С.В., Чжао А.В. История криохирургии. Хирургия. 2015; 5: 62–74.
12. Альперович Б.И. Исторический очерк криохирургии в России. Криохирургия в гепатологии. Достижения криомедицины. СПб.: Наука, 2001: 4–21.
13. Ханевич М.Д., Манихас Г.М. Криохирургия рака поджелудочной железы. СПб.: Аграф+, 2011. 228 с.
14. Ханевич М.Д., Вашкуров С.М., Семенов А.В., Анисимова А.В. Новые возможности криохирургии в онкологии. Сборник научных трудов 1-й Международной научно- практической конференции “Криохирургия. Современные методы и инновационные технологии”. СПб., 2007: 21–28.
15. Цыганов Д.И. Процессы и аппараты. М.: Сайнс-Прейс, 2011. 303 с.
16. Kovach S.J., Hendrickson R.J., Cappadona C.R. Cryoablation of unresectable cancer. Surgery. 2002; 131 (4): 463–464.
17. Prokhorov G., Prokhorov D., Andreev A. et al. Total body hypothermia in cryosurgery. In: Korpan N., ed. Basics of Cryosurgery. Wien: Springer, 2001. 324 p.
18. Чжао А.В., Ионкин Д.А., Степанова Ю.А., Шуракова А.Б. Криодеструкция рака поджелудочной железы. Высокотехно логическая медицина. 2016; 2: 4–11.
19. Ducreux M., Cuhna A.S., Caramella C., Hollebecque A., Burtin P., Goere D., Seufferlein T., Haustermans K., Van Laethem J.L., Conroy T., Arnold D. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2015; (Suppl. 5): v56–v68. DOI: 10.1093/annonc/mdv295.
20. Chu K.F., Dupuy D.E. Thermal ablation of tumors: biological mechanisms and advances in therapy. Nat. Rev. Cancer. 2014; 14 (3): 199–208. DOI: 10.18632/oncotarget.
21. Gage A.A., Bauhst J. Mechanisms of tissue injury in cryosurgery. Cryobiology. 1998; 37 (3): 171–186.
22. Гранов А.М., Давыдов М.И. Интервенционная радиология в онкологии (Пути развития). Научно-практическое издание. СПб.: ФОЛИАНТ, 2013. 545 с.
23. Альперович Б.И., Комкова Т.Б., Мерзликин Н.В. Основы криохирургии печени и поджелудочной железы. Томск: Печатная мануфактура, 2006. 232 с.
24. Keogan M.T., Edelman R.R. Technologic advances in abdominal MR imaging. Radiol. 2001; 220 (2): 310–320.
25. Matsumoto R., Selig A.M., Colucci V.M., Jolesz F.A. MR monitoring during cryoterapy in the liver: predictability of histologic outcome. J. Magn. Reson. Imaging. 1993; 3 (5): 770–776.
26. Morrin M.M., Rofsky N.M. Techniques for liver MR imaging. Magn. Reson. Imaging Clin. N. Am. 2001; 9 (4): 75–96.
27. Чжао А.В., Земсков В.М., Козлова М.Н., Ионкин Д.А. Мониторинг иммунного статуса при криодеструкции злокачественных опухолей поджелудочной железы. Высокотехнологическая медицина. 2017; 4: 5–11.
28. Waitz R., Solomon S.B., Petre E.N., Trumble A.E., Fassò M., Norton L., Allison J.P. Potent induction of tumor immunity by combination tumor cryoablation with anti-CTLA-4 therapy. Cancer Res. 2012; 72 (2): 430–439. DOI: 10.1158/0008-5472.CAN-11-1782.
29. Sabel M.S., Nehs M.A., Su G., Lowler K.P., Ferrara J.L., Chang A.E. Immunologic response to cryoablation of breast cancer. Breast Cancer. Res. Treat. 2005; 90 (1): 97–104.
30. Korpan N.N. Cryosurgery: ultrastructural changes in pancreas tissue after low temperature exposure. Technol. Cancer Res. Treat. 2007; 6 (2): 59–67. DOI: 10.1177/153303460700600202.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Цель. Улучшить качество и увеличить продолжительность жизни больных местнораспространенным раком поджелудочной железы. Материал и методы. С 2012 г. криодеструкция лапаротомным доступом была выполнена 36 больным местнораспространенным раком поджелудочной железы. Мужчин было 14 (38,9%), женщин - 22 (61,1%), средний возраст больных - 58 ± 6,8 года. Размер опухолей поджелудочной железы варьировал от 4 до 10 см. Применяли отечественные установки “Крио-МТ”, “КРИО-01” (ЕЛАМЕД), криоаппликаторы 2-5 см. Целевая температура составляла -186 °С, время экспозиции - 3-5 мин. Число сеансов зависело от размера опухоли и варьировало от 1 до 5 (в среднем 2,4). Локальная криодеструкция была дополнена формированием обходных анастомозов в 18 (50%) наблюдениях. Всем больным в дальнейшем проведена адъювантная химиотерапия, в 10 наблюдениях дополненная регионарной химиоэмболизацией. Результаты. Летальных исходов во время криодеструкции и в послеоперационном периоде не было. В ближайшем послеоперационном периоде осложнения отмечены у 14 (38,8%) больных, тяжелые осложнения - у 13,6%. После криодеструкции происходило полное исчезновение болевого синдрома (39,2%) либо значительное его уменьшение (41,6%). Выживаемость больных через 6, 12, 24, 36 мес составила соответственно 92, 84, 48 и 14%, медиана выживаемости - 18,2 мес. Заключение. Криодеструкция при местнораспространенном раке поджелудочной железы является вмешательством, в значительной степени улучшающим качество жизни онкологических пациентов, в первую очередь за счет уменьшения болевого синдрома. В сочетании с химиотерапевтическим лечением отмечено и некоторое увеличение выживаемости.
Ключевые слова:
поджелудочная железа, рак, криохирургия, криодеструкция, осложнения, отдаленные результаты, pancreas, cancer, cryosurgery, cryodestruction, complications, long-term results
Литература:
1.Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2009 г. Вестник ГУ РОНЦ им. Н.Н. Блохина РАМН. 2011; 22 (3): (85) (прил. 1): 172 с.
2.Напалков Н.П. Заболеваемость и смертность от рака основных локализаций (по материалам сборника ВОЗ “World Health 1995. Bridging the Gaps”). Диагностика и интервенционная радиология опухолей малого таза. Доклад на 23-м Европейском семинаре по диагностической и интервенционной радиологии. Обнинск, 1995 г. 8-9 октября. 35 с.
3.Чиссов В.И., Дарьялова С.Л. Онкология (клинические рекомендации). М.: ГЭОТАР-Медиа, 2006. 720 с.
4.Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М.: Медпрактика-М, 2003. 386 с.
5.Xu K.C., Korpan N.N., Niu L.Z. Modern cryosurgery for cancer. World Scientific. 2012. 903 p.
6.Warshaw A.L., Castilo C.F. Pancreatic carcinoma. N. Engl. J. Med. 1992; 326 (7): 455-465.
7.Korpan N.N. Basics of cryosurgery. Wien, New York: Shringer-Verlag, 2001. 325 p.
8.Прохоров Г.Г. Основы криохирургии (Обзор истории и со временного состояния проблемы). Международный сборник научных трудов под ред. д.м.н. В.И. Коченова “Медицинская криология”. Н. Новгород, 2008. Вып. 5. 408 с.
9.Альперович Б.И., Мерзликин Н.В., Комкова Т.Б. Криохирургические операции при заболеваниях печени и поджелудочной железы. Под ред. Альперовича Б.И. М.: ГЭОТАР-Медиа, 2015. 240 с.
10.Xu K.C., Niu L.Z., Hu Y.Z. A pilot study on combination of cryosurgery and 125iodine seed implantation for treatment of locally advanced pancreatic cancer. World J. Gastroenterol. 2008; 14: 1603-1611.
11.Кубышкин В.А., Ионкин Д.А., Кунгурцев С.В., Чжао А.В. История криохирургии. Хирургия. 2015; 5: 62-74.
12.Альперович Б.И. Исторический очерк криохирургии в России. Криохирургия в гепатологии. Достижения криомедицины. СПб.: Наука, 2001: 4-21.
13.Ханевич М.Д., Манихас Г.М. Криохирургия рака поджелудочной железы. СПб.: Аграф+, 2011. 228 с.
14.Ханевич М.Д., Вашкуров С.М., Семенов А.В., Анисимова А.В. Новые возможности криохирургии в онкологии. Сборник научных трудов 1-й Международной научно-практической конференции “Криохирургия. Современные методы и инновационные технологии”. СПб., 2007: 21-28.
15.Цыганов Д.И. Процессы и аппараты. М.: Сайнс-Прейс, 2011. 303 с.
16.Kovach S.J., Hendrickson R.J., Cappadona C.R. Cryoablation of unresectable cancer. Surgery. 2002; 131 (4): 463-464.
17.Prokhorov G., Prokhorov D., Andreev A. et al. Total body hypothermia in cryosurgery. In: Korpan N., ed. Basics of Cryosurgery. Wien: Springer, 2001. 324 p.
18.Чжао А.В., Ионкин Д.А., Степанова Ю.А., Шуракова А.Б. Криодеструкция рака поджелудочной железы. Высокотехно логическая медицина. 2016; 2: 4-11.
19.Ducreux M., Cuhna A.S., Caramella C., Hollebecque A., Burtin P., Goere D., Seufferlein T., Haustermans K., Van Laethem J.L., Conroy T., Arnold D. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2015; (Suppl. 5): v56-v68. DOI: 10.1093/annonc/mdv295.
20.Chu K.F., Dupuy D.E. Thermal ablation of tumors: biological mechanisms and advances in therapy. Nat. Rev. Cancer. 2014; 14 (3): 199-208. DOI: 10.18632/oncotarget.
21.Gage A.A., Bauhst J. Mechanisms of tissue injury in cryosurgery. Cryobiology. 1998; 37 (3): 171-186.
22.Гранов А.М., Давыдов М.И. Интервенционная радиология в онкологии (Пути развития). Научно-практическое издание. СПб.: ФОЛИАНТ, 2013. 545 с.
23.Альперович Б.И., Комкова Т.Б., Мерзликин Н.В. Основы криохирургии печени и поджелудочной железы. Томск: Печатная мануфактура, 2006. 232 с.
24.Keogan M.T., Edelman R.R. Technologic advances in abdominal MR imaging. Radiol. 2001; 220 (2): 310-320.
25.Matsumoto R., Selig A.M., Colucci V.M., Jolesz F.A. MR monitoring during cryoterapy in the liver: predictability of histologic outcome. J. Magn. Reson. Imaging. 1993; 3 (5): 770-776.
26.Morrin M.M., Rofsky N.M. Techniques for liver MR imaging. Magn. Reson. Imaging Clin. N. Am. 2001; 9 (4): 75-96.
27.Чжао А.В., Земсков В.М., Козлова М.Н., Ионкин Д.А. Мониторинг иммунного статуса при криодеструкции злокачественных опухолей поджелудочной железы. Высокотехнологическая медицина. 2017; 4: 5-11.
28.Waitz R., Solomon S.B., Petre E.N., Trumble A.E., Fassò M., Norton L., Allison J.P. Potent induction of tumor immunity by combination tumor cryoablation with anti-CTLA-4 therapy. Cancer Res. 2012; 72 (2): 430-439. DOI: 10.1158/0008-5472.CAN-11-1782.
29.Sabel M.S., Nehs M.A., Su G., Lowler K.P., Ferrara J.L., Chang A.E. Immunologic response to cryoablation of breast cancer. Breast Cancer. Res. Treat. 2005; 90 (1): 97-104.
30.Korpan N.N. Cryosurgery: ultrastructural changes in pancreas tissue after low temperature exposure. Technol. Cancer Res. Treat. 2007; 6 (2): 59-67. DOI: 10.1177/153303460700600202.
Aim. To improve quality and duration of life in patients with locally advanced pancreatic cancer. Material and methods. Cryosurgery through laparotomy has been performed in 36 patients with locally advanced pancreatic cancer since 2012. There were 14 (38.9%) men and 22 (61.1%) women (mean age 58 ± 6.8 years). Dimensions of pancreatic tumors were from 4 to 10 cm. Domestic devices “CRYO-MT”, “CRYO-01”, “ELAMED” and cryoapplicators with a diameter 2-5 cm were applied. Target temperature was about 186 °C, time of exposure - 3-5 min. There were 1-5 sessions of cryoablation (mean 2.4) and their number depended on tumor dimensions. Local cryodestruction was supplemented by bypass anastomoses in 18 patients (50%). All patients subsequently underwent adjuvant chemotherapy with additional regional chemoembolization in 10 of them. Results. There were no lethal outcomes during cryodestruction and in postoperative period. Early postoperative complications occurred in 14 (38.8%) patients, severe complications - in 13.6%. Cryodestruction was followed by complete regression (39.2%) or significant improvement (41.6%) of pain syndrome. 6-, 12-, 24- and 36-month survival was 92%, 84%, 48% and 14%, respectively. Median survival was 18.2 months. Conclusion. Cryodestruction is able to improve patients’ quality of life due to reduced pain syndrome in case of locally advanced pancreatic cancer. Certain increase of survival was observed in additional chemotherapy.
Keywords:
поджелудочная железа, рак, криохирургия, криодеструкция, осложнения, отдаленные результаты, pancreas, cancer, cryosurgery, cryodestruction, complications, long-term results
Злокачественные опухоли поджелудочной железы делятся на две группы: опухоли экзокринной части (95% случаев) и опухоли эндокринной части (5% случаев). В казуистически редких случаях встречаются мезенхимальные опухоли и лимфомы.
Злокачественные опухоли поджелудочной железы делятся на две группы: опухоли экзокринной части (95% случаев) и опухоли эндокринной части (5% случаев). В казуистически редких случаях встречаются мезенхимальные опухоли и лимфомы. Данные рекомендации посвящены только карциномам
экзокринной части поджелудочной железы.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Стадирование осуществляется на основании TNM классификации рака поджелудочной железы (РПЖ) (8-е издание, 2017 г.) (табл. 1).
Первичная опухоль (T):
• ТХ — недостаточно данных для оценки первичной опухоли
• Tis — carcinoma in situ
• T1 — опухоль ограничена поджелудочной железой до 2 см в наибольшем измерении
• Т2 — опухоль ограничена поджелудочной железой; более 2 см, но не более 4 см в наибольшем измерении
• Т3 — опухоль более 4 см в наибольшем измерении
• Т4 — опухоль распространяется на чревный ствол, верхнюю брыжеечную или общую печёночную артерию
Регионарные лимфатические узлы (N):
• NX — недостаточно данных для оценки состояния регионарных лимфоузлов
• N0 — нет признаков метастатического поражения регионарных лимфоузлов
• N1 — наличие метастазов в 1-3 регионарных лимфоузлах
• N2 — наличие метастазов в 4 или более регионарных лимфоузлах
К регионарным лимфоузлам для опухоли головки поджелудочной железы относятся лимфоузлы вдоль общего желчного протока, общей печёночной артерии, воротной вены, пилорические, инфрапилорические, субпилорические, проксимальные брыжеечные, чревные, передние и задние панкреатоду-оденальные, вдоль верхней брыжеечной вены и правой латеральной стенки верхней брыжеечной артерии. К регионарным лимфоузлам для опухоли тела и хвоста поджелудочной железы относятся лимфоузлы вдоль общей печёночной артерии, чревного ствола, селезёночной артерии, ворот селезёнки, а также забрюшинные и латеральные аортальные лимфоузлы. Адекватное послеоперационное стадирование предполагает морфологическое изучение не менее 10 лимфатических узлов.
Отдалённые метастазы (M):
• M0 — нет отдалённых метастазов
• M1 — наличие отдалённых метастазов
Таблица 1. Стадирование рака поджелудочной железы
Диагноз РПЖ устанавливается на основании анамнестических и лабораторных данных и результатов инструментального обследования. Морфологическое исследование является основой диагноза. Материал для него может быть получен во время операции или с помощью пункции/биопсии. Хирургическое вмешательство в ряде случаев может быть выполнено без морфологического подтверждения диагноза, в то время как консервативное лечение требует обязательной верификации ввиду значительной вероятности ложноположи-
тельных заключений инструментальных методов исследования, а также для исключения нейроэндокринных опухолей. В случае высокого риска осложнений, связанных с биопсией, при планировании гистологического исследования следует выполнить тонкоигольную пункцию образования (чрескожную или эндоскопическую). В план обследования должны быть включены:
• осмотр, сбор анамнеза болезни, семейного анамнеза;
• клинический анализ крови;
• биохимический анализ крови с оценкой функции печени, почек;
• УЗИ органов брюшной полости, забрюшинного пространства, шейно-надключичной области;
• УЗИ малого таза для женщин;
• R-графия органов грудной клетки;
• эндосонография для оценки распространённости и резектабельности, а также для навигации забора материала с целью морфологического исследования;
• КТ грудной клетки, брюшной полости и малого таза с в/в контрастированием (обязательно получение изображений в артериальную и портальную венозую фазы)для определения степени распространённости, резектабельности или оценки эффективности консервативного лечения;
• МРТ брюшной полости и малого таза с в/в контрастированием для определения степени распространённости, резектабельности или оценки эффективности консервативного лечения;
• ПЭТ/КТ для оценки первичной распространённости при решении вопроса о возможности выполнения радикальной операции или при планировании ЛТ;
• лапароскопия с целью определения распространённости, оценки резектабельности или взятия биопсии;
• ангиография с целью определения резектабельности;
• пункция/биопсия первичной опухоли или метастаза с целью морфологической верификации диагноза;
• при наличии в семейном анамнезе опухолевых заболеваний (>1 близкая родственница, страдавшая раком яичников в любом возрасте или раком молочной железы в возрасте до 50 лет, или два родственника, страдавших раком поджелудочной железы, яичников, молочной железы или предстательной железы)целесообразно генетическое консультирование и определение герминальной мутации BRCA 1 и 2.
3.1. Лечение неметастатического рака поджелудочной железы (любая Т, любая N, M0)
Решение о тактике лечения неметастатического РПЖ основано на оценке резектабельности первичной опухоли, которая должна производиться специалистами-хирургами, обладающими достаточным опытом хирургического
лечения больных с опухолями билиопанкреатодуоденальной области. В табл.2 приведена классификация, которая позволяет судить о резектабельности процесса по данным КТ.
Таблица 2. Оценка резектабельности неметастатического рака поджелудочной железы
(критерии клиники M. D. Anderson)
Не вовлечена;
нормальная
жировая про-
слойка между
опухолью
и артерией
Опухолевая инфильтрация 2 /сут. внутрь ежедневно в течение всего периода облучения. Применение гемцитабина в дозе 300 мг/м 2 еженедельно в качестве радиосенсибилизатора во время ЛТ является возможной альтернативой, однако существенно более токсичной, и, по-видимому, менее эффективной. При проведении стереотаксической ЛТ сочетанная ХТ не проводится, РОД составляет 7,5 Гр, 5 раз до СОД 37,5 Гр.
Основным дозолимитирующим фактором при стереотаксической ЛТ рака поджелудочной железы является наличие полых органов, таких как желудок, двенадцатиперстная кишка, тонкая или толстая кишка. Это обусловлено высоким риском развития тяжёлых постлучевых повреждений (расстояние между объёмом облучения и органами риска должно составлять не менее 5 мм).
Вовлечение этих органов в опухолевый процесс является противопоказанием к стереотаксической ЛТ.
3.1.3. Хирургическое лечение
Стандартным доступом при всех операциях на поджелудочной железе является срединная лапаротомия. При опухолях головки поджелудочной железы следует выполнять гастропанкреатодуоденальную резекцию. При опухолях тела или хвоста поджелудочной железы следует выполнять дистальную субтотальную резекцию
поджелудочной железы, включающую удаление тела, хвоста железы, а также селезёнки. Стандартный объём лимфодиссекции предполагает удаление следующих лимфатических узлов: надпилорических и подпилорических, лимфоузлов по ходу печёночной артерии и чревного ствола с его ветвями, лимфоузлов вдоль
общего желчного протока, лимфоузлов вокруг пузырного протока, ретропанкреатических лимфоузлов, лимфоузлов по нижнему краю головки поджелудочной железы, лимфоузлов по правой полуокружности верхней брыжеечной артерии, лимфоузлов по верхнему краю головки поджелудочной железы. При карциномах тела и хвоста поджелудочной железы рекомендовано удаление следующих групп лимфоузлов: лимфоузлов ворот селезёнки, лимфоузлов вдоль селезёночной артерии, лимфоузлов по нижнему краю поджелудочной железы.
Стандартная лимфаденэктомия должна включать удаление не менее 10 лимфатических узлов.
3.1.4. Адъювантная терапия
В случае предоперационной ХТ длительностью 6 мес. с последующим хирургическим лечением после операции рекомендовано динамическое наблюдение без адъювантной терапии. При длительности предоперационной ХТ
меньше 6 мес. рекомендовано применение адъювантной ХТ так, чтобы общая продолжительность ХТ составила 6 мес. В случае хирургического лечения без предоперационной ХТ адъювантная ХТ рекомендована всем пациентам вне зависимости от стадии и радикальности операции. Лечение должно быть начато в течение 3 мес. после операции (оптимально — в течение 6 нед.).
Если послеоперационные осложнения не позволяют начать ХТ в течение 3 мес., проведение адъювантной ХТ в более поздний период нецелесообразно, показано динамическое наблюдение и назначение лечения по факту прогрессирования болезни. Рекомендуемые режимы адъювантной ХТ представлены в табл. 3.
Таблица 3. Рекомендуемые режимы адъювантной химиотерапии при раке поджелудочной железы
mFOLFIRINOX 1 : оксалиплатин 85мг/м 2 в/в 120 мин., иринотекан 150мг/м 2 в/в 90 мин.,
кальция фолинат 400 мг/м 2 в/в 120 мин., 5-фторурацил 2400 мг/м 2 в/в инфузия в тече-
ние 46 часов, каждые 2 нед., всего 12 циклов
GEMCAP: гемцитабин 1000 мг/м 2 в/в капельно 30 мин. в 1-й, 8-й и 15-й дни + капецита-
бин 1660 мг/м 2 внутрь ежедневно с 1 -го по 21-й день каждые 4 нед., всего 6 циклов
• гемцитабин 1000 мг/м 2 в/в капельно 30 мин. еженедельно 7 нед., далее 1000 мг/м 2
в 1 -й, 8-й и 15-й дни каждые 4 нед., всего 6 циклов или
• капецитабин 2000-2500 мг/м 2 /сут. внутрь с 1 -го по 14-й день каждые 3 нед., всего
8 циклов или
• 5-фторурацил 425 мг/м 2 в/в струйно + кальция фолинат 20 мг/м 2 в/в струйно
с 1 -го по 5-й дни каждые 4 нед., всего 6 циклов
1 mFOLFIRINOXрекомендуется только пациентам в удовлетворительном общем состоянии (по шкале ECOG 0-1 балл, без серьёзных осложнений хирургического лечения, сопутствующих заболеваний и с уровнем общего билирубина 2
в/в 120 мин., иринотекан 180 мг/м 2
в/в 90 мин., кальция фолинат
400 мг/м 2 в/в 120 мин., 5-фторурацил
400 мг/м 2 в/в болюс, 5-фторурацил
2400 мг/м 2 в/в инфузия в течение 46
часов, каждые 2 нед.)
• состояние по шкале ECOG 0-1 балл;
• общий билирубин 2
в/в капельно 30 мин. + гемцитабин
1000 мг/м 2 в/в капельно 30 мин. в 1-й,
8-й, 15-й дни каждые 4 нед.
• состояние по шкале ECOG 0-2 балла;
• общий билирубин 2 в/в 1-й, 8-й
дни каждые 3 нед. в сочетании с од-
ним из производных платины:
• цисплатин 60-75мг/м 2 в/в в 1-й
день или
• карбоплатин AUC 4-5 в/в в 1-й
день или
• оксалиплатин 100-130мг/м 2 в/в
в 1-й день
• состояние по шкале ECOG 0-2 балла;
• общий билирубин 2 в/в 1,8, 15
каждые 4 нед.
• состояние по шкале ECOG 2 балла
• общий билирубин 2 или полная отмена) и инфузионного (до 2000 мг/м 2 ) введения 5-фторурацила;
• редукция дозы иринотекана (до 165 мг/м 2 );
• редукция дозы оксалиплатина (до 65 мг/м 2 ).
3.2.2. Лучевая терапия
Применение ЛТ возможно в случае локорегионарного рецидива после хирургического лечения, а также продолженного роста первичной нерезектабельной опухоли после ХТ при отсутствии отдалённых метастазов.
Оптимальная последовательность применения ХТ и ЛТ в таких ситуациях не определена.
Облучение проводится в РОД 1,8-2,0 Гр до СОД 45-54 Гр в сочетании с капецитабином в дозе 1600 мг/м 2 /сут. внутрь ежедневно в течение всего периода облучения. В случае применения стереотаксической ЛТ рекомендуется ис- пользовать 3 фракции до СОД 30-45 Гр или 5 фракций до СОД 25-45 Гр. В объём
облучения включаются первичная опухоль с вовлечёнными лимфатическими узлами или рецидивная опухоль.
3.2.3. Химиотерапия II линии
Рекомендуемые режимы ХТ II линии при РПЖ суммированы в табл. 5.
Таблица 5. Рекомендуемые режимы химиотерапии II линии рака поджелудочной железы
Режим ХТ (лечение до прогрессирования/
неприемлемой токсичности)
Критерии
выбора режима ХТ
Nab-паклитаксел 100-125мг/м 2 в/в капельно 30 мин. +
гемцитабин 750-1000 мг/м 2 в/в капельно 30 мин. в 1-й,
8-й, 15-й дни каждые 4 нед.
• ранее не использовался гемцитабин
и nab-паклитаксел;
• состояние по шкале ECOG 0-1 балл;
• общий билирубин 2 в/в в 1-й и 8-й дни каждые
3 нед. в сочетании с одним из производных платины:
• цисплатин 60-75 мг/м 2 в/в в 1-й день или
• карбоплатин AUC 4-5 в/в в 1-й день или
• оксалиплатин 100-130 мг/м 2 в/в в 1-й день
• ранее не использовался гемцитабин и про-
изводное платины;
• состояние по шкале ECOG 0-2 балла;
• общий билирубин 2 в/в в 1-й, 8-й, 15-й дни
каждые 4 нед.
• ранее не использовался гемцитабин;
• состояние по шкале ECOG 1-2 балла;
• общий билирубин 2 в/в 120 мин.,
иринотекан 165-180 мг/м 2 в/в 90 мин., кальция фолинат
400 мг/м 2 в/в 120 мин., 5-фторурацил 320-400 мг/м 2
в/в болюс, 5-фторурацил 2000-2400 мг/м 2 в/в инфузия
в течение 46 часов, интервал между циклами 2 нед.)
• ранее использовался гемцитабин;
• состояние по шкале ECOG 0-1 балл;
• общий билирубин 2 в/в 120 мин., кальция
фолинат 400 мг/м 2 в/в 120 мин., 5-фторурацил 400 мг/м 2
в/в болюс, 5-фторурацил 2400 мг/м 2 в/в инфузия в тече-
ние 46 часов, интервал между циклами 2 нед.);
XELOX (оксалиплатин 130 мг/м 2 в/в 120 мин. в 1-й день, ка-
пецитабин 2000 мг/м 2 /сут. внутрь 1-14 дни каждые 3 нед.);
FOLFIRI.3 (иринотекан 90 мг/м 2 в/в 60 мин. в 1-й день,
кальция фолинат 400 мг/м 2 в/в 120 мин. в 1-й день,
5-фторурацил 2000 мг/м 2 в/в инфузия в течение 46
часов, иринотекан 90 мг/м 2 в/в 60 мин. в 3-й день после
окончания инфузии 5-фторурацила, интервал между
циклами 2 нед.);
CAPIRI (иринотекан 200 мг/м 2 в/в 90 мин. в 1-й день, ка-
пецитабин 1600 мг/м 2 /сут. внутрь в 1-14-й дни каждые
3 нед.)
OFF (оксалиплатин 85 мг/м 2 в/в 120 мин. в 1 день,
кальция фолинат 200 мг/м 2 в/в 120 мин. в 1-й, 8-й, 15-й
дни, 5-фторурацил 2000 мг/м 2 в/в инфузия в течение 24
часов в 1 -й, 8-й, 15-й дни, интервал между циклами 3 нед.
• ранее использовался гемцитабин;
• состояние по шкале ECOG 0-1 балл;
• общий билирубин 2 /сут. внутрь в 1-14-й дни
каждые 3 нед.;
5-фторурацил 425 мг/м 2 в/в струйно + кальция фолинат
20 мг/м 2 в/в струйно в 1-5-й дни каждые 4 нед.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
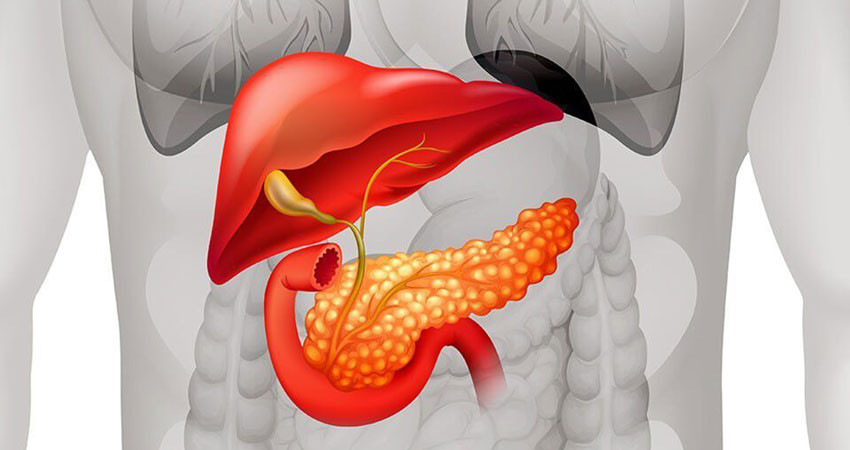
Рак поджелудочной железы относится к онкологическим заболеваниям, с которыми сложно бороться, и которые характеризуются относительно низкой выживаемостью. В течение 5 лет с момента установления диагноза в живых остаются лишь 9% больных. Рак поджелудочной железы нередко диагностируют в запущенной стадии, потому что не существует эффективного рекомендованного скрининга, злокачественная опухоль может долго не вызывать симптомов.
Тем не менее, пациенту можно помочь, даже если заболевание диагностировано на поздней стадии. В случаях, когда невозможно добиться ремиссии, врачи могут продлить жизнь пациента и избавить его от мучительных симптомов. Эффективное лечение можно получить в клинике Медицина 24/7.
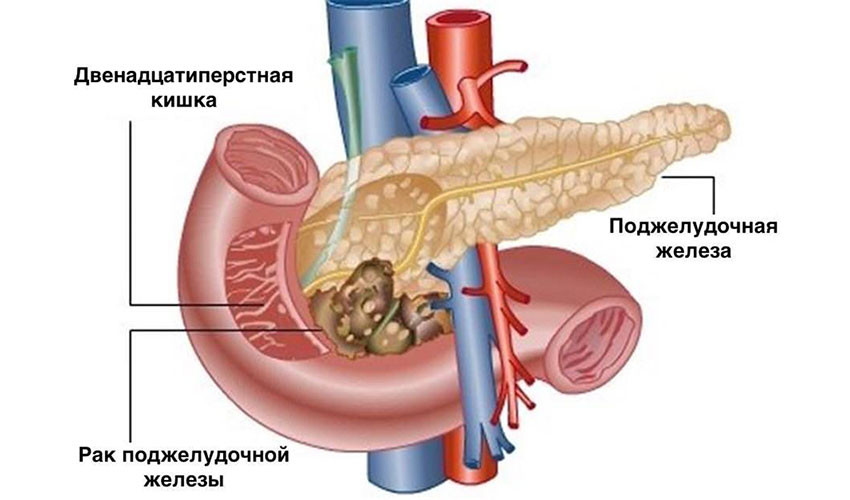
Хирургическое лечение
Хирургическое удаление опухоли — самый эффективный метод лечения рака поджелудочной железы. Это единственная реальная возможность достичь ремиссии. К сожалению, на момент постановки диагноза только у одного из пяти пациентов опухоль не успела распространиться за пределы поджелудочной железы, и лишь у некоторых из них рак можно полностью удалить. Обычно это узлы в головке органа: через неё проходит желчный проток, при его сдавлении развивается механическая желтуха, и эта симптоматика помогает рано диагностировать опухоль.
Операцию проводят, если хирург уверен, что он сможет удалить рак полностью. Циторедуктивные вмешательства, направленные на частичное удаление как можно большего количества опухолевой ткани, не проводятся, так как нет доказательств того, что они помогают продлевать жизнь пациентов.
При раке головки поджелудочной железы чаще всего выполняют операцию Уиппла. Во время нее удаляют головку органа, иногда вместе с телом, и часть окружающих органов: тонкой кишки, желчного протока, ближайшие лимфатические узлы, желчный пузырь, иногда часть желудка.
При резектабельном раке хвоста поджелудочной железы проводят дистальную панкреатэктомию: удаляют хвост поджелудочной железы, иногда вместе с телом, и селезенку.
В редких случаях встречаются ситуации, когда злокачественная опухоль распространилась по всей поджелудочной железе, но все еще является операбельной. При этом может быть выполнена тотальная панкреатэктомия: поджелудочную железу удаляют полностью, вместе с ней — желчный пузырь, часть желудка и тонкой кишки.

Паллиативные операции
Во время паллиативных операций не удаляют рак, их цель — избавить больного от симптомов, вызванных злокачественной опухолью. При раке головки поджелудочной железы нередко развивается механическая желтуха — состояние, вызванное сдавлением желчного протока и нарушением оттока желчи. У больного окрашиваются в желтый цвет кожа, слизистые оболочки и белки глаз, беспокоит кожный зуд, ухудшается общее состояние, прогноз.
С этим осложнением можно справиться тремя способами:
- Дренирование. Во время эндоскопической ретроградной холангиопанкреатографии (РХПГ) или чрескожной чреспеченочной холангиографии в желчные протоки устанавливают дренажную трубку. По ней желчь может оттекать наружу, в просвет двенадцатиперстной кишки или сразу в обоих направлениях. Это достаточно эффективно, но не очень удобно: дренажная трубка постоянно мешается, может случайно сместиться, выпасть.
- Стентирование — более современное решение. Эндоскопически, с помощью катетера, заведенного в желчные протоки из двенадцатиперстной кишки, в заблокированном участке устанавливают стент — трубку с сетчатой стенкой из полимера или металла. Он расширяет просвет протока и обеспечивает свободный отток желчи. Стентирование — быстрая и относительно безопасная процедура, ее выполняют без разрезов.
- Шунтирование — операция, во время которой хирург создает обходной путь для оттока желчи. По сравнению со стентированием, хирургическое вмешательство несет более высокий риск осложнений, его могут перенести не все больные. Но иногда оно позволяет более эффективно, надолго восстановить отток желчи. Во время операции можно перерезать нервы, которых беспокоят мучительные боли.
Насколько эффективна химиотерапия при раке поджелудочной железы?
Химиопрепараты довольно часто применяют при злокачественных опухолях поджелудочной железы. Они могут быть назначены с разными целями:
- Адъювантная химиотерапия проводится до операции, чтобы уменьшить объем опухоли.
- Неоадъювантная химиотерапия проводится после операции, чтобы снизить риск рецидива.
- Химиотерапия как основной метод лечения применяется при неоперабельных опухолях. Цель лечения в таком случае — не достичь ремиссии, а как можно дольше держать болезнь под контролем.
Чаще всего применяют такие химиопрепараты, как гемцитабин (Гемзар), оксалиплатин (Элоксатин), иринотекан (Камптозар), , цисплатин, капецитабин (Кселода). Обычно назначают комбинации из двух препаратов с разными механизмами действия, это помогает повысить эффективность лечения. Ослабленным пациентам назначают только один препарат риска серьезных побочных эффектов.
Эффективность лучевой терапии
Лучевую терапию при раке поджелудочной железы зачастую применяют вместе с химиопрепаратами. Такое лечение называется химиолучевой терапией. Ее назначают после операции, при неоперабельном раке.
Если опухоль находится в пограничном состоянии между резектабельной и нерезектабельной, после курса неоадъювантной лучевой терапии ее размеры могут уменьшиться так, что ее получится удалить хирургическим путем.
Также лучевую терапию при раке поджелудочной железы применяют в качестве симптоматического лечения, например, если беспокоят мучительные боли, и пациенту противопоказано хирургическое вмешательство.
Таргетная терапия
На поверхности раковых клеток в поджелудочной железе нередко увеличено количество молекул EGFR. Активируясь, он заставляет клетки быстро размножаться. Его можно заблокировать с помощью таргетного препарата эрлотиниб (Тарцева). Его часто назначают в сочетании с химиопрепаратом гемцитабином. Эффективность этой комбинации различается у разных онкологических больных.
Помогает ли иммунотерапия при раке поджелудочной железы?
Иммунная система человека должна не только атаковать чужеродные агенты, но и знать, когда пора остановиться, чтобы не навредить собственным тканям организма. Для этого в ней есть специальные сигнальные молекулы, подавляющие активность иммунных клеток. При раке эти молекулы начинают мешать. Они не дают иммунитету эффективно распознавать и уничтожать опухолевые клетки. Существуют препараты, которые могут заблокировать эти молекулы, они называются ингибиторами контрольных точек.
При раке поджелудочной железы ингибиторы контрольных точек могут быть полезны для пациентов, у которых выявлены определенные генетические отклонения: высокий уровень микросателлитной нестабильности, мутации в генах восстановления несоответствия (MMR).
В клинике Медицина 24/7 при многих типах рака можно пройти исследование, которое помогает выявить мишени для лекарственных препаратов, имеющиеся в раковых клетках пациента, и назначить оптимальную, персонализированную терапию.
Читайте также:





